文章信息
- 赵东磊, 辛文静, 杨莹, 卢飞, 效雪梅, 段亚冰, 周明国
- ZHAO Donglei, XIN Wenjing, YANG Ying, LU Fei, XIAO Xuemei, DUAN Yabing, ZHOU Mingguo
- 稻瘟病菌对咪鲜胺的抗药性风险评估
- Risk assessment of resistance to prochloraz in Magnaporthe oryzae
- 南京农业大学学报, 2019, 42(3): 440-447
- Journal of Nanjing Agricultural University, 2019, 42(3): 440-447.
- http://dx.doi.org/10.7685/jnau.201809009
-
文章历史
- 收稿日期: 2018-09-06
稻瘟病广泛分布于世界各地, 在80多个国家和地区均有发生, 每年给全球水稻造成10%~30%的产量损失[1-2]。由于稻瘟病菌的遗传多样性和致病性生理小种群体形成的突发性, 选育抗谱广、抗性稳定的水稻品种成为一大难题[3]。因此, 采用高效、安全的杀菌剂已经成为控制稻瘟病流行不可或缺的重要手段。针对稻瘟病菌分生孢子萌发的芽管分化形成附着胞直接穿透宿主表皮进入宿主, 或通过伤口直接侵入的生物学特征[4-5], 抑制孢子萌发或芽管和菌丝发育或附着胞形成的选择性杀菌剂得到广泛应用。由于长期高频率使用同一种或作用机制相同的杀菌剂, 病原菌出现了抗药性, 时常造成防治效果降低甚至失效。自1971年Yoshii等[6]报道了日本稻瘟病菌对春日霉素产生抗性, 导致化学防治失败后, 国内外学者对稻瘟病菌的抗药性问题进行了广泛研究[7-8]。目前, 稻瘟净、异稻瘟净、稻瘟灵、嘧菌酯等菌丝发育和孢子萌发抑制剂都出现了田间抗药性菌株[7, 9]。另外, 稻瘟病菌经过连续驯化后对附着胞形成抑制剂三环唑也出现低水平抗药性[10]。
咪鲜胺(prochloraz)是一种高效、广谱的麦角甾醇生物合成抑制剂(ergosterol biosynthesis inhibitor, EBI), 兼有治疗和保护作用, 对多种作物由子囊菌和半知菌引起的病害具有明显的防效。但由于EBI类杀菌剂的作用位点单一, 田间已有多种重要的植物病原真菌, 如苹果黑星病菌、小麦白粉病菌和禾谷镰孢菌已对其产生了不同程度的抗药性[11-12]。咪鲜胺在我国已有20多年的用药历史, 其对稻瘟病菌有很强的抑制效果并得到了广泛的应用。目前在生产上未见稻瘟病菌对咪鲜胺产生抗药性的报道, 而且尚缺少咪鲜胺抗药性风险的系统研究。
本研究通过药剂驯化得到咪鲜胺抗性突变体, 测定其菌丝生长速率、产孢量、致病力以及在低温和高温条件下的生长特征, 分析抗药性突变体的环境适合度及对不同杀菌剂之间的交互抗性, 其结果对评估咪鲜胺在防治稻瘟病中的抗药性风险及指导其科学合理使用具有重要意义。
1 材料与方法 1.1 供试菌株稻瘟病菌(Magnaporthe oryzae)野生敏感菌株S-1由南京农业大学植物保护学院杀菌剂生物学实验室从江苏省句容市未使用过EBI杀菌剂的水稻上采集、分离、保存, 具有野生敏感群体的代表性。
1.2 供试药剂97%咪鲜胺(prochloraz)原药和97%氟环唑(epoxiconazole)原药由江苏省辉丰农化股份有限公司提供, 97%嘧菌酯(azoxystrobin)原药由先正达生物科技有限公司提供, 99%水杨肟酸(salicyl hydroxamic acid, SHAM)原药由上海麦克林生化科技有限公司提供, 97%戊唑醇(tebuconazole)原药由常州天择化工有限公司提供, 95%己唑醇(hexaconazole)原药由湖北远成赛创科技有限公司提供。用甲醇溶解原药配制成质量浓度为1×104 μg · mL-1的母液, 保存于4 ℃备用。
1.3 供试培养基马铃薯葡萄糖琼脂培养基(PDA)用于真菌保存、培养和菌丝生长速率测定。AEA培养基用于测定对嘧菌酯的敏感性。马铃薯葡萄糖液体培养基(PDB)用于振荡培养菌丝球。燕麦番茄培养基(30 g燕麦、150 g番茄、20 g琼脂粉, 煮沸20 min, 2层纱布过滤, 用去离子水定容至1 L)用于稻瘟病菌产孢。
1.4 咪鲜胺抗性突变体驯化将野生敏感菌株S-1接种在PDA培养基平板上, 28 ℃培养5 d, 在菌落边缘用打孔器制取直径为5 mm的菌碟, 转接到含有0.2 μg · mL-1咪鲜胺的PDA平板上, 每个直径90 mm平板接种10个菌碟, 共接种3 000个菌碟, 28 ℃下培养20 d后检查能快速生长形成角突变扇形的菌落。将角突部分菌丝转接到含有0.2 μg · mL-1咪鲜胺的PDA平板上, 能够迅速生长的视为抗药性突变体, 并转接到无药剂PDA上培养和保存, 用于后续试验。
1.5 咪鲜胺抗性指数测定及抗性水平划分 1.5.1 抗药性水平测定将抗药性突变体及敏感菌株S-1在无药PDA平板上培养, 并在菌落边缘制取直径为5 mm的菌碟, 分别转接到含咪鲜胺系列质量浓度(0、0.03、0.06、0.10、0.20、0.50和1.25 μg · mL-1)的PDA平板上, 28 ℃下培养7 d, 采用十字交叉法测量各突变体在不同浓度梯度平板上的菌落直径, 计算各药剂浓度的生长抑制率。将杀菌剂剂量转换成对数, 菌丝抑制率转换成概率值, 得到毒力回归方程, 计算突变体有效中浓度(EC50)。
1.5.2 抗性水平划分根据咪鲜胺对各突变体及敏感菌株S-1的有效中浓度(EC50)计算抗性指数[EC50(突变体)/EC50(敏感菌株S-1)]。根据抗性指数将得到的抗药性突变体的抗性水平划分为低抗、中抗和高抗[13]:3≤抗性指数 < 10为低抗(LR); 10≤抗性指数 < 100为中抗(MR); 抗性指数≥100为高抗(HR)。
1.6 突变体的抗性遗传稳定性测定参考文献[13-15]将抗药性突变体转接到无药PDA平板上, 28 ℃培养5 d, 连续转代培养8次, 再在室温下保存20 d。转接培养后, 按1.5节方法测定抗药性水平, 分析抗药性状在无药剂选择压下的遗传稳定性。
1.7 交互抗性测定测定敏感菌株S-1和随机挑选的3个咪鲜胺抗性突变体对常用于水稻上的EBI类杀菌剂氟环唑、戊唑醇、己唑醇和醌外抑制剂(quinone outside inhibitor, QoI)类杀菌剂嘧菌酯的敏感性(EC50), 分析稻瘟病菌咪鲜胺抗性突变体是否对这4种杀菌剂存在交互抗药性。氟环唑、戊唑醇和己唑醇质量浓度梯度设定为:0、0.1、0.4、0.8、1.6、3.0、5.0和10.0 μg · mL-1。嘧菌酯质量浓度梯度设定为:0、0.005、0.010、0.015、0.020、0.030、0.040、0.060和0.120 μg · mL-1(各处理另加旁路氧化酶抑制剂水杨肟酸50 μg · mL-1)。EC50计算参照1.5节方法。
1.8 咪鲜胺抗性突变体的适合度测定 1.8.1 菌丝生长速率的测定将敏感菌株和抗药性突变体转接于无药PDA平板上, 28 ℃预培养5 d, 再转接到PDA平板上培养7 d。测量菌落直径, 计算菌丝生长速率。
1.8.2 分生孢子量的测定将敏感菌株和抗药性突变体转接于燕麦番茄培养基, 黑暗条件下28 ℃培养3 d, 加2 mL无菌水, 用无菌棉签洗脱气生菌丝, 将气生菌丝液均匀涂抹在新的燕麦番茄培养基上, 无菌条件下晾干, 置于黑暗条件下28 ℃培养24 h, 加2 mL无菌水, 用无菌棉签洗脱气生菌丝并晾干, 置于28 ℃下光暗交替培养(14 h光照/10 h黑暗)5 d, 用含0.2 g · L-1吐温20的无菌水洗脱平板上的分生孢子, 孢子液经3层擦镜纸过滤后, 用血球计数板统计每皿的产孢量。
1.8.3 致病力的测定由于多数抗药性突变体产孢量大幅下降, 甚至不产孢, 因此我们利用菌丝球接种大麦来检测其致病力[16]。剪取生长7 d的大麦叶片4片, 置于90 mm玻璃皿中, 2层滤纸保湿, 叶片正面朝上。用灭菌刀片切取在PDA培养基上生长3 d的3 mm×3 mm的菌丝块, 置于含有100 mL PDB培养基的三角瓶中, 28 ℃、175 r · min-1摇培2 d; 用灭菌镊子将菌丝球接种于大麦叶片, 每叶2个。28 ℃下光暗交替培养(14 h光照/10 h黑暗)5 d后观察结果。
1.8.4 温度对抗药性菌株生长影响的测定将敏感菌株和抗药性突变体转接于PDA平板上, 黑暗条件下28 ℃预培养5 d, 在菌落边缘用打孔器制取直径为5 mm菌碟, 转接至PDA平板上, 分别置于15 ℃和30 ℃的培养箱黑暗培养, 7 d后测量菌落直径, 计算生长速率。
2 结果与分析 2.1 抗药性突变体频率将野生敏感菌株S-1接种到含有0.2 μg · mL-1咪鲜胺的PDA平板上, 驯化培养20 d。将能快速生长形成角突变扇形的菌落转接到含有0.2 μg · mL-1咪鲜胺的PDA平板上验证, 仍然能够迅速生长的视为抗药性突变体。驯化培养3 000个菌碟, 共获得30个抗药性突变体(R-1—R-30), 突变频率为1%, 说明稻瘟病菌对咪鲜胺产生抗药性变异的频率较高。
2.2 抗药性突变体的抗性水平及抗性突变频率测定抗药性突变体对咪鲜胺的抗药性并计算抗性指数, 划分抗药性突变体的抗性水平。如表 1所示:30个抗药性突变体的抗性指数介于3.2~7.0, 均属于低抗水平。
| 菌株 Strain |
回归方程 Regression equation |
R2 | EC50/(μg·mL-1) | 抗性指数 Resistance index |
抗性水平 Resistance level |
| S-1 | Y=1.809X+7.127 | 0.993 | 0.067 | ||
| R-1 | Y=1.352X+5.595 | 0.999 | 0.363 | 5.4 | LR |
| R-2 | Y=1.331X+5.605 | 0.988 | 0.351 | 5.3 | LR |
| R-3 | Y=0.699X+5.279 | 0.993 | 0.399 | 6.0 | LR |
| R-4 | Y=0.230X+5.531 | 0.998 | 0.370 | 5.6 | LR |
| R-5 | Y=1.798X+5.763 | 0.997 | 0.377 | 5.7 | LR |
| R-6 | Y=1.363X+5.558 | 0.994 | 0.389 | 5.8 | LR |
| R-7 | Y=0.940X+5.496 | 0.999 | 0.297 | 4.5 | LR |
| R-8 | Y=1.397X+5.596 | 0.994 | 0.375 | 5.6 | LR |
| R-9 | Y=1.269X+5.528 | 0.965 | 0.384 | 5.8 | LR |
| R-10 | Y=1.414X+5.686 | 0.991 | 0.327 | 4.9 | LR |
| R-11 | Y=1.012X+5.334 | 0.996 | 0.467 | 7.0 | LR |
| R-12 | Y=1.348X+5.552 | 0.991 | 0.390 | 5.8 | LR |
| R-13 | Y=1.245X+5.690 | 0.995 | 0.279 | 4.2 | LR |
| R-14 | Y=1.196X+5.531 | 0.996 | 0.360 | 5.4 | LR |
| R-15 | Y=1.031X+5.690 | 0.999 | 0.214 | 3.2 | LR |
| R-16 | Y=0.910X+5.562 | 0.994 | 0.241 | 3.6 | LR |
| R-17 | Y=1.294X+5.553 | 0.992 | 0.374 | 5.6 | LR |
| R-18 | Y=0.958X+5.481 | 0.994 | 0.315 | 4.7 | LR |
| R-19 | Y=0.976X+5.597 | 0.997 | 0.245 | 3.7 | LR |
| R-20 | Y=1.340X+5.814 | 0.991 | 0.247 | 3.7 | LR |
| R-21 | Y=0.979X+5.392 | 0.995 | 0.398 | 6.0 | LR |
| R-22 | Y=0.978X+5.400 | 0.996 | 0.390 | 5.8 | LR |
| R-23 | Y=1.174X+5.774 | 0.986 | 0.219 | 3.3 | LR |
| R-24 | Y=0.900X+5.562 | 0.996 | 0.237 | 3.6 | LR |
| R-25 | Y=0.974X+5.434 | 0.998 | 0.359 | 5.4 | LR |
| R-26 | Y=1.080X+5.605 | 0.993 | 0.275 | 4.1 | LR |
| R-27 | Y=1.326X+5.504 | 0.993 | 0.417 | 6.3 | LR |
| R-28 | Y=1.287X+5.464 | 0.996 | 0.436 | 6.5 | LR |
| R-29 | Y=1.244X+5.549 | 0.996 | 0.362 | 5.4 | LR |
| R-30 | Y=1.285X+5.571 | 0.994 | 0.360 | 5.4 | LR |
| 注:LR:低抗水平Low resistance level. EC50:有效中浓度Median effective concentration.下同。The same as follows. | |||||
将抗药性突变体转接到无药PDA平板上, 连续转代培养8次, 再在室温下保存20 d, 转接培养后, 测定其抗性水平。结果(表 2)显示:30个抗药性突变体在无选择压下转接培养后, 抗药性水平未见显著变化, 仍然保持低抗水平, 说明稻瘟病菌对咪鲜胺的抗药性性状能够稳定遗传。
| 菌株 Strain |
回归方程 Regression equation |
R2 | EC50/ (μg·mL-1) |
抗性指数 Resistance index |
抗性水平 Resistance level |
| R-1 | Y=1.744X+5.525 | 0.996 | 0.500 | 7.5 | LR |
| R-2 | Y=1.667X+5.740 | 0.988 | 0.360 | 5.4 | LR |
| R-3 | Y=1.047X+5.286 | 0.988 | 0.533 | 8.0 | LR |
| R-4 | Y=1.149X+5.495 | 0.985 | 0.371 | 5.6 | LR |
| R-5 | Y=1.343X+5.468 | 0.961 | 0.448 | 6.7 | LR |
| R-6 | Y=1.205X+5.293 | 0.991 | 0.571 | 8.6 | LR |
| R-7 | Y=1.023X+5.491 | 0.994 | 0.331 | 5.0 | LR |
| R-8 | Y=1.631X+5.463 | 0.988 | 0.520 | 7.8 | LR |
| R-9 | Y=1.455X+5.766 | 0.978 | 0.297 | 4.5 | LR |
| R-10 | Y=1.399X+5.515 | 0.997 | 0.428 | 6.4 | LR |
| R-11 | Y=1.598X+5.573 | 0.972 | 0.438 | 6.6 | LR |
| R-12 | Y=1.023X+5.241 | 0.992 | 0.581 | 8.7 | LR |
| R-13 | Y=1.578X+5.648 | 0.990 | 0.389 | 5.8 | LR |
| R-14 | Y=1.062X+5.291 | 0.988 | 0.532 | 8.0 | LR |
| R-15 | Y=1.190X+5.722 | 0.993 | 0.247 | 3.7 | LR |
| R-16 | Y=1.212X+5.791 | 0.997 | 0.223 | 3.3 | LR |
| R-17 | Y=1.415X+5.448 | 0.986 | 0.482 | 7.2 | LR |
| R-18 | Y=1.343X+5.662 | 0.988 | 0.322 | 4.8 | LR |
| R-19 | Y=1.343X+5.773 | 0.988 | 0.266 | 4.0 | LR |
| R-20 | Y=1.598X+5.507 | 0.997 | 0.482 | 7.2 | LR |
| R-21 | Y=1.559X+5.538 | 0.997 | 0.451 | 6.8 | LR |
| R-22 | Y=1.023X+5.467 | 0.995 | 0.349 | 5.2 | LR |
| R-23 | Y=1.640X+5.755 | 0.993 | 0.346 | 5.2 | LR |
| R-24 | Y=1.171X+5.614 | 0.995 | 0.299 | 4.5 | LR |
| R-25 | Y=1.529X+5.843 | 0.991 | 0.281 | 4.2 | LR |
| R-26 | Y=0.922X+5.478 | 0.985 | 0.303 | 4.6 | LR |
| R-27 | Y=1.155X+5.469 | 0.947 | 0.392 | 5.9 | LR |
| R-28 | Y=1.083X+5.544 | 0.993 | 0.314 | 4.7 | LR |
| R-29 | Y=1.414X+5.461 | 0.985 | 0.472 | 7.1 | LR |
| R-30 | Y=1.325X+5.410 | 0.947 | 0.491 | 7.4 | LR |
从表 3可以看出:随机选取的3个对咪鲜胺产生抗药性的突变体对同类型EBI类杀菌剂氟环唑、戊唑醇和己唑醇的敏感性显著下降。然而, 抗性倍数只有1.3~4.6, 说明咪鲜胺与相同作用机制的氟环唑、戊唑醇和己唑醇存在不完全交互抗性[17-18]。3个咪鲜胺抗性突变体对QoI类杀菌剂嘧菌酯的敏感性则表现了一定程度的降低或增加, 说明咪鲜胺对嘧菌酯不存在交互抗性。
| 杀菌剂 Fungicides |
菌株 Strain |
回归方程 Regression equation |
R2 | EC50/ (μg·mL-1) |
抗性倍数 Resistance multiple |
| 氟环唑 Epoxiconazole |
S | Y=2.080X+5.788 | 0.977 | 0.418 | |
| R | Y=1.125X+5.046 | 0.994 | 0.911 | 2.2 | |
| Y=1.198X+4.884 | 0.980 | 1.251 | 3.0 | ||
| Y=1.132X+4.992 | 0.979 | 1.017 | 2.4 | ||
| 戊唑醇Tebuconazole | S | Y=1.836X+5.166 | 0.984 | 0.812 | |
| R | Y=1.080X+4.481 | 0.978 | 3.026 | 3.7 | |
| Y=1.173X+4.321 | 0.996 | 3.752 | 4.6 | ||
| Y=1.224X+4.704 | 0.978 | 1.745 | 2.1 | ||
| 己唑醇Hexaconazole | S | Y=1.591X+4.993 | 0.978 | 1.011 | |
| R | Y=1.116X+4.794 | 0.988 | 1.529 | 1.5 | |
| Y=1.336X+4.646 | 0.991 | 1.842 | 1.8 | ||
| Y=1.044X+4.885 | 0.951 | 1.289 | 1.3 | ||
| 嘧菌酯 Azoxystrobin |
S | Y=2.061X+8.538 | 0.990 | 0.019 | |
| R | Y=1.836X+7.972 | 0.963 | 0.024 | 1.3 | |
| Y=1.568X+7.615 | 0.979 | 0.022 | 1.2 | ||
| Y=2.619X+9.850 | 0.994 | 0.014 | 0.7 | ||
| 注:S:敏感菌株S-1 Sensitive strain S-1;R:随机选取的3个抗药性突变体Three resistance mutants randomly selected. | |||||
测定敏感菌株S-1和抗药性突变体在PDA平板上的菌丝线性生长速率。从图 1可以看出:与敏感菌株S-1相比, 有12个抗药性突变体生长速率极显著下降, 其余无显著变化。
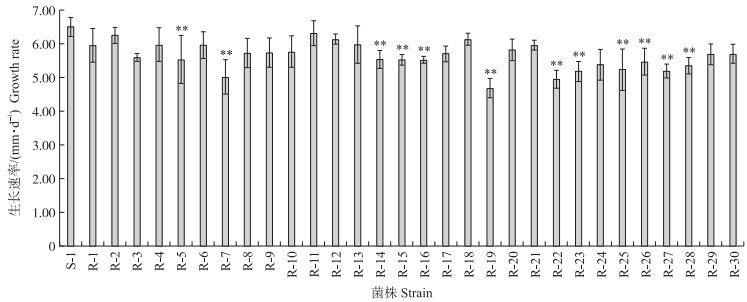
|
图 1 稻瘟病菌敏感菌株和咪鲜胺抗药性突变体的生长速率 Fig. 1 Growth rate of the M. oryzae sensitive strain S-1 and its prochloraz-resistance mutants * *表示相同处理下抗药性突变体的生长速率与S-1在0.01水平差异显著(Duncan ’ s新复极差法)。下同。 * * indicates the significant differences of S-1 and the resistant mutations under the same treatment at 0.01 level by Duncan ' s multiple range test. The same below. |
测定稻瘟病菌敏感菌株S-1和咪鲜胺抗性突变体产孢量。结果(图 2)显示, 与敏感菌株S-1相比, 抗药性突变体分生孢子产量出现不同程度下降。说明稻瘟病菌对咪鲜胺发生抗药性突变的同时, 也降低了无性繁殖能力, 从而使分生孢子产量下降。
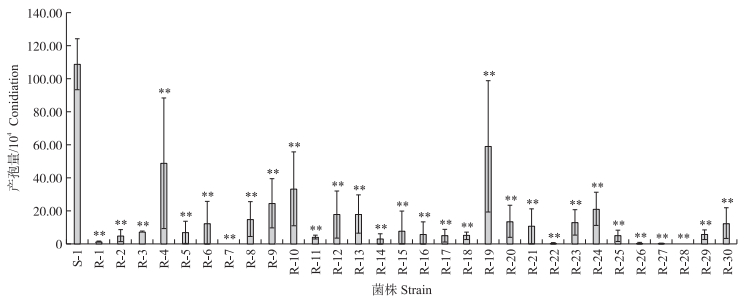
|
图 2 稻瘟病菌敏感菌株和咪鲜胺抗药性突变体的分生孢子量 Fig. 2 Conidia production of the M. oryzae sensitive strain S-1 and its prochloraz-resistance mutants |
测定稻瘟病菌敏感菌株S-1和咪鲜胺抗药性突变体在低于(15 ℃)或高于(30 ℃)菌丝生长最适温度下的生长速率。结果如图 3所示, 在较低温度(15 ℃)下培养, 多数抗药性突变体的生长速率显著低于敏感菌株, 在较高温度(30 ℃)下所有抗药性突变体的生长速率显著低于敏感菌株。说明稻瘟病菌咪鲜胺抗药性突变体对温度变化的适合度下降。
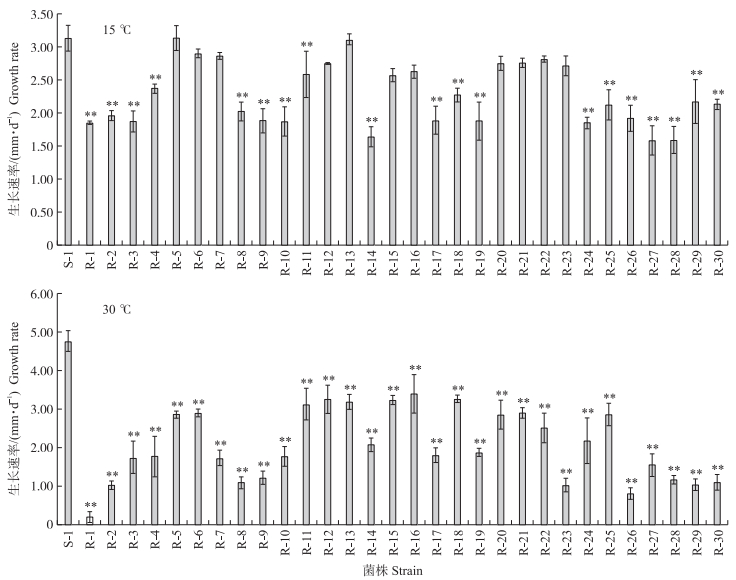
|
图 3 在不同温度下稻瘟病菌咪鲜胺抗药性突变体的生长速率 Fig. 3 Growth rate of the M. oryzae sensitive strain S-1 and its prochloraz-resistance mutants under different temperature |
在大麦叶片上测定稻瘟病菌敏感菌株S-1和咪鲜胺抗药性突变体的致病力。结果(图 4)表明:与敏感菌株S-1相比, 20个抗药性突变体致病力显著下降, 10个失去致病性(R-1、R-4、R-5、R-11、R-12、R-22、R-23、R-2、R-26和R-27)。

|
图 4 稻瘟病菌敏感菌株和咪鲜胺抗药性突变体致病力比较 Fig. 4 Representative photographs of infected barley leaves inoculated with mycelial pellets of the M. oryzae sensitive strain S-1 and its prochloraz-resistance mutants |
虽然田间尚未发现对咪鲜胺产生抗药性的稻瘟病菌菌株, 但是该杀菌剂作用位点单一且被大量广泛使用, 所以其对稻瘟病菌的选择压力不应被忽视。已知病原菌产生抗药性的风险不仅与药剂靶标突变频率、抗药性水平及相对适合度有关, 也与病原菌的繁殖速率及同类杀菌剂使用的选择压力等因素有关。为了评估稻瘟病菌对咪鲜胺的抗药性风险, 本研究将敏感菌株在咪鲜胺亚致死剂量下驯化培养, 发现稻瘟病菌对咪鲜胺的抗药性突变频率可达1%, 说明稻瘟病菌在连续的选择压下容易对咪鲜胺产生抗药性。然而, 获得的30个抗药性突变体均表现为低抗水平, 并且其抗药性可稳定遗传。
尽管咪鲜胺与戊唑醇都作用于麦角甾醇生物合成途径中的14α-脱甲基酶[19], 而且已知戊唑醇抗药性突变体与同类型EBI类杀菌剂苯醚甲环唑和烯唑醇具有交互抗性[18], 但本研究发现稻瘟病菌咪鲜胺抗药性突变体与水稻上常用的同类型EBI类杀菌剂氟环唑、戊唑醇和己唑醇只存在不完全交互抗性, 说明稻瘟病菌对咪鲜胺的抗药性风险低于戊唑醇。另外, 咪鲜胺与水稻上使用的不同类型QoI类杀菌剂嘧菌酯之间不存在交互抗性。
抗药性遗传变异往往会伴有其他生物学性状的改变, 影响抗药性突变体与敏感菌株在自然环境中的竞争力。因此, 抗药性菌株的适合度是评价抗药性风险的重要参数[20]。目前报道的大多数植物病原菌抗药性突变体适合度都低于敏感菌株。鲜菲[18]通过药剂驯化得到的稻瘟病菌戊唑醇抗药性突变体, 其无性繁殖能力不变或显著降低, 生长速率和致病力显著降低。张晓柯等[21]从田间检测到的氟吡菌酰胺抗性草莓灰霉菌株的致病力和生长速率也显著低于敏感菌株。本文通过对30个咪鲜胺抗药性突变体的菌丝生长速率、产孢量、致病力以及在低温和高温条件下的生长速率进行测定, 发现40%的抗药性突变体的菌丝生长速率显著降低, 有60%的抗药性突变体无显著变化; 所有抗药性突变体分生孢子产量出现不同程度下降, 说明稻瘟病菌在发生咪鲜胺抗性的遗传变异时降低了无性繁殖能力。抗药性突变体对15 ℃低温或30 ℃高温更加敏感, 线性生长速率显著下降。在离体大麦叶片上测定致病力时也发现有1/3的突变体完全丧失了致病力, 其余2/3的抗药性突变体致病力也显著下降。
综上所述, 稻瘟病菌对咪鲜胺产生抗药性的变异频率虽然较高, 但与水稻上常用的杀菌剂无完全交互抗药性, 而且抗药性突变体的生长速率、繁殖能力、致病力及对环境温度变化的适合度显著下降, 在自然环境下降低了与敏感种群的竞争力, 不易形成抗药性群体, 抗药性风险较低。
| [1] |
Ishii H, Hollomon D W. Fungicide Resistance in Plant Pathogens[M]. Tokyo: Springer, 2015.
|
| [2] |
Law J W, Ser H L, Khan T M, et al. The potential of streptomyces as biocontrol agents against the rice blast fungus, Magnaporthe oryzae(Pyricularia oryzae)[J]. Frontiers in Microbiology, 2017, 8: 3. |
| [3] |
钟宝玉, 黄德超, 朱小源, 等. 近十年广东稻瘟病菌生理小种变化分析[J]. 仲恺农业工程学院学报, 2018, 31(1): 24-29. Zhong B Y, Huang D C, Zhu X Y, et al. Analysis of physiological races of Magnaporthe oryzae in Guangdong during recent decade[J]. Journal of Zhongkai University of Agriculture and Engineering, 2018, 31(1): 24-29 (in Chinese with English abstract). DOI:10.3969/j.issn.1674-5663.2018.01.005 |
| [4] |
Ryder L S, Talbot N J. Regulation of appressorium development in pathogenic fungi[J]. Current Opinion in Plant Biology, 2015, 26: 8-13. |
| [5] |
Martin-Urdiroz M, Oses-Ruiz M, Ryder L S, et al. Investigating the biology of plant infection by the rice blast fungus Magnaporthe oryzae[J]. Fungal Genetics and Biology, 2016, 90: 61-68. DOI:10.1016/j.fgb.2015.12.009 |
| [6] |
Yoshii A, Moriyama H, Fukuhara T. The novel kasugamycin 2'-N-acetyltransferase gene, aac(2 ')-Ⅱa, encoded by the IncP island confers kasugamycin resistance to rice-pathogenic bacteria[J]. Applied and Environmental Microbiology, 2012, 78(16): 5555-5564. DOI:10.1128/AEM.01155-12 |
| [7] |
Zhu D, Kang H X, Li Z Q, et al. A genome-wide association study of field resistance to Magnaporthe oryzae in rice[J]. Rice, 2016, 9(1): 44. DOI:10.1186/s12284-016-0116-3 |
| [8] |
王海宁.辽宁省稻瘟病菌抗药性研究[D].沈阳: 沈阳农业大学, 2016. Wang H N. The study on resistance of Pyricularia oryzae from Liaoning Province[D]. Shenyang: Shenyang Agricultural University, 2016(in Chinese with English abstract). |
| [9] |
Hayashi K, Ashizawa T, Sasaya T, et al. Rapid PCR technique to detect QoI-resistant strains of Magnaporthe oryzae[J]. Journal of General Plant Pathology, 2015, 81(2): 131-135. DOI:10.1007/s10327-014-0573-8 |
| [10] |
Zhang C Q, Zhu G N, Ma Z H, et al. Isolation, characterization and preliminary genetic analysis of laboratory tricyclazole-resistant mutants of the rice blast fungus, Magnaporthe grisea[J]. Journal of Phytopathology, 2006, 154(7/8): 392-397. |
| [11] |
Golembiewski R C, Vargas J M, Jones A L, et al. Detection of demethylation inhibitor(DMI)resistance in Sclerotinia homoeocarpa populations[J]. Plant Disease, 1995, 79(5): 491-493. DOI:10.1094/PD-79-0491 |
| [12] |
叶滔, 马志强, 王文桥, 等. 禾谷镰孢菌对戊唑醇抗药性的诱导及抗性菌株特性研究[J]. 农药学学报, 2011, 13(3): 261-266. Ye T, Ma Z Q, Wang W Q, et al. Resistance induction of Fusarium graminearum to tebuconazole and bionomics of resistant-mutants[J]. Chinese Journal of Pesticide Science, 2011, 13(3): 261-266 (in Chinese with English abstract). DOI:10.3969/j.issn.1008-7303.2011.03.08 |
| [13] |
兰波, 李湘民, 黄瑞荣, 等. 江西省稻瘟病菌对富士一号的抗药性研究[J]. 江西农业大学学报, 2007, 29(3): 351-355. Lan B, Li X M, Huang R R, et al. The resistance of different strains of rice blast(Magnaporthe grisea)in Jiangxi Province to isoprothiolane[J]. Acta Agriculturae Universitatis Jiangxiensis, 2007, 29(3): 351-355 (in Chinese with English abstract). DOI:10.3969/j.issn.1000-2286.2007.03.006 |
| [14] |
罗彦涛, 孟润杰, 赵建江, 等. 马铃薯晚疫病菌对氟吡菌胺抗性突变体的获得及其生物学性状[J]. 中国农业科学, 2016, 49(19): 3733-3745. Luo Y T, Meng R J, Zhao J J, et al. Acquisition and biological characteristics of fluopicolide-resistant isolates in Phytophthora infestans[J]. Scientia Agricultura Sinica, 2016, 49(19): 3733-3745 (in Chinese with English abstract). DOI:10.3864/j.issn.0578-1752.2016.19.006 |
| [15] |
李恒奎, 陈长军, 王建新, 等. 禾谷镰孢菌对氰烯菌酯的敏感性基线及室内抗药性风险初步评估[J]. 植物病理学报, 2006, 36(3): 273-278. Li H K, Chen C J, Wang J X, et al. Study on baseline-sensitivity of Fusarium graminearum to JS399-19 and assessment of the risk of resistance in vitro[J]. Acta Phytopathologica Sinica, 2006, 36(3): 273-278 (in Chinese with English abstract). DOI:10.3321/j.issn:0412-0914.2006.03.012 |
| [16] |
Chen Y, Zhai S, Sun Y, et al. MoTup1 is required for growth, conidiogenesis and pathogenicity of Magnaporthe oryzae[J]. Molecular Plant Pathology, 2015, 16(8): 799-810. DOI:10.1111/mpp.2015.16.issue-8 |
| [17] |
胡燕, 王怀训, 夏晓明, 等. 四地区小麦纹枯病菌对6种杀菌剂的抗性比较[J]. 植物保护学报, 2006, 33(4): 423-427. Hu Y, Wang H X, Xia X M, et al. Susceptibility of Rhizoctonia cerealis to six fungicides in four wheat areas[J]. Journal of Plant Protection, 2006, 33(4): 423-427 (in Chinese with English abstract). DOI:10.3321/j.issn:0577-7518.2006.04.017 |
| [18] |
鲜菲.西南地区稻瘟病菌对戊唑醇的抗性监测及抗性分子机理研究[D].重庆: 西南大学, 2016. Xian F. Monitoring and molecule mechanisms of resistance to tebuconazole by Magnaporthe oryzae in Southwest China[D]. Chongqing: Southwest University, 2016(in Chinese with English abstract). |
| [19] |
Hamamoto H, Hasegawa K, Nakaune R, et al. Tandem repeat of a transcriptional enhancer upstream of the sterol 14α-demethylase gene(CYP51)in Penicillium digitatum[J]. Applied and Environmental Microbiology, 2000, 66(8): 3421-3426. DOI:10.1128/AEM.66.8.3421-3426.2000 |
| [20] |
Ziogas B N, Markoglou A N, Spyropoulou V. Effect of phenylpyrrole-resistance mutations on ecological fitness of Botrytis cinerea and their genetical basis in Ustilago maydis[J]. European Journal of Plant Pathology, 2005, 113(1): 83-100. DOI:10.1007/s10658-005-1227-7 |
| [21] |
张晓柯, 韩絮, 马薇薇, 等. 江苏省草莓灰霉病菌对氟吡菌酰胺敏感性基线的建立及抗性风险评估[J]. 南京农业大学学报, 2015, 38(5): 810-815. Zhang X K, Han X, Ma W W, et al. Baseline sensitivity of fluopyram and its resistance risk assessment against Botrytis cinerea from strawberry in Jiangsu Province[J]. Journal of Nanjing Agricultural University, 2015, 38(5): 810-815 (in Chinese with English abstract). DOI:10.7685/j.issn.1000-2030.2015.05.016 |




