文章信息
- 汤崴, 白云赫, 胡雨晴, 王晨, 崔梦杰, 张文颖, 房经贵
- TANG Wei, BAI Yunhe, HU Yuqing, WANG Chen, CUI Mengjie, ZHANG Wenying, FANG Jinggui
- 葡萄木质素相关基因PAL、4CL和CAD特征鉴定及其应答赤霉素在果实发育过程中的作用
- Characterization of grape lignin-related genes PAL, 4CL, CAD and the role of GA in the berry development
- 南京农业大学学报, 2019, 42(3): 430-439
- Journal of Nanjing Agricultural University, 2019, 42(3): 430-439.
- http://dx.doi.org/10.7685/jnau.201802028
-
文章历史
- 收稿日期: 2018-02-24
2. 浙江大学农业与生物技术学院, 浙江 杭州 310028
2. College of Agriculture and Biotechnology, Zhejiang University, Hangzhou 310028, China
葡萄(Vitis vinifera L.)是世界上重要的栽培果树, 需求量和栽培量逐渐增加, 无核葡萄因其风味口感较好而市场需求量日益增大[1]。木质素是葡萄种子的重要组成物质, 在葡萄浆果发育过程中抑制木质素的合成可诱导形成无籽葡萄[2]。木质素在高等植物天然化合物中含量仅次于纤维素, 主要由木质素单体聚合而成[3]。苯丙氨酸解氨酶(PAL)、4-香豆酸-辅酶A连接酶(4CL)、肉桂醇脱氧酶(CAD)为控制木质素合成的3个关键酶[4-6]。PAL存在于大部分高等植物中, 影响植物木质化过程并在抗虫、抗逆等过程中起到重要作用[7-10]。4CL是植物调控木质素代谢、参与类黄酮和其他次生代谢产物合成的关键酶, 位于苯丙氨酸生物合成途径的分支点上, 控制碳流进入下游不同代谢支路[11-12]。CAD是催化木质素单体合成最后一步的关键酶, 它能够将木质素前体和木脂素类物质转化成木质素单体。在葡萄硬核形成过程中, 会出现细胞壁内木质素积累现象, 即发育木质化现象, 其主要出现在植物木质部、种子种皮和果实果皮中。近年来, 关于木质素在果实中合成机制的研究越来越多, 如枣、桃、梨等[13-15], 但在葡萄中的研究却相对较少, 因此研究葡萄果实发育过程中木质素合成关键基因的表达分析对于无核果实的研究具有重要意义。
赤霉素(GA)是植物花和果实发育的必需植物激素, GA在葡萄成花诱导、花序伸长、诱导无籽果实以及果实膨大中起重要作用[16-17]。目前有关GA调控木质素合成影响葡萄核发育的研究较少。因此, 本试验以‘白罗莎’葡萄为试材, 利用GA调控木质素的合成来分析GA对诱导葡萄果实无核影响, 了解木质素合成关键基因VvPAL、Vv4CL和VvCAD不同时期的时空表达图谱, 并结合葡萄果实发育过程中形态指标综合阐释了3个基因在葡萄果实发育过程的潜在调控作用, 为葡萄木质素合成关键酶基因的功能分析奠定基础。
1 材料与方法 1.1 试验材料试验于2016年5月11日至8月21日在江苏省农博园葡萄园内进行。园区位于句容市, 属于亚热带季风气候, 年均气温15.4 ℃, 年降雨量1 150 mm。供试材料为5年生、欧亚种葡萄‘白罗莎’, 株距1 m, 行距2.5 m, 双十字V型架, 避雨栽培。选取生长势、负载量较为一致的植株, 根据前人研究和预试验结果, 设置50 mg · L-1赤霉素(GA)水溶液处理, 以清水处理作为对照, 每个处理选择6株长势较为一致的植株, 每2株为1个重复, 共设3次重复。于葡萄盛花期(5月12日)进行浸蘸花穗处理, 每次30 s, 共浸蘸3次。试验分别从每组对照与处理的植株中随机选择4果穗, 每穗上、中、下3个部位分别随机采取若干个果粒。采集后的样品一半用于生理指标测定及体式显微镜观察等; 另一半用液氮速冻后带回实验室于-70 ℃冰箱中保存。利用CTAB方法[18]提取葡萄果实RNA, 用反转录试剂盒Prime ScriptTM RT-PCR(TaKaRa)合成cDNA。
1.2 VvPAL、Vv4CL和VvCAD基因序列相关分析利用NCBI网站的BLASTp程序进行同源序列比对; DNAMAN 6.0软件分析其氨基酸序列; 利用NCBI中Conserved Domains(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)程序进行蛋白保守域结构预测; 利用在线软件MEME(http://meme-suite.org/tools/meme)进行蛋白质作用元件分析。利用PredictProtein在线软件(http://www.predictprotein.org/)进行蛋白质亚细胞定位预测。
1.3 VvPAL、Vv4CL和VvCAD基因的启动子作用元件分析根据基因编号VIT_16s0039g01130(VvPAL)、VIT_11s0052g01090(Vv4CL)和VIT_04s0044g00210(VvCAD), 在Grape Genome Browser(http://www.genoscope.cns.fr/externe/GenomeBrowser/Vitis/)中寻找每一个基因序列上游1 500 bp的片段, 即获得基因的启动子序列, 将其放入PlantCARE中(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/), 即可查找到每个基因的启动子所对应的作用元件, 从而预测每一个基因潜在的生物学功能。
1.4 VvPAL、Vv4CL和VvCAD基因的表达分析葡萄芯片数据来源于NCBI的GEO数据库芯片平台GPL13936, 芯片编号GSE36128, 葡萄芯片数据包括54个葡萄样品, 覆盖了不同阶段的大部分葡萄器官。不同组织中基因表达的差异运用HemI软件进行热图的绘制。
1.5 VvPAL、Vv4CL和VvCAD基因在葡萄果实发育过程中的表达采用VvACTIN(XM_002273532)作为内参基因。根据定量PCR引物的设计原则, 利用Primer3 Input(http://primer3.ut.ee/), 对VvPAL、Vv4CL和VvCAD基因设计定量PCR引物, VvPAL1-F:TTACGATATCGCAGGTGGCG, VvPAL1-R:TGAAGGGCACCACCTTGTTT; Vv4CL2-F:CGACGGCGAATCCGTTTTAC, Vv4CL2-R:TTCGTCAGCTCCGAGAAGTG; VvCAD9-F:AAGCATCTGGGTGTGTCTGG, VvCAD9-R:GGAGAGAA-GGAAGGCATCGG。按照SYBR Premix ExTaqTM试剂盒(宝生物工程有限公司)操作指导, 采用实时荧光定量PCR(RT-qPCR)方法, 检测基因的相对表达量。扩增体系20 μL:1 μL cDNA, 上、下游引物各0.4 μL, 10 μL 2×TransStart® Tip Green qPCR SuperMix, 8.2 μL ddH2O。反应程序为:94 ℃ 30 s; 94 ℃ 5 s, 60 ℃ 15 s, 72 ℃ 10 s, 40个循环。试验设置3次重复。反应结束后分析荧光值变化曲线以及熔解曲线。试验数据采用2-ΔΔCT法分析。
1.6 数据处理试验数据采用Excel 2016软件进行整理和作图, DPS软件进行显著性分析。
2 结果与分析 2.1 赤霉素处理对葡萄果实发育的影响由图 1可见:在葡萄果实发育过程中, 果实颜色逐渐退绿, 转为浅绿色。清水处理(对照, CK)的葡萄种子正常发育, 种子中胚发育正常, 且存在明显的木质化过程。而经过GA处理的葡萄产生无籽果实, 核区发生明显退化, 且与CK相比, GA处理的葡萄果刷长度变短且直径变小。由于种子和果刷主要成分是纤维素和木质素类物质, 且GA诱导处理葡萄果核退化明显, 木质化程度显著降低。

|
图 1 赤霉素(GA)处理对‘白罗莎’葡萄果实发育的影响 Fig. 1 Effects of gibberellin(GA)treatment on fruit development of'Rosario Bianco'grape |
以拟南芥PAL(AT5G04230)、4CL(AT1G51680)和CAD(AT4G34230)的基因序列为信息探针, 对葡萄基因组进行BLAST搜索, 得到VvPAL1、Vv4CL2和VvCAD9基因在葡萄染色体中的基因位置、序列和编号信息(表 1)。
| 基因名称 Gene name |
基因编号 Gene code |
基因长度/bp Length of gene |
染色体 Chromosome |
位置 Position |
| VvPAL1 | VIT_16s0039g01130 | 3 050 | 16 | 619 675~622 725 |
| Vv4CL2 | VIT_11s0052g01090 | 4 031 | 11 | 18 816 428~18 820 459 |
| VvCAD9 | VIT_04s0044g00210 | 2 564 | 4 | 20 897 658~20 900 222 |
将VvPAL1、Vv4CL2、VvCAD9基因编码的氨基酸序列与其他同源物种进行比对, 结果显示:VvPAL1与榴莲(Durio zibethinus)、陆地棉(Gossypium hirsutum)、蓖麻(Ricinus communis)等物种的蛋白相似性达98%以上; Vv4CL2与核桃(Juglans regia)、毛果杨(Populus trichocarpa)和柑橘(Citrus sinensis)等物种的蛋白相似性达95%以上; 而VvCAD9与月季(Rosa chinensis)、欧洲李(Prunus domestica)、麻疯树(Jatropha curcas)的蛋白相似性为100%。通过与同源物种的进化分析显示, 葡萄VvPAL、Vv4CL和VvCAD蛋白序列具有高度的保守性。
2.3.2 基因序列进化与基因结构分析将VvPAL1、Vv4CL2和VvCAD9基因序列以及基因结构分别与其他物种进行比对分析, 结果如图 2所示。与其他物种相比, VvPAL、Vv4CL和VvCAD基因的进化保守性较强。VvPAL1基因与枣树的ZjPAL有较近的亲缘关系; VvCAD9基因与ZjCAD基因有较近的亲缘关系; 而Vv4CL2基因, 除枣树Zj4CL2基因外, 与其他物种的亲缘关系相对较远。基因结构分析显示, 4CL与CAD基因均含有5个外显子及4个内含子, PAL基因均含有2个外显子和1个内含子。且PAL、4CL、CAD基因内含子与外显子的分布位置较为相似, 推断VvPAL、Vv4CL、VvCAD这3个基因进化保守性较强。
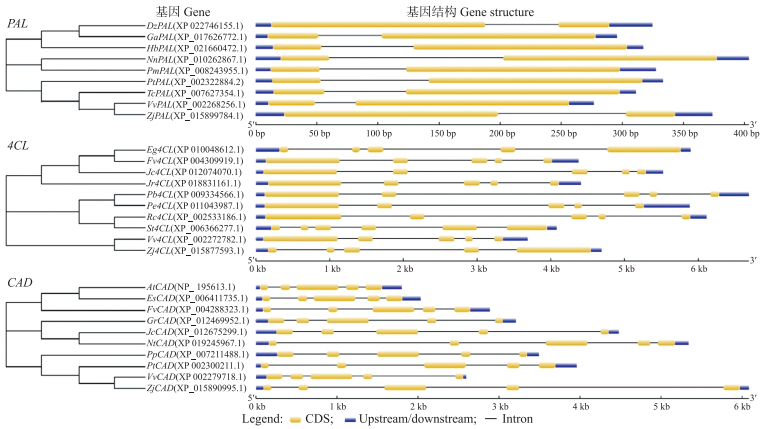
|
图 2 葡萄PAL、4CL和CAD基因序列进化与基因结构分析 Fig. 2 Sequence phylogeny and gene structure analysis of PAL, 4CL and CAD in grape Vv:葡萄Vitis vinifera; Dz:榴莲Durio zibethinus; Ga:木本棉Gossypium arboreum; Hb:橡胶树Hevea brasiliensis; Nn:莲花Nelumbo nucifera; Pm:梅花Prunus mume; Pt:毛果杨Populus trichocarpa; Tc:可可Theobroma cacao; Zj:枣树Ziziphus jujuba; Fv:草莓Fragaria vesca; Pb:梨树Pyrus × bretschneideri; Jr:核桃Juglans regia; Pe:胡杨Populus euphratica; Jc:麻疯树Jatropha curcas; Rc:蓖麻Ricinus communis; Eg:桉树Eucalyptus grandis; Nt:烟草Nicotiana tabacum; St:马铃薯Solanum tuberosum; At:拟南芥Arabidopsis thaliana; Es:藻类Eutrema salsugineum; Gr:棉花Gossypium raimondii; Pp:桃树Prunus persica.下同。The same as follows. |
利用NCBI中保守结构域分析程序对VvPAL、Vv4CL和VvCAD编码的蛋白和其他同源物种进行蛋白质保守结构域分析, 如图 3所示。PAL蛋白均含有pfam-Lyase-aromatic保守结构域, 4CL蛋白均含有pfam-AMP-binding和pfam-AMP-binding-c保守结构域, CAD蛋白均含有pfam-ADH-N和pfam-ADH-zinc-N保守结构域, 表明VvPAL、Vv4CL和VvCAD和其他同源物种的蛋白质保守结构域相似。

|
图 3 葡萄与其他物种的PAL、4CL、CAD的蛋白质保守结构域分析 Fig. 3 Protein conserved domain analysis of PAL, 4CL, CAD in grape and other species |
亚细胞定位预测表明:VvPAL、Vv4CL和VvCAD主要集中在细胞质和细胞膜中表达(表 2)。推测可知, VvPAL、Vv4CL、VvCAD表达部位、表达量不同, 可能与木质素合成途径的冗杂性相关。通过蛋白互作预测发现, 葡萄VvPAL、Vv4CL、VvCAD蛋白分别与5个蛋白互作表达(表 3), VvPAL亚体互作蛋白主要是4CL和肉桂酸-4-羟化酶(C4H), Vv4CL互作蛋白主要是C4H蛋白, VvCAD互作蛋白主要是咖啡酸甲基转移酶蛋白(OMT)。
| % | |||||||
| 蛋白 Protein |
细胞质 Cytoplasm |
叶绿体 Chloroplast |
细胞核 Nucleus |
细胞膜 Membrane |
线粒体 Mitochondria |
液泡 Vacuole |
内质网 Endoplasmic reticulum |
| VvPAL1 | 7.69 | 30.77 | 15.39 | 15.39 | 7.68 | 0 | 23.08 |
| Vv4CL2 | 15.39 | 0 | 0 | 46.15 | 0 | 23.07 | 15.39 |
| VvCAD9 | 76.92 | 0 | 0 | 7.69 | 0 | 15.39 | 0 |
| 基因编号Gene code | 基因名称Gene name | 功能预测Function prediction |
| VIT_16s0039g01130 | PAL1 | 苯丙氨酸解氨酶Phenylalanine ammonia-lyase |
| VIT_11s0052g01110 | 4CL1 | 4-香豆酸-辅酶A连接酶4-coumaric acid-CoA ligase |
| VIT_11s0052g01090 | 4CL2 | 4-香豆酸-辅酶A连接酶4-coumaric acid-CoA ligase |
| VIT_06s0004g08150 | C4H | 肉桂酸-4-羟化酶Cinnamate-4-hydroxylase |
| VIT_08s0058g01000 | ASP1 | 天冬氨酸转氨酸Aspartate aminotransferase |
| VIT_06s0061g00450 | 4CL7 | 4-香豆酸-辅酶A连接酶4-coumaric acid-CoA ligase |
| VIT_11s0052g01090 | 4CL2 | 4-香豆酸-辅酶A连接酶4-coumaric acid-CoA ligase |
| VIT_11s0078g00290 | C4H1 | 肉桂酸-4-羟化酶Cinnamate-4-hydroxylase |
| VIT_06s0004g08150 | C4H2 | 肉桂酸-4-羟化酶Cinnamate-4-hydroxylase |
| VIT_11s0065g00350 | C4H4 | 肉桂酸-4-羟化酶Cinnamate-4-hydroxylase |
| VIT_09s0070g00240 | CCR1 | 肉桂基还原酶Cinnamoyl-reductase |
| VIT_04s0023g02900 | FAH1 | 二甲醛5-羟化酶Coniferylaldehyde 5-hydroxylase |
| VIT_04s0044g00210 | CAD9 | 肉桂醇脱氢酶Cinnamyl alcohol dehydrogenase |
| VIT_15s0048g02490 | COMT1 | 茶酚-O-甲基转移酶Catechol O-methyltransferase |
| VIT_15s0048g02460 | OMT1 | 咖啡酸氧甲基转移酶Caffeic acid O-methyltransferase |
| VIT_18s0072g00920 | OMT3 | 咖啡酸氧甲基转移酶Caffeic acid O-methyltransferase |
| VIT_19s0135g00030 | OMT4 | 咖啡酸氧甲基转移酶Caffeic acid O-methyltransferase |
| VIT_09s0070g00240 | CCR1 | 肉桂基还原酶Cinnamoyl-reductase |
由图 4可知:葡萄VvPAL1、Vv4CL2、VvCAD9基因转录因子家族所含有的启动子作用元件大致可分为5类, 分别为光反应相关响应元件、激素相关响应元件、胁迫相关响应元件、组织特异性响应元件和周期节律相关的元件。除了VvCAD9基因没有周期节律性相关元件外, VvPAL1和Vv4CL2基因启动子都含有上述5类作用元件, 其中光反应响应元件数量最多, 激素相关响应元件和组织特异性响应元件也占较高的比例。
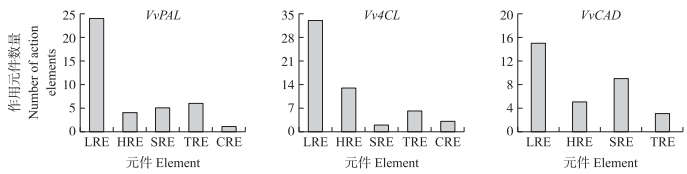
|
图 4 VvPAL1、Vv4CL2和VvCAD9基因启动子作用元件分析 Fig. 4 Analysis of VvPAL1, Vv4CL2 and VvCAD9 gene promoter action elements LRE:光反应相关响应元件Light reaction related response element; HRE:激素相关响应元件Hormone related response element; SRE:胁迫相关响应元件Stress related response element; TRE:组织特异性响应元件Tissue specificity response element; CRE:周期节律相关元件Circadian rhythms related element.下同。The same as follows. |
由表 4可见:3个基因的激素相关响应元件中均含有茉莉酸甲酯和水杨酸的响应元件, 在VvPAL1和VvCAD9基因中均含有乙烯响应元件, 其主要是促进果实成熟的作用元件。Vv4CL2基因中含有脱落酸和赤霉素响应元件, 其主要为促进果实生长发育的作用元件。在组织特异性响应元件中, 3个基因均含有胚乳发育作用元件, 推测VvPAL、Vv4CL和VvCAD基因可能与葡萄种子及果实的发育密切相关。
| 基因 Gene |
相关元件 Related element |
元件名称 Element name |
数量 Number |
功能注释 Function annotation |
| VvPAL1 | HRE | CGTCA-motif | 2 | 茉莉酸甲酯响应元件MeJA-response element |
| TGACG-motif | 2 | 茉莉酸甲酯响应元件MeJA-response element | ||
| ERE-element | 2 | 乙烯响应元件Ethylene-response element | ||
| TCA-element | 1 | 水杨酸响应元件Salicylic acid response element | ||
| TRE | AACA_motif | 2 | 胚乳响应元件Endosperm response element | |
| GCN4_motif | 2 | 胚乳响应元件Endosperm response element | ||
| CAT-box | 1 | 分生组织响应元件Meristem response element | ||
| Vv4CL2 | HRE | CGTCA-motif | 6 | 茉莉酸甲酯响应元件MeJA-response element |
| TGACG-motif | 6 | 茉莉酸甲酯响应元件MeJA-response element | ||
| ABRE | 5 | 脱落酸响应元件Abscisic acid response element | ||
| P-box | 1 | 赤霉素响应元件Gibberellin-response element | ||
| TCA-element | 1 | 水杨酸响应元件Salicylic acid response element | ||
| TRE | Skn-1_motif | 5 | 胚乳响应元件Endosperm response element | |
| VvCAD9 | HRE | CGTCA-motif | 2 | 茉莉酸甲酯响应元件MeJA-response element |
| TGACG-motif | 2 | 茉莉酸甲酯响应元件MeJA-response element | ||
| ERE | 1 | 乙烯响应元件Ethylene-response element | ||
| TCA-element | 1 | 水杨酸响应元件Salicylic acid response element | ||
| TRE | O2-site | 1 | 玉米蛋白代谢相关元件Zein metabolism related element | |
| Skn-1_motif | 2 | 胚乳响应元件Endosperm response element |
从葡萄基因芯片中选择VvPAL、Vv4CL和VvCAD在生长全过程中的表达谱, 结果(图 5)显示:VvPAL和Vv4CL基因在葡萄的整个发育过程中均有较高的表达, 均集中于根、穗轴以及种子成熟过程中和衰老枯萎的组织中, 并且Vv4CL基因在芽和花中的表达量也较高; 而VvCAD基因在葡萄发育的过程中集中高表达于种子及种子转色, 中熟和后熟的过程中。VvPAL、Vv4CL和VvCAD基因都高表达于木质化程度较高的组织之中。因此通过调控3个基因的表达强度可直接调节木质素的合成, 进而诱导果核退化产生无籽葡萄。
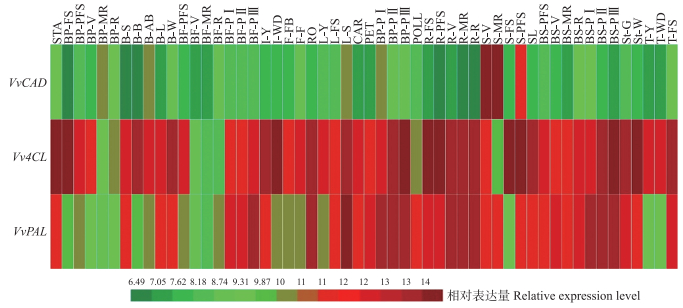
|
图 5 VvPAL、Vv4CL和VvCAD在不同组织中的表达模式 Fig. 5 The expression pattern of VvPAL, Vv4CL and VvCAD gene in different stage and tissues STA:花蕊Stamen; BP-FS:浆果果皮Berry pericarp fruit; BP-PFS:浆果果皮前期Berry pericarp post-fruit; BP-V:浆果果皮转色期Berry pericarp veraison; BP-MR:浆果果皮中熟Berry pericarp mid-ripening; BP-R:浆果果皮成熟Berry pericarp ripening; B-S:芽膨胀Bud swell; B-B:芽展开Bud burst; B-AB:芽后展开Bud after-burst; B-L:潜伏芽Batent bud; B-W:冬芽Winter bud; BF-PFS:浆果果肉Berry flesh post fruit set; BF-V:浆果肉转色期Berry flesh veraison; BF-MR:浆果中成熟Berry flesh mid-ripening; BF-R:浆果肉成熟Berry flesh ripening; BF-PⅠ:浆果果肉收后枯萎Ⅰ Berry flesh post-harvest withering Ⅰ; BF-PⅡ:浆果果肉收后枯萎Ⅱ Berry flesh post-harvest withering Ⅱ; BF-PⅢ:浆果果肉收后枯萎Ⅲ Berry flesh post-harvest withering Ⅲ; I-Y:幼嫩花序Young inflorescence; I-WD:单花分离Well developed inflorescence; F-FB:花开10% Flowering(10% caps off); F-F:花开50% Flowering(50% caps off); RO:根Root; L-Y:幼叶Young leaf; L-FS:成熟叶子Mature leaf; L-S:衰老叶Senescencing leaf; CAR:心皮Carpel; PET:花瓣Petal; BP-PⅠ:浆果果皮收获后枯萎Ⅰ Berry pericarp post-harvest withering Ⅰ; BP-PⅡ:浆果果皮收获后萎凋Ⅱ Berry pericarp post-harvest withering Ⅱ; BP-PⅢ:浆果果皮收获后萎凋Ⅲ Berry pericarp post-harvest withering Ⅲ; POLL:花粉Pollen; R-FS:脊柱果Rachis fruit set; R-PFS:脊柱后果Rachis post fruit set; R-V:穗轴转色Rachis veraison; R-MR:穗轴中熟Rachis mid-ripening; R-R:穗轴成熟Rachis ripening; S-V:种子转色Seed veraison; S-MR:种子中熟Seed mid-ripening; S-FS:种子果实集合Seed fruit set; S-PFS:种子后熟Seed post fruit set; SL:播种Seeding; BS-PFS:浆果皮后熟Berry skin post fruit set; BS-V:浆果皮转色Berry skin veraison; BS-MR:浆果皮中熟Berry skin mid-ripening; BS-R:果皮成熟Berry skin ripeninng; BS-PⅠ:浆果皮收获后枯萎Ⅰ Berry skin post-harvest witheringⅠ; BS-PⅡ:浆果皮收获后萎凋Ⅱ Berry skin berry skin post-harvest withering Ⅱ; BS-PⅢ:浆果皮收获后萎凋Ⅲ Berry skin post-harvest withering Ⅲ; St-G:绿色茎Green stem; St-W:木质茎Woody stem; T-Y:幼嫩卷须Young tendril; T-WD:发达卷须Well developed tendril; T-FS:成熟卷须Mature tendril. |
由图 6可见:在对照(CK)中, VvPAL基因在果皮中的表达量较高, Vv4CL基因在果核中的表达量较高, 而VvCAD基因在各组织的表达量较均衡。在葡萄的果肉、果皮和果核这3个组织中, VvPAL基因的表达趋势随着果实的发育均呈先升后降的趋势, VvPAL基因表达量相对较高的时期在花后46 d果实硬核期到花后60 d果实第2次膨大期。而Vv4CL与VvCAD基因表达趋势随着果实的发育呈先降后升的趋势, 基因的表达量相对较高的时期在花后32 d果实第1次膨大期以及花后80 d果实转色期。
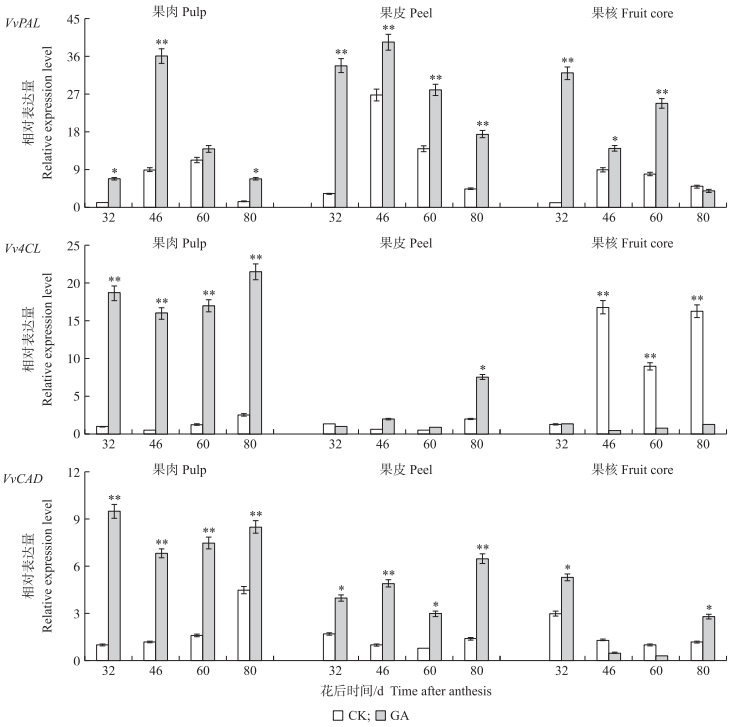
|
图 6 VvPAL、Vv4CL、VvCAD在葡萄不同组织中的表达分析 Fig. 6 Expression analysis of VvPAL, Vv4CL, VvCAD in different tissues of grape *P < 0.05, * *P < 0.01. |
GA处理后, 与CK相比, VvPAL在果肉、果皮和果核中的表达均显著增加, 但其变化趋势相同; Vv4CL在果肉中的表达量极显著升高, 在果皮中的最后一个时期(花后80 d)增加, 其余时期无显著差异, 而在果核中, 除花后32 d外, 其表达量在其余时期均极显著下降; VvCAD在果肉和果皮中的表达量均显著升高, 而在果核中呈现出促进-抑制-促进的表达模式。
3 讨论无核是葡萄极其重要的经济性状, 而葡萄对GA高度敏感, 并且在生产中常使用GA诱导无核葡萄的产生[19-20]。结合我们前期的研究[21-23], 笔者以50 mg · L-1 GA于盛花期处理‘白罗莎’葡萄花穗, 发现GA处理后的葡萄核区明显退化, 形成无核或残核果实, 果刷长度变短、直径变小; 并且明显拉长果实纵经和果穗长度。此外, 赤霉素在其他物种(如番茄[24]、梨[25]、柑橘[26]等)产生无籽果实的过程中同样具有重要作用。
本研究中, VvPAL1、Vv4CL2和VvCAD9基因所编码蛋白与其他同源物种的同源性高达95%以上, 其中VvCAD9与其同源物种的蛋白同源性高达100%, 并且在VvPAL1、Vv4CL2和VvCAD9的基因结构、基因进化分析和功能分析上结果较一致。亚细胞定位预测发现, VvPAL1、Vv4CL2和VvCAD9的表达部位、表达量不同, 表明它们可能与木质素合成途径的冗杂性相关。启动子作用元件分析表明, 3个基因均含有胚乳发育相关的调控元件, 表明它们可能参与无核果实的发育。
研究表明, 杨树PAL基因在木质部和韧皮部纤维组织中的表达丰度较高, 而在木质素含量较低的组织中, 如茎叶、髓部中的表达丰度较低[27]; 将菜豆PAL基因启动子转入烟草中, 发现其主要在花药、柱头、芽中的表达较高, 而在萼片、叶等部位表达较低[28]。在对拟南芥[29]、毛白杨[30]、烟草[31]等植物的研究中发现, 4CL的表达与木质素的形成密切关联。CAD基因在毛白杨[32]、拟南芥[33]、烟草[34]等植物中具有时空表达差异。在高粱[35]中, CAD基因在茎基部的表达量显著高于茎上部, 在叶片中不表达, 在野生型幼苗的节间组织表达丰度较高; 而在黑麦草[36]、小麦[37]茎组织中表达丰度较高。本试验基因芯片表达图谱表明, VvPAL和Vv4CL基因在葡萄的整个发育过程中均有较高的表达, 而VvCAD除在种子转色、种子中熟和种子后熟阶段有较高的表达外, 其余发育时期表达量较低, 表明这3个基因在参与木质素合成的过程中具有时空差异性。
荧光定量PCR表达分析结果表明, VvPAL在果肉、果皮和果核中的表达呈先上升后下降的趋势, GA处理后显著增加了各个时期、不同组织中的表达量, 表明GA处理能增加VvPAL基因的表达, 该结果与王可可[38]的研究结果相反, 可能与材料、处理浓度以及VvPAL参与多种途径有关。Vv4CL基因在果肉、果皮以及果核中第1个时期的表达量低, 而在果核中的后3个时期表达量较高; GA处理后, 果肉中的表达量显著增加, 果核中的表达量显著降低, 而在果皮中的表达量变化不大。表明GA处理促进果肉中Vv4CL表达, 在果核中抑制Vv4CL表达, 该结果与Li等[39]的研究结果一致。可能是由于Vv4CL启动子中含有赤霉素和胚乳响应元件, 同时Vv4CL响应GA, 表达下调造成核区木质素含量下降, 导致无核。GA处理后, 显著上调VvCAD在果肉、果皮中的表达, 而在果核中呈促进-抑制-促进模式, 这与葛茜等[40]和刘尊英等[41]的研究结果有一定的差异。表明VvPAL1、Vv4CL2和VvCAD9虽然都是木质素合成途径中的基因, 但是其响应GA信号调控木质素的合成, 参与果实无核化的机制还需进一步研究。
| [1] |
崔梦杰, 王晨, 张文颖, 等. 无核葡萄研究进展[J]. 植物生理学报, 2017, 53(3): 317-330. Cui M J, Wang C, Zhang W Y, et al. Progress in the study of seedless grapes[J]. Plant Physiology Journal, 2017, 53(3): 317-330 (in Chinese with English abstract). |
| [2] |
汤威, 王洁, 张文颖, 等. 木质素在果实果核退化中的作用[J]. 分子植物育种, 2018, 16(11): 3752-3762. Tang W, Wang J, Zhang W Y, et al. The role of lignin in fruit core degeneration[J]. Molecular Plant Breeding, 2018, 16(11): 3752-3762 (in Chinese with English abstract). |
| [3] |
Baucher M, Chabbert B, Pilate G, et al. Red xylem and higher lignin extract ability by down-regulating a cinnamyl alcohol dehydrogenase in poplar[J]. Plant Physiology, 1996, 112(4): 1479-1490. DOI:10.1104/pp.112.4.1479 |
| [4] |
Boudet A M. Evolution and current status of research in phenolic compounds[J]. Phytochemistry, 2007, 68(22): 2722-2735. |
| [5] |
Yuki T, Chen F, Jin N, et al. Coexistence but in-dependent biosynthesis of catechyl and guaiacyl/syringyl lignin polymers in seed coats[J]. The Plant Cell, 2013, 25: 2587-2600. DOI:10.1105/tpc.113.113142 |
| [6] |
Baucher M, Halpin C, Petit-Conil M, et al. Lignin:genetic engineering and impact on pulping[J]. Critical Reviews in Biochemistry and Molecular Biology, 2003, 38(4): 305-350. DOI:10.1080/10409230391036757 |
| [7] |
Lepelley M, Mashesh V, Mcarthy J, et al. Characterization high-resolution mapping and differential expression of three homologous PAL genes in Coffea canephora Pierre(Rubiaceae)[J]. Planta, 2012, 236: 313-326. DOI:10.1007/s00425-012-1613-2 |
| [8] |
朱海生, 温文旭, 刘建汀, 等. 丝瓜苯丙氨酸解氨酶基因PAL克隆及表达分析[J]. 植物遗传资源学报, 2018, 19(2): 305-313. Zhu H S, Wen W X, Liu J T, et al. Cloning and expression analysis of phenolic alanine ammonia-lyase gene PAL[J]. Journal of Plant Genetic Resources, 2018, 19(2): 305-313 (in Chinese with English abstract). |
| [9] |
宋修鹏, 黄杏, 莫凤连, 等. 甘蔗苯丙氨酸解氨酶基因(PAL)的克隆和表达分析[J]. 中国农业科学, 2013, 46(14): 2856-2868. Song X P, Huang X, Mo F L, et al. Cloning and expression analysis of phenylalanine ammonia lyase gene(PAL)from sugarcane[J]. Chinese Agricultural Science, 2013, 46(14): 2856-2868 (in Chinese with English abstract). DOI:10.3864/j.issn.0578-1752.2013.14.002 |
| [10] |
Aterola A M, Lewis N G. Trends in lignin modmcation:arcomprehensive analysis of the effects of genetic mantipulations/mutations on lignificaton and vascular integrity[J]. Phytochemistry, 2002, 61(33): 221-294. |
| [11] |
Allina S M, Pri-Hadash A, Theilmann D A, et al. 4-coumarate:coenzyme A ligase in hybridpoplar. Properties of native enzymes, cDNA cloning, and analysis of recombinant enzymes[J]. Plant Physiology, 1998, 116(2): 743-754. DOI:10.1104/pp.116.2.743 |
| [12] |
Mansell R L, Babbel G R, Zenk M H. Multiple forms and specificity of cinnamyl alcoholdehydrogenase from cambial regions of higher plants[J]. Phytochemistry, 1976, 15: 1849-1853. DOI:10.1016/S0031-9422(00)88829-9 |
| [13] |
胡昊.桃果实硬核期差异蛋白质组及木质化相关转录因子表达谱的分析[D].北京: 北京林业大学, 2012. Hu H. Analysis of differential proteome and expression of lignification-related transcription factors in peach fruit during hard core stage[D]. Beijing: Beijing Forestry University, 2012(in Chinese with English abstract). |
| [14] |
王丹阳, 高付永, 孙炜, 等. '砀山酥梨'果实CCoAOMT基因的克隆与表达分析[J]. 南京农业大学学报, 2015, 38(1): 33-40. Wang D Y, Gao F Y, Sun W, et al. Cloning and expression analysis of CCoAOMT gene in'Dangshan Pear'fruit[J]. Journal of Nanjing Agricultural University, 2015, 38(1): 33-40 (in Chinese with English abstract). DOI:10.7685/j.issn.1000-2030.2015.01.006 |
| [15] |
Abu-Zahra T R. Berry size of thompson seedless as influenced by the application of gibberelic acid DNA can girdling[J]. Pak J Bot, 2010, 42: 1755-1760. |
| [16] |
Depuydt S, Hardtke C S. Hormone signaling crosstalk in plant growth regulation[J]. Curr Biol, 2011, 21: R365-R373. DOI:10.1016/j.cub.2011.03.013 |
| [17] |
Wang C, Han J, Liu C, et al. Identification of microRNAs from Amur grape(Vitis amurensis Rupr.)by deep sequencing and analysis of microRNA variations with bioinformatics[J]. BMC Genomics, 2012, 13: 122. DOI:10.1186/1471-2164-13-122 |
| [18] |
张彦苹, 王晨, 于华平, 等. 适于葡萄不同组织RNA提取方法的筛选[J]. 西北农业学报, 2010, 19(11): 135-140. Zhang Y P, Wang C, Yu H P, et al. Screening of RNA extraction methods for various grapevine organs and tissues[J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2010, 19(11): 135-140 (in Chinese with English abstract). |
| [19] |
Wang X, Zhao M, Wu W, et al. Comparative transcriptome analysis of berry-sizing effects of gibberellin(GA3)on seedless Vitis vinifera L.[J]. Genes & Genomics, 2017, 39(7161): 1-15. |
| [20] |
Acheampong A K, Chuanlin Z, Tamar H, et al. Abnormal endogenous repression of GA signaling in a seedless table grape cultivar with high berry growth response to GA application[J]. Frontiers in Plant Science, 2017, 8: 850. DOI:10.3389/fpls.2017.00850 |
| [21] |
Wang M Q, Sun X, Wang C, et al. Characterization of miR061 and its target genes in grapevine responding to exogenous gibberellic acid[J]. Functional & Integrative Genomics, 2017, 17(5): 537-549. |
| [22] |
Cui M J, Wang C, Zhang W Y, et al. Characterization of Vv-miR156:Vv-SPL pairs involved in the modulation of grape berry development and ripening[J]. Molecular Genetics and Genomics, 2018, 293(6): 1333-1354. DOI:10.1007/s00438-018-1462-1 |
| [23] |
Wang C, Sudisha J, Zhang W Y, et al. Spatio-temporal expression of miRNA159 family members and their GAMYB target gene during the modulation of gibberellin-induced grapevine parthenocarpy[J]. Journal of Experimental Botany, 2018, 69(15): 3639-3650. DOI:10.1093/jxb/ery172 |
| [24] |
Hazra P, Dutta A K, Chatterjee P. Altered gibberellin and auxin levels in the ovaries in the manifestation of genetic parthenocarpy in tomato(Solanum lycopersicum)[J]. Current Science, 2010, 99(10): 1439-1443. |
| [25] |
Liu L, Wang Z, Liu J, et al. Histological, hormonal and transcriptomic reveal the changes upon gibberellin-induced parthenocarpy in pear fruit[J]. Horticulture Research, 2018, 5: 1. DOI:10.1038/s41438-017-0012-z |
| [26] |
Mesejo C, Yuste R, Reig C, et al. Gibberellin reactivates and maintains ovary-wall cell division causing fruit set in parthenocarpic Citrus species[J]. Plant Science, 2016, 247: 13-24. DOI:10.1016/j.plantsci.2016.02.018 |
| [27] |
Osakabe Y, Nanto K, Kitamura H, et al. Immunocytochemical localization of phenylalanine ammonia-lyase in tissues of Populus kitakamiensis[J]. Planta, 1996, 200(1): 13-19. |
| [28] |
Liang X W, Dron M, Schmid J, et al. Developmental and environmental regulation of a phenylalanine ammonia-lyase-beta-glucuronidase gene fusion in transgenic tobacco plants[J]. Proc Natl Acad Sci USA, 1989, 86(23): 9284-9288. DOI:10.1073/pnas.86.23.9284 |
| [29] |
Lee D, Meyer K, Douglas C, et al. Antisense suppression of 4-coumarate:coenzyme A ligase activity in Arabidopsis leads to altered lignin subunit composition[J]. The Plant Cell, 1997, 9(11): 1985-1998. DOI:10.1105/tpc.9.11.1985 |
| [30] |
赵艳玲, 陆海, 陶霞娟, 等. GRP1.8融合反义4CL1基因调控烟草木质素生物合成[J]. 北京林业大学学报, 2003, 25(4): 16-20. Zhao Y L, Lu H, Tao X J, et al. Modulate the lignin biosynthesis by expression GRP1.8 promoter:anti- 4CL1 gene in transgenic tobacco[J]. Journal of Beijing Forestry University, 2003, 25(4): 16-20 (in Chinese with English abstract). DOI:10.3321/j.issn:1000-1522.2003.04.004 |
| [31] |
Reinold S, Hauffe K D, Douglas C J, et al. Tobacco and parsley 4-coumarate:coenzyme A ligase genes are temporally and spatially regulated in a cell type-specific manner during tobacco flower development[J]. Plant Physiology, 1993, 101(2): 373-383. DOI:10.1104/pp.101.2.373 |
| [32] |
Barakat A, Bagniewska Z A, Choi A, et al. The cinnamyl alcohol dehydrogenase gene family in Populus:phylogeny, organization, and expression[J]. BMC Plant Biology, 2009, 9(1): 26. DOI:10.1186/1471-2229-9-26 |
| [33] |
Sibout R, Eudes A, Pollet B, et al. Expression pattern of two paralogs encoding cinnamyl alcohol dehydrogenases in Arabidopsis. Isolation and characterization of the corresponding mutants[J]. Plant Physiology, 2003, 132(2): 848-860. DOI:10.1104/pp.103.021048 |
| [34] |
Damiani I, Morreel K, Danoun S, et al. Metabolite profiling reveals a role for atypical cinnamyl alcohol dehydrogenase CAD1 in the synthesis of coniferyl alcohol in tobacco xylem[J]. Plant Molecular Biology, 2005, 59(5): 753-769. DOI:10.1007/s11103-005-0947-6 |
| [35] |
Tsuruta S I, Ebina M, Nakagawa H, et al. Isolation and characterization of cDNA encoding cinnamyl alcohol dehydrogenase(CAD)in sorghum(Sorghum bicolor(L.)Moench)[J]. Grassland Science, 2007, 53(2): 103-109. DOI:10.1111/grs.2007.53.issue-2 |
| [36] |
Lynch D, Lidgett A, Mcinnes R, et al. Isolation and characterisation of three cinnamyl alcohol dehydrogenase homologue cDNAs from perennial ryegrass(Lolium perenne L.)[J]. Journal of Plant Physiology, 2002, 159(6): 653-660. DOI:10.1078/0176-1617-0776 |
| [37] |
Qinghu M. Functional analysis of a cinnamyl alcohol dehydrogenase involved in lignin biosynthesis in wheat[J]. Journal of Experimental Botany, 2010, 61(10): 2735-2744. DOI:10.1093/jxb/erq107 |
| [38] |
王可可.外源赤霉素在心里美萝卜幼苗花青素代谢中作用研究[D].新乡: 河南师范大学, 2014. Wang K K. The role of exogenous gibberellin in the metabolism of anthocyanins in the heart of the radish seedlings[D]. Xinxiang: Henan Normal University, 2014(in Chinese with English abstract). |
| [39] |
Li W F, Mao J, Yang S J, et al. Anthocyanin accumulation correlates with hormones in the fruit skin of'Red Delicious'and its four generation bud sport mutants[J]. BMC Plant Biology, 2018, 18: 363. DOI:10.1186/s12870-018-1595-8 |
| [40] |
葛茜, 邝静, 武玉翠, 等. 丹参肉桂醇脱氢酶基因(SmCAD)的克隆及表达分析[J]. 植物科学学报, 2013, 31(3): 261-268. Ge Q, Kuang J, Wu Y C, et al. Cloning and expression analysis of cinnamyl alcohol dehydrogenase gene(SmCAD)from Salvia miltiorrhiza[J]. Plant Science Journal, 2013, 31(3): 261-268 (in Chinese with English abstract). |
| [41] |
刘尊英, 姜微波, 赵玉梅, 等. 温度、赤霉素和乙烯处理对采后豌豆苗纤维合成及品质变化的影响[J]. 中国农业大学学报, 2003, 8(1): 75-77. Liu Z Y, Jiang W W, Zhao Y M, et al. Effects of temperature, gibberellin and ethylene treatment on fiber synthesis and quality changes of postharvest pea seedlings[J]. Journal of China Agricultural University, 2003, 8(1): 75-77 (in Chinese with English abstract). DOI:10.3321/j.issn:1007-4333.2003.01.017 |




