文章信息
- 吕子豪, 王春燕, 林同
- LÜ Zihao, WANG Chunyan, LIN Tong
- 黄野螟糖原磷酸化酶基因的时空表达动态及其对温度胁迫的响应
- Temporal and spatial expression dynamics of glycogen phosphorylase gene and its response to temperature stress in Heortia vitessoides
- 南京农业大学学报, 2019, 42(2): 276-283
- Journal of Nanjing Agricultural University, 2019, 42(2): 276-283.
- http://dx.doi.org/10.7685/jnau.201807010
-
文章历史
- 收稿日期: 2018-07-04
黄野螟(Heortia vitessoides Moore)是我国土沉香(Aquilaria sinensis)种植区大面积发生的一种食叶害虫, 对土沉香危害最为严重。其主要分布在我国南方各省、台湾地区和香港特别行政区, 在尼泊尔、斯里兰卡、印度、斐济等国家也有分布[1]。黄野螟在暴发时期具有暴食性的特点, 且生长发育迅速, 虫口密度大, 短时间内便可吃光土沉香叶片, 造成枯苗、死苗, 严重影响土沉香的产量和结香质量[2]。
由于每年冬季的持续低温气候影响昆虫的繁殖与生存[3], 大多数昆虫都形成了一套抗寒物质系统以应对外界低温胁迫对种群生存及繁衍造成的不利影响[4]。例如:桑绢野螟(Diaphania pyloalis)幼虫的海藻糖-甘露醇-山梨醇-氨基酸-甘油-蛋白质-结合脂肪系统[5], 欧桦小蠹虫(Scolytus ratzeburgi)幼虫的甘油-山梨醇-葡萄糖-海藻糖系统[6], 黄地老虎(Agrotis segetum)幼虫的小分子糖-氨基酸-糖蛋白系统[7]。糖原磷酸化酶(glycogen phosphorylase, GP)为糖原降解过程中的限速酶, 呈二聚体结构。GP能催化糖原降解产生海藻糖、葡萄糖等小分子碳水化合物[8-9], 来维持细胞内渗透压平衡, 且其在低温环境下仍能保持较高活性, 促进甘油、山梨醇、海藻糖等抗冻保护剂的合成[10-14]。
1936年, GP最早发现于兔子的骨骼肌中[13], 随后对伏蝇(Phormia regina)飞行肌的研究中发现了昆虫GP的2种形式——GPa和GPb[15]。GPa为活性形式, 起主要催化作用, GPb则为非活性形式。昆虫中的GP不同于哺乳动物, 没有脑型、肝型和肌型之分。GP活性的主要调控机制为共价修饰, 糖原、AMP和Pi为GP的激活剂, 能促进其活性, 葡萄糖、ATP和6-磷酸葡萄糖则为其抑制剂[16]。
刻克罗普斯蚕蛾(Hyalophora cecropia)的蛹在4 ℃冷处理条件下, 脂肪体中GP被迅速激活, 且此冷激活在25 ℃时会迅速逆转[17]。飞蝗(Locusta migratoria)、黄粉虫(Tenebrio molitor)、麻蝇(Sarcophaga crassipalpis)和蟋蟀(Acheta domesticus)的GP也能被低温刺激激活[10, 18-19]。家蚕(Bombyx mori)和麦红吸浆虫(Sitodiplosis mosellana)滞育前、后通过GP活性变化以调节糖原分解速度和各种化学物质的代谢, 使其机体免受损伤[14, 20]。以上研究表明, GP很可能在昆虫抵御低温过程中发挥一定作用。
GP的研究不仅有助于研究者深入了解害虫种群发展和扩散规律, 而且对越冬虫害发生的监测及害虫综合治理具有重大意义。然而, 有关昆虫GP的分子生物学研究较少, 鳞翅目昆虫中仅有家蚕、帝王斑蝶(Danaus plexippus)、甜菜夜蛾(Spodoptera exigua)和亚洲玉米螟GP基因的报道。因此, 本研究从黄野螟cDNA文库中筛选出GP基因同源序列, 对其进行生物信息学分析与鉴定, 并利用实时荧光定量PCR反应技术检测其发育表达谱与各组织器官表达谱, 并且对黄野螟进行了不同温度的胁迫处理, 初步探讨了黄野螟GP基因在各温度下的表达规律, 旨在为黄野螟GP基因在抗寒等生理过程中的作用研究奠定基础。
1 材料与方法 1.1 供试昆虫和主要试剂黄野螟(Heortia vitessoides Moore)幼虫采自广州天鹿湖森林公园, 饲养于人工气候箱中, 温度为26 ℃, 相对湿度为70%~75%, 光照时间为14 h。
总RNA提取试剂盒(E.Z.N.ATM Total RNA KitⅡ)购自OMEGA公司; 反转录试剂盒(PrimeScript RT reagent Kit With gDNA Eraser)及实时荧光定量试剂盒(TB GreenTM Premix Ex TaqTM)均购自TaKaRa公司。
1.2 试验方法 1.2.1 HvGP在不同虫态的表达量测定收集从野外采集回来的黄野螟各虫态虫体。卵15片, 每5片为1个生物学重复; 1龄幼虫90头, 每30头为1个生物学重复; 2龄幼虫45头, 每15头为1个生物学重复; 3~5龄幼虫、蛹和成虫各共6头, 每2头为1个生物学重复。经灭菌蒸馏水清洗后, 立即置于无菌去酶的冻存管中, 经液氮速冻后, 存放于-80 ℃冰箱。
1.2.2 HvGP在不同组织的表达量分析黄野螟幼虫表达谱显示, HvGP在4龄和5龄时有较高表达, 因此选取40头4~5龄幼虫经灭菌蒸馏水清洗后, 在腊盘上解剖, 获得头、足、体壁、脂肪体、中肠和后肠, 立即置于无菌去酶的冻存管中, 经液氮速冻后, 存放于-80 ℃冰箱。选取30头1日龄成虫, 用无菌棉球稍沾蒸馏水轻擦体表污质, 在腊盘上解剖, 获得触角、足、头、胸、腹和翅等组织, 并立即置于无菌去酶的冻存管中, 经液氮速冻后, 存放于-80 ℃冰箱。
1.2.3 温度胁迫对HvGP表达量的影响将野外采集的3龄幼虫用新鲜叶片饲养至4龄第1天, 随即在人工气候箱中进行0、5、10、15、20、25、30、35和40 ℃处理, 在低温培养箱中进行-7和-5 ℃处理, 各温度处理时间均为90 min, 每个处理30头试虫。极端温度处理会出现昆虫昏迷现象, 温度处理后用毛笔轻触虫体, 30 s内不能恢复运动的个体不被选用, 取合格样品每2头为1个生物学重复, 共3个生物学重复, 经液氮速冻后, 存放于-80 ℃冰箱。
1.2.4 总RNA的提取、cDNA的合成及引物设计严格按照总RNA提取试剂盒说明书提取各样本总RNA, 经琼脂糖凝胶电泳以及微量紫外分光光度计(Nanodrop 2000)检测合格后, 置于-80 ℃冰箱保存备用。严格按照反转录试剂盒说明书, 将总RNA(800 ng)反转录为第1链cDNA, 稀释20倍后置于-20 ℃冰箱保存备用。根据荧光定量PCR引物设计原则, 利用Primer Premier 5.0软件进行引物设计。引物为:正向:5′-GCCGCAGACCTCAGTGAACAG-3′, 反向:5′-CTCCTCGCCAGCCTCCTCAG-3′。
以26 ℃条件下饲养的4龄幼虫cDNA为模版, 通过普通PCR扩增目的基因及内参基因片段, 琼脂糖凝胶电泳检测结果显示, 条带大小符合预期且无杂带, 经测序确认, 且RT-qPCR的熔解曲线只有1个信号峰, 说明引物特异性高, 试验结果可靠。
将模板稀释为5个浓度梯度进行PCR反应, 用反应后的样品CT值与模板初始量的log值做标准曲线。根据标准曲线的斜率(分别为3.494、3.429), 计算出β-actin基因和HvGP基因的扩散效率分别为93.3%和95.7%, 均在90%~105%的高扩增范围内, 且R2大于0.99, 说明引物扩增效率符合优化要求, 可以采用2-ΔΔCT法对试验数据进行分析。
1.2.5 糖原磷酸化酶基因的筛选及表达分析从本实验室的黄野螟成虫转录组文库中筛选出GP基因完整编码序列。用RT-qPCR检测基因的表达量, 所用内参基因为β-actin; 阴性对照为无菌超纯水处理。反应体系包括:cDNA模板20 μL, TB Green Premix Ex Taq 10.0 μL, 上、下游引物各0.4 μL, ddH2O 7.2 μL。反应程序为:95 ℃ 5 min; 95 ℃ 10 s, 60 ℃ 20 s, 共40个循环。每个样本设置3个技术重复, 根据反应结束后的CT值, 使用2-ΔΔCT相对定量法计算HvGP相对表达量。用Excel 2007进行数据的初步统计分析, 采用SPSS 18.0进行单因素方差分析与邓肯氏多重比较, 并采用GraphPad Prism 5绘图。
1.3 生物信息学分析采用NCBI网站的BLAST功能将可能的黄野螟GP基因与已知物种的GP序列进行同源比对; 采用TMpred软件进行跨膜区分析; 采用ProtParam软件分析理化性质; 采用SignalP软件进行信号肽预测; 采用NetPhos 3.1预测磷酸化修饰位点; 采用PSORT预测亚细胞定位; 采用ProScale软件分析HvGP的物理性质; 采用NPS在线工具预测蛋白质二级结构; 采用Conserved Domains在线工具分析氨基酸序列的结构功能域; 采用SWISS-MODEL在线工具模拟GP蛋白三级结构; 采用ClustalX软件和MEGA 4.0软件构建系统发育进化树(NJ法)。
2 结果与分析 2.1 基因序列及其编码的蛋白质高级结构分析从黄野螟cDNA文库中筛选出具有完整ORF的目的片段, 利用NCBI网站的BLAST功能, 与已有物种的GP基因进行同源比对, 确认该基因为GP基因并将其命名为HvGP, 序列包含2 526 bp的ORF, 共编码841个氨基酸(图 1)。

|
图 1 黄野螟GP基因核苷酸序列及其编码的氨基酸序列 Fig. 1 Nucleotide and deduced amino acid sequences of GP gene from Heortia vitessoides AMP结合位点以方括号标注; 磷酸吡哆醛结合位点以阴影覆盖; 糖原储存位点以打点标注; 磷酸化位点分别以圆形(Thr)、方形(Ser)、倒三角形(Tyr)标注; 低密度复杂区以加粗下划线标注; 起始密码子和终止密码子TAG分别以细横线与星号标注。AMP binding site are marked with brackets; pyridoxal phosphate cofactor binding site are marked with shadow; glycogen storage site are marked with dot; threonine phosphorylation sites, serine phosphorylation sites, tyrosine phosphorylation sites are marked with round, square and triangles, respectively; low-complexity regions are marked with rough underline; the initiation codon and the termination codon are marked with fine stripes and asterisks, respectively. |
使用ProtParam软件分析HvGP的理化性质, 结果显示:该蛋白的相对分子质量为96.58×103, 等电点为5.96, 带负电荷的残基总数为111个, 带正电荷的残基总数为99个, 不稳定指数为43.51。使用ProScale软件分析HvGP的物理性质, 结果显示:该蛋白同时存在亲水区和疏水区, 整体则表现出较强亲水性, 推测其为亲水性蛋白。使用SignalP在线工具预测显示:HvGP没有信号肽, 为非分泌蛋白, 因此可能不存在N-糖基化位点; 用同样方法对亚洲玉米螟GP序列进行预测, 得到一致的结果。由亚细胞定位预测结果可知:HvGP位于细胞质的可能性最大, 为47.8%, 其次是位于细胞核, 有26.1%的可能性, 位于细胞骨架和细胞膜的可能性则较低, 低于5%。糖原的合成及分解在细胞质基质中进行, 结合预测结果分析, HvGP的亚细胞定位可能与糖原分布有密切关系。使用NetPhos 3.1软件预测到10个丝氨酸磷酸化位点, 3个苏氨酸磷酸化位点, 2个酪氨酸磷酸化位点, 得分在0.9以上。TMpred软件分析表明:HvGP为跨膜蛋白, 具有6个跨膜结构域, 其中得分大于500的3个重要跨膜区域中, 有2个是从内向外的, 分别位于139~157位氨基酸和442~458位氨基酸, 而从外向内的1个重要跨膜区域也位于139~157位氨基酸。
使用NCBI网站上的Conserved Domains软件分析可能的结构功能域, 结果表明:HvGP属于糖基转移酶GTB型家族成员, 催化低聚糖分解为葡萄糖-1-磷酸寡糖单位。GP单体由1个N-末端结构域和C-末端结构域组成[20], 是碳水化合物代谢中重要的变构酶。HvGP保守结构域区间位于氨基酸位点28~826(图 2), 具有Ser-14磷酸化位点、糖原储存位点、AMP结合位点和磷酸吡哆醛结合位点[21]。低密度复杂区(low-complexity regions, LCR)是结构极不稳定的氨基酸区域。HvGP存在1个LCR, 位于114~137氨基酸位点间(图 1), 它的存在可能有助于氨基酸序列的改变, 以适应进化过程中的环境变化[22]。
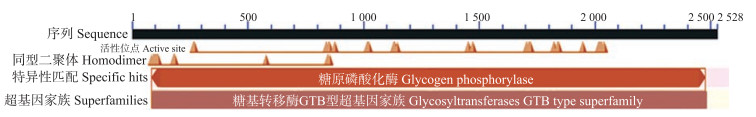
|
图 2 HvGP的NCBI保守结构域分析结果 Fig. 2 Analysis on NCBI conserved domains of HvGP |
在NPS网站进行蛋白质二级结构预测, 结果显示:HvGP的α-螺旋占50.06%, 延伸链占12.49%, β-转角占7.02%, 无规则卷曲占30.44%。由此推测, 该蛋白二级结构的主要元件为α螺旋和无规则卷曲。采用SWISS-MODEL软件进行蛋白质三级结构建模, 结果显示此基因编码的蛋白主要由α-螺旋与无规则卷曲组成, 预测结果与NPS网站一致(图 3)。
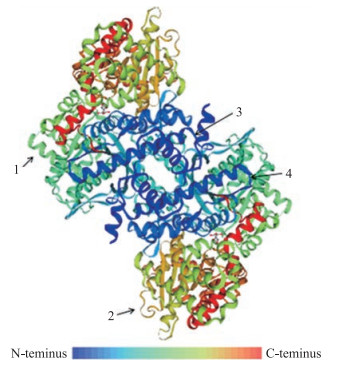
|
图 3 预测的HvGP三级结构 Fig. 3 Three-dimensional structure of HvGP 图中彩虹条表示从N端到C端的氨基酸; 1、2、3、4分别表示α-螺旋、无规则卷曲、延伸链和β-转角。 The rainbow bar represents the amino acid from N-terminal to C-terminal; 1, 2, 3, 4 represent α-helix, random coil, extended strand and β-turn, respectively. |
通过将HvGP的氨基酸序列在NCBI网站上进行BLASTp同源搜索, 发现其与亚洲玉米螟的同源性最高, 达95%;与烟粉虱的同源性最低, 为78%。基于HvGP及鳞翅目、膜翅目、鞘翅目、双翅目、半翅目等5个目13种昆虫的GP氨基酸序列比对, 采用NJ法构建系统发育树。结果表明, 黄野螟与烟粉虱同源性最低, 与亚洲玉米螟处于同一分支, 与同源性比对结果一致(图 4)。
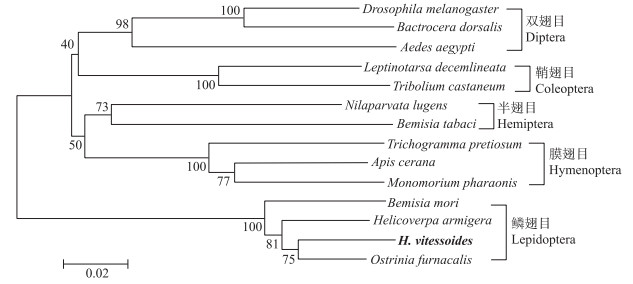
|
图 4 基于GP氨基酸序列构建的系统发育树(NJ法) Fig. 4 Phylogenetic relationships based on GP amino acids from 14 species of insect O.furnacalis:亚洲玉米螟(AFO54708.2);H.armigera:棉铃虫(XP_021190210.1);B.mori:家蚕(NP_001116811.1);N.lugens:褐飞虱(XP_022190596.1);D.melanogaster:黑腹果蝇(NP_722762.1);A.cerana:中华蜜蜂(XP_016904748.1);B.dorsalis:桔小实蝇(XP_011197467.1);B.tabaci:烟粉虱(XP_018895868.1);L.decemlineata:马铃薯甲虫(ARI45060.1);T.castaneum:赤拟谷盗(XP_968960.1);M.pharaonis:小黄家蚁(XP_012535441.1);A.aegypti:埃及伊蚊(XP_001650265.1);T.pretiosum:短管赤眼蜂(XP_014238995.1). |
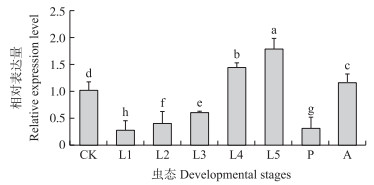
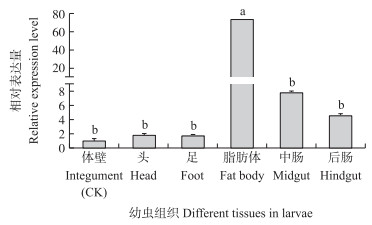
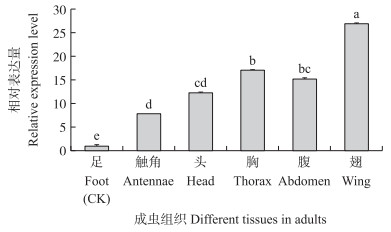
由图 5可见:HvGP在黄野螟各虫态均有表达, 且各虫态间差异显著, 其表达量在5龄幼虫时达到峰值, 为卵的1.77倍, 而在1龄幼虫和蛹时表达量最低, 仅为卵的0.26和0.30倍。由图 6可知:HvGP在黄野螟幼虫各组织中均有表达, 其中, 在脂肪体中表达量突出, 为体壁的72.85倍, 而在头和足等组织中表达量较低, 为体壁的1.79与1.75倍, 均与在脂肪体中的表达量相差近40倍。成虫时(图 7), HvGP则在翅的表达量较高, 为对照的26.97倍, 其次是胸与腹, 表达量分别为对照(足)的17.15与15.21倍。
|
图 5 HvGP基因在黄野螟各虫态中的表达量
Fig. 5 The expression level of HvGP in developmental stages of H.vitessoides
数据为“平均数±标准差”, 不同字母代表差异显著(P < 0.05), 下同。Data in the figure are represented as x±SD. Different letters mean significant difference at 0.05 level. The same as below. CK:卵Egg; L1、L2、L3、L4、L5:1~5龄幼虫Larve stage 1-5;P:蛹Pupal; A:成虫Adult. |
|
图 6 HvGP基因在黄野螟4~5龄幼虫各组织中的表达量 Fig. 6 The expression level of HvGP in different tissues of the 4-5th instar larvae of H.vitessoides |
|
图 7 HvGP基因在黄野螟1日龄成虫各组织中的表达量 Fig. 7 The expression level of HvGP in different tissues of the 1-day-old adults of H.vitessoides |
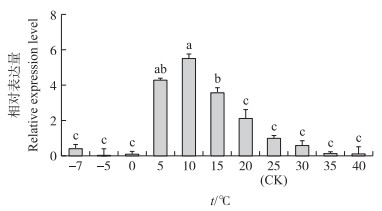
以25 ℃为对照, 探讨不同温度梯度下HvGP的表达量差异。结果(图 8)显示:在-7、-5和0 ℃时, HvGP表达量显著低于对照, 在-5 ℃时几乎不表达。在5~25 ℃的温度区间, HvGP的表达量呈先上升后下降的趋势, 在10 ℃时达到峰值, 表达量为对照的5.53倍。直到20 ℃时, HvGP的表达量仍高于对照。在30、35、40 ℃时, HvGP的表达量呈逐渐下降趋势, 且均低于对照。
|
图 8 4龄幼虫在不同温度处理后HvGP基因的表达量 Fig. 8 The expression level of HvGP after exposure to different temperature in 4th instar larvae |
本研究通过对黄野螟转录组进行数据分析及同源比对, 鉴定并获得了HvGP基因。亚细胞定位结果表明, HvGP主要定位于细胞质, 从而说明其具有与糖原相关的生物学功能。预测的磷酸化位点(得分大于0.9)有15个, 其中Ser-14磷酸化位点在GP催化活性与非催化活性的转换过程中发挥关键作用。HvGP的23个糖原储存位点、11个AMP结合位点和15个磷酸吡哆醛结合位点可能与其行使磷酸化酶功能有关。昆虫生长是一个动态变化的过程, 每个阶段都伴随不同的能量代谢, GP作为降解糖原为海藻糖和葡萄糖的限速酶, 在碳水化合物代谢过程中发挥重要作用[23]。RT-qPCR的结果表明, HvGP基因在黄野螟各发育阶段均有表达, 卵期较高的表达量暗示昆虫胚胎发育需要分解糖原来维持能量供给。本试验中, L2至L5期的表达量分别为L1期的1.50、2.27、5.46、6.81倍, 推测原因为:黄野螟幼虫在L1期运动量小, 3龄前的进食量仅占幼虫期的17.77%[2], 且器官未发育成熟, 体内新陈代谢较为缓慢; L4至L5期是黄野螟快速生长阶段, 在此期间其运动量暴增, 开始分散活动, 食叶量达幼虫期总食叶量的82.7%[2], 势必伴随大量的糖原分解以满足其运动等生命活动。另一方面, 昆虫在蛹期不进食, 需提前将糖类物质转化为储藏物质, 以确保成虫器官的重建及羽化等生命活动顺利进行。糖原代谢可能参与昆虫幼虫的几丁质化, 并参与缺氧、渗透调节等生命活动[24]。GP是糖原分解的限速酶, 与糖原分布存在关联。昆虫的脂肪体富含糖原[25], 糖原合成并储存于脂肪体中[26], 本研究结果与预期一致, HvGP基因在黄野螟幼虫脂肪体中的表达显著高于其他组织。分析成虫不同组织HvGP基因表达模式发现, HvGP在成虫翅中表达量远高于其他部位, 暗示HvGP可以分解糖原为成虫飞行提供能量。其次HvGP在成虫胸、腹也有高表达, 这可能与它们是成虫运动中心、代谢中心有关。
在5~20 ℃冷胁迫区间, HvGP表达量显著上调。昆虫体内糖原不仅是代谢储备, 其代谢产物葡萄糖-6-磷酸还是其他代谢途径的起始物[8]。鳞翅目昆虫家蚕、双翅目昆虫麻蝇、鞘翅目非滞育昆虫黄粉虫的GP活性受冷胁迫刺激均能被激活, 推测黄野螟受冷胁迫时, HvGP基因表达上调且HvGP被激活以促进糖原转化为一些抗冻保护剂[10, 17-18]。但处于0 ℃以下低温时HvGP表达量显著下调, 在低温条件下昆虫的生理特性会改变, 其抗冻机制很复杂, 推测0 ℃以下便超出HvGP的作用范围[27-28], 说明HvGP只有处于一定范围的低温条件下才被激活参与虫体抗冻。30~40 ℃热胁迫温度区间, HvGP的表达受到抑制且呈逐渐下降趋势, 此结果表明高温不能诱导HvGP表达, 推测远离适宜温度时, 由于运动强度降低, 进食减少, 体内糖原代谢速率减缓, HvGP的表达量处于较低水平, 高温与HvGP表达量的负相关关系值得进一步探明。
本研究结果丰富了黄野螟糖原磷酸化酶基因的分子生物学信息, 为探究昆虫糖原降解提供分子依据, 为探索黄野螟GP基因的功能奠定了基础。近年来, 通过基因干扰手段防治害虫的基础研究日益增多, 我们将利用基因编辑与RNA干扰等技术, 深入研究HvGP基因功能。
| [1] |
茅裕婷, 张蒙, 靳秀芳, 等. 土沉香对黄野螟的抗性研究[J]. 华南农业大学学报, 2017, 38(6): 89-96. Mao Y T, Zhang M, Jin X F, et al. Study on resistance of Aquilaria sinensis against Heortia vitessoides[J]. Journal of South China Agricultural University, 2017, 38(6): 89-96 (in Chinese with English abstract). |
| [2] |
乔海莉, 陆鹏飞, 陈君, 等. 黄野螟生物学特性及发生规律研究[J]. 应用昆虫学报, 2013, 50(5): 1244-1252. Qiao H L, Lu P F, Chen J, et al. Biological characteristics and occurrence patterns of Heortia vitessoides[J]. Chinese Journal of Applied Entomology, 2013, 50(5): 1244-1252 (in Chinese with English abstract). |
| [3] |
Hoffmann A A, Sørensen J G, Loeschcke V. Adaptation of Drosophila to temperature extremes:bringing together quantitative and molecular approaches[J]. Journal of Thermal Biology, 2003, 28(3): 175-216. DOI:10.1016/S0306-4565(02)00057-8 |
| [4] |
陈豪, 梁革梅, 邹朗云, 等. 昆虫抗寒性的研究进展[J]. 植物保护, 2010, 36(2): 18-24. Chen H, Liang G M, Zou L Y, et al. Research progresses in the cold hardiness of insects[J]. Plant Protection, 2010, 36(2): 18-24 (in Chinese with English abstract). DOI:10.3969/j.issn.0529-1542.2010.02.005 |
| [5] |
陈永杰, 孙绪艮, 张卫光, 等. 桑螟越冬幼虫体内蛋白质、氨基酸、碳水化合物的变化与抗寒性的关系[J]. 蚕业科学, 2005, 31(2): 111-116. Chen Y J, Sun X G, Zhang W G, et al. Relationship between variation of protein, amino acid, low-molecular carbohydrate in over-wintering Diaphania pyloalis walker larvae and cold-hardiness[J]. Acta Sericologica Sinica, 2005, 31(2): 111-116 (in Chinese with English abstract). DOI:10.3969/j.issn.0257-4799.2005.02.001 |
| [6] |
韩瑞东, 孙绪艮, 许永玉, 等. 赤松毛虫越冬幼虫生化物质变化与抗寒性的关系[J]. 生态学报, 2005, 25(6): 1352-1356. Han R D, Sun X G, Xu Y Y, et al. The biochemical mechanism of cold-hardiness in overwintering larva of Dendrolimus spectabilis Butler(Lepidoptera:Lasiocampidae)[J]. Acta Ecologica Sinica, 2005, 25(6): 1352-1356 (in Chinese with English abstract). DOI:10.3321/j.issn:1000-0933.2005.06.019 |
| [7] |
Zhao N, Hou M, Wang T, et al. Cloning and expression patterns of the brine shrimp(Artemia sinica)glycogen phosphorylase(GPase)gene during development and in response to temperature stress[J]. Molecular Biology Reports, 2014, 41(1): 9-18. DOI:10.1007/s11033-013-2764-3 |
| [8] |
Steele J E. Glycogen phosphorylase in insects[J]. Insect Biochemistry, 1982, 12(2): 131-147. |
| [9] |
Brostrom C O, Hunkeler F L, Krebs E G. The regulation of skeletal muscle phosphorylase kinase by Ca2+[J]. Journal of Biological Chemistry, 1971, 246(7): 1961-1967. |
| [10] |
Chen C P, Denlinger D L. Activation of phosphorylase in response to cold and heat stress in the flesh fly, Sarcophaga crassipalpis[J]. Journal of Insect Physiology, 1990, 36(8): 549-553. DOI:10.1016/0022-1910(90)90022-8 |
| [11] |
李毅平, 龚和, 朴镐用. 松针瘿蚊越冬幼虫体内酶活性的时序变化[J]. 昆虫学报, 2000, 43(3): 227-232. Li Y P, Gong H, Park H Y. Profile of enzymic activity in overwintering mature larvae of the pine needle gall midge, Thecodiplosis japonensis[J]. Acta Entomologica Sinica, 2000, 43(3): 227-232 (in Chinese with English abstract). DOI:10.3321/j.issn:0454-6296.2000.03.001 |
| [12] |
Joanisse D R, Storey K B. Enzyme activity profiles in an overwintering population of freeze-tolerant larvae of the gall fly, Eurosta solidaginis[J]. Journal of Comparative Physiology B, 1994, 164(3): 247-255. DOI:10.1007/BF00354086 |
| [13] |
Cori C F, Cori G T. Mechanism of formation of hexosemonophosphate in muscle and isolation of a new phosphate ester[J]. Experimental Biology and Medicine, 1936, 34(5): 702-705. DOI:10.3181/00379727-34-8759P |
| [14] |
Yamashita O, Suzuki K, Hasegawa K. Glycogen phosphorylase activity in relation to diapause initiation in Bombyx eggs[J]. Insect Biochemistry, 1975, 5(6): 707-718. DOI:10.1016/0020-1790(75)90015-3 |
| [15] |
郭建青.亚洲玉米螟糖原磷酸化酶基因的克隆及表达分析[D].北京: 中国农业科学院, 2013. Guo J Q. Cloning and expression analysis of glycogen phosphorylase gene in Ostrinia furnacalis(Guenée)(Lepidoptera: Crambidae)[D]. Beijing: Chinese Academy of Agricultural Sciences, 2013(in Chinese with English abstract). |
| [16] |
Barford D, Hu S H, Johnson L N. Structural mechanism for glycogen phosphorylase control by phosphorylation and AMP[J]. Journal of Molecular Biology, 1991, 218(1): 233-260. DOI:10.1016/0022-2836(91)90887-C |
| [17] |
Ziegler R, Ashida M, Fallon A M, et al. Regulation of glycogen phosphorylase in fat body of Cecropia silkmoth pupae[J]. Journal of Comparative Physiology, 1979, 131(4): 321-332. DOI:10.1007/BF00688807 |
| [18] |
Bahjou A, Gourdoux L, Moreau R, et al. In vitro regulation of glycogen phosphorylase of the larval fat body of Tenebrio molitor[J]. Comparative Biochemistry and Physiology Part B:Comparative Biochemistry, 1988, 89(2): 233-237. DOI:10.1016/0305-0491(88)90216-7 |
| [19] |
刘流, 贺莉芳, 刘晖, 等. 滞育家蝇幼虫糖的变化[J]. 医学动物防制, 2008, 24(11): 803-804. Liu L, He L F, Liu H, et al. The change of carbohydrate of Musca domestica larva in the diapause[J]. Chinese Journal of Pest Control, 2008, 24(11): 803-804 (in Chinese with English abstract). DOI:10.3969/j.issn.1003-6245.2008.11.002 |
| [20] |
Buchbinder J L, Fletterick R J. Role of the active site gate of glycogen phosphorylase in allosteric inhibition and substrate binding[J]. Journal of Biological Chemistry, 1996, 271(37): 22305-22309. DOI:10.1074/jbc.271.37.22305 |
| [21] |
Hudson J W, Golding G B, Crerar M M. Evolution of allosteric control in glycogen phosphorylase[J]. Journal of Molecular Biology, 1993, 234(3): 700-721. DOI:10.1006/jmbi.1993.1621 |
| [22] |
Toll-Riera M, Radó-Trilla N, Martys F, et al. Role of low-complexity sequences in the formation of novel protein coding sequences[J]. Molecular Biology and Evolution, 2012, 29(3): 883-886. DOI:10.1093/molbev/msr263 |
| [23] |
Mitsumasu K, Kanamori Y, Fujita M, et al. Enzymatic control of anhydrobiosis-related accumulation of trehalose in the sleeping chironomid, Polypedilum vanderplanki[J]. FEBS Journal, 2010, 277(20): 4215-4228. DOI:10.1111/j.1742-4658.2010.07811.x |
| [24] |
赵娜.糖原磷酸化酶基因在中国卤虫胚胎发育和温度胁迫过程中的表达模式[D].大连: 辽宁师范大学, 2013. Zhao N. Expression pattern of glycogen phosphorylase gene during development and in response to temperature stress from brine shrimp, Artemia sinica[D]. Dalian: Liaoning Normal University, 2013(in Chinese with English abstract). |
| [25] |
易传辉, 陈晓鸣, 史军义, 等. 柑橘凤蝶滞育期间糖类物质和脂肪含量变化[J]. 西南农业学报, 2009, 22(4): 1142-1145. Yi C H, Chen X M, Shi J Y, et al. Change of carbohydrate and fat contents in pupae of Papilio xuthus L. during diapause stage[J]. Southwest China Journal of Agricultural Sciences, 2009, 22(4): 1142-1145 (in Chinese with English abstract). DOI:10.3969/j.issn.1001-4829.2009.04.057 |
| [26] |
Arrese E L, Soulages J L. Insect fat body:energy, metabolism, and regulation[J]. Annual Review of Entomology, 2010, 55: 207-225. DOI:10.1146/annurev-ento-112408-085356 |
| [27] |
景晓红, 郝树广, 康乐. 昆虫对低温的适应——抗冻蛋白研究进展[J]. 昆虫学报, 2002, 45(5): 679-683. Jing X H, Hao S G, Kang L. Cold adaptation in insects:progress in antifreeze protein research[J]. Acta Entomologica Sinica, 2002, 45(5): 679-683 (in Chinese with English abstract). DOI:10.3321/j.issn:0454-6296.2002.05.023 |
| [28] |
Koštál V, Renault D, Mehrabianová A, et al. Insect cold tolerance and repair of chill-injury at fluctuating thermal regimes:role of ion homeostasis[J]. Comparative Biochemistry and Physiology Part A:Molecular and Integrative Physiology, 2007, 147(1): 231-238. DOI:10.1016/j.cbpa.2006.12.033 |




