文章信息
- 朱胜琪, 徐德宝, 王永鑫, 冯凯, 刘洁霞, 仇亮, 熊爱生
- ZHU Shengqi, XU Debao, WANG Yongxin, FENG Kai, LIU Jiexia, QIU Liang, XIONG Aisheng
- 水芹咖啡酰辅酶A-O-甲基转移酶基因的克隆与表达特性分析
- Cloning and expression characteristics analysis of caffeoyl-CoA O-methyltransferase gene in Oenanthe javanica
- 南京农业大学学报, 2019, 42(1): 51-58
- Journal of Nanjing Agricultural University, 2019, 42(1): 51-58.
- http://dx.doi.org/10.7685/jnau.201802034
-
文章历史
- 收稿日期: 2018-02-28
水芹(Oenanthe javanica)是伞形科(Apiaceae)水芹属多年生水生草本植物[1], 富含多种维生素、脂肪、碳水化合物、粗纤维以及钙、磷、铁等矿质营养。水芹病虫害较少, 适应性较强、产量高, 目前在我国长江流域及其以南地区栽培较多。不同贮藏条件对水芹品质影响明显, 室温(25 ℃)条件下的水芹失水萎蔫速度快, 短时间内商品价值损失严重。低温(4 ℃)条件与室温相比, 可以显著延长水芹贮藏期, 这与低温能够抑制蔬菜呼吸、减少蒸腾、抑制各代谢过程中间酶的活性有关[2]。避光(黑暗)贮藏多用于茎菜类(如马铃薯、洋葱、芋头等)蔬菜, 主要是为了延长蔬菜休眠、防止茎块发芽产生有毒物质。对于水芹这样以嫩叶和叶柄为主要食用器官的叶菜类蔬菜, 黑暗贮藏也具有一定的保鲜效果。
木质素是维管植物细胞壁的重要组分之一[3], 作为一种复杂的苯丙烷单体聚合物, 它可以将植物细胞壁中的纤维素和半纤维素紧密黏合在一起, 并起到填充作用[4]; 还可以疏导组织的水分运输, 提高细胞的运输能力[5]。在双子叶植物中, 愈创木基-紫丁香基木质素(G-S木质素)主要由愈创木基单体和紫丁香基单体聚合形成[6]。随着植物的生长发育, 木质素含量的增加也会对蔬菜的口感和营养品质产生一定的影响。咖啡酰辅酶A-O-甲基转移酶(CCoAOMT)是调控植物中G型木质素合成的1个关键酶, 与木质素合成中芳香环上羟基的甲基化有关[7]。CCoAOMT能将咖啡酰辅酶A甲基化成阿魏酰辅酶A[8]。自从Kuhnl等[9]和Pakusch等[10]在欧芹(Petroselinum crispum)和胡萝卜(Daucus carota)的细胞悬浮液中发现CCoAOMT以来, CCoAOMT基因已在多种植物中被克隆得到[11-16]。但其在木质素合成代谢中的作用研究起步较晚, 因此伞形科植物CCoAOMT基因功能报道较少。
'南选八卦洲紫水芹’是南京'八卦洲水芹’的自发突变体, 由本实验室获得并保存, 其叶柄由于花青素积累而呈紫色[17]。本研究选用'南选八卦洲紫水芹’和'八卦洲水芹’2个品种, 利用RT-PCR技术克隆CCoAOMT基因, 并用生物信息学方法对获得的序列进行分析, 同时选取室温(25 ℃)、低温(4 ℃)和室温黑暗(25 ℃)3种常见的贮藏方式, 通过实时荧光定量PCR技术, 检测OjCCoAOMT基因在不同组织以及不同贮藏条件下的表达情况, 以了解该基因在水芹木质素代谢中的作用, 为改良水芹品质提供研究基础。
1 材料与方法 1.1 材料于2017年5月将'八卦洲水芹’和'南选八卦洲紫水芹’种植于南京农业大学作物遗传与种质创新国家重点实验室人工气候室。生长条件为:25 ℃光照12 h, 20 ℃黑暗12 h, 光照强度300 μmol·m-2·s-1。待植株长至第45天, 从2种水芹中各选取3株长势一致的植株作为重复, 采集每株顶部第3~4片叶的叶片和叶柄, 用锡纸包裹后, 液氮速冻, 保存于-80 ℃冰箱。待长至第65天, 2个品种水芹由茎基部进行采摘, 各选取3株高度为50 cm、鲜绿、无病虫害、粗细基本一致的植株。将每个品种的3株水芹分别放置于室温(25 ℃)、低温(4 ℃)和室温黑暗(25 ℃)条件下, 处理时间为0、1、2和3 d, 每天同一时段剪取生长位置一致的叶片和叶柄, 液氮速冻, 保存于-80 ℃冰箱。
大肠杆菌(Escherichia coli)菌株DH5α保存于本实验室; pMD19-T质粒载体、TaKaRa Ex Taq Mix、SYBR Premix Ex Taq试剂盒、Prime Script RT reagent Kit和DL2000 Marker等均购自宝生物工程(大连)有限公司; Axy Prep DNA凝胶回收试剂盒购自爱思进生物技术(杭州)有限公司; RNA Simple Total RNA Kit购自天根生化科技(北京)有限公司。
1.2 水芹总RNA的提取与cDNA的合成利用RNA Simple Total RNA Kit提取水芹样品总RNA, 检测总RNA浓度, 并按照Prime Script RT reagent Kit说明书将总RNA反转录成cDNA。
1.3 水芹OjCCoAOMT基因的克隆根据本课题组的水芹转录组数据[18], 检索得到编码水芹OjCCoAOMT蛋白的基因序列, 根据该基因序列设计1对特异引物, 正向引物序列为5'-ATGGCTCCTAATGGTGAATC-3', 反向为5'-TCAGCTGATACGGCGACATA-3'。以水芹cDNA为模板进行目的基因(即'八卦洲水芹’OjCCoAOMT基因)片段的PCR扩增。扩增体系总体积10.0 μL:cDNA模板1.0 μL, TaKaRa Ex Taq Mix 5.0 μL, ddH2O 3.0 μL, 0.10 μmol·L-1正、反向引物各0.5 μL。扩增条件为:94 ℃ 5 min; 94 ℃ 30 s, 54 ℃ 30 s, 72 ℃ 80 s, 共34个循环; 72 ℃ 10 min。将反应所得产物用质量浓度12 g·L-1琼脂糖凝胶进行电泳分离, 切取含目的片段的胶块, 采用Axy Prep DNA凝胶回收试剂盒回收目的片段。将回收产物连接到pMD19-T质粒载体上, 并转化至大肠杆菌DH5α中。转化菌液检测后送至南京金斯瑞生物科技有限公司测序鉴定。
1.4 序列分析采用BioXM 2.6软件对克隆获得的水芹OjCCoAOMT基因片段进行核苷酸和氨基酸序列分析; 采用DNAMAN 6.0软件进行氨基酸序列的亲水性和疏水性分析; 在NCBI网站上采用BLASTp程序对氨基酸序列进行保守域预测及同源性分析; 不同物种CCoAOMT蛋白的氨基酸组成及理化性质分析均在ExPASy(http://www.expasy.org)上完成[19]; 采用MEGA 5.2软件绘制系统进化树; 利用SWISS-MODEL软件对目的基因OjCCoAOMT编码的氨基酸序列进行空间建模分析[20]。
1.5 实时荧光定量PCR和基因表达分析实时荧光定量PCR试验操作步骤按照SYBR Premix Ex Taq试剂盒说明书进行, 数据处理采用iQTM 5软件完成。根据克隆获得的OjCCoAOMT基因序列, 利用Primer Premier 6软件设计1对荧光定量PCR引物, 正向:5'-ATCTAAACATTCAGAAGTTGGGC-3', 反向:5'-TGGCGGTGACATCTCTAAGC-3'。以水芹的actin基因作为荧光定量数据处理的内参基因, 正向:5'-CTGGATTCTGGTGATGGT-3', 反向:5'-GCAGTTGTTGTGAAGGAG-3'[21]。扩增体系总体积20 μL:cDNA模板2.0 μL, SYBR Premix Ex Taq 10 μL, ddH2O 7.2 μL, 0.10 μmol·L-1正、反向荧光定量引物各0.4 μL。扩增条件为:95 ℃ 30 s; 95 ℃ 5 s, 60 ℃ 30 s, 共40个循环。每个样本设3次生物学重复。基因相对表达量的计算采用2-ΔΔCT方法[22]。采用Microsoft Excel 2007和SPSS 20.0进行数据分析。
2 结果与分析 2.1 水芹OjCCoAOMT基因的克隆及序列分析以'八卦洲水芹’叶片cDNA为模板, 扩增获得长约750 bp的特异片段, 命名为OjCCoAOMT基因。测序结果(图 1)显示, OjCCoAOMT基因包含1个长度为726 bp的开放阅读框(ORF), 编码241个氨基酸。OjCCoAOMT蛋白在第80位至160位氨基酸间含有1个保守的AdoMet_MTases结构域(图 2), 该蛋白属于AdoMet_MTases超级家族。

|
图 1 水芹OjCCoAOMT基因的核苷酸序列及其编码的氨基酸序列 Fig. 1 Nucleotide sequence of OjCCoAOMT gene in Oenanthe javanica and its encoded amino acids sequence *表示终止密码子。*represents the stop codon. |

|
图 2 水芹OjCCoAOMT蛋白的保守域预测结果 Fig. 2 Prediction result of conserved domain of OjCCoAOMT protein in O.javanica |
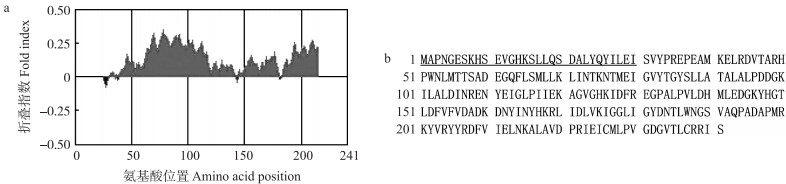
利用DNAMAN 6.0软件进行蛋白亲、疏水性分析, 结果显示:OjCCoAOMT氨基酸中位于第159位的天冬氨酸亲水性最强, 位于第66位的丝氨酸、第115位的亮氨酸和第227位的甲硫氨酸疏水性最强。总体来看, 在OjCCoAOMT蛋白中, 疏水性氨基酸多于亲水性氨基酸, 据此推测该蛋白属于疏水性蛋白。OjCCoAOMT蛋白序列折叠无序化分析显示, 整个基因区段中有1个区域无序, 共含有30个氨基酸, 无序化比例为12.45%(图 3)。
|
图 3 水芹OjCCoAOMT折叠状态分析 Fig. 3 Analysis of the folding state of OjCCoAOMT in O.javanica a.氨基酸折叠指数Fold index of amino acidꎻb.氨基酸序列Amino acid sequence.下划线标注的为无序状态的氨基酸ꎮ Underlined amino acids are disordered. |
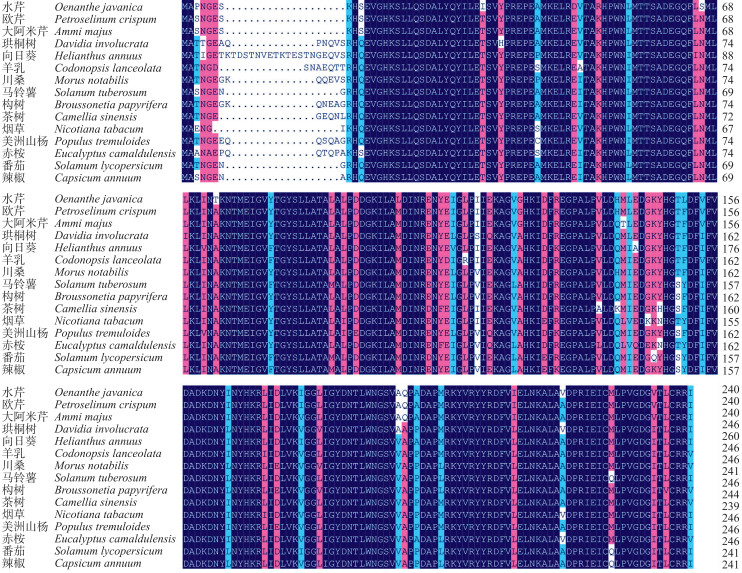
对水芹OjCCoAOMT进行BLASTp同源性检索, 并与其他植物进行比对, 结果(图 4)表明, 水芹OjCCoAOMT蛋白与欧芹(P28034.1)、大阿米芹(AAT40111.1)、珙桐树(AQY61711.1)、向日葵(XP_021989010.1)、羊乳(BAE48788)、川桑(XP_010107916)、马铃薯(NP_001305508.1)、构树(AAT37172.1)、茶树(AGR51164.1)、烟草(NP_001311999.1)、美洲山杨(Q43095.1)、赤桉(ACY66929.1)、番茄(NP_001307032.1)和辣椒(PHT90368.1)具有较高的相似度, 平均达到87.64%, 说明CCoAOMT蛋白具有高度保守性。
|
图 4 水芹与其他物种CCoAOMT蛋白氨基酸序列的多重比对 Fig. 4 The multiple alignment of amino acids sequences of CCoAOMT protein in O.javanica and other species |
由表 1可见:CCoAOMT蛋白氨基酸数量为240~261, 水芹与欧芹、大阿米芹的氨基酸数量相等; 相对分子质量为(27.043~29.257)×103, 理论等电点为5.17~5.51, 变幅不大; 酸性氨基酸比例为20%~23%, 碱性氨基酸比例差异很小, 为13%~14%;脂肪族氨基酸含量为23%~26%, 明显高于芳香族氨基酸; 总平均亲水性为-0.276~-0.181。
| 物种 Species |
氨基酸数量 Number ofamino acids |
相对分子质量/103 Relativemolecular mass |
理论等电点 Theoretical pI |
比例/% Percentage | 总平均亲水性 Grand average ofhydropathicity |
|||
| AC | BA | AR | AL | |||||
| 水芹Oenanthe javanica | 241 | 27.111 | 5.38 | 20 | 14 | 8 | 26 | -0.181 |
| 欧芹Petroselinum crispum | 241 | 27.096 | 5.39 | 21 | 14 | 9 | 24 | -0.220 |
| 大阿米芹 Ammi majus | 241 | 27.043 | 5.29 | 21 | 13 | 9 | 24 | -0.233 |
| 茶树Camellia sinensis | 245 | 27.554 | 5.39 | 22 | 14 | 8 | 24 | -0.216 |
| 向日葵Helianthus annuus | 261 | 29.257 | 5.21 | 22 | 13 | 8 | 24 | -0.243 |
| 番茄Solanum lycopersicum | 242 | 27.290 | 5.17 | 22 | 13 | 9 | 24 | -0.242 |
| 马铃薯Solanum tuberosum | 242 | 27.262 | 5.29 | 22 | 13 | 9 | 24 | -0.245 |
| 辣椒Capsicum annuum | 242 | 27.232 | 5.30 | 22 | 13 | 9 | 24 | -0.232 |
| 烟草Nicotiana tabacum | 240 | 27.170 | 5.42 | 22 | 14 | 8 | 26 | -0.208 |
| 羊乳Codonopsis lanceolata | 247 | 27.799 | 5.29 | 22 | 13 | 9 | 23 | -0.276 |
| 川桑Morus notabilis | 247 | 27.895 | 5.41 | 22 | 14 | 9 | 25 | -0.262 |
| 构树Broussonetia papyrifera | 247 | 27.733 | 5.31 | 22 | 13 | 9 | 24 | -0.245 |
| 美洲山杨Populus tremuloides | 247 | 27.867 | 5.30 | 23 | 13 | 9 | 24 | -0.257 |
| 珙桐树Davidia involucrata | 247 | 27.753 | 5.51 | 22 | 13 | 8 | 24 | -0.247 |
| 赤桉Eucalyptus camaldulensis | 247 | 27.777 | 5.40 | 22 | 13 | 8 | 25 | -0.215 |
| 注:AC:酸性氨基酸Acidic amino acids; BA:碱性氨基酸Basic amino acids; AR:芳香族氨基酸Aromatic amino acids; AL:脂肪族氨基酸Aliphatic amino acids. | ||||||||
由图 5可见:这15种植物被分成2支:隶属于伞形科、山茶科、菊科和茄科的9种植物聚为一支, 隶属于桔梗科、桑科、杨柳科、蓝果树科和桃金娘科的6种植物聚为另一支。其中, 同属于伞形科的水芹、欧芹和大阿米芹, 同属于茄科的番茄、马铃薯和辣椒以及同属于桑科的川桑和构树都在同一分支中, 说明同科的植物具有较近的亲缘关系; 水芹与欧芹进化关系最近, 其次是大阿米芹、茶树和向日葵; 水芹与珙桐树和赤桉进化关系最远。

|
图 5 水芹及其他植物CCoAOMT蛋白的系统进化树 Fig. 5 Phylogenetic tree of CCoAOMT protein in O.javanica and other species |
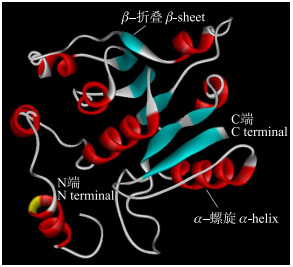
通过SWISS-MODEL软件对水芹OjCCoAOMT蛋白的三级结构进行预测及分析, 并对其蛋白序列进行同源建模。结果显示:该蛋白与紫花苜蓿(Medicago satwa)CCoAoMT蛋白三级结构的一致性达85.4%, 其中水芹OjCCoAOMT蛋白结构主要由8个α-螺旋和7个β-折叠组成(图 6)。
|
图 6 水芹OjCCoAOMT蛋白的三级结构 Fig. 6 Tertiary structure of OjCCoAOMTprotein in O.javanica |
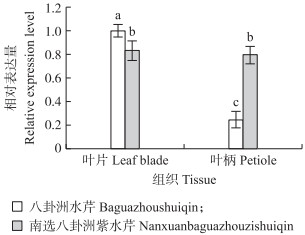
由图 7可见:在2个水芹品种叶片和叶柄中均能检测到OjCCoAOMT基因的表达, 且叶片中表达量较高。'南选八卦洲紫水芹’叶柄中的表达量是'八卦洲水芹’的3.31倍, 具有明显的材料差异性。'八卦洲水芹’叶片中OjCCoAOMT基因的表达量是叶柄中的4.17倍, 具有明显的组织特异性。'南选八卦洲紫水芹’叶片中该基因的表达量与叶柄中的基本相当, 无显著差异。
|
图 7 OjCCoAOMT基因在水芹不同组织中的相对表达水平 Fig. 7 Relative expression level of OjCCoAOMT genein different tissues of O.javanica 不同字母表示差异显著(P<0.05)。下同。Different letters indicate significant difference at 0.05 level. The same as follows. |
由图 8可见:3种贮藏条件下OjCCoAOMT基因的表达量较对照均有显著变化, 其中4 ℃低温条件下表达量变化最大, 室温条件下变化最小。室温条件(25 ℃)下, '八卦洲水芹’叶片和'南选八卦洲紫水芹’叶柄中基因表达量均呈先升后降再升的趋势, 其中处理1 d时达到峰值。低温条件(4 ℃)下, 2个水芹品种叶片中的表达量均在3 d时达到峰值。叶柄中表达量的峰值'八卦洲水芹’出现在处理2 d时, '南选八卦洲紫水芹’出现在1 d时, 分别为对照的9.19倍和5.63倍。室温黑暗条件下, '八卦洲水芹’叶片以及'南选八卦洲紫水芹’叶柄中的表达量变化均不明显。'南选八卦洲紫水芹’叶片和'八卦洲水芹’叶柄中基因表达量峰值分别出现在3和2 d时, 分别为对照的5.48倍和5.97倍。
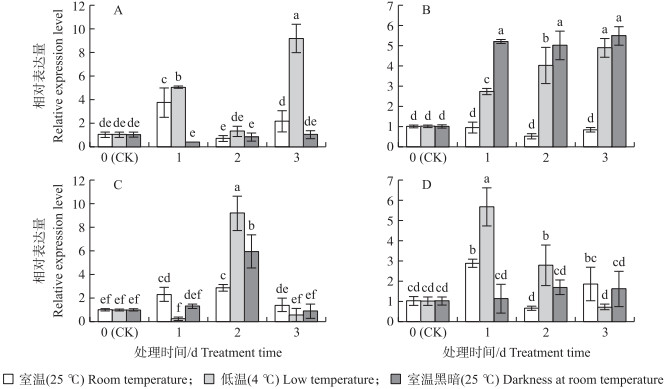
|
图 8 不同贮藏条件下水芹叶片和叶柄中OjCCoAOMT基因的相对表达水平 Fig. 8 Relative expression level of OjCCoAOMT gene under different storage conditionsin leaf blade and petiole of O.javanica A. '八卦洲水芹’叶片Leaf blade of 'Baguazhoushuiqin’; B. '南选八卦洲紫水芹’叶片Leaf blade of 'Nanxuanbaguazhouzishuiqin’; C. '八卦洲水芹’叶柄Petiole of 'Baguazhoushuiqin’; D. '南选八卦洲紫水芹’叶柄Petiole of 'Nanxuanbaguazhouzishuiqin’. |
木质素对植物的生长发育具有非常重要的作用, 它能够形成纤维素并组成细胞壁, 从而增强植物的韧性和机械强度, 提高植物的抗逆性[23]。植物的木质素合成途径十分复杂, 受多种酶的综合调控[24]。CCoAOMT亚家族是O-甲基转移酶(OMT)基因家族的主要成员, 可以参与调控植物G-S木质素的含量及G木质素单体与S木质素单体的比例[4]。CCoAOMT基因的功能与植物细胞壁的发育有关, 已有研究发现在转反义CCoAOMT基因植物中木质素含量得到一定程度的抑制, 且G/S木质素比例降低[25]。
本研究结果显示, OjCCoAOMT基因在不同组织中均能表达, 但其相对表达量存在明显差异。CCoAOMT基因在不同植物组织中的表达情况有很多类似的报道, 如PsCCoAOMT基因在木奈的小果中表达量最低[26]; DLCCoAOMT基因在龙眼根、茎、叶中均有表达, 其中根和茎中的表达量较多, 叶中较少[15]; 棉花的GhCCoAOMT2基因在茎部的表达量最高[27]。本试验中, OjCCoAOMT基因在水芹中的表达具有组织特异性, 这可能与水芹叶片、叶柄等组织木质素代谢不同有关。本研究发现, 该基因在4 ℃低温贮藏条件下表达量显著增加并且变化最大, 室温条件下表达量虽有增加但变化最小。4 ℃条件下采后水芹在处理期内一直保持良好的商品性, 处理3 d时依然颜色鲜绿、香味浓郁, 与室温3 d时失水萎蔫、褐变黄化的水芹形成鲜明的对比, 同时也优于黑暗条件下3 d时颜色加深、叶片微卷的情况。同时, 2个水芹品种对不同贮藏条件的响应也有差异, 说明该基因在响应外界环境方面存在品种特异性。研究表明, CCoAOMT能够响应逆境胁迫, 即当植物体在受到各种生物和非生物胁迫时, 会诱导CCoAOMT基因的表达, 以抵抗各种不利环境条件[28]。水芹OjCCoAOMT基因在低温中的上调表达可能与通过调节木质素代谢过程增强植株抗逆性或者发挥其他作用有关, 具体机制尚需要进一步深入研究。
| [1] |
贾晓玲, 余徐润, 王枫, 等. 水芹和旱芹营养器官结构和叶片光合特性的比较分析[J]. 南京农业大学学报, 2014, 37(2): 21-25. Jia X L, Yu X R, Wang F, et al. Comparison and analysis of the nutritional organ structure and photosynthetic characters in cress and celery[J]. Journal of Nanjing Agricultural University, 2014, 37(2): 21-25 (in Chinese with English abstract). DOI:10.7685/j.issn.1000-2030.2014.02.004 |
| [2] |
庄言, 张婷, 韩永斌, 等. 冰水预冷及贮藏温度对水芹贮藏品质的影响[J]. 食品科学, 2013, 34(24): 279-284. Zhuang Y, Zhang T, Han Y B, et al. Effects of ice water precooling and storage temperature on physiological and biochemical characteristics of Oenanthe javanica[J]. Food Science, 2013, 34(24): 279-284 (in Chinese with English abstract). DOI:10.7506/spkx1002-6630-201324058 |
| [3] |
郭光艳, 柏峰, 刘伟, 等. 转录因子对木质素生物合成调控的研究进展[J]. 中国农业科学, 2015, 48(7): 1277-1287. Guo G Y, Bai F, Liu W, et al. Advances in research of the regulation of transcription factors of lignin biosynthesis[J]. Scientia Agricultura Sinica, 2015, 48(7): 1277-1287 (in Chinese with English abstract). |
| [4] |
谷振军, 章怀云, 张党权, 等. 赤桉CCoAOMT亚家族的基因克隆及可变剪接分析[J]. 林业科学, 2014, 50(5): 62-69. Gu Z J, Zhang H Y, Zhang D Q, et al. Gene cloning and alternative splicing of CCoAOMT subfamily genes from Eucalyptus camaldulensis[J]. Scientia Silvae Sinicae, 2014, 50(5): 62-69 (in Chinese with English abstract). |
| [5] |
谷振军, 张党权, 黄青云. 木质素合成关键酶基因与造纸植物转基因改良应用研究[J]. 中南林业科技大学学报, 2010, 30(3): 67-74. Gu Z J, Zhang D Q, Huang Q Y. Transgenic modification on pulp plants by key genes regulating lignin biosynthesis[J]. Journal of Central South University of Forestry and Technology, 2010, 30(3): 67-74 (in Chinese with English abstract). |
| [6] |
刘贺娟, 李悦鹏, 刘威, 等. 接种枯萎病菌对甜瓜木质素合成相关酶活性及CmCADs表达的影响[J]. 中国农业科学, 2016, 49(11): 2153-2163. Liu H J, Li Y P, Liu W, et al. Effects of Fusarium oxysporum f. sp. melonis on lignin, activities of lingin-related enzymes and genes expressions of CmCADs in oriental melon(Cucumis melo var. makuwa Makino)[J]. Scientia Agricultura Sinica, 2016, 49(11): 2153-2163 (in Chinese with English abstract). DOI:10.3864/j.issn.0578-1752.2016.11.011 |
| [7] |
Wagner A, Tobimatsu Y, Phillips L, et al. CCoAOMT suppression modifies lignin composition in Pinus radiata[J]. The Plant Journal, 2011, 67(1): 119-129. DOI:10.1111/tpj.2011.67.issue-1 |
| [8] |
Ferrer J L, Austin M B, Stewart C, Jr, et al. Structure and function of enzymes involved in the biosynthesis of phenylpropanoids[J]. Plant Physiology and Biochemistry, 2008, 46(3): 356-370. DOI:10.1016/j.plaphy.2007.12.009 |
| [9] |
Kuhnl T, Koch U, Heller W, et al. Elicitor induced S-adenosyl-L-methionine:caffeoyl-CoA 3-O-methyltransferase from carrot cell suspension cultures[J]. Plant Science, 1989, 60(1): 21-25. DOI:10.1016/0168-9452(89)90039-3 |
| [10] |
Pakusch A E, Kneusel R E, Matern U. S-adenosyl-L-methionine:trans-caffeoyl-coenzyme A 3-O-methyltransferase from elicitor-treated parsley cell suspension cultures[J]. Archives of Biochemistry and Biophysics, 1989, 271(2): 488-494. DOI:10.1016/0003-9861(89)90299-3 |
| [11] |
Pfeiffer J, Kuhnel C, Brandt J, et al. Biosynthesis of flavan 3-ols by leucoanthocyanidin 4-reductases and anthocyanidin reductases in leaves of grape(Vitis vinifera L.), apple(Malus×domestica Borkh.) and other crops[J]. Plant Physiology and Biochemistry, 2006, 44: 323-334. DOI:10.1016/j.plaphy.2006.06.001 |
| [12] |
马春雷, 乔小燕, 陈亮. 茶树无色花色素还原酶基因克隆及表达分析[J]. 茶叶科学, 2010, 30(1): 27-36. Ma C L, Qiao X Y, Chen L. Cloning and expression analysis of leucoanthocyantin reducase gene of tea plant(Camellia sinensis)[J]. Journal of Tea Science, 2010, 30(1): 27-36 (in Chinese with English abstract). |
| [13] |
Wang L J, Jiang Y Z, Yuan L, et al. Isolation and characterization of cDNAs encoding leucoanthocyanidin reductase and anthocyanidin reductase from Populus trichocarpa[J]. PLoS One, 2013, 8(5): e64664. DOI:10.1371/journal.pone.0064664 |
| [14] |
Do C T, Pollet B, Thevenin J, et al. Both caffeoyl coenzyme A 3-O-methyltransferase 1 and caffeic acid O-methyltransferase 1 are involved in redundant functions for lignin, flavonoids and sinapoyl malate biosynthesis in Arabidopsis[J]. Planta, 2007, 226(5): 1117-1129. DOI:10.1007/s00425-007-0558-3 |
| [15] |
陈虎, 何新华, 罗聪, 等. 龙眼咖啡酰辅酶A-O-甲基转移酶(DLCCoAOMT)基因的克隆和表达分析[J]. 中国农业科学, 2012, 45(1): 118-126. Chen H, He X H, Luo C, et al. Molecular cloning of longan caffeoyl-CoA O-methyltransferase(DLCCoAOMT) and its expression analysis[J]. Scientia Agricultura Sinica, 2012, 45(1): 118-126 (in Chinese with English abstract). DOI:10.3864/j.issn.0578-1752.2012.01.014 |
| [16] |
Zhao H Y, Sheng Q X, Lu S Y, et al. Characterization of three rice CCoAOMT genes[J]. Chinese Science Bulletin, 2004, 49(15): 1602-1606. |
| [17] |
Feng K, Xu Z S, Que F, et al. An R2R3-MYB transcription factor, OjMYB1, functions in anthocyanin biosynthesis in Oenanthe javanica[J]. Planta, 2018, 247(4): 301-315. |
| [18] |
Jiang Q, Wang F, Tan H W, et al. De novo transcriptome assembly, gene annotation, marker development, and miRNA potential target genes validation under abiotic stresses in Oenanthe javanica[J]. Molecular Genetics and Genomics, 2015, 290(2): 671-683. DOI:10.1007/s00438-014-0953-y |
| [19] |
Gasteiger E, Gattiker A, Hoogland C, et al. ExPASy:the proteomics server for in-depth protein knowledge and analysis[J]. Nucleic Acids Research, 2003, 31(13): 3784-3788. DOI:10.1093/nar/gkg563 |
| [20] |
Schwede T, Kopp J, Guex N, et al. SWISS-MODEL:an automated protein homology-modeling server[J]. Nucleic Acids Research, 2003, 31(13): 3381-3385. DOI:10.1093/nar/gkg520 |
| [21] |
Jiang Q, Wang F, Li M Y, et al. Selection of suitable reference genes for qPCR normalization under abiotic stresses in Oenanthe javanica(BI.) DC[J]. PLoS One, 2014, 9(3): e92262. DOI:10.1371/journal.pone.0092262 |
| [22] |
Schäffer A A, Aravind L, Madden T L, et al. Improving the accuracy of PSI-BLAST protein database searches with composition-based statistics and other refinements[J]. Nucleic Acids Research, 2001, 29(14): 2994-3005. DOI:10.1093/nar/29.14.2994 |
| [23] |
Acker R V, Vanholme R, Storme V, et al. Lignin biosynthesis perturbations affect secondary cell wall composition and saccharification yield in Arabidopsis thaliana[J]. Biotechnology for Biofuels, 2013, 6(1): 1-17. |
| [24] |
苑笑阳, 吴雪君, 聂力, 等. 芹菜品种'六合黄心芹'AgCCoAOMT基因的克隆及表达特性分析[J]. 植物资源与环境学报, 2016, 25(3): 19-27. Yuan X Y, Wu X J, Nie L, et al. Analyses on cloning and expression characteristics of AgCCoAOMT gene from Apium graveolens 'Liuhe Huangxinqin'[J]. Journal of Plant Resources and Environment, 2016, 25(3): 19-27 (in Chinese with English abstract). DOI:10.3969/j.issn.1674-7895.2016.03.03 |
| [25] |
Guo D J, Chen F, Inoue K, et al. Downregulation of caffeic acid 3-O-methyltransferase and caffeoyl CoA 3-O-methyltransferase in transgenic alfalfa:impacts on lignin structure and implications for the biosynthesis of G and S lignin[J]. Plant Cell, 2001, 13(1): 73-88. DOI:10.1105/tpc.13.1.73 |
| [26] |
陈桂信, 王玉珍, 赵利, 等. [HT6, 3.5]木[HT6, 5.]奈[HT6]果实CCoAOMT与LAR基因的筛选与表达分析[J]. 北方园艺, 2015(9): 87-94. Chen G X, Wang Y Z, Zhao L, et al. Screening and expression of CCoAOMT and LAR genes from Nai's fruit[J]. Northern Horticulture, 2015(9): 87-94 (in Chinese with English abstract). |
| [27] |
倪志勇, 吕萌, 马文静, 等. 棉花咖啡酰辅酶A-O-甲基转移酶基因的克隆及表达[J]. 西北植物学报, 2009, 29(10): 1946-1953. Ni Z Y, Lü M, Ma W J, et al. Cloning and expression analysis of CCoAOMT gene from Gossypium hirsutum L.[J]. Acta Botanica Boreali-Occidentalia Sinica, 2009, 29(10): 1946-1953 (in Chinese with English abstract). |
| [28] |
Liu Y X, Zou D M, Wu B S, et al. Cloning and expression analysis of a CCoAOMT, homolog in loquat fruit in response to low-temperature storage[J]. Postharvest Biology and Technology, 2015, 105: 45-50. DOI:10.1016/j.postharvbio.2015.03.008 |




