文章信息
- 夏朝阳, 安晓晖, 张中起, 葛冬冬, 刘康
- XIA Zhaoyang, AN Xiaohui, ZHANG Zhongqi, GE Dongdong, LIU Kang
- 棉花E3泛素连接酶基因GhRING1-like的克隆及功能分析
- Cloning and functional analysis of cotton E3 ubiquitin ligase gene GhRING1-like
- 南京农业大学学报, 2049, 42(1): 39-50
- Journal of Nanjing Agricultural University, 2049, 42(1): 39-50.
- http://dx.doi.org/10.7685/jnau.201804020
-
文章历史
- 收稿日期: 2018-04-11
干旱是影响植物生长发育最普遍的环境胁迫之一, 是导致大田作物减产的首要因素[1]。我国棉花主产区水资源供需矛盾以及棉田灌溉造成生态用水短缺已经成为制约棉花生产可持续发展的重要因素[2], 培育推广耐旱节水型棉花新品种是最经济环保的途径。遭受干旱胁迫时, 植物也能启动一系列细胞和分子信号激活植物适应或抵御水分亏缺, 维系植物生长发育[3]。泛素蛋白酶体系统(UPS)是重要的调控途径之一[4], E3泛素连接酶是UPS最丰富的组分, 负责识别特定的靶标蛋白并使之泛素化降解, 从而在植物激素调控、胚胎发生、光形态建成、发育、衰老、非生物胁迫抗性以及植物免疫等过程中起重要调控作用[5-7]。
RING(really interesting new gene)finger E3泛素连接酶是真核生物中广泛存在的一类E3泛素连接酶, 拟南芥基因组中至少有477个基因编码RING finger结构域的E3连接酶, 是最大的E3泛素基因家族。根据金属配体出现的氨基酸残基位置及其间隔可将其划分为8个亚类, 其中RING-H2和RING-HC占90%, 是最主要的2种类型[8]。近年来, 越来越多的RING finger E3泛素连接酶基因被鉴定。其中大多数与非生物胁迫尤其是干旱胁迫有关[9]。RING finger E3泛素连接酶可以通过调控脱落酸(ABA)信号通路参与干旱胁迫响应。例如, XERICO是一种RING-H2 E3泛素连接酶, 过表达XERICO能增强ABA的生物合成、提高拟南芥的抗旱性[10-11]。ABI5是一种短寿命的bZIP转录因子, ABA、干旱、盐胁迫诱导ABI5累积, 从而导致生长发育停滞。KEG可以介导ABI5的泛素化降解, 降低胞内ABI5的积累从而抑制ABA信号通路[12-13]。ABI5上游的ABI3是一种B3型转录因子, 另一个RING finger E3泛素连接酶AIP2同样通过泛素化降解ABI3对ABA信号起负调控作用[14]。SDIR1(盐与干旱诱导的RING finger1)则是作用于ABF和ABI5上游的另一个RING finger E3泛素连接酶, 过表达SDIR1可以显著提高拟南芥和水稻对ABA的响应以及对干旱和盐的耐性[15-17]。RHA2a和RHA2b是2个协同作用的RING-H2 E3泛素连接酶, 在ABA信号途径中位于ABI2的下游, 与ABI3/4/5平行, 通过协同调控ABA信号转导, 正向调控拟南芥干旱胁迫的响应过程[18-19]。拟南芥AIRP1和AIRP2分别是RING-H2和RING-HC型E3泛素连接酶, 它们都依赖于ABA响应干旱胁迫, 过表达可以提高植物的抗旱性[20-21]。有些RING finger E3泛素连接酶可以与其他转录因子或者水孔蛋白[22]、叶绿体蛋白12和核糖体蛋白1[23]等结构蛋白互作调控植物的抗旱性。因此该家族蛋白对于植物抗旱起复杂而重要的调控作用。
虽然棉花具有一定的耐旱性, 但是棉花生产严重依赖于灌溉。因此, 挖掘和利用棉花抗旱基因资源进一步提高棉花的水分利用效率, 对于棉花生产尤其是干旱和半干旱地区的棉花生产可持续发展至关重要。然而, 目前对于在抗旱胁迫中具有重要功能的RING finger E3泛素连接酶的研究主要集中在拟南芥和水稻等模式植物, 棉花中只有少量报道[24-25]。本研究鉴定了一个RING-H2 E3泛素连接酶基因GhRING1-like, 其具有高度保守的RING-H2功能结构域, 通过分析其组织表达特性及对不同非生物胁迫或激素处理的响应模式, 以及VIGS沉默和过表达转基因植株的表型分析, 初步证明GhRING1-like对植物抗旱胁迫具有调控作用。
1 材料与方法 1.1 试验材料、菌株与试剂植物材料为陆地棉遗传标准系TM-1, 野生型拟南芥Col-0。大肠杆菌DH5α菌株、根癌农杆菌GV3101菌株、植物过表达载体pBI121和VIGS载体(pTRV1和pTRV2)均由本实验室保存。构建载体所用高保真酶PrimerSTAR、限制性内切酶、T4连接酶、反转录酶、荧光定量PCR(SYBR Green)试剂盒均购自TaKaRa公司。引物及测序由南京金斯瑞生物科技有限公司完成。
1.2 试验处理与取样棉花组织样品取样:试验材料种植于南京农业大学棉花育种圃, 在棉花盛花期采取健康植株根、茎、叶、花, 及开花后0、5、15和20 d花蕾(铃)。胁迫处理与取样:棉花植株温室生长至2叶1心, 用200 g·L-1 PEG6000和200 mmol·L-1NaCl溶液灌根, 在处理后0、1、3、6、12、24 h分别取样。植物激素处理与取样:用100 μmol·L-1ABA、100 μmol·L-1水杨酸(SA)均匀喷洒2叶1心拟南芥植株的叶片表面, 分别在处理后0、1、3、6、12、24 h取样。所取样品迅速用液氮冷冻后置于-80 ℃保存备用。每个处理3次生物学重复。
1.3 基因克隆及序列分析利用Primer Premier 5.0设计PCR扩增引物(表 1), 以陆地棉TM-1的cDNA为模板扩增GhRING1-like全长ORF序列。利用Compute pI/Mw(http://web.expasy.org/compute_pi/)预测蛋白质的相对分子质量和等电点。PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测顺式作用元件。SMART(http://smart.embl-heidelberg.de/)分析蛋白质功能结构域。BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)搜索GhRING1-like同源蛋白并下载序列, 用DNAMAN v6.0进行蛋白序列的多重序列比对, 在MEGA 5.0软件中采用最大似然法构建系统进化树。
| 引物名称Name of primer | 引物序列Sequence of primer(5'→3') | 引物用途Usage of primer |
| GRLO-F GRLO-R |
GGATCCATGTCGTCCGACGGGAACG GGTACCATCCAAATCTTCTTGTCTGGTCTCC |
编码区扩增Amplification of coding region |
| GRLR-F GRLR-R |
CTCCTGCTTATGTTGACCTTGA GACTCGGATGGGCTGTTCT |
实时荧光定量PCR qRT-PCR |
| GRLV-F GRLV-R |
GCTCTAGATCCCTAATCAAGCTTCCAAC CGGGATCCGATGCTGGTGGGGTCCCGTAC |
构建VIGS载体Constructing VIGS vector |
| Actin9-F Actin9-R |
TGGCTTTCATTTGTTTCCACAA AATAGGCATCGCAATCGCTCTC |
棉花内参基因Reference gene of cotton |
| UBQ10-F UBQ10-R |
GGCCTTGTATAATCCCTGATGAATAAG AAAGAGATAACAGGAACGGAAACATAGT |
拟南芥内参基因Reference gene of Arabidopsis thaliana |
棉花总RNA用EASYspin Plus多糖多酚/复杂RNA快速提取试剂盒(北京艾德莱)提取; 拟南芥总RNA采用Trizol方法提取[26]。用PrimeScriptTM RT reagent Kit with gDNA Eraser(TaKaRa)将RNA反转录为cDNA第1链。用SYBR Green PCR试剂盒(TaKaRa)在荧光定量PCR仪(Roche 480)上进行qRT-PCR分析, 20 μL反应体系中SYBR Premix Ex Taq 10 μL, cDNA(50 ng·μL-1)2 μL, 正、反向引物(10 μmol·L-1)各0.8 μL, ddH2O 6.4 μL。扩增程序:95 ℃ 30 s; 95 ℃ 5 s, 60 ℃ 30 s, 40个循环。棉花以Actin9为内参, 拟南芥以UBQ10为内参。3个生物学重复, 基因相对表达量采用2ΔΔCT法计算。
1.5 亚细胞定位利用BamHⅠ和KpnⅠ酶切位点, 将GhRING1-like全长ORF序列插入pBIN-GFP4表达载体中, 通过农杆菌介导法将构建好的融合载体pBIN-GhRING1-like-GFP4和RFP-HDEL共转化注射烟草下表皮, 培养箱中孵育48 h后激光共聚焦荧光显微镜(Zeiss)观察, GFP和RFP荧光分别用488 nm和543 nm的激光激发成像观察。
1.6 VIGS沉默棉花GhRING1-like基因利用SGN VIGS Tool(http://vigs.solgenomics.net/)设计GhRING1-like基因的VIGS干扰序列(400 bp), 并构建到pTRV2载体上, 将pTRV1、pTRV2、pTRV2-GhCLA1和pTRV2-GhRING1-like分别转化根癌农杆菌GV3101, 用卡那霉素(50 mg·mL-1)和利福平(50 mg·mL-1)进行筛选。参照Gao等[27]的方法进行VIGS注射:农杆菌菌液D600=0.8, 室温下静置3 h以上, 将含有pTRV1的农杆菌分别与含有pTRV2、pTRV2-GhCLA1和pTRV2-GhRING1-like的农杆菌按1:1(体积比)混匀, 注射10日龄的棉花幼苗子叶。待阳性对照pTRV2-GhCLA1出现白化表型时, 取样分析GhRING1-like的表达水平, 标记沉默植株供下一步试验。
取生长状况一致的沉默和对照棉花植株, 在营养土吸饱水分后倒去多余的水, 移入光周期为16 h光照/8 h黑暗、昼/夜温度为28 ℃/25 ℃的植株培养室, 进行缺水处理, 观察记录植株生长发育表现, 测定相对含水量、叶绿素荧光参数、离子渗透率、MDA含量等生理指标。
1.7 转基因拟南芥抗旱性分析利用重组酶法将6×His-tag标签的GhRING1-like克隆到过表达载体pBI121上, 转化农杆菌GV3101, 泡花法转化拟南芥[28]。卡那霉素筛选纯合的转基因株系, PCR验证, qRT-PCR分析转基因表达水平, 选取2个高表达的GhRING1-like转基因株系和野生型(WT)进行以下抗旱性分析。
萌发抗旱性分析:将拟南芥种子播在甘露醇浓度分别为0、150、300 mmol·L-1的1/2 MS培养基(pH5.8)上, 22 ℃恒温培养4 d后统计其发芽率。
幼苗抗旱性分析:拟南芥种子在1/2 MS培养基上发芽4 d后, 移入含0、150、300 mmol·L-1甘露醇的1/2 MS培养基中, 22 ℃恒温培养室中培养10 d后测定幼苗根长。
营养生长中后期抗旱性分析:拟南芥种子在1/2 MS培养基上发芽4 d后, 将幼苗移入装有营养土的穴盘中生长3周, 停止浇水生长10 d后再复水, 观察记录植物表型变化, 测定植株生存率、失水率、气孔开度等生理指标。
1.8 抗旱生理指标测定相对含水量测定:取不同处理的植株同部位叶片称其质量(Wf), 然后置于蒸馏水中吸水8 h至饱和, 吸水纸吸干叶片表面水分后再称其质量(Wt)。将水饱和的叶子置于烘箱中烘干至恒质量(Wd)。计算叶片的相对含水量(RWC):RWC=(Wf-Wd)/(Wt-Wd)×100%。
叶绿素荧光参数的测定:使用MINI-PAM调制荧光仪(德国WALZ)测量叶片的叶绿素荧光。每次测量前, 将植物暗处理20 min以上, 然后用恒定光照强度的饱和脉冲照射植物。记录叶绿素荧光参数Fv/Fm(代表开放PSⅡ的最大量子产率), 计算公式为:Fv/Fm=(Fm-Fo)/Fm[23]。
电解质渗透率测定:取自然干旱的对照和VIGS植株, 洗净后剪成小段放入20 mL蒸馏水中, 于真空干燥器中抽气15 min, 在室温下静置2 h, 测量初始电导率C1, 然后放入100 ℃沸水浴中15 min以引起最大电解质渗透, 快速冷却至室温后测量其电导率C2。相对电导率=C1/C2×100%。
MDA含量测定:取自然干旱的对照和VIGS植株样品0.1 g左右, 加入磷酸盐缓冲液充分研磨, 取上清液, 采用硫代巴比妥酸法检测沉默植株和对照植株的丙二醛含量。
失水率测定:选取拟南芥植株莲座叶片称其质量, 然后放入培养室(温度为25 ℃, 相对湿度为60%~65%), 每隔一定时间称量1次鲜质量, 计算叶片的失水率[23]。
气孔观察:使用市售指甲油快速涂抹拟南芥叶片下表皮, 待完全干燥后, 小心撕下指甲油结膜, 置于显微镜40倍物镜下进行观察、拍照, 使用ImageJ测定气孔开度, 每个生物学重复至少测定30个气孔[23]。
以上所有的测定都设置3次生物学重复。使用单因素方差分析(ANOVA)和Student-t测验进行差异显著性分析。
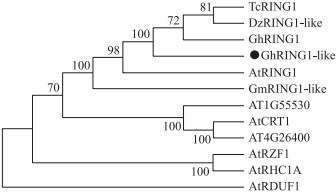
2 结果与分析 2.1 GhRING1-like的克隆及其序列分析以陆地棉TM-1的cDNA为模板, PCR扩增GhRING1-like(XP_016666470)的ORF序列, 全长996 bp, 编码332个氨基酸。预测的蛋白质相对分子质量为35.8×103, 理论等电点为5.03。与NCBI的数据库对比显示, 陆地棉GhRING1-like与可可、榴莲、拟南芥中同源蛋白的相似度分别为74%、72%和56%, 与已经鉴定的陆地棉GhRING1相似度为73%。其N端都含有1个Zinc-ribbon结构域, C端都含有1个RING-H2(C3H2C3)结构域(图 1)。系统进化树分析结果表明, 棉花GhRING1-like与可可TcRING1、榴莲DzRING1-like、陆地棉GhRING1、拟南芥AtRING1聚为1个亚类(图 2)。

|
图 1 GhRING1-like与其他植物RING-H2蛋白的多序列比对 Fig. 1 Multi-alignment of GhRING1-like with other plant RING-H2 finger protein Gh:棉花Gossypium hirsutum; Gm:大豆Glycine max; Tc:可可Theobroma cacao; Dz:榴莲Durio zibethinus; At:拟南芥Arabidopsis thaliana.下同。The same as follows. |
|
图 2 GhRING-like与其他物种同源蛋白的进化树聚类分析 Fig. 2 Phylogenetic tree analysis of GhRING-like andother proteins from different species |
利用PlantCARE对GhRING1-like上游2 kb区域进行顺式作用元件预测分析, 发现含有与干旱胁迫相关的MBS、逆境胁迫和防卫反应相关的TC-rich repeats、高温响应相关的HSE、SA响应相关的TCA-element等顺式元件(表 2)。因此GhRING1-like的表达可能受多种环境因素诱导, 参与多种胁迫响应过程。
| 名称Name | 序列Sequence(5'→3') | 功能Function |
| MBS | CAACTG | 干旱诱导相关顺式元件MYB binding site involved in drought-inducibility |
| as-2-box | GATAATGATG | 地上部分特异表达相关顺式元件Shoot-specific expression element |
| TC-rich repeats | GTTTTCTTAC | 逆境胁迫和防卫反应相关作用元件Defense and stress responsive element |
| HSE | AAAAAATTTC | 高温响应相关顺式元件Heat stress responsive element |
| ARE | TGGTTT | 厌氧诱导顺式元件Anaerobic induction element |
| CCGTCC-box | CCGTCC | 分生组织激活相关顺式元件Meristem specific activation element |
| TC-rich repeats | GTTTTCTTAC | 逆境胁迫和防卫反应相关作用元件Defense and stress responsive element |
| TCA-element | CCATCTTTTT | SA响应相关顺式元件Salicylic acid responsive element |
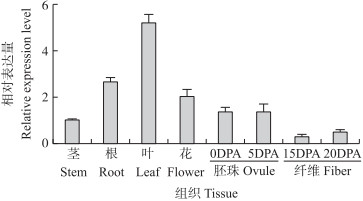
为了分析GhRING1-like的组织表达特征及其对环境因素的响应, 利用实时荧光定量PCR分析该基因在棉花根、茎、叶、花、胚珠、纤维等不同组织器官以及PEG6000、NaCl、ABA、SA等不同处理中棉花幼苗的GhRING1-like转录水平, 结果显示GhRING1-like在棉花的根、茎、叶、花、胚珠以及纤维中均有表达, 在叶中的表达量最高, 根和花次之, 茎、胚珠表达量较低, 纤维中的表达量最低(图 3)。
|
图 3 棉花不同组织GhRING1-like表达水平的qRT-PCR分析 Fig. 3 qRT-PCR analysis of GhRING1-like expressionin different tissues of cotton DPA:开花后天数Days post anthesis. |
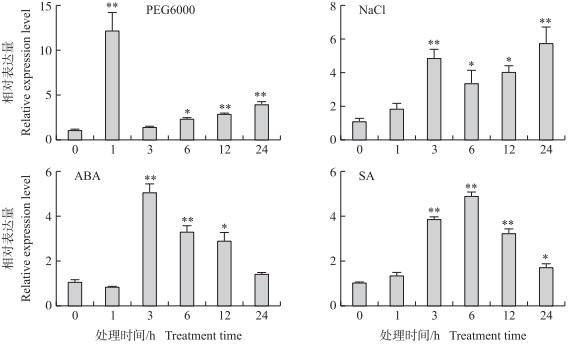
GhRING1-like对PEG6000最为敏感:PEG 6000处理1 h, GhRING1-like的转录水平迅速上升到对照的12倍, 3 h时又迅速下降到处理前水平, 6 h后又显著上升至处理前的2~4倍, 说明GhRING1-like是一种可以瞬时快速响应早期生理脱水反应的基因。GhRING1-like对NaCl、ABA和SA的响应时间都在处理后3 h, 上调表达的程度十分接近, 都在5倍左右。但是表达的时间动态模式略有差异:NaCl处理3 h后GhRING1-like一直维持在较高水平, 24 h后达到了峰值; ABA处理的峰值出现在3 h, 此后逐渐下降(图 4)。上述结果表明, PEG、NaCl、ABA、SA等环境因子均可以迅速而显著诱导GhRING1-like的表达, 说明GhRING1-like可能是调节植物对多种环境胁迫响应的重要机制成分之一。
|
图 4 不同环境因素对棉花GhRING1-like表达的影响 Fig. 4 Effects of different environmental factors on GhRING1-like expression in cotton |
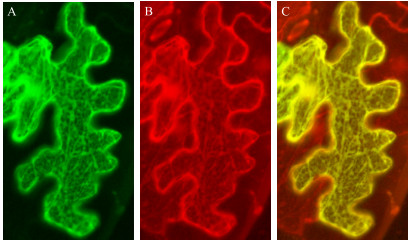
为了进一步分析GhRING1-like蛋白功能, 将转化了pBIN-GhRING1-like-GFP融合蛋白表达载体的农杆菌注射烟草叶片下表皮, 使其瞬时表达。激光共聚焦显微镜观察结果显示, pBIN-GhRING1-like-GFP的绿色荧光分布在类似内质网的具有网状结构的细胞器上(图 5-A)。采用同样的方法, 将GhRING1-like-GFP和红色荧光蛋白标签的内质网定位标记蛋白RFP-HDE共转化烟草叶片, 激光共聚焦显微镜观察结果表明2种荧光信号高度重合(图 5-B、C), 表明GhRING1-like定位于内质网上。
|
图 5 GhRING1-like蛋白的亚细胞定位 Fig. 5 Subcellular localization of GhRING1-like protein A. GhRING1-like-GFP融合蛋白的细胞定位; B. RFP-HDEL融合蛋白的细胞定位; C. GFP和RFP叠加信号。 A. Localization of GhRING1-like-GFP fusion protein in a cell; B. Localization of RFP-HDEL fusion protein in a cell; C. Superimposition of GFP and RFP signals. |
为了研究GhRING1-like基因在棉花干旱胁迫反应中的作用, 采用子叶注射法对棉花GhRING1-like进行VIGS沉默。在TRV2:GhCLA1阳性对照植株发生白化时(图 6-A), 采用qRT-PCR分析鉴定TRV2:GhRING1-like棉花植株中目标基因沉默的效率。结果显示, VIGS沉默的棉花植株中GhRING1-like RNA水平为对照植株的21.2%, 表明GhRING1-like沉默有效(图 6-B)。
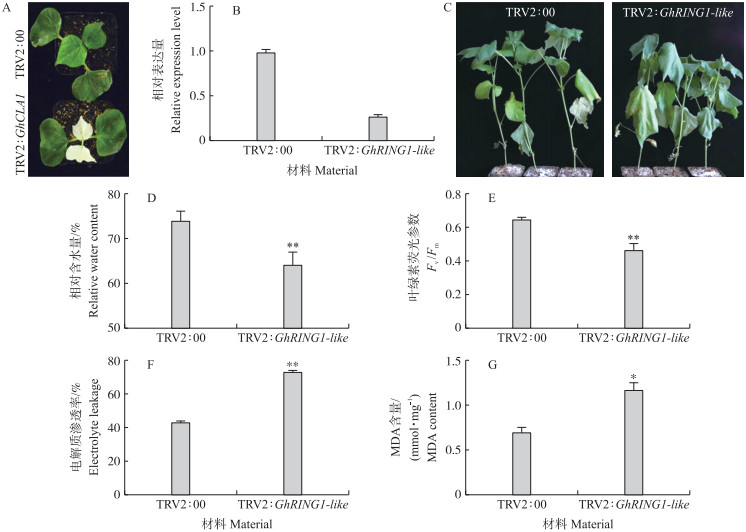
|
图 6 VIGS沉默GhRING1-like对棉花抗旱性的影响 Fig. 6 VIGS silencing of GhRING1-like compromised cotton tolerance to drought stress A. VIGS阳性对照, GhCLA1沉默后出现白化; B. qRT-PCR分析VIGS沉默植株GhRING1-like相对表达量; C. VIGS沉默GhRING1-like对缺水处理更为敏感; D—G. VIGS沉默GhRING1-like对干旱胁迫下棉花相对含水量、叶绿素荧光参数Fv/Fm、电解质渗透率、丙二醛(MDA)含量的影响。 A. The positive control of VIGS, the photobleaching phenotype of cotton leaves triggered by GhCLA1 VIGS; B. The relative transcript level of GhRING1-like in control and silenced plants by qRT-PCR analysis; C. Silencing of GhRING1-like enhanced plant susceptibility to water deficit; D-G. Effect of silencing of GhRING1-like on cotton relative water content(D), leaf chlorophyll fluorescence parameter Fv/Fm(E), electrolyte leakage(F), and malondialdehyde(MDA)content(G)under water deficit. |
将对照和VIGS沉默棉花幼苗进行缺水处理12 d后, 所有的棉花植株都出现了明显的萎焉, 但TRV2:GhRING1-like棉花植株萎焉程度较对照更为严重(图 6-C)。干旱胁迫处理后, TRV2:GhRING1-like植株相对含水量为62.5%, 对照植株的相对含水量为73.2%, TRV2:GhRING1-like植株的相对含水量显著降低17.1%(图 6-D)。干旱胁迫下TRV2:GhRING1-like棉花叶片叶绿素荧光参数Fv/Fm显著低于对照, 较对照降低30.6%(图 6-E)。沉默GhRING1-like导致棉花植株失水显著增多, 叶片萎焉程度更为严重, 而Fv/Fm显著低于对照, 暗示PSⅡ的光能转换效率受损程度显著高于对照。
干旱胁迫往往导致脂质过氧化, 从而损失膜系统。电解质渗透率和丙二醛含量分别为指示膜透性以及脂质过氧化程度的生理指标。干旱胁迫下TRV2:GhRING1-like植株叶片的电解质渗透率为71.2%, 丙二醛含量为1.2 mmol·mg-1; 对照植株的电解质渗透率为41.8%, 丙二醛含量为0.7 mmol·mg-1。沉默GhRING1-like使植株叶片电解质渗透率较对照提高70.3%, 丙二醛含量提高71.4%(图 6-F、G)。
以上结果表明, GhRING1-like为干旱胁迫下棉花维持植株水势、PSⅡ功能以及膜稳定性所必需。
2.5 过表达GhRING1-like增强拟南芥抗旱性为验证GhRING1-like在植物抗旱性中的作用, 将CaMV 35S启动子驱动的GhRING1-like转化拟南芥, 获得7个独立转基因系纯合体。利用qRT-PCR检测拟南芥转基因系GhRING1-like表达水平, 结果表明外源基因在所有转基因系中均有不同程度的表达, 取35S ∷GhRING1-like #1和35S∷GhRING1-like#3这2个高表达株系进行后续试验。
将灭菌后的拟南芥种子均匀铺于含有0、150和300 mmol·L-1甘露醇的1/2 MS上。在没有甘露醇的培养基上, 野生型和转基因拟南芥发芽率没有显著差异, 都在97.5%以上; 添加150 mmol·L-1甘露醇时, 35S ∷GhRING1-like #1和35S∷GhRING1-like#3转基因拟南芥种子的发芽率分别为77.3%和78.6%, 较野生型对照提高23.4%和25.5%;甘露醇浓度为300 mmol·L-1时, 35S∷GhRING1-like #1和35S∷GhRING1-like#3拟南芥的发芽率分别为51.2%和47.7%, 较野生型对照高1.9倍和1.7倍(图 7-A、B)。过表达GhRING1-like显著提高拟南芥萌发时期的抗旱性。
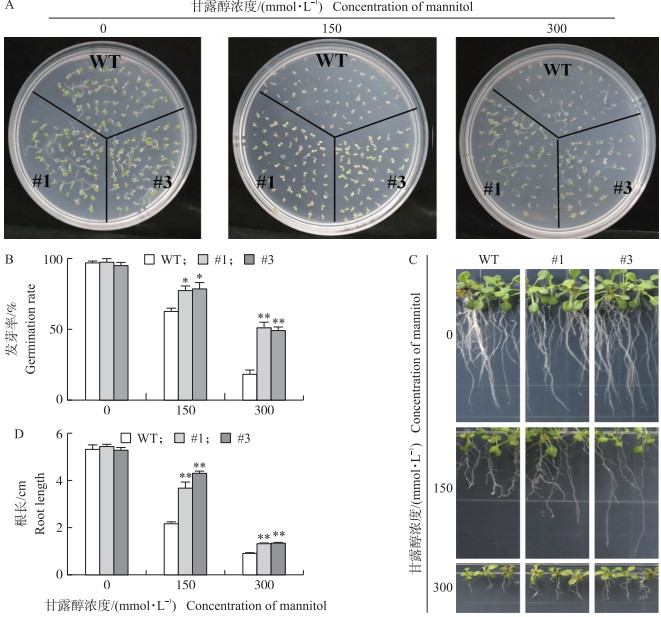
|
图 7 过表达GhRING1-like增强了拟南芥萌发和幼苗期的抗旱性 Fig. 7 Overexpression of GhRING1-like enhanced the drought resistance of Arabidopsis thaliana germination and seedling A.不同浓度甘露醇处理对野生型(WT)和过表达GhRING1-like拟南芥种子萌发的影响; B.不同浓度甘露醇处理后拟南芥种子的发芽率; C.不同浓度甘露醇对野生型WT和过表达GhRING1-like拟南芥幼苗根长的影响; D.不同浓度甘露醇处理10 d后拟南芥植物的根长。 A. Seed germination of wild-type(WT)and GhRING1-like overexpressed Arabidopsis plants under various concentrations of mannitol; B. Seed germination rate of Arabidopsis plants under various concentrations of mannitol; C. Root elongation of WT and GhRING1-like overexpressed Arabidopsis plants in response to various concentrations of mannitol; D. The root length of each plant was measured 10 days after treatment. |
将刚长出真叶的拟南芥幼苗分别移栽到含有0、150和300 mmol·L-1甘露醇的MS培养基上, 观察拟南芥生长情况。研究发现在没有甘露醇的培养基上, 野生型与过表达GhRING1-like转基因拟南芥均正常生长, 没有明显表型差异。而在添加甘露醇的培养基中, 拟南芥生长均受到明显抑制, 甘露醇浓度越大, 生长受抑制程度越大。在含150、300 mmol·L-1的甘露醇培养基上, 野生型根长分别减少了62.3%和78%, 而过表达GhRING1-like #1和#3拟南芥根长分别减少30.3%和64.2%, 相对于野生型, 2个拟南芥转基因系植株根长生长受抑程度显著低于野生型对照(图 7-C、D)。说明过表达GhRING1-like基因能够增强拟南芥幼苗期对渗透胁迫的抗性。
将生长3周的拟南芥进行缺水干旱处理, 分析GhRING1-like对营养生长中后期拟南芥抗旱性的影响。缺水处理10 d后, 过表达GhRING1-like转基因拟南芥萎蔫程度明显低于野生型; 复水2 d后, 野生型植株大量枯死, 存活率为29.2%, 而转基因株系GhRING1-like # 1和GhRING1-like#3的存活率分别为70.3%和68.8%, 均是野生型的2.4倍左右(图 8-A、B)。水分亏缺胁迫下, 转基因拟南芥叶片失水率较野生型低(图 8-C), 转基因拟南芥叶片气孔开度比野生型显著降低37.0%(#1)、27.8%(#3)(图 8-D、E)。过表达GhRING1-like显著提高了拟南芥营养生长中后期的抗旱性。
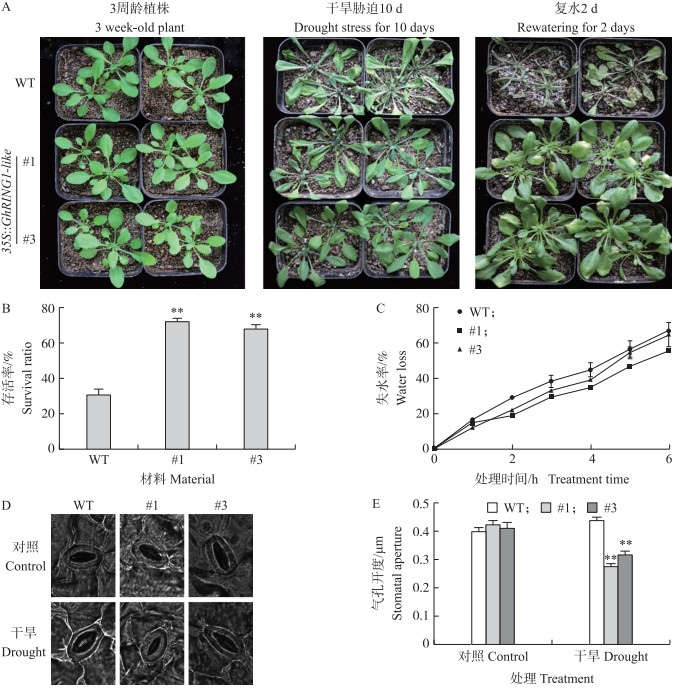
|
图 8 过表达GhRING1-like增强了拟南芥生长中后期的抗旱性 Fig. 8 Overexpression of GhRING1-like in A.thaliana enhances the drought resistanceat middle and late stage growth A.水分亏缺胁迫下过表达GhRING1-like对拟南芥生长的影响; B.野生型WT和转基因拟南芥存活率统计; C.水分亏缺胁迫下过表达GhRING1-like对叶片失水率的影响; D, E.水分亏缺胁迫下过表达GhRING1-like对叶片气孔开度的影响。 A. Effect of overexpression of GhRING1-like on A.thaliana plant growthy under water deficit; B. Survival rate of WT and transgenic Arabidopsis; C. Effect of overexpression of GhRING1-like on leaf water loss rate under water deficit; D, E. Effect of overexpression of GhRING1-like on stomatal apertures under water deficit. |
利用qRT-PCR分析过表达GhRING1-like对拟南芥AtPLD、AtAREB1、AtERD15、AtRD29A、AtDREB等5个干旱胁迫响应标志基因表达的影响(图 9)。结果发现, 5个基因的表达在未经干旱处理的转基因拟南芥与野生型之间无显著差异, 渗透胁迫处理后, AtPLD、AtDREB的表达水平没有显著差异, GhRING1-like对于不依赖于ABA的干旱诱导基因脯氨酸合成基因AtPLD和干旱诱导的转录因子AtDREB没有明显的调控作用; 而干旱胁迫下依赖于ABA诱导表达的AtAREB1在转基因拟南芥中显著上调表达, 依赖于ABA诱导表达的AtERD15、AtRD29A则在野生型和过表达GhRING1-like拟南芥中均显著上调表达, 转基因拟南芥中的表达水平显著高于野生型。提示:GhRING1-like可能主要通过调控依赖于ABA的信号通路提高植物的抗旱反应。
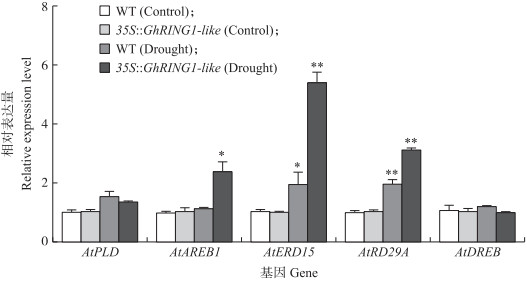
|
图 9 GhRING1-like对拟南芥干旱胁迫反应标志基因表达的影响 Fig. 9 9 Influence of ectopic GhRING1-like in expression of drought response marker genes in A.thaliana |
RING finger E3泛素连接酶是一种广泛存在于真核生物的一个大家族蛋白, 是拟南芥蛋白质组中最多的一类E3泛素连接酶, 目前, 拟南芥477个RING finger E3泛素连接酶中, 只有50多个基因的功能得到研究, 它们的功能覆盖生长发育、细胞分裂、激素信号调控及其响应以及生物和非生物胁迫抗性等方面[29-30]。棉花基因组中预测有412个RING finger E3泛素连接酶基因, 目前报道的只有2个基因[24-25]。本研究从陆地棉中分离鉴定了1个编码含有典型RING-H2结构域的RING finger E3泛素连接酶基因, 其编码的氨基酸序列与拟南芥AtRING1相似度较高, 命名为GhRING1-like。该基因上游启动子区含有干旱、防卫反应、SA等响应元件, 提示该基因可能与干旱以及生物胁迫反应有关。PEG、NaCl、ABA、SA均能诱导该基因迅速上调表达, 其中, 对PEG的响应最为敏感, 1 h以内上调12倍, 快于对ABA、SA等激素的响应, GhRING1-like是一种脱水诱导早期应答基因, 可以快速应答干旱反应, 从而可能通过依赖和(或)不依赖于ABA通路调控植物的抗旱性[3]。植物抗盐与抗旱共享很多分子机制, 已经发现很多RING finger基因兼具抗旱抗盐功能[31]。SA是植物抗病的重要信号分子, 因此GhRING1-like也可能参与抗病防卫反应的调控。拟南芥中的相似基因AtRING1受真菌毒素烟曲霉毒素B1以及PST DC3000(avrRPM1)诱导上调表达, 并触发植物程序性死亡通路[32]。因此, GhRING1-like是否具有耐干旱、盐以及生物胁迫等功能, 值得进一步研究。
为了阐明GhRING1-like在干旱胁迫下的生物学功能, 分别对GhRING1-like沉默棉花植株以及过表达拟南芥植株进行抗旱性鉴定。沉默GhRING1-like使棉花对干旱更敏感, 叶片相对含水量降低, 光合电子传递效率下降, 电解质渗透率和MDA含量提高, GhRING1-like对于维持干旱胁迫下植株的含水量、光合作用、膜透性以及抗氧化功能是必需的。过表达GhRING1-like则显著提高了拟南芥幼苗对于甘露醇引起的渗透胁迫的耐受性。过表达GhRING1-like对营养生长中后期拟南芥抗旱性的提高更为显著, 可使叶片失水率降低, 气孔开度变小, 缺水处理10 d后的植株存活率提高2.4倍。GhRING1-like可能通过调节气孔的开闭减少干旱胁迫下水分蒸腾从而提高抗旱性。综合沉默和过表达分析结果, GhRING1-like在植物抗旱中起正调控作用。RING finger E3泛素连接酶对于植物抗旱反应的调控作用可以通过依赖于ABA或不依赖于ABA两类途径进行, 其中, 依赖于ABA途径的调控作用包括调控ABA生物合成[10-11]、ABA信号通路[12-15, 18-19]以及依赖于ABA的干旱胁迫响应蛋白[20-21]。分析GhRING1-like对于拟南芥干旱胁迫相关标志基因表达的影响时发现, AtAREB、AtERD15、AtRD29A在过表达GhRING1-like拟南芥中的表达水平显著提高。其中AtAREB是调控干旱反应中依赖于ABRE元件的ABA信号通路基因表达的重要转录因子, 过表达AtAREB1可以提高植物的抗旱性[29]。AtERD15在干旱条件下快速而瞬时表达, 过表达AtERD15可降低对干旱胁迫的抗性以及对ABA的敏感性, 但是可以提高ABA的积累, AtERD15通过调控干旱胁迫下ABA信号的敏感性和ABA积累两者之间的平衡综合调控植株的抗旱性[33]。GhRING1-like使拟南芥AtERD15上调表达幅度最大, 其作用及其分子机制有待进一步研究。AtRD29A也可以通过不依赖ABA的信号通路受干旱诱导表达[34], GhRING1-like使干旱胁迫下AtRD29A显著上调表达通过什么通路, 也需要进一步阐述。有趣的是, 不依赖于ABA的干旱胁迫诱导基因AtDREB2[35]和脯氨酸合成基因AtPLD的表达均未受GhRING1-like的影响。提示GhRING1-like可能主要通过ABA信号通路调控干旱胁迫反应。但是由于GhRING1-like是一种E3泛素连接酶, 主要通过翻译后修饰调控植物的生物学过程, 因此, 对干旱胁迫反应的分子调控机制仍不清楚, 分析鉴定GhRING1-like互作蛋白及其泛素化蛋白质底物, 是全面解析GhRING1-like调控机制所必需的。
| [1] |
Luo L J. Breeding for water-saving and drought-resistance rice(WDR) in China[J]. Journal of Experimental Botany, 2010, 61(13): 3509-3517. DOI:10.1093/jxb/erq185 |
| [2] |
马琼, 王雅鹏. 新疆棉花生产的外部环境成本评估[J]. 干旱区资源与环境, 2015, 29(6): 63-68. Ma Q, Wang Y P. Evaluating the externally environmental cost of cotton production in Xinjiang[J]. Journal of Arid Land Resources and Environment, 2015, 29(6): 63-68 (in Chinese with English abstract). |
| [3] |
Shinozaki K, Yamaguchi-Shinozaki K. Gene networks involved in drought stress response and tolerance[J]. Journal of Experimental Botany, 2007, 58(2): 221-227. |
| [4] |
Xia Z L, Su X H, Liu J J, et al. The RING-H2 finger gene 1(RHF1) encodes an E3 ubiquitin ligase and participates in drought stress response in Nicotiana tabacum[J]. Genetica, 2013, 141(1/2/3): 11-21. |
| [5] |
Sharma B, Joshi D, Yadav P K, et al. Role of ubiquitin-mediated degradation system in plant biology[J]. Frontiers in Plant Science, 2016, 7: 806. |
| [6] |
Santner A, Estelle M. The ubiquitin-proteasome system regulates plant hormone signaling[J]. Plant Journal, 2010, 61(6): 1029-1040. DOI:10.1111/tpj.2010.61.issue-6 |
| [7] |
Hellmann H, Estelle M. Plant development:regulation by protein degradation[J]. Science, 2002, 297(5582): 793-797. DOI:10.1126/science.1072831 |
| [8] |
Stone S L, Hauksdottir H, Troy A, et al. Functional analysis of the RING-type ubiquitin ligase family of Arabidopsis[J]. Plant Physiology, 2005, 137(1): 13-30. DOI:10.1104/pp.104.052423 |
| [9] |
Lyzenga W J, Stone S L. Abiotic stress tolerance mediated by protein ubiquitination[J]. Journal of Experimental Botany, 2012, 63(2): 599-616. DOI:10.1093/jxb/err310 |
| [10] |
Ko J H, Yang S H, Han K H. Upregulation of an Arabidopsis RING-H2 gene, XERICO, confers drought tolerance through increased abscisic acid biosynthesis[J]. Plant Journal, 2006, 47(3): 343-355. DOI:10.1111/tpj.2006.47.issue-3 |
| [11] |
Zeng D E, Hou P, Xiao F M, et al. Overexpression of Arabidopsis XERICO gene confers enhanced drought and salt stress tolerance in rice(Oryza sativa L.)[J]. Journal of Plant Biochemistry and Biotechnology, 205, 24(1): 56-64. |
| [12] |
Stone S L, Williams L A, Farmer L M, et al. KEEP ON GOING, a RING E3 ligase essential for Arabidopsis growth and development, is involved in abscisic acid signaling[J]. Plant Cell, 2006, 18(12): 3415-3428. DOI:10.1105/tpc.106.046532 |
| [13] |
Liu H, Stone S L. Abscisic acid increases Arabidopsis ABI5 transcription factor levels by promoting KEG E3 ligase self-ubiquitination and proteasomal degradation[J]. Plant Cell, 2010, 22(8): 2630-2641. DOI:10.1105/tpc.110.076075 |
| [14] |
Zhang X, Garreton V, Chua N H. The AIP2 E3 ligase acts as a novel negative regulator of ABA signaling by promoting ABI3 degradation[J]. Genes & Development, 2005, 19(13): 1532-1543. |
| [15] |
Zhang Y Y, Yang C W, Li Y, et al. SDIR1 is a RING finger E3 ligase that positively regulates stress-responsive abscisic acid signaling in Arabidopsis[J]. Plant Cell, 2007, 19(6): 1912-1929. DOI:10.1105/tpc.106.048488 |
| [16] |
Zhang H W, Cui F, Wu Y, et al. The RING finger ubiquitin E3 ligase SDIR1 targets SDIR1-INTERACTING PROTEIN1 for degradation to modulate the salt stress response and ABA signaling in Arabidopsis[J]. Plant Cell, 2015, 27(1): 214-227. DOI:10.1105/tpc.114.134163 |
| [17] |
Gao T, Wu Y, Zhang Y Y, et al. OsSDIR1 overexpression greatly improves drought tolerance in transgenic rice[J]. Plant Molecular Biology, 2011, 76(1/2): 145-156. |
| [18] |
Li H, Jiang H, Bu Q, et al. The Arabidopsis RING finger E3 ligase RHA2b acts additively with RHA2a in regulating abscisic acid signaling and drought response[J]. Plant Physiology, 2011, 156(2): 550-563. DOI:10.1104/pp.111.176214 |
| [19] |
Bu Q, Li H, Zhao Q, et al. The Arabidopsis RING finger E3 ligase RHA2a is a novel positive regulator of abscisic acid signaling during seed germination and early seedling development[J]. Plant Physiology, 2009, 150(1): 463-481. DOI:10.1104/pp.109.135269 |
| [20] |
Ryu M Y, Cho S K, Kim W T. The Arabidopsis C3H2C3-type RING E3 ubiquitin ligase AtAIRP1 is a positive regulator of an abscisic acid-dependent response to drought stress[J]. Plant Physiology, 2010, 154(4): 1983-1997. DOI:10.1104/pp.110.164749 |
| [21] |
Cho S K, Ryu M Y, Seo D H, et al. The Arabidopsis RING E3 ubiquitin ligase AtAIRP2 plays combinatory roles with AtAIRP1 in abscisic acid-mediated drought stress responses[J]. Plant Physiology, 2011, 157(4): 2240-2257. DOI:10.1104/pp.111.185595 |
| [22] |
Lee H K, Cho S K, Son O, et al. Drought stress-induced Rma1H1, a RING membrane-anchor E3 ubiquitin ligase homolog, regulates aquaporin levels via ubiquitination in transgenic Arabidopsis plants[J]. Plant Cell, 2009, 21(2): 622-641. DOI:10.1105/tpc.108.061994 |
| [23] |
Lim S D, Lee C, Jang C S. The rice RING E3 ligase, OsCTR1, inhibits trafficking to the chloroplasts of OsCP12 and OsRP1, and its overexpression confers drought tolerance in Arabidopsis[J]. Plant, Cell & Environment, 2014, 37(5): 1097-1113. |
| [24] |
Ho M H, Saha S, Jenkins J N, et al. Characterization and promoter analysis of a cotton RING-type ubiquitin ligase(E3) gene[J]. Molecular Biotechnology, 2010, 46(2): 140-148. DOI:10.1007/s12033-010-9280-7 |
| [25] |
Liu Y C, Zhang X N, Zhu S H, et al. Overexpression of GhSARP1 encoding a E3 ligase from cotton reduce the tolerance to salt in transgenic Arabidopsis[J]. Biochemical and Biophysical Research Communications, 2016, 478(4): 1491-1496. DOI:10.1016/j.bbrc.2016.07.033 |
| [26] |
Lü F, Han M Y, Ge D D, et al. GhVLN4 is involved in cell elongation via regulation of actin organization[J]. Planta, 2017, 246(4): 687-700. DOI:10.1007/s00425-017-2723-7 |
| [27] |
Gao X Q, Britt R C, J r, Shan L B, et al. Agrobacterium-mediated virus-induced gene silencing assay in cotton[J]. Journal of Visualized Experiments, 2011, 54: e2938. |
| [28] |
Martinez-Trujillo M, Limones-Briones V, Cabrera-Ponce J L, et al. Improving transformation efficiency of Arabidopsis thaliana by modifying the floral dip method[J]. Plant Molecular Biology Reporter, 2004, 22(1): 63-70. DOI:10.1007/BF02773350 |
| [29] |
Zhao L N, Li Y Q, Xie Q, et al. Loss of CDKC; 2 increases both cell division and drought tolerance in Arabidopsis thaliana[J]. Plant Journal, 2017, 91: 816-828. DOI:10.1111/tpj.2017.91.issue-5 |
| [30] |
Pauwels L, Ritter A, Goossens J, et al. The RING E3 ligase KEEP ON GOING modulates JASMONATE ZIM-DOMAIN12 stability[J]. Plant Physiology, 2015, 169(2): 1405-1417. DOI:10.1104/pp.15.00479 |
| [31] |
Chapagain S, Park Y C, Jang C S. Functional diversity of RING E3 ligases of major cereal crops in response to abiotic stresses[J]. Journal of Crop Science and Biotechnology, 2017, 20(5): 351-357. DOI:10.1007/s12892-017-0104-0 |
| [32] |
Lin S S, Martin R, Mongrand S, et al. RING1 E3 ligase localizes to plasma membrane lipid rafts to trigger FB1-induced programmed cell death in Arabidopsi[J]. Plant Journal, 2008, 56(4): 550-561. DOI:10.1111/tpj.2008.56.issue-4 |
| [33] |
Yoshida T, Mogami J, Yamaguchi-Shinozaki K. ABA-dependent and ABA-independent signaling in response to osmotic stress in plants[J]. Current Opinion in Plant Biology, 2014, 21: 133-139. DOI:10.1016/j.pbi.2014.07.009 |
| [34] |
Kariola T, Brader G, Helenius E, et al. EARLY RESPONSIVE TO DEHYDRATION 15, a negative regulator of abscisic acid responses in Arabidopsis[J]. Plant Physiology, 2006, 142(4): 1559-1573. DOI:10.1104/pp.106.086223 |
| [35] |
Msanne J, Lin J S, Stone J M, et al. Characterization of abiotic stress-responsive Arabidopsis thaliana RD29A and RD29B genes and evaluation of transgenes[J]. Planta, 2011, 234(1): 97-107. DOI:10.1007/s00425-011-1387-y |




