文章信息
- 侯金秀, 郑阳, 李照耀, 胡峰, 陈熊男, 张云娜, 周斌
- HOU Jinxiu, ZHENG Yang, LI Zhaoyao, HU Feng, CHEN Xiongnan, ZHANG Yunna, ZHOU Bin
- 猪瘟病毒非结构蛋白NS3和NS5B多克隆抗体的制备和鉴定
- Preparation and identification of polyclonal antibody against NS3 and NS5B proteins of classical swine fever virus
- 南京农业大学学报, 2018, 41(6): 1093-1099
- Journal of Nanjing Agricultural University, 2018, 41(6): 1093-1099.
- http://dx.doi.org/10.7685/jnau.201804005
-
文章历史
- 收稿日期: 2018-04-04
2. 南京农业大学校医院, 江苏 南京 210095
2. School Hospital, Nanjing Agricultural University, Nanjing 210095, China
猪瘟是由猪瘟病毒(classical swine fever virus,CSFV)引起的猪高度接触性致死性传染病,对养猪业造成严重危害。CSFV为黄病毒科(Flaviviridae)瘟病毒属(Pestivirus)成员,同属的还有牛病毒性腹泻病毒(BVDV)和羊边界病病毒(BDV)[1]。CSFV为有囊膜的单股正链RNA病毒,病毒全基因组大小为12.3 kb,由5′非编码区(含有IRES)、开放阅读框(ORF)和缺少polyA的3′非编码区组成[2-3]。ORF编码3 898个氨基酸组成的多聚蛋白,主要排列顺序从N端至C端依次为Npro—C—Erns—E1—E2—p7—NS2—NS3—NS4A—NS4B—NS5A—NS5B[4-5]。
NS3和NS5B为CSFV的非结构蛋白,在CSFV复制过程中起着重要作用。NS3蛋白由683个氨基酸组成,相对分子质量为76×103[6]。NS3蛋白能与RNA结合,具有丝氨酸蛋白酶活性、核苷酸活性和RNA解旋酶(NTPase)活性[7]。NS3蛋白与细胞转化相关,是病毒致病性标志。Xu等[8]构建pEGFP-C1-NS3转染PK-15细胞后,发现pEGFP-C1-NS3阳性细胞中的细胞病变(CPE)是由细胞凋亡诱导的,NS3的表达与细胞凋亡有关。NS5B蛋白是RNA依赖性RNA聚合酶(RdRp),包含718个氨基酸,相对质分子质量为82×103,它能结合基因组3′-UTR的同源序列并启动翻译过程。NS5B蛋白主要分布在细胞质膜附近,具有RdRp活性[9];NS5B不但可作为病毒复制酶[10],还具有核苷酸转移酶(TNTase)活性[11]。
本试验根据大肠杆菌对密码子的偏嗜性优化了NS3密码子[12],截取了NS5B第239~479位氨基酸,使NS3和NS5B这2段基因利于在大肠杆菌原核表达系统中表达,将纯化得到的NS3和NS5B蛋白分别免疫BALB/c小鼠[13],获得了具有生物学活性的多克隆抗体,将有助于对NS3和NS5B蛋白结构、功能以及在CSFV致病机制上的研究。
1 材料与方法 1.1 菌株、细胞和试验动物猪瘟病毒石门株购自中国兽医药品监察所;载体pColdI、大肠杆菌DH5α、Rossetta 2(R2),质粒pcDNA3.0-NS3和pcDNA3.0-NS5B、PK-15细胞均由本实验室保存。6周龄BALB/c雌性小鼠12只,SPF级,购自南京农业大学实验动物中心。
1.2 主要试剂病毒RNA提取试剂盒购自北京天恩泽基因科技有限公司;高保真Taq酶购自英潍捷基(上海)贸易有限公司;蛋白质标准品购自美国Thermo scientific公司;RNA反转录试剂盒、DNA标准品、胶回收试剂盒、限制性内切酶KpnⅠ、HindⅢ、BamHⅠ、T4连接酶购自TaKaRa宝生物工程(大连)有限公司;质粒提取试剂盒购自美国Omega公司;ECL发光试剂盒购自Bio-Rad生命医学产品(上海)有限公司;镍磁珠购自英芮诚生化科技(上海)有限公司;鼠源6×His单抗购自Cell Signaling Technology公司;弗氏完全佐剂和弗氏不完全佐剂购自美国Sigma-Aldrich公司;DMEM、胎牛血清购自Gibco公司;CSFV多克隆抗体由哈尔滨兽医研究所仇华吉研究员惠赠;荧光标记羊抗鼠IgG购自Santa Cruz公司。
1.3 基因合成与引物设计根据CSFV基因组序列(AF092448.2)NS3基因的高级结构及GC含量、大肠杆菌宿主密码子使用频率等,利用Rare Codon Caltor分析了NS3基因中含有的稀有密码子,并进行优化[14-15],优化后序列由武汉金开瑞生物工程有限公司合成;根据CSFV基因组序列(AF092448.2)NS5B基因序列,用SnapGene软件设计1对特异引物:P1:5′-TGACGGTACC ATGAAAGTCGAAGAGATTATTGACAATCT-3′(KpnⅠ),P2:3′-TGACAAGCTT TTAGATCTTCTGGGGCTTCCC(HindⅢ),下划线部分为酶切位点。引物由南京金斯瑞生物科技有限公司合成。
1.4 NS3和NS5B基因的克隆提取猪瘟病毒石门株RNA,RT-PCR扩增NS5B基因(720 bp)。用KpnⅠ和HindⅢ分别对载体pColdI和胶回收纯化的NS5B产物进行酶切,用KpnⅠ和BamHⅠ分别对pColdI和胶回收纯化的NS3产物进行酶切,对双酶切产物胶进行回收、纯化。纯化的酶切产物用T4连接酶于16 ℃连接过夜,连接产物转化大肠杆菌DH5α,涂布于具有氨苄抗性的LA平板,37 ℃培养过夜。将PCR扩增、酶切和测序鉴定正确的阳性克隆分别命名为pColdI-NS3和pColdI-NS5B。
1.5 NS3和NS5B基因在大肠杆菌中的表达与纯化将空载体质粒pColdI、重组质粒pColdI-NS3、pColdI-NS5B分别转化Rossetta 2感受态细胞,转化后的阳性克隆37 ℃振荡培养至D600为0.6~0.8,加入IPTG(终浓度0.1 mmol·L-1)18 ℃振荡诱导培养过夜,同时设置诱导的Rossetta 2空菌作为阴性对照。诱导后的菌液4 ℃离心,收集菌体,PBS重悬菌体后使用超声波破碎仪于冰上破碎,高速离心后分离上清液和包涵体,加入5×SDS电泳上样缓冲液煮沸,进行SDS-PAGE,并对其进行考马斯亮蓝染色和脱色,观察重组蛋白的表达情况。
1.6 多克隆抗体的制备大量诱导表达的NS3和NS5B产物以包涵体形式存在,包涵体经8 mol·L-1尿素溶解,用His标签蛋白磁珠进行纯化。纯化的蛋白经透析复性、去除蛋白中咪唑等有害物质后,以每只50~100 μg的剂量与弗氏完全佐剂(1 : 1)乳化后免疫小鼠,首免后每隔14 d将纯化蛋白经弗氏不完全佐剂(1 : 1)乳化后进行二免和三免,三免7 d后小鼠眼眶静脉丛采血,分离血清于-80 ℃保存备用。
1.7 Western blot检测多克隆抗体的反应性将生长状态良好的PK-15细胞接种6孔板,待细胞长至70%~90%贴壁时,分别对不同细胞孔瞬时转染重组质粒pcDNA3.0-NS3、pcDNA3.0-NS5B、感染CSFV,同时设置未转染质粒、未接毒的细胞孔作为阴性对照;24 h后收取瞬时表达细胞样本,48 h后收取CSFV感染的细胞样本。分别用重组NS3和NS5B蛋白以及瞬时表达的NS3和NS5B蛋白、CSFV感染PK-15细胞48 h后进行SDS-PAGE,转印PVDF膜,100 g·L-1脱脂奶粉室温封闭1 h。PBST洗膜3次,分别经1 : 1 000稀释的鼠源6×His单抗、抗NS3多抗和抗NS5B多抗4 ℃孵育过夜,PBST洗膜3次,加入HRP标记羊抗鼠IgG(1 : 10 000稀释)室温下孵育1 h;重组蛋白NS3和NS5B经1 : 200稀释的抗CSFV多抗4 ℃孵育过夜,PBST洗膜3次后,加入HRP标记羊抗猪IgG(1 : 100 000稀释)室温下孵育1 h。PBST洗膜3次后加ECL试剂曝光观察结果。
1.8 间接免疫荧光(IFA)检测多克隆抗体的反应性将PK-15细胞分别瞬时转染pcDNA3.0-NS3和pcDNA3.0-NS5B、感染CSFV(MOI为1),未转染质粒、未接毒的PK-15细胞作为阴性对照。PK-15细胞经转染质粒24 h或者感染CSFV 48 h后,4%多聚甲醛固定细胞,X-Triton透膜,10%羊血清封闭,1 : 200稀释的抗CSFV多抗、小鼠抗NS3多抗和小鼠抗NS5B多抗37 ℃分别孵育2 h,PBST洗涤3次,再加入1 : 100稀释的荧光标记山羊抗鼠IgG 37 ℃孵育1 h,PBST洗涤3次,DAPI染核20 min,激光共聚焦显微镜观察。
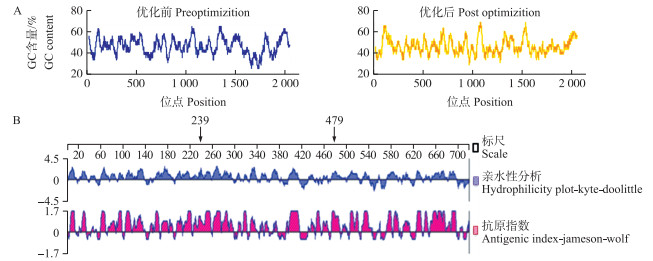
2 结果与分析 2.1 NS3密码子优化及NS5B抗原表位选择根据CSFV NS3基因序列中的稀有密码子分布情况(表 1),依据大肠杆菌对特定密码子的偏嗜性,改变原基因序列中的部分稀有密码子,使序列中只含有2个ACG,并使NS3基因各位点GC含量均匀分布在40%(图 1-A),使该基因利于在大肠杆菌中表达。另外,经DNAStar分析,选择NS5B基因亲水性及抗原性皆好的第239~479位氨基酸进行克隆表达(图 1-B)。
| 稀有密码子(编码氨基酸) Rare codon(encoded amino acid) |
出现次数 Occurrence |
频率/% Frequency |
| CGA(Arg) | 1 | 0.1 |
| CGG(Arg) | 3 | 0.4 |
| AGG(Arg) | 18 | 2.6 |
| AGA(Arg) | 16 | 2.3 |
| GGA(Gly) | 16 | 2.3 |
| GGG(Gly) | 20 | 2.9 |
| AUA(Iso) | 21 | 3.0 |
| CUA(Leu) | 6 | 0.8 |
| CCC(Pro) | 5 | 0.7 |
| ACG(Thr) | 6 | 0.8 |
| 总计Total | 112 | 16.1 |
|
图 1 NS3和NS5B蛋白的特性分析 Figure 1 Analysis of NS3 and NS5B protein properties A.优化NS3基因的GC含量;B.NS5B多肽链的亲水性分析。 A. Optimize GC content of NS3 gene; B. Hydrophilic analysis of NS5B polypeptide chain. |
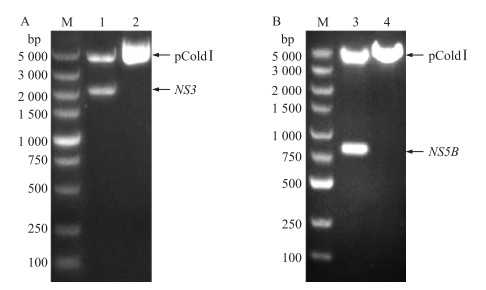
合成的NS3基因(2 049 bp)经KpnⅠ和BamHⅠ酶切后连接pColdI;以CSFV石门株基因组cDNA为模板,PCR扩增得到720 bp的NS5B基因片段,扩增产物经KpnⅠ和HindⅢ酶切后连接pColdI。重组表达质粒双酶切鉴定结果表明:NS3基因和NS5B基因成功连接至pColdI(图 2-A、B),且重组质粒测序正确。
|
图 2 重组质粒pColdI-NS3 (A)和pColdI-NS5B(B)的双酶切鉴定 Figure 2 Identification of recombinant plasmid pColdI-NS3 and pCold I-NS5B M.核酸标准品(DL5000);1、2.分别为pColdI-NS3和pColdI质粒均经KpnⅠ和BamHⅠ双酶切的产物;3、4.分别为pColdI-NS5B和pColdI质粒均经KpnⅠ和HindⅢ双酶切的产物。 M. DNA marker(DL5000);1, 2. The pColdI-NS3 and pColdI plasmid were digested by KpnⅠ and BamHⅠ, restpectively; 3, 4. The pColdI-NS5B and pColdI plasmid were digested by KpnⅠ and HindⅢ, respectively. |
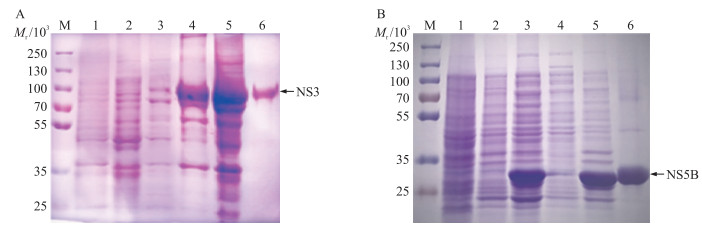
将重组菌株R2(pColdI-NS3)、R2(pColdI-NS5B)经IPTG诱导后表达成功的包涵体产物进行洗涤和溶解,用His标签蛋白磁珠进行纯化。SDS-PAGE结果显示:在相对分子质量约80×103处可见NS3蛋白(图 3-A),在相对分子质量约27×103处可见NS5B(图 3-B),且2种重组蛋白主要以包涵体形式存在,并经镍磁珠纯化获得了高纯度重组蛋白。
|
图 3 重组蛋白NS3(A)和NS5B(B)的SDS-PAGE鉴定 Figure 3 SDS-PAGE identification of recombinant proteins NS3 and NS5B M.蛋白标准品;1.诱导的R2;2.诱导的R2(pColdI);3.诱导的R2(pColdI-NS3/NS5B)上清液;4.诱导的R2(pColdI-NS3/NS5B)包涵体;5.诱导的R2(pColdI-NS3/NS5B)全菌;6.纯化后的NS3/NS5B。 M. Protein marker; 1. Induced R2;2. Induced R2(pColdI); 3. Induced R2(pColdI-NS3/NS5B)supernatant; 4. Induced R2(pColdI-NS3/NS5B)inclusion bodies; 5. Induced R2(pColdI-NS3/NS5B); 6. Purified NS3 or NS5B. |
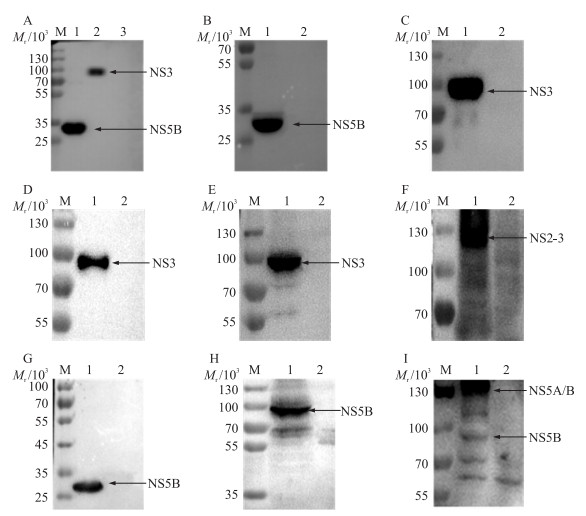
用原核表达的重组NS3和NS5B蛋白、真核表达的NS3和NS5B蛋白、感染CSFV 48 h后的PK-15细胞裂解物分别进行Western blot分析。结果显示:重组蛋白NS5B和NS3能被抗CSFV多抗能识别(图 4-A),用鼠源6×His单抗能检测出重组蛋白NS5B和NS3(图 4-B、C),小鼠抗NS3多抗能与重组NS3蛋白(图 4-D)、瞬时表达的NS3蛋白(图 4-E)和病毒感染的细胞裂解物发生反应(图 4-F);同样,小鼠抗NS5B多抗能与重组NS5B蛋白(图 4-G)、瞬时表达的NS5B蛋白(图 4-H)和CSFV感染的细胞裂解物发生反应(图 4-I)。其中,因 NS2-NS3 、NS5A-NS5B位点切割不完全会分别形成蛋白二聚体NS2-3(图 4-F)和NS5A/B(图 4-I)。
|
图 4 Western blot检测多抗的反应性 Figure 4 Western blot detection of polyclonal antibody reactivity A.检测抗CSFV多克隆抗体与重组蛋白NS3/NS5B反应性(M.蛋白标准品;1. NS3;2. NS5B;3. pColdI);B、C.检测6×His单抗与重组蛋白NS3/NS5B反应性;D、G.检测抗NS3/NS5B多抗与重组蛋白NS3/NS5B反应性(M.蛋白标准品;1. NS3/NS5B;2. pColdI);E、H.检测抗NS3/NS5B多抗与瞬时转染NS3/NS5B反应性(M.蛋白标准品;1. NS3/NS5B;2. Mock);F、I.检测抗NS3/NS5B多抗与CSFV反应性(M.蛋白标准品;1. CSFV;2. Mock)。 A. Detection of anti-CSFV polyclonal antibodies and recombinant protein NS3/NS5B reactivity(M. Protein marker; 1. NS3;2. NS5B;3. pColdI); B, C. Detection of 6×His-McAb reactivity with recombinant protein NS3/NS5B;D, G. Detection of NS3/NS5B pAb reactivity with recombinant protein NS3/NS5B(M. Protein marker; 1. NS3/NS5B;2. pColdI); E, H. Detection of NS3/NS5B pAb reactivity with transient transfection of NS3/NS5B(M. Protein marker; 1. NS3/NS5B;2. Mock); F, I. Detection of NS3/NS5B pAb reactivity with CSFV(M. Protein marker; 1. CSFV; 2. Mock). |
激光共聚焦显微镜观察结果显示:抗CSFV多抗能识别CSFV病毒(图 5-A),小鼠抗NS3多抗(图 5-B)和抗NS5B多抗(图 5-C)能分别与瞬时表达的NS3和NS5B、感染CSFV石门株的PK-15细胞发生反应,在感染病毒的PK-15细胞胞浆中发现有特异性红色荧光;而空白对照细胞PK-15胞浆中未发现有特异性红色荧光。
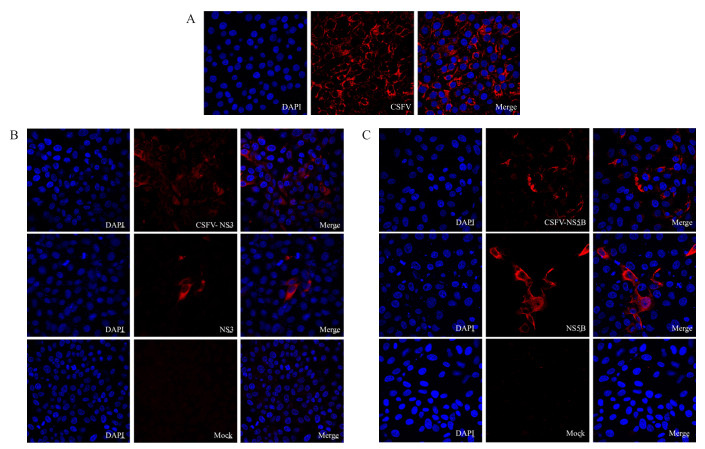
|
图 5 间接免疫荧光试验(IFA)检测多抗的反应性 Figure 5 Indirect immunofluorescence assay(IFA)to detect the reactivity of polyclonal antibodies A. CSFV与抗CSFV多抗反应性鉴定;B. CSFV、pcDNA3.0-NS3、Mock与抗NS3多抗反应性鉴定;C. CSFV、pcDNA3.0-NS5B、Mock与抗NS5B多抗反应性鉴定。 A. Identification of CSFV and anti-NS3 pAb reactivity; B. Identification of CSFV, pcDNA3.0-NS3, Mock and anti-NS3 pAb reactivity; C. Identification of CSFV, pcDNA3.0-NS5B, Mock and anti-NS5B pAb reactivity. |
CSFV的12种蛋白中,Erns和E2能诱导猪瘟病毒中和抗体产生[16],Erns蛋白可用于CSFV血清学检测,能鉴别疫苗免疫和流行毒株感染[17];E2蛋白亚单位疫苗已得到广泛应用[18]。陆欣然等[19]建立了猪瘟病毒NS3蛋白抗体间接ELISA检测方法,但NS3蛋白在临床上尚未得到广泛应用。尽管有许多研究证明了NS3和NS5B功能,如Zhu等[20]发现NS5B蛋白可以通过刺激NS3蛋白来提高翻译的速率,NS5B蛋白也可以与NS3蛋白的蛋白酶结构域反应来削弱NS3蛋白和IRES的相互作用,但NS3和NS5B作为CSFV 2种重要的非结构蛋白,其功能仍需进一步探究。
NS3基因长度为2 049 bp,NS5B基因长度为2 154 bp,利用Rare Codon Caltor和DNAStar软件分析出NS 3和NS5B基因中含有大量稀有密码子和疏水基团,这也是这2种蛋白在原核表达系统中表达相对困难的原因,因此本研究通过优化NS3密码子和选取NS5B 239~479位亲水区域,利用大肠杆菌表达系统成功表达并纯化出了NS3和NS5B蛋白,制备出具有生物学活性的特异性多克隆抗体。本试验中使用的pCold载体是由Qing等[21]2004年开发的冷休克载体,其已被用于表达许多使用常规载体难以表达的蛋白质[22]。低温诱导重组子能使目的蛋白高效表达,也能利于目的蛋白积累和产生可溶性蛋白。此外,本试验采用镍磁珠纯化蛋白,优化蛋白纯化流程,能更快速简便地纯化出目的蛋白,获得的重组蛋白纯度高。
研究表明,在瘟病毒中NS2/3位点切割不完全,多以NS3和NS2-3这2种形式出现。NS3蛋白是鉴定致细胞病变BVDV毒株的重要标志[23],而猪瘟病毒中的NS2-3为一种免疫优势蛋白[24]。本试验的Western blot结果表明,1 : 1 000稀释的2种多克隆抗体能分别与相应的重组蛋白、宿主真核表达蛋白反应;其中抗NS3多抗能识别CSFV感染PK-15细胞后表达的NS2-3蛋白,未检测到NS3单体蛋白,抗NS5B多抗能识别CSFV感染PK-15细胞后表达的NS5B蛋白和NS5A/B二聚体,此结果也与Lamp等[4]的研究结果相似。IFA结果显示,1 : 200稀释的2种多克隆抗体均能识别瞬时表达的NS3和NS5B蛋白以及感染CSFV的PK-15细胞蛋白,并且均能在胞浆中观察到特异性荧光。
本试验成功制备了特异性鼠抗CSFV非结构蛋白NS3和NS5B的多克隆抗体,并且2种多克隆抗体均可应用于与CSFV相关的Western blot和IFA试验,为进一步研究NS3和NS5B蛋白结构功能及CSFV复制和致病机制提供了基础。
| [1] |
陈溥言. 兽医传染病学[M]. 5版. 北京: 中国农业出版社, 2013. Chen P Y. Veterinary Lemology[M]. 5th ed. Beijing: Chinese Agriculture Press, 2013: 210-215 (in Chinese). |
| [2] |
Ji W, Guo Z, Ding N Z, et al. Studying classical swine fever virus:making the best of a bad virus[J]. Virus Research, 2015, 197: 35-47. DOI:10.1016/j.virusres.2014.12.006 |
| [3] |
Zhou B, Liu K, Jiang Y, et al. Multiple linear B-cell epitopes of classical swine fever virus glycoprotein E2 expressed in E. coli as multiple epitope vaccine induces a protective immune response[J]. Virology Journal, 2011, 8(1): 378. DOI:10.1186/1743-422X-8-378 |
| [4] |
Lamp B, Riedel C, Romansosa G, et al. Biosynthesis of classical swine fever virus nonstructural proteins[J]. Journal of Virology, 2011, 85(7): 3607-3620. DOI:10.1128/JVI.02206-10 |
| [5] |
侯玉臻, 赵丹彤, 刘国英, 等. 猪瘟病毒核心蛋白研究进展[J]. 病毒学报, 2015, 31(5): 579-584. Hou Y Z, Zhao D T, Liu G Y, et al. Research progress in the core proteins of the classical swine fever virus[J]. Chinese Journal of Virology, 2015, 31(5): 579-584 (in Chinese with English abstract). |
| [6] |
Lamp B, Riedel C, Wentz E, et al. Autocatalytic cleavage within classical swine fever virus NS3 leads to a functional separation of protease and helicase[J]. Journal of Virology, 2013, 87(21): 11872-11883. DOI:10.1128/JVI.00754-13 |
| [7] |
Sheng C, Xiao M, Geng X, et al. Characterization of interaction of classical swine fever virus NS3 helicase with 3' untranslated region[J]. Virus Research, 2007, 129(1): 43-53. DOI:10.1016/j.virusres.2007.05.004 |
| [8] |
Xu H, Hong H X, Zhang Y M, et al. Cytopathic effect of classical swine fever virus NS3 protein on PK-15 cells[J]. Intervirology, 2007, 50(6): 433. DOI:10.1159/000113467 |
| [9] |
Xiao M, Chen J, Li B. RNA-dependent RNA polymerase activity of classical swine fever virus NS5B protein expressed in natural host cells[J]. Acta Virologica, 2003, 47(2): 79-85. |
| [10] |
伊光辉.猪瘟病毒RNA依赖的RNA聚合酶起始基因组RNA复制的分子机制研究[D].武汉: 武汉大学, 2004. Yi G H. Initiation of genomic RNA replication by a recombinant classical swine fever virus RNA-dependent RNA polymerase[D]. Wuhan: Wuhan University, 2004 (in Chinese with English abstract). |
| [11] |
Xiao M, Gao J, Wang W, et al. Specific interaction between the classical swine fever virus NS5B protein and the viral genome[J]. European Journal of Biochemistry, 2004, 271(19): 3888-3896. DOI:10.1111/ejb.2004.271.issue-19 |
| [12] |
苏鹏, 龚国利. 优化大肠杆菌表达外源蛋白的研究进展[J]. 生物技术通报, 2017, 33(2): 16-23. Su P, Gong G L. Research progress on optimizing the expression of exogenous proteins in Escherichia coli[J]. Biotechnology Bulletin, 2017, 33(2): 16-23 (in Chinese with English abstract). |
| [13] |
景娇, 张小敏, 何丹妮, 等. 猪瘟病毒Core蛋白的原核表达和抗体制备及应用[J]. 畜牧与兽医, 2015, 47(6): 7-11. Jing J, Zhang X M, He D N, et al. Prokaryotic expression of classical swine fever virus core protein and application of its polyclonal antibody[J]. Animal Husbandry and Veterinary Medicine, 2015, 47(6): 7-11 (in Chinese with English abstract). |
| [14] |
Sharp P M, Li W H. The codon adaptation index:a measure of directional synonymous codon usage bias, and its potential applications[J]. Nucleic Acids Research, 1987, 15(3): 1281-1295. DOI:10.1093/nar/15.3.1281 |
| [15] |
陈阿娜, 叶生梅, 孟娜, 等. 外源蛋白在大肠杆菌中高效可溶性表达和胞外分泌策略研究综述[J]. 安徽农学通报, 2015(13): 25-27. Chen A N, Ye S M, Meng N, et al. Advances of soluble and extracellular overexpression of heterologous proteins in Escherichia coli[J]. Anhui Agricultural Science Bulletin, 2015(13): 25-27 (in Chinese with English abstract). DOI:10.3969/j.issn.1007-7731.2015.13.012 |
| [16] |
贾俊杰, 张必凯, 张莉, 等. 猪瘟病毒E0蛋白的原核表达及多克隆抗体的制备[J]. 动物医学进展, 2016, 37(5): 5-10. Jia J J, Zhang B K, Zhang L, et al. Prokaryotic expression of E0 protein of classical swine fever virus and preparation of its polyclonal antibody[J]. Progress in Veterinary Medicine, 2016, 37(5): 5-10 (in Chinese with English abstract). DOI:10.3969/j.issn.1007-5038.2016.05.002 |
| [17] |
Luo Y, Lin L, Austermannbusch S, et al. Enhanced expression of the Erns, protein of classical swine fever virus in yeast and its application in an indirect enzyme-linked immunosorbent assay for antibody differentiation of infected from vaccinated animals[J]. Journal of Virology Methods, 2015, 222(2): 22-27. |
| [18] |
Huang Y L, Deng M C, Wang F I, et al. The challenges of classical swine fever control:modified live and E2 subunit vaccines[J]. Virus Research, 2014, 179(3): 1-11. |
| [19] |
陆欣然, 华思红, 樊钰莹, 等. 猪瘟病毒石门株NS3蛋白的原核表达及其抗体检测间接ELISA的建立[J]. 动物医学进展, 2017, 38(4): 28-34. Lu X R, Hua S H, Fan Y Y, et al. Prokaryotic expression of NS3 protein in classical swine fever virus shimen strain and establishment of indirect ELISA for antibody detection[J]. Progress in Veterinary Medicine, 2017, 38(4): 28-34 (in Chinese with English abstract). DOI:10.3969/j.issn.1007-5038.2017.04.006 |
| [20] |
Zhu Z, Wang Y, Yu J, et al. Classical swine fever virus NS3 is an IRES-binding protein and increases IRES-dependent translation[J]. Virus Research, 2010, 153(1): 106-112. DOI:10.1016/j.virusres.2010.07.013 |
| [21] |
Qing G, Ma L C, Khorchid A, et al. Cold-shock induced high-yield protein production in Escherichia coli[J]. Nature Biotechnology, 2004, 22(7): 877-882. DOI:10.1038/nbt984 |
| [22] |
Tamura M, Ito K, Kunihiro S, et al. Production of human beta-actin and a mutant using a bacterial expression system with a cold shock vector[J]. Protein Expression Purification, 2011, 78(1): 1-5. DOI:10.1016/j.pep.2010.09.007 |
| [23] |
Tang Q H, Zhang Y M, Xu Y Z, et al. Up-regulation of integrin β3 expression in porcine vascular endothelial cells cultured in vitro by classical swine fever virus[J]. Veterinary Immunology & Immunopathology, 2010, 133(2/3/4): 237-242. |
| [24] |
Kümmerer B M, Tautz N, Becher P, et al. The genetic basis for cytopathogenicity of pestiviruses[J]. Veterinary Microbiology, 2000, 77(1/2): 117-128. |




