文章信息
- Tanzeela Zia, 陈书林, 丰瑞英, 程保平, 赵弘巍
- Tanzeela Zia, CHEN Shulin, FENG Ruiying, CHENG Baoping, ZHAO Hongwei
- 柑橘黄龙病菌与寄主互作过程中4个小RNA的检测及功能分析
- Detection and functional analysis of four small RNA associated with citrus Huanglongbing(HLB)
- 南京农业大学学报, 2018, 41(6): 1029-1036
- Journal of Nanjing Agricultural University, 2018, 41(6): 1029-1036.
- http://dx.doi.org/10.7685/jnau.201712039
-
文章历史
- 收稿日期: 2017-12-26
2. 广东省农业科学院植物保护研究所/广东省植物保护新技术重点实验室, 广东 广州 510640
2. Plant Protection Research Institute/Guangdong Provincial Key Laboratory of High Technology for Plant Protection, Guangdong Academy of Agricultural Sciences, Guangzhou 510640, China
柑橘黄龙病是柑橘产业中极具毁灭性的病害,在亚洲、非洲、大洋洲、南美洲、北美洲的近50个国家(地区)均有发生[1]。黄龙病菌侵染柑橘后,潜伏期长,在组织间分布不均匀。此时虽然已经具有传染能力,但是由于没有明显发病症状,普通方法难以及时诊断,极易造成病情蔓延。病情显现后,田间症状主要表现为叶片斑驳黄化、均匀黄化和类似缺素的黄化[2];病叶的水分含量降低,开花时间提早,花量增大。最终严重影响柑橘的质量和产量。柑橘黄龙病迄今尚无有效的抗病品种和高效药剂,因此急需深入研究柑橘与黄龙病菌的互作机制,为新型防控方法的建立提供理论基础,且开发特异性早期诊断的分子靶标也是黄龙病防治的紧迫需要。
植物小RNA是一种大小约21~24个碱基的单链小分子RNA,是由发卡状的RNA前体通过Dicer-like蛋白切割而产生的,其可与Argonaute蛋白形成复合体,抑制靶标基因的表达[3-4],对植物的生长、发育以及抗病等相关途径均具有重要调控作用[5]。一些寄主的小RNA在病原菌侵染过程中被快速诱导,并调控寄主抗病相关基因的表达。例如:flg22在拟南芥中可以激发miR393,后者又作用于具有F-box的生长素受体靶标(TIR1、AFB2和AFB3),抑制与生长素相关的信号途径,最终增强植物抗病性[6]。在番茄中,miR482/2118家族中的miR482和miR5300可调控针对尖镰孢(Fusarium oxysporum)病菌的4个抗病基因的表达[7]。因此,柑橘小RNA在其与黄龙病菌相互作用过程中的重要意义值得进行深入研究。
本研究前期通过高通量测序,筛选出一些黄龙病菌与寄主互作早期有差异表达的小RNA,包括miR399、miR-753E-3p、miR-451b、miR2633和miR838-3p。目前已初步探明,miR399的诱导与柑橘的磷缺乏症状有关[8],但其他4个小RNA的作用尚未明确,其作为早期诊断分子标记的检测方法也未建立。本研究建立了上述4个小RNA的检测方法,分析其对靶标基因的调控情况,初步探明其在“黄龙病菌-柑橘”早期互作中的作用。
1 材料与方法 1.1 植物材料3年树龄的砂糖橘(Citrus reticulata Blanco ‘Shatangju’)分别嫁接黄龙病染病接穗和健康接穗,3个月后,用荧光定量PCR检测苗木是否已感染黄龙病,分别以发病和健康苗木的叶片为材料提取叶片总RNA(AxygenAP-MX-MS-RNA-25)用于后续试验。
1.2 柑橘黄龙病菌检测引物与步骤用于黄龙病菌检测的PCR引物参照文献[9]。荧光定量PCR反应体系为20 μL,其中引物为250 nmol · L-1,探针为150 nmol · L-1,缓冲液成分及用量参照TaKaRa实时荧光定量PCR试剂盒(PrimeScriptTMRT reagent Kit)说明书。PCR反应程序为:95 ℃ 20 s;95 ℃ 5 s,58 ℃ 40 s,共40个循环。试验所用仪器为Roche,LightCycler® 480 Ⅱ型实时荧光定量PCR仪。
1.3 柑橘样品总RNA的提取及质量分析分别提取健康样品和发病样品的总RNA并保存于-80 ℃备用。制备12 g · L-1琼脂糖凝胶,取RNA 2 μL进行电泳,然后在紫外透射光下拍照,观察28S和18S 2条RNA条带的明亮程度,取质量较好的RNA用于后续的反转录试验。
1.4 柑橘RNA样品的cDNA合成参照文献[10]进行柑橘RNA样品的cDNA合成。在冰浴的PCR管中加入柑橘总RNA 2 μL、小RNA特异颈环引物(10 μmol · L-1)1 μL,然后用RNase-free ddH2O补足至10 μL。反应混合物在65 ℃温浴5 min,然后冰浴2 min,再加入5×Reaction Buffer 4.0 μL、dNTP Mix 2.0 μL、RNase抑制剂(40 U · μL-1)0.5 μL、反转录酶PrimeScript RTase(200 U · μL-1)1 μL、RNase-free ddH2O 4.5 μL。混匀后,在PCR仪上按照下列条件进行反转录反应:25 ℃孵育10 min,50 ℃孵育30 min,最后85 ℃ 5 min终止反应。
1.5 柑橘小RNA反转录引物及检测引物的设计使用Primer Premier 5.0软件设计了4个小RNA及内参miR159的反转录颈环引物与荧光定量PCR检测引物,引物序列见表 1。进一步用Primer Premier 5.0软件设计了小RNA靶标基因的荧光定量PCR检测引物,引物序列见表 2。
| 小RNA名称 Small RNA name |
引物名称 Primer name |
引物序列(5′→3′) Primer sequence |
| miR159 | miR159 RT miR159-F | CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGTAGAGCTC ACACTCCAGCTGGGTTTGGATTGAAGGG |
| miR-753E-3p | miR-753E-3p RT miR-753E-3p-F | CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGGAAGAGCT ACACTCCAGCTGGGTGAGATCATTATTCA |
| miR-451b | miR-451b RT miR-451b-F | CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGAATGGTAA ACACTCCAGCTGGGTAGCAAGAGAACCA |
| miR2633 | miR2633 RT miR2633-F | CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGTGAATCTG ACACTCCAGCTGGGTGACATTTTGCTCC |
| miR838-3p | miR838-3p RT miR838-3p-F | CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGTGTGCAA ACACTCCAGCTGGGTTTTCTTCTTCTTC |
| Universal reverse primer | Primer R | TGGTGTCGTGGAGTCG |
| 基因名称Gene name | 引物名称Primer name | 引物序列(5′→3′) Primer sequence |
| Cs6g21280 | Cs6g21280-F/Cs6g21280-R | GATGTTCGTCACTTCAGCCG/AACTAGCAATTGCCGGTCCT |
| Cs6g05770 | Cs6g05770-F/Cs6g05770-R | GTCCGACAGAAGGGATGACG/GCTGTTAAACCCGCAAAGACC |
| Cs2g08190 | Cs2g08190-F/Cs2g08190-R | GGCTACGATGGAGCTAAGGC/TGTCGAGAACCATGGAGGAC |
| Cs8g02530 | Cs8g02530-F/Cs8g02530-R | TGGATCTTCTGGGTTGGTCC/CTGCGGAATGATCCCAAAGC |
| EF-1α | EF-1α-F/EF-1α-R | TGCTTTGCTTGCTTTCACCC/TCGAAACCAGAGATGGGCAC |
为验证小RNA检测引物的扩增效率,合成了4个小RNA的片段,进行10倍浓度梯度稀释作为模板,使用表 1中的引物进行荧光定量PCR检测。参照文献[11]使用TaKaRa SYBR® Premix Ex TaqTM Ⅱ试剂盒进行柑橘小RNA及其靶标基因的检测。在冰浴的PCR管中加入SYBR Premix Ex TaqTM Ⅱ Buffer 10 μL、引物F/R(10 μmol · L-1)各0.4 μL、ddH2O 7.2 μL、模板(cDNA)2 μL,总体系20 μL。反应程序为:95 ℃ 3 min;95 ℃ 7 s,57 ℃ 10 s,72 ℃ 15 s,共45个循环,最后测定熔解曲线。试验使用仪器为LightCycler® 480 Ⅱ型实时荧光定量PCR仪(Roche)。
2 结果与分析 2.1 4个小RNA检测引物的分析验证本研究前期通过高通量测序,筛选出一些黄龙病菌与柑橘互作早期有显著差异表达的小RNA,包括miR-753E-3p、miR-451b、miR2633和miR838-3p。设计特异引物(表 1)并对柑橘cDNA样品进行了检测,结果表明4个小RNA在健康样品和黄龙病发病样品的cDNA中均可检出,且熔解曲线均呈现为单一曲线(图 1)。
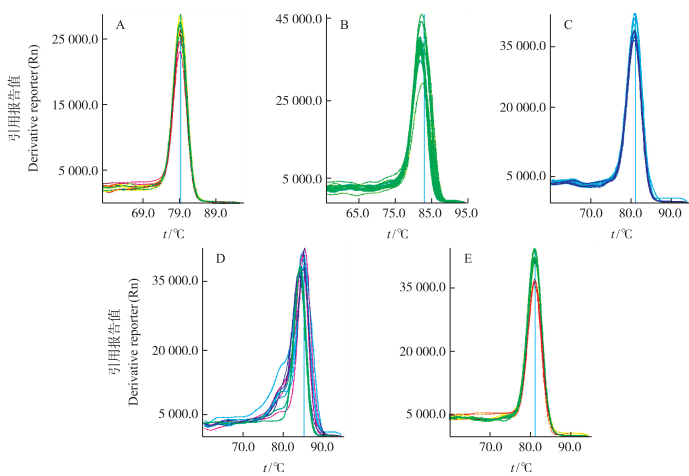
|
图 1 4个差异表达小RNA及内参小RNA的熔解曲线 Figure 1 Melting curves of four differentially expressed small RNA and a housekeeping small RNA A. miR-753E-3p;B. miR-451b;C. miR2633;D. miR838-3p;E. miR159. |
使用本研究设计的引物进行荧光定量PCR检测,以CT值为纵坐标,以小RNA梯度稀释倍数的对数值为横坐标绘图,通过直线斜率计算扩增效率。结果(图 2)表明:本研究所用引物对miR-753E-3p、miR-451b、miR2633、miR838-3p和miR159的扩增效率依次为:104.64%、105.12%、105.59%、105.12%和105.12%,数值接近,可用于下一步试验。
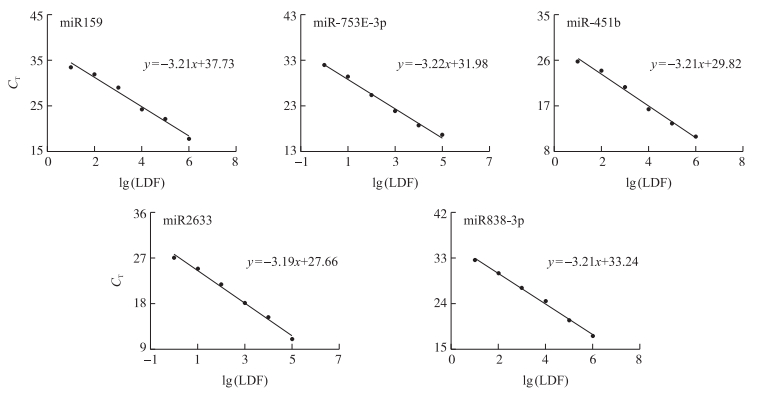
|
图 2 4个小RNA及内参小RNA的相对定量标准曲线 Figure 2 Relative quantitative standard curves of four differentially expressed small RNA and a housekeeping small RNA lg(LDF):稀释倍数的对数值。Logarithm of dilution factor. |
进一步以健康样品和黄龙病发病样品的cDNA为模板,以miR159为内参,利用2-ΔΔCT方法对4个小RNA的表达量进行分析检测。结果(图 3)表明:当小RNA在健康样品中的表达量等效为1时,miR-753E-3p、miR-451b、miR2633和miR838-3p在黄龙病发病样品中的表达量分别为健康对照的4.69、0.44、0.36和3.08倍。t-test统计分析表明,4个小RNA的表达量在发病样品和健康样品之间差异显著。
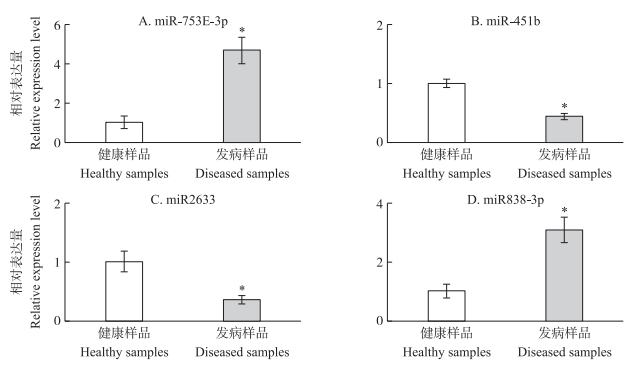
|
图 3 4个小RNA相对表达量分析 Figure 3 Relative expression analysis of the four small RNA *P < 0.05. The same as follows. |
根据小RNA与潜在靶标基因之间的碱基互补配对情况,在柑橘转录组数据库中预测了4个小RNA的作用靶标。miR-753E-3p、miR-451b、miR2633和miR838-3p的靶标基因分别为Cs6g21280、Cs6g05770、Cs2g08190和Cs8g02530 (图 4)。进一步设计引物,以柑橘EF-1α为内参基因,利用2-ΔΔCT方法对健康及黄龙病发病样品内的靶标基因的表达量进行了分析。结果(图 5)表明:当靶标基因在健康样品中的表达量等效为1时,Cs6g21280、Cs6g05770、Cs2g08190和Cs8g02530在发病样品中的表达量分别为健康对照的0.14、8.95、3.06和0.29倍。t-test统计分析表明,4个靶标基因的表达量在发病样品和健康样品之间差异显著。

|
图 4 4个小RNA与靶标片段的配对情况 Figure 4 Base-pairing pattern between the four small RNA and their target genes |
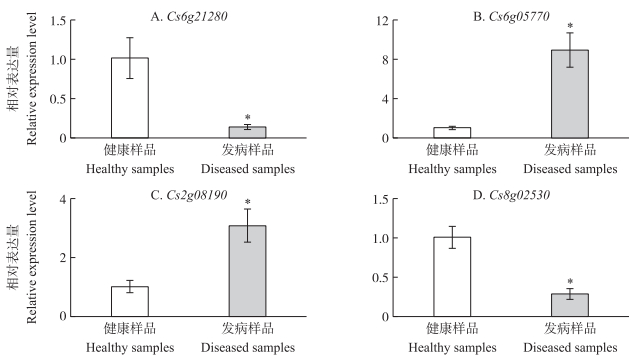
|
图 5 4个小RNA靶标基因的相对表达量分析 Figure 5 Relative expression analysis of target genes of four small RNA |
把4个小RNA及其靶标基因在健康与黄龙病发病样品中的表达量进行了对比。结果表明:4个小RNA的表达与其靶标基因的表达均呈负相关性。使用靶标基因的序列在其他物种的数据库中进行了同源基因比对分析。结果表明,4个小RNA可能调控植物抗逆相关基因(表 3)。
| 小RNA Small RNA |
靶标基因 Target gene |
表达量(发病样品/健康样品) Expression(diseased/healthy) |
靶标基因功能分析 Function analysis of target genes |
|
| 小RNA Small RNA |
靶标基因 Target gene |
|||
| miR-753E-3p | Cs6g21280 | 4.69 | 0.14 | Cs6g21280在拟南芥中的同源基因ATSMC4与抑制开花及抑制逆境相关的DNA修复等生理过程相关。 Cs6g21280 is a homolog of Arabidopsis ATSMC4,which acts to suppress genes involved in flowering or DNA repair. |
| miR-451b | Cs6g05770 | 0.44 | 8.95 | Cs6g05770在拟南芥中的同源基因BRASSINOSTEROID INSENSITIVE 1-associated receptor kinase 1(BAK1)可介导由病原特征分子激发的抗病反应。 Cs6g05770 is a homolog of Arabidopsis BAK1,which acts in pathogen-associated molecular pattern-triggered immunity. |
| miR2633 | Cs2g08190 | 0.36 | 3.06 | Cs2g08190在拟南芥中的同源基因CIPK23可提高钾转运蛋白的活性,从而增加气孔开度。 Cs2g08190 is a homolog of Arabidopsis CIPK23,which serves as a positive regulator of the potassium transporter AKT1,which increases stomatal opening. |
| miR838-3p | Cs8g02530 | 3.08 | 0.29 | Cs8g02530在拟南芥中的同源基因PIP2是一个水通道蛋白,可调节植物耐涝耐旱性。 Cs8g02530 is a homolog of Arabidopsis PIP2,which functions as aquaporin and response to various water stress conditions. |
柑橘黄龙病的症状与缺素及病毒病的症状非常相似,仅靠观察病症难以确诊黄龙病;并且黄龙病潜伏期较长,在组织间分布不均匀,许多由于没有及时发现而得到治理的病树成为病源,加速了病害的蔓延。因此,早期分子检测对黄龙病的诊断极为重要。本研究所设计的引物可用于黄龙病菌与寄主早期互作中4个小RNA的检测。以这些差异表达的小RNA作为检测靶标具有独特的优势:1)4个小RNA受黄龙病诱导后会差异表达,但不会在柑橘衰退病及柑橘缺硼/缺素情况下诱导差异表达[12-13],表明这些小RNA与黄龙病有一定的特异关联性;2)4个小RNA在黄龙病侵染早期即可诱导差异表达;3)黄龙病菌在柑橘体内的分布极不均匀,普通的分子检测极易发生漏检[1, 9, 14],而黄龙病菌激发的小RNA可以快速移动到附近不含黄龙病菌的植物组织中,因此在病样中的分布更广,不易发生漏检。因此本研究所用的小RNA检测方法有望为黄龙病检测方法的开发提供新的思路。
不同柑橘品种对黄龙病的耐病性有差异[15],抗病栽培等农艺措施也可在一定时期内提高柑橘对黄龙病的耐病性[16],表明柑橘存在一定内源免疫反应来对抗黄龙病菌[17]。拟南芥中的BAK1可介导病原特征分子激发的植物抗病反应[18]。本研究表明:柑橘的Cs6g05770与BAK1同源,且被miR-451b调控上调表达,提示该调控可能与黄龙病菌病原特征分子诱导的植物免疫反应有关。此外,拟南芥中的ATSMC4是一种参与染色质集缩包装的集缩素蛋白的核心亚基,可促进异染色质高级结构的形成从而广泛抑制开花及抗逆相关基因的表达[19]。本研究表明:ATSMC4在柑橘中的同源基因Cs6g21280被miR-753E-3p调控下调表达,暗示该调控可能以相似的机制促进黄龙病病树开花并激活抗逆相关反应。
与健康叶片相比,黄龙病病叶中的水分含量较低[20-21],但机制尚不明确。拟南芥中的PIP2是一个水通道蛋白,可调节植物耐涝耐旱性[22]。本研究表明:PIP2在柑橘中的同源基因Cs8g02530受miR838-3p调控下调表达,提示该调控可能与黄龙病病叶含水量减少有关。此外,拟南芥中的CIPK23可提高钾转运蛋白的活性,使保卫细胞水势降低而吸水,从而增加气孔开度,加速蒸腾失水作用[23]。本研究表明:柑橘的Cs2g08190与CIPK23同源,且受miR2633调控上调表达,暗示该调控可能与黄龙病病叶气孔开度增加、含水量减少有关。值得注意的是,气孔也是植物次生代谢物质向外释放的重要通路,因此柑橘病树气孔开度的增加可能也有助于吸引黄龙病的传毒虫媒——柑橘木虱[24]。需要注意的是,以上关键同源基因的序列比对分析仅仅提供了初步线索,还需要在柑橘中进行功能分析验证。
综上所述,受到黄龙病菌侵染时,柑橘内的小RNA调控了一些抗病及病症相关基因的表达,其中有些小RNA的调控是有利于黄龙病菌致病性发展的,可能是受到黄龙病菌诱导产生的;有些小RNA的调控是有利于诱导和增强柑橘的防卫反应的,可能是柑橘自身免疫的一部分。上述结果揭示了黄龙病菌与寄主在小RNA水平上发生的侵染与防卫的对抗作用,有望为黄龙病病症形成分子机制及寄主免疫相关分子机制的研究提供新的线索。
| [1] |
Bové J M. Huanglongbing:a destructive, newly-emerging, century-old disease of citrus[J]. Journal of Plant Pathology, 2006, 88(1): 7-37. |
| [2] |
许美容, 陈燕玲, 邓晓玲. 柑橘黄龙病症状与"Candidatus Liberibacter asiaticus"PCR检测结果的相关性分析[J]. 植物病理学报, 2016, 46(1): 367-373. Xu M R, Chen Y L, Deng X L. Correlationship between symptoms of citrus Huanglongbing and PCR detection of 'Candidatus Liberibacter asiaticus'[J]. Acta Phytopathologica Sinica, 2016, 46(1): 367-373 (in Chinese with English abstract). |
| [3] |
Sarkar D S, Prakash K, Kumar N A, et al. Small RNA mediated regulation of seed germination[J]. Frontiers in Plant Science, 2015, 6: 828. |
| [4] |
Zhang Z, Liu X, Guo X, et al. Arabidopsis AGO3 predominantly recruits 24-nt small RNAs to regulate epigenetic silencing[J]. Nature Plants, 2016, 2(5): 16049. DOI:10.1038/nplants.2016.49 |
| [5] |
Khalid A, Zhang Q, Yasir M, et al. Small RNA based genetic engineering for plant viral resistance:application in crop protection[J]. Frontiers in Microbiology, 2017, 8: 43. |
| [6] |
Robert-Seilaniantz A, Dan M L, Jikumaru Y, et al. The microRNA miR393 re-directs secondary metabolite biosynthesis away from camalexin and towards glucosinolates[J]. Plant Journal, 2011, 67(2): 218. DOI:10.1111/tpj.2011.67.issue-2 |
| [7] |
Ouyang S, Park G, Atamian H S, et al. MicroRNAs suppress NB domain genes in tomato that confer resistance to Fusarium oxysporum[J]. PLoS Pathogens, 2014, 10(10): e1004464. DOI:10.1371/journal.ppat.1004464 |
| [8] |
Zhao H, Sun R, Albrecht U, et al. Small RNA profiling reveals phosphorus deficiency as a contributing factor in symptom expression for citrus Huanglongbing disease[J]. Molecular Plant, 2013, 6(2): 301-310. DOI:10.1093/mp/sst002 |
| [9] |
Li W, Hartung J S, Levy L. Quantitative real-time PCR for detection and identification of Candidatus Liberibacter species associated with citrus Huanglongbing[J]. Journal of Microbiological Methods, 2006, 66(1): 104-115. DOI:10.1016/j.mimet.2005.10.018 |
| [10] |
孙菲菲, 侯喜林, 李英, 等. 不结球白菜硝酸还原酶基因cDNA的克隆及序列分析[J]. 南京农业大学学报, 2006, 29(2): 15-19. Sun F F, Hou X L, Li Y, et al. Cloning and sequence analysis of nitrate reductase gene cDNA fragments from non-heading Chinese cabbage[J]. Journal of Nanjing Agricultural University, 2006, 29(2): 15-19 (in Chinese with English abstract). DOI:10.7685/j.issn.1000-2030.2006.02.004 |
| [11] |
王彦杰, 陈叶清, 薛泽云, 等. 荷花花瓣着色过程实时荧光定量PCR内参基因的筛选及验证[J]. 南京农业大学学报, 2017, 40(3): 408-415. Wang Y J, Chen Y Q, Xue Z Y, et al. Selection and validation of reference genes for RT-qPCR normalization in lotus (Nelumb onucifera)during petal coloration[J]. Journal of Nanjing Agricultural University, 2017, 40(3): 408-415 (in Chinese with English abstract). DOI:10.7685/jnau.201609033 |
| [12] |
Ruiz-Ruiz S, Navarro B, Gisel A, et al. Citrus tristeza virus infection induces the accumulation of viral small RNAs (21-24-nt)mapping preferentially at the 3'-terminal region of the genomic RNA and affects the host small RNA profile[J]. Plant Molecular Biology, 2011, 75(6): 607. DOI:10.1007/s11103-011-9754-4 |
| [13] |
Lu Y B, Yang L T, Qi Y P, et al. Identification of boron-deficiency-responsive microRNAs in citrus sinensis roots by Illumina sequencing[J]. BMC Plant Biology, 2014, 14(1): 123. DOI:10.1186/1471-2229-14-123 |
| [14] |
程保平, 赵弘巍, 彭埃天, 等. 以omp基因为靶标的3种检测方法对柑橘黄龙病菌检测效果比较[J]. 广东农业科学, 2014, 41(5): 141-145. Cheng B P, Zhao H W, Peng A T, et al. Comparative study on citrus Huanglongbing molecular detection methods with the omp target gene[J]. Guangdong Agricultural Sciences, 2014, 41(5): 141-145 (in Chinese with English abstract). DOI:10.3969/j.issn.1004-874X.2014.05.036 |
| [15] |
Mccollum G, Hilf M, Irey M, et al. Susceptibility of sixteen citrus genotypes to 'Candidatus Liberibacter asiaticus'[J]. Plant Disease, 2016, 100(6): 1080-1086. DOI:10.1094/PDIS-08-15-0940-RE |
| [16] |
张敏荣, 余继华, 於一敏, 等. 采取健身栽培措施减轻柑橘黄龙病发生[J]. 浙江柑橘, 2007, 24(4): 28-30. Zhang M R, Yu J H, Yu Y M, et al. Mitigation of Huanglongbing disease with disease resistance cultivation[J]. Zhejiang Citrus, 2007, 24(4): 28-30 (in Chinese). DOI:10.3969/j.issn.1009-0584.2007.04.012 |
| [17] |
Canales E, Coll Y, Hernández I, et al. 'Candidatus Liberibacter asiaticus', causal agent of citrus Huanglongbing, is reduced by treatment with brassinosteroids[J]. PLoS One, 2016, 11(1): e0146223. DOI:10.1371/journal.pone.0146223 |
| [18] |
Domínguezferreras A, Kisspapp M, Jehle A K, et al. An overdose of the Arabidopsis coreceptor BRASSINOSTEROID INSENSITIVE1-ASSOCIATED RECEPTOR KINASE1 or its ectodomain causes autoimmunity in a suppressor of BIR1-1-dependent manner[J]. Plant Physiology, 2015, 168(3): 1106. DOI:10.1104/pp.15.00537 |
| [19] |
Wang J, Blevins T, Podicheti R, et al. Mutation of Arabidopsis SMC4 identifies condensin as a corepressor of pericentromeric transposons and conditionally expressed genes[J]. Genes and Development, 2017, 31(15): 1601-1614. DOI:10.1101/gad.301499.117 |
| [20] |
李修华, 李民赞, Lee W S, 等. 柑橘黄龙病的可见-近红外光谱特征[J]. 光谱学与光谱分析, 2014, 34(6): 1553-1559. Li X H, Li M Z, Lee W S, et al. Visible-NIR spectral feature of citrus greening disease[J]. Spectroscopy and Spectral Analysis, 2014, 34(6): 1553-1559 (in Chinese with English abstract). DOI:10.3964/j.issn.1000-0593(2014)06-1553-07 |
| [21] |
刘燕德, 肖怀春, 邓清, 等. 柑橘黄龙病近红外光谱无损检测[J]. 农业工程学报, 2016, 32(14): 202-208. Liu Y D, Xiao H C, Deng Q, et al. Nondestructive detection of citrus greening by near infrared spectroscopy[J]. Transactions of the Chinese Society of Agricultural Engineering, 2016, 32(14): 202-208 (in Chinese with English abstract). DOI:10.11975/j.issn.1002-6819.2016.14.027 |
| [22] |
Wang L, Zhang C, Wang Y, et al. Tamarix hispida aquaporin ThPIP2, 5 confers salt and osmotic stress tolerance to transgenic Tamarix and Arabidopsis[J]. Environmental and Experimental Botany, 2018, 152: 158-166. DOI:10.1016/j.envexpbot.2017.05.018 |
| [23] |
Cheong Y H, Pandey G K, Grant J J, et al. Two calcineurin B-like calcium sensors, interacting with protein kinase CIPK23, regulate leaf transpiration and root potassium uptake in Arabidopsis[J]. Plant Journal for Cell & Molecular Biology, 2007, 52(2): 223-239. |
| [24] |
杨玉枝, 徐迪, 岑伊静. 健康和感染黄龙病砂糖桔嫩梢挥发性成分的分析[J]. 环境昆虫学报, 2015, 37(2): 328-333. Yang Y Z, Xu D, Cen Y J. Analysis of volatile compounds from young shoots of non-infected and Huanglongbing-infected citrus[J]. Journal of Environmental Entomology, 2015, 37(2): 328-333 (in Chinese with English abstract). |




