文章信息
- 姜藻航, 贺丹丹, 夏梦圆, 李振, 陈杰
- JIANG Zaohang, HE Dandan, XIA Mengyuan, LI Zhen, CHEN Jie
- AdipoR2介导C2C12肌管细胞促进3T3-L1前体脂肪细胞的糖代谢能力
- Mediation of AdipoR2 in 3T3-L1 preadipocytes co-cultured with C2C12 myotubes for glucose absorption and consumption
- 南京农业大学学报, 2018, 41(5): 911-916
- Journal of Nanjing Agricultural University, 2018, 41(5): 911-916.
- http://dx.doi.org/10.7685/jnau.201709012
-
文章历史
- 收稿日期: 2017-09-05
肌肉组织与脂肪组织均为生物机体内重要的组织器官,近年来众多研究表明二者均具有内分泌功能,分别分泌肌肉因子与脂肪因子,这两种因子能够通过调节机体内的能量代谢以维持正常的生命活动[1-3]。前人研究发现肌肉组织对脂肪组织具有一定的影响,肌肉细胞对脂肪细胞同样具有一定的影响。在细胞水平上探讨这二者间的相互作用能够进一步了解脂肪细胞在肌肉环境中的状态,这对于机体的代谢稳定具有一定的研究价值。
脂联素受体2(adiponectin receptor 2,AdipoR2)位于细胞膜上,通过接受脂联素所带来的信息进而调节细胞内的能量代谢活动。脂联素受体2含有7个跨膜领域,呈现出与其他G蛋白偶联受体相反的拓扑构象[4]。脂联素可在不同组织中发挥不同作用,脂联素受体在不同组织中同样有着不同的效应与作用方式。例如:在胰腺中,脂联素受体能够影响胰岛β细胞功能的正常发挥,进而影响到胰岛素的生成[5];血浆中AdipoR1基因的表达则与机体胰岛素敏感性相关,而AdipoR2基因的表达则与甘油三酯的聚集存在一定的关系。普遍认为脂联素可在AdipoR2的协同作用中激活下游PPARα基因,促进细胞内脂肪酸的氧化分解,也有研究表明AdipoR2可能也具备脂联素受体1(AdipoR1)调节葡萄糖吸收与消耗的能力[4, 6]。
共培养技术是将不同种类的细胞置于同种特定环境中进行培养,用以观察细胞间相互影响的一种细胞培养技术,其广泛应用于医药学和微生物生态学领域的研究[7]。随着细胞共培养技术的日渐完善,培养模型也趋于合理和多样化[8]。本试验拟通过将成熟肌纤维细胞与前体脂肪细胞共培养的方法,即将诱导成为肌管的C2C12细胞与未经过分化诱导的3T3-L1前体脂肪细胞进行共培养,探讨AdipoR2基因在该系统中对前体脂肪细胞葡萄糖利用能力的影响。
1 材料与方法 1.1 试验材料 1.1.1 细胞来源C2C12细胞购于南京科佰生物科技股份有限公司,3T3-L1前体脂肪细胞购于中国科学院上海细胞库。
1.1.2 试验试剂Trizol试剂盒(Invitrogen公司); Vazyme HiScript Ⅱ 1st Strand cDNA Synthesis Kit,Vazyme AceQ qPCR SYBR Green Master Mix(南京诺唯赞生物股份有限公司);DMEM高糖培养基、胎牛血清(FBS)、马血清(HS)(Gibco公司)。
1.1.3 细胞培养耗材T25细胞培养瓶、6孔细胞培养板、Transwell细胞共培养小室均购于南京市江宁区益恒实验器材经营部。
1.2 试验方法 1.2.1 细胞培养将C2C12细胞培养于Transwell细胞培养小室中,用含2%HS(体积分数)的培养基诱导直至形成显著的肌管。将3T3-L1前体脂肪细胞置于6孔细胞培养板进行培养,待其生长约培养板总面积的80%时,将含有C2C12肌管细胞的小室置于含有3T3-L1前体脂肪细胞的细胞培养孔内进行共培养,24 h后收集细胞样品。
1.2.2 RNA提取和cDNA合成利用Trizol法提取细胞中总RNA,随后按照试剂盒说明书合成cDNA,具体操作方法如下:在0.2 mL PCR管中依次加入1 μL Oligo dT23VN(50 μmol · L-1),1 μL Random hexamers(50 ng · μL-1),2 μL HiScript Ⅱ Enzyme Mix,10 μL 2× RT Mix,1 000 ng RNA,用ddH2O补足至20 μL;混匀后进行反转录,程序为25 ℃ 5 min,50 ℃ 15 min,85 ℃ 5 min,4 ℃保存,转录完成后测定cDNA的浓度。将最终获得的cDNA用DEPC水稀释至20 ng · μL-1。
1.2.3 引物设计利用GenBank数据库查找相应基因的序列信息,使用Primer Premier 5.0软件设计相应引物,引物交由擎科生物有限公司合成。本试验所用引物的详细信息如表 1所示。
| 基因名称Gene name | 引物对序列(5′→3′) Primer pairs sequences | 产物长度/bp Product length |
| RPLP0 | AGATTCGGGATATGCTGTTGGC/TCGGGTCCTAGACCAGTGTTC | 109 |
| AdipoR1 | AAGGTGGTCTTCGGGATGTT/GTGGGGAGCAGTAGAAGGAG | 190 |
| AdipoR2 | GGAGTGTTCGTGGGCTTAGG/GCAGCTCCGGTGATATAGAGG | 140 |
| Slc2a1 | CAGTTCGGCTATAACACTGGTG/GCCCCCGACAGAGAAGATG | 156 |
| Slc2a4 | GTGACTGGAACACTGGTCCTA/CCAGCCACGTTGCATTGTAG | 127 |
siRNA设计与合成交由上海生工生物工程股份有限公司完成。序列为:5′-CCGAGUGUCAUGAUGACAATT-3′和5′-UUGUCAUCAUGACACUCGGTT-3′。使用LipofectamineTM 3000试剂盒(Invitrogen公司)对细胞进行相应的转染操作,具体过程参照试剂盒说明书进行。
1.2.5 荧光定量PCR(qPCR)使用试剂盒进行qPCR试验。反应程序:95 ℃ 5 min;95 ℃ 10 s,60 ℃ 30 s共计40个循环;95 ℃ 15 s,60 ℃ 1 min,每15 s升温0.3 ℃,95 ℃ 15 s。
1.2.6 葡萄糖和蛋白含量检测分别使用葡萄糖检测试剂盒(葡萄糖氧化酶GOD法)、BCA蛋白浓度检测试剂盒检测葡萄糖和蛋白含量,均重复检测6次。根据标准曲线计算培养基中的葡萄糖含量和细胞总蛋白含量。消耗的葡萄糖量为不含细胞培养孔中培养基的葡萄糖量减去含有细胞培养孔内培养基的葡萄糖量所获得差值。利用细胞总蛋白含量来表示细胞数量。用含每单位蛋白量的细胞所消耗葡萄糖的量来表示细胞对葡萄糖的消耗能力。
1.3 数据处理使用Microsoft Excel 2010及SPSS Statistics 22.0对试验数据进行数据处理和统计分析,通过独立样本t测验检测是否存在显著差异,并通过Graphpad Prism 5.0软件作图。
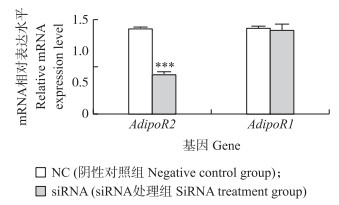
2 结果与分析 2.1 3T3-L1前体脂肪细胞中特异性敲减AdipoR2基因效果的鉴定设计并合成AdipoR2基因特异性的siRNA,将其转染至体外培养的3T3-L1前体脂肪细胞中。24 h后,利用qPCR方法检测3T3-L1前体脂肪细胞中AdipoR2 mRNA表达水平。结果显示:AdipoR2特异性siRNA能够极显著降低3T3-L1前体脂肪细胞中AdipoR2 mRNA表达水平(P < 0.001)(图 1)。鉴于AdipoR1基因与AdiopR2基因在序列上具有66.7%的同源性,本试验同时检测了AdipoR1基因的表达水平。结果显示AdipoR2特异性siRNA对AdiopR1基因表达没有影响,说明该siRNA能够靶向特异性抑制AdipoR2基因的表达。
|
图 1 siRNA处理后3T3-L1前体脂肪细胞内脂联素受体(AdipoR)表达情况 Figure 1 Expression of adiponectin receptors(AdipoR) after the siRNA treatment in 3T3-L1 preadipocytes * * * P < 0.001. The same as follows. |
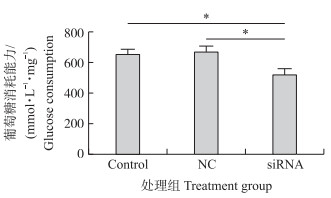
为了探究AdipoR2基因是否能够影响3T3-L1前体脂肪细胞对葡萄糖摄取的能力,利用每单位蛋白所消耗葡萄糖的量为标准来评定细胞对葡萄糖的消耗能力[9]。在AdipoR2 -siRNA转染3T3-L1前体脂肪细胞24 h后,使用无酚红的培养基培养30 min后更换为相同培养基,检测转染前、后葡萄糖含量变化。检测发现,siRNA处理组与阴性对照(NC)组相比,每单位蛋白所消耗葡萄糖量显著下降(P < 0.05),siRNA处理与空白对照(Control)组相比显著下降(P < 0.05),而NC组与Control组相比没有显著差异(图 2)。上述结果表明转染试剂不会对3T3-L1细胞的摄糖能力造成影响,而AdipoR2干扰后能够显著影响3T3-L1前体脂肪细胞对葡萄糖吸收能力。
|
图 2 siRNA处理后3T3-L1前体脂肪细胞对葡萄糖消耗能力的影响 Figure 2 The glucose consumption of 3T3-L1 preadipocytes after the siRNA treatment * P < 0.05. The same as follows. |
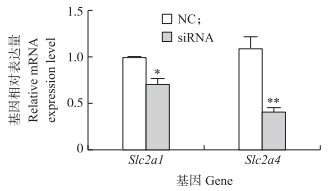
细胞利用葡萄糖时需要通过葡萄糖转运蛋白来吸收培养环境中的葡萄糖。综合上述结果推测AdipoR2可能影响3T3-L1前体脂肪细胞对葡萄糖的转运过程。随后检测了在干扰AdipoR2后3T3-L1细胞中葡萄糖转运蛋白1(Slc2a1)和葡萄糖转运蛋白4(Slc2a4)基因的表达(图 3)。结果表明,干扰AdipoR2基因后能够显著降低3T3-L1前体脂肪细胞中上述Slc2a1和Slc2a4基因的mRNA表达水平。
|
图 3 siRNA处理后3T3-L1前体脂肪细胞内葡萄糖转运蛋白基因(Slc2a1、Slc2a4)的表达情况 Figure 3 Expression of Slc2a1 and Slc2a4 genes after the siRNA treatment in 3T3-L1 preadipocytes * * P < 0.01. The same as follows. |
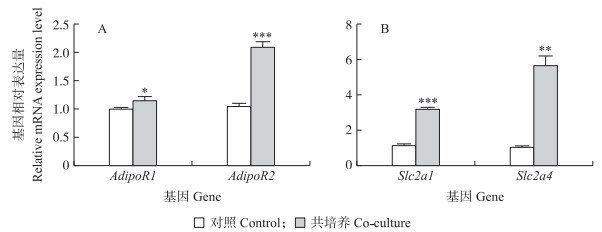
将C2C12肌管细胞与3T3-L1前体脂肪细胞共培养24 h,分别检测共培养前后3T3-L1前体脂肪细胞中AdipoR基因与葡萄糖转运蛋白基因Slc2a的表达(图 4)。结果表明,共培养后3T3-L1前体脂肪细胞中AdipoR2基因与葡萄糖转运蛋白基因的表达水平均显著上调。
|
图 4 共培前、后3T3-L1前体脂肪细胞内AdipoR基因(A)和Slc2a基因(B)表达水平的变化 Figure 4 Gene expression level of AdipoR genes(A)and Slc2a genes(B)in 3T3-L1 preadipocytes under co-culture system |
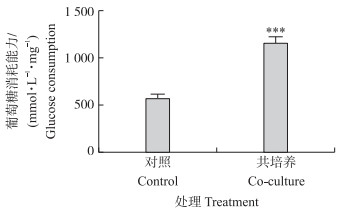
共培试验结束后撤去Transwell培养小室,检测共培养后3T3-L1前体脂肪细胞对葡萄糖消耗的能力。结果表明,与C2C12肌管细胞共培养后,3T3-L1前体脂肪细胞对葡萄糖的消耗能力极显著上升(图 5)。
|
图 5 共培养对3T3-L1前体脂肪细胞利用葡萄糖能力的影响 Figure 5 Glucose consumption ability of 3T3-L1 preadipocytes under co-culture system |
细胞共培养是一个含有较多因素的细胞培养体系,由于2种细胞相互作用,一些效应会有等级存在,在时间上的优先也会对整个体系产生影响[10]。参考了3T3-L1细胞与C2C12细胞或与巨噬细胞共培养[11]的试验方法,本试验将对照组和共培组3T3-L1前体脂肪细胞数目控制在同一水平,确保试验不会因细胞数目相差过大而对后续结果造成误差。由于整个培养系统中2种细胞的作用是相互的,但仅仅从3T3-L1前体脂肪细胞的角度来观察分化后的C2C12肌管细胞对其的影响,是否存在交替相互作用的关系仍需要后续研究探索。同时,本试验通过建立2种细胞立体的共培方式,在二者无法直接接触的情况下,C2C12肌管细胞通过分泌细胞因子来影响3T3-L1前体脂肪细胞。本研究中的共培系统更接近于肌纤维对前体脂肪细胞作用的模型,但从具体的结果同样看到一些非肌肉内前体脂肪细胞有差异变化基因的出现,说明肌肉分泌的细胞因子不仅可以对自身所含前体脂肪细胞造成影响,同样也可能对其他部位的前体脂肪细胞产生一定的效应。
作为脂联素的受体,AdiopR1和AdipR2的变化都可对下游能量代谢相关通路产生影响,比如在Ⅱ型糖尿病的研究中发现,同时上调二者的表达量会有效缓解肌肉对葡萄糖利用较弱的现象[12],并且在患者体内发现2种受体的表达水平均低于正常个体[13],表明AdiopR1和AdipR2均可参与相关的能量代谢过程。AdiopR1可通过调节AMPK的表达情况来调控能量平衡。Iwabu等[14]发现当AdiopR1受到抑制时,AMPK的激活会受到抑制,肌肉表现出胰岛素抑制的现象,进而减少对葡萄糖的吸收和利用。AdipoR2通过PPARα通路来调节脂肪酸的代谢过程。本次试验通过干扰3T3-L1前体脂肪细胞内AdipoR2的表达后发现,与葡萄糖代谢转运相关的基因Slc2a1和Slc2a4的表达水平也同时下降,并且AdipoR1的表达水平并没有因为siRNA的干扰作用而下降。在表型上表现为干扰AdipoR 2表达后细胞对葡萄糖的消耗水平下降,说明AdiopR2也可作用于Slc2a1与Slc2a4的上游,其自身的变化也会调节这2个基因的表达水平。Slc2a1与Slc2a4作为葡萄糖转运的重要基因,其表达水平的提高可促进细胞对葡萄糖的吸收,促进细胞内与糖酵解相关的基因发挥作用[15],进而影响细胞对葡萄糖的消耗能力。研究表明脂联素受体可作为AMPK通路的上游信号[16],因此推断AdipoR2可能通过调节AMPK通路进而调节Slc2a1与Slc2a4的表达,最终影响3T3-L1前体脂肪细胞对葡萄糖的消耗能力。
前体脂肪细胞分化成为成熟脂肪细胞的过程中需要对葡萄糖进行摄取与利用,在细胞内葡萄糖可以提供能量以维持细胞正常的生命活动,也可以通过一系列作用转化成为甘油三酯合成底物。在试验中,3T3-L1前体脂肪细胞对葡萄糖的消耗水平与AdipoR2的表达有关。当AdipoR2表达量下降时,细胞对葡萄糖的消耗能力减弱。在与诱导分化后的C2C12肌管细胞共培养后,3T3-L1前体脂肪细胞对葡萄糖的消耗能力增加。以上结果说明共培养系统会促进3T3-L1前体脂肪细胞内AdipoR2的表达,进而引起下游Slc2a1与Slc2a4表达水平的上调,在表型上表现为细胞对葡萄糖的消耗能力提高。鉴于共培养系统的复杂性,3T3-L1前体脂肪细胞葡萄糖消耗能力增强的诱导因素极其复杂。Pandurangan等[17]通过将未分化的C2C12细胞与3T3-L1细胞共培养后发现3T3-L1细胞内与凋亡相关基因和热应激相关基因的表达水平都有所上升,Ravikumar等[18]也在这种共培体系中观察到热应激蛋白的显著变化,进而促进3T3-L1细胞对葡萄糖的吸收。有研究表明共培养系统会造成细胞发生氧化应激进而造成NO应激,这种应激会显著促进细胞对葡萄糖的吸收与利用[19-20]。这些研究均证明该共培养系统会提高3T3-L1前体脂肪细胞对葡萄糖的吸收与消耗能力,造成该现象的因素有很多,仍需要更多的研究和探索。
本试验表明AdipoR2基因可调节3T3-L1前体脂肪细胞内葡萄糖转运蛋白基因的表达,并在C2C12肌管细胞与3T3-L1前体脂肪细胞的共培养体系中介导3T3-L1前体脂肪细胞增强对葡萄糖的消耗能力。
| [1] | Joulia D, Bernardi H, Garandel V, et al. Mechanisms involved in the inhibition of myoblast proliferation and differentiation by myostatin[J]. Experimental Cell Research, 2003, 286(2): 263-275. DOI: 10.1016/S0014-4827(03)00074-0 |
| [2] | Sciorati C, Clementi E, Manfredi A A, et al. Fat deposition and accumulation in the damaged and inflamed skeletal muscle:cellular and molecular players[J]. Cellular and Molecular Life Sciences, 2015, 72(11): 2135-2156. DOI: 10.1007/s00018-015-1857-7 |
| [3] | Buch A, Carmeli E, Boker L K, et al. Muscle function and fat content in relation to sarcopenia, obesity and frailty of old age:an overview[J]. Experimental Gerontology, 2016, 76: 25-32. DOI: 10.1016/j.exger.2016.01.008 |
| [4] | Yamauchi T, Kamon J, Ito Y, et al. Cloning of adiponectin receptors that mediate antidiabetic metabolic effects[J]. Nature, 2003, 423(6941): 762-769. DOI: 10.1038/nature01705 |
| [5] | Kharroubi I, Rasschaert J, Eizirik D L, et al. Expression of adiponectin receptors in pancreatic beta cells[J]. Biochemical and Biophysical Research Communications, 2003, 312(4): 1118-1122. DOI: 10.1016/j.bbrc.2003.11.042 |
| [6] | Yamauchi T, Nio Y, Maki T, et al. Targeted disruption of AdipoR1 and AdipoR2 causes abrogation of adiponectin binding and metabolic actions[J]. Nature Medicine, 2007, 13(3): 332-339. DOI: 10.1038/nm1557 |
| [7] | Wu M H, Huang S B, Lee G B. Microfluidic cell culture systems for drug research[J]. Lab Chip, 2010, 10(8): 939-956. DOI: 10.1039/b921695b |
| [8] | Androulakis I P. Systems engineering meets quantitative systems pharmacology:from low-level targets to engaging the host defenses[J]. Wiley Interdisciplinary Reviews Systems Biology and Medicine, 2015, 7(3): 101-112. DOI: 10.1002/wsbm.1294 |
| [9] | Tan X C, Chua K H, Ravishankar R M, et al. Monoterpenes:novel insights into their biological effects and roles on glucose uptake and lipid metabolism in 3T3-L1 adipocytes[J]. Food Chemistry, 2016, 196: 242-250. DOI: 10.1016/j.foodchem.2015.09.042 |
| [10] | Goers L, Freemont P, Polizzi K M. Co-culture systems and technologies:taking synthetic biology to the next level[J]. Journal of the Royal Society, Interface, 2014, 11(96): 65-70. DOI: 10.1098/rsif.2014.0065 |
| [11] | Huang W C, Chang W T, Wu S J, et al. Phloretin and phlorizin promote lipolysis and inhibit inflammation in mouse 3T3-L1 cells and in macrophage-adipocyte co-cultures[J]. Molecular Nutrition & Food Research, 2013, 57(10): 1803-1813. |
| [12] | Tsuchida A, Yamauchi T, Ito Y, et al. Insulin/Foxo1 pathway regulates expression levels of adiponectin receptors and adiponectin sensitivity[J]. The Journal of Biological Chemistry, 2004, 279(29): 30817-30822. DOI: 10.1074/jbc.M402367200 |
| [13] | Civitarese A E, Jenkinson C P, Richardson D, et al. Adiponectin receptors gene expression and insulin sensitivity in non-diabetic Mexican Americans with or without a family history of Type 2 diabetes[J]. Diabetologia, 2004, 47(5): 816-820. DOI: 10.1007/s00125-004-1359-x |
| [14] | Iwabu M, Yamauchi T, Okada-Iwabu M, et al. Adiponectin and AdipoR1 regulate PGC-1alpha and mitochondria by Ca(2+)and AMPK/SIRT1[J]. Nature, 2010, 464(7293): 1313-1319. DOI: 10.1038/nature08991 |
| [15] | Bricker D K, Taylor E B, Schell J C, et al. A mitochondrial pyruvate carrier required for pyruvate uptake in yeast, Drosophila, and humans[J]. Science, 2012, 337(6090): 96-100. DOI: 10.1126/science.1218099 |
| [16] | Peters K E, Beilby J, Cadby G, et al. A comprehensive investigation of variants in genes encoding adiponectin(ADIPOQ)and its receptors(ADIPOR1/R2), and their association with serum adiponectin, type 2 diabetes, insulin resistance and the metabolic syndrome[J]. BMC Medical Genetics, 2013, 14: 15. |
| [17] | Pandurangan M, Jeong D, Amna T, et al. Co-culture of C2C12 and 3T3-L1 preadipocyte cells alters the gene expression of calpains, caspases and heat shock proteins[J]. In vitro Cellular & Developmental Biology Animal, 2012, 48(9): 577-582. |
| [18] | Ravikumar S, Muthuraman P. Cortisol effect on heat shock proteins in the C2C12 and 3T3-L1 cells[J]. In vitro Cellular & Developmental Biology Animal, 2014, 50(7): 581-586. |
| [19] | Tanaka T, Nakatani K, Morioka K, et al. Nitric oxide stimulates glucose transport through insulin-independent GLUT4 translocation in 3T3-L1 adipocytes[J]. European Journal of Endocrinology, 2003, 149(1): 61-67. DOI: 10.1530/eje.0.1490061 |
| [20] | Canova N, Lincova D, Farghali H. Inconsistent role of nitric oxide on lipolysis in isolated rat adipocytes[J]. Physiological Research, 2005, 54(4): 387-393. |




