文章信息
- 古芸, 郑赛, 曲峰龙, 王韬略, 余光辉, 冉炜, 沈其荣
- GU Yun, ZHENG Sai, QU Fenglong, WANG Taolue, YU Guanghui, RAN Wei, SHEN Qirong
- 水铁矿对玉米生长及其抗氧化系统的影响
- Effect of ferrihydrite on maize growth and antioxidant system
- 南京农业大学学报, 2018, 41(5): 860-866
- Journal of Nanjing Agricultural University, 2018, 41(5): 860-866.
- http://dx.doi.org/10.7685/jnau.201802022
-
文章历史
- 收稿日期: 2018-02-13
铁是植物生长发育必需的微量元素。植物在缺铁条件下,叶片脉间失绿黄化,正常生长发育受到抑制[1]。土壤中可被植物利用的铁为Fe2+和Fe3+,但Fe2+易被氧化为Fe3+,Fe3+经水解和脱水作用,转化为晶型和弱晶型氧化物或氢氧化物,降低植物的吸收利用率[2]。水体和土壤沉积物中的纳米铁氧化物可被植物吸收[3]。铁氧化物纳米颗粒可显著增加柚子叶绿素含量,提高根系活力和铁还原酶基因的表达,从而促进铁元素的转化[4],并且在增加花卉生物量、叶绿素和蛋白质含量等方面具有良好的促进作用[5]。适宜浓度的纳米铁氧化物可以显著增加大豆幼苗的鲜质量和叶面积[6],促进柞树种子萌发以及提高植株的生物量和叶绿素含量[7]。然而,纳米铁氧化物对植物生长也有消极影响。如磁铁矿纳米颗粒相比于磁铁矿非纳米颗粒更易诱发氧化胁迫,对黑麦草和南瓜形成生理毒害效应[8],降低黄瓜种子的萌发指数,抑制种子萌发[9]。因此,纳米铁氧化物对植物生长影响有利有弊。
水铁矿是一种在自然界中广泛存在的弱结晶形态的纳米铁氧化物,平均粒径为2~6 nm[10],其对植物利弊的临界浓度以及影响植物生长的机制并不清楚。本研究以玉米为供试植株,采用人工合成水铁矿进行浸种和培养试验,研究10~500 mg·L-1水铁矿对玉米种子萌发、生理生化指标和细胞微形态结构等方面的影响,为水铁矿作为新型铁肥运用于植物的生长提供理论依据。
1 材料与方法 1.1 试验材料水铁矿的配制:向4 mol·L-1 FeCl3溶液中搅拌并缓慢加入1 mol·L-1 NaOH,调节pH值至7.0,溶液呈悬浊状,室温静置2~6 h,充分沉淀。4 ℃、3 600 r·min-1离心20 min,去离子水冲洗沉淀物后再次离心。上述过程重复8~9次,以除去电解质。室温晾干,研磨,过75 μm筛,备用。
供试玉米种子:品种为‘江南紫糯’,购自江苏省农业科学院。
1.2 试验设计 1.2.1 玉米种子萌发将种子用体积分数为3%的H2O2消毒2~3 min,去离子水冲洗3~5次,以去离子水为对照(CK1),设置6个处理,分别是:10(f1)、20(f2)、50(f3)、100(f4)、200(f5)和500 mg·L-1(f6)的水铁矿溶液。种子先用水浸泡0.5 h,然后挑选大小一致、形态饱满的种子,置于铺有双层洁净滤纸的培养皿(Φ=9 cm)内,每皿15粒种子,加2 mL处理液。28 ℃恒温培养72 h,计算发芽势、平均发芽时间、萌发指数和活力指数,测量平均根长,每处理3次重复。
1.2.2 玉米植株培养种子经10、20、50、100、200和500 mg·L-1水铁矿溶液浸种培养至72 h后,每个处理选取长势一致的种子,移入装有基质和珍珠岩(m : m=7 : 3)的盆钵中培养28 d,至6~7叶期。试验设置2组对照,分别为不含铁的1/2 Hoagland营养液(CK2)和含EDTA-Fe的1/2 Hoagland营养液(CK3)。6个处理分别为以CK2为基础分别添加10、20、50、100、200和500 mg·L-1的水铁矿,即F1、F2、F3、F4、F5和F6处理。每隔3 d加1次处理液,每次加100 mL,共加9次。至28 d后测定植株的生理生化指标;观察根尖细胞显微结构变化并测定植株地上部铁含量。于2017年9—10月在江苏省宜兴市中宜生物肥料工程中心温室进行玉米植株培养,日平均气温为19~26 ℃。
1.3 测定项目与方法 1.3.1 种子萌发指标测定以种子芽长超过2 mm作为萌发标准,每12 h统计发芽情况,处理72 h后采用以下公式计算发芽势、平均发芽时间[11]、萌发指数[12]、活力指数[13],测定平均根长。

|
式中:F为X d内种子新萌发的数量;X是指种子从浸种开始至种子萌发需要的时间(d);Gt为在t日的发芽数;Dt为发芽时间。
1.3.2 植株生理生化指标测定玉米生长至6~7叶期时,每个处理随机选取5株植株测定形态指标。称量地上部鲜质量,测量植株株高(茎到心叶之间的高度)。采用乙醇提取分光光度法测定叶绿素含量;采用氯化三苯基四氮唑(TTC)法测定根系活力;采用考马斯亮蓝(G250)法测定可溶性蛋白含量;采用硫代巴比妥酸(TBA)法测定丙二醛含量[14]。参照南京建成生物公司提供的试剂盒说明书测定超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性。SOD活性是每克叶片鲜样中的酶活性,POD和CAT活性是每毫克鲜样蛋白中的酶活性。
1.3.3 玉米根尖细胞观察用双面刀片切取玉米幼苗根尖1 mm左右,用4%(体积分数)戊二醛溶液(pH7.2~7.4,0.1 mol·L-1PBS配制)4 ℃固定4 h,再用1%锇酸固定2 h后,用PBS清洗,乙醇梯度脱水,环氧树脂包埋,醋酸铀染色,超薄切片机切片(70~100 nm),最后用透射电子显微镜观察玉米根尖形态和水铁矿在根尖细胞内的分布[3, 15]。
1.3.4 玉米植株地上部铁含量测定新鲜植株样品105 ℃杀青30 min后,75 ℃烘干至恒质量。称取粉碎的地上部植株样品1.00 g,加15 mL混酸(HNO3和HClO4,体积比为4 : 1)消煮,至液体澄清透亮,定容至100 mL,过0.45 μm滤膜,用电感耦合等离子体(ICP)光谱仪测定铁含量。
1.4 数据处理采用Excel 2007和SPSS 16.0软件进行数据处理和差异显著性分析,Origin 8.0软件绘图。
2 结果与分析 2.1 水铁矿对玉米种子萌发的影响从图 1可知:水铁矿(10~500 mg·L-1)对玉米种子发芽势的影响不显著,但显著缩短发芽时间。与CK1相比,种子萌发指数、活力指数和平均根长随水铁矿质量浓度增加,呈先上升后下降的趋势。与CK1相比,f1~f6处理平均发芽时间分别缩短48.19%、56.63%、32.5%、49.40%、21.69%和37.35%;f1、f2和f6处理萌发指数分别增加13.64%、38.33%和12.73%;f1~f6处理活力指数分别增加25.61%、61.99%、46.34%、39.63%、15.85%和30.08%;f1~f6处理平均根长分别增加41.67%、53.91%、40.63%、41.15%、18.75%和35.42%。其中20 mg·L-1水铁矿对玉米种子萌发促进作用最强。
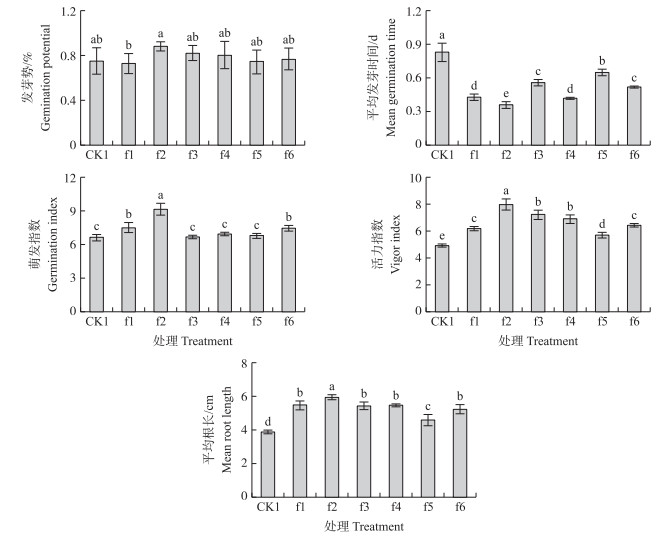
|
图 1 不同质量浓度水铁矿对玉米种子萌发的影响
Figure 1 Effect of different ferrihydrite concentrations on seed germination of maize
1)CK1:去离子水对照;f1~f6:分别为10、20、50、100、200和500 mg·L-1的水铁矿溶液处理。CK1:Deionized water;f1 to f6:Treatments containing 10,20,50,100,200 and 500 mg·L-1ferrihydrite. 2)不同小写字母表示处理间在0.05水平有显著差异。下同。The different letters in the same column indicate significant difference among treatments at 0.05 level. The same as follows. |
从图 2可知:与CK2相比,F1、F2和F3处理有助于提高玉米地上部鲜质量、株高和叶绿素含量。其中,F2处理地上部鲜质量比CK2增加15.38%;F1、F2和F3处理株高分别比CK2增加9.64%、10.03%和10.45%;F2和F3处理叶绿素含量分别比CK2增加24.85%和25.44%(P < 0.05)。叶片中可溶性蛋白含量随水铁矿质量浓度的增加,呈先上升后下降的趋势。其中,F1、F2和F3处理显著增加叶片中可溶性蛋白含量,均为CK2的1.67倍;F4和F6处理可溶性蛋白分别增加22.22%和11.11%(P < 0.05)。与CK3处理相比,F2和F3处理显著提高了叶绿素含量,其他处理对植株生长未表现显著促进作用,且高浓度处理不利于玉米生长。随水铁矿质量浓度的增加,玉米根系活力呈先上升后下降的趋势。F1处理玉米根系活力较CK2和CK3分别显著增加18.87%和14.40%;F2~F6处理,根系活力逐渐下降,且均低于CK2和CK3(P < 0.05)。
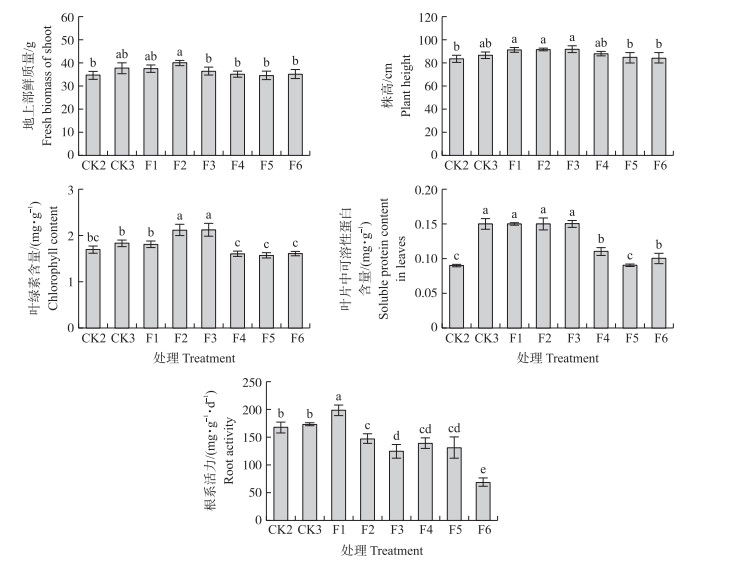
|
图 2 不同质量浓度水铁矿对玉米生长指标的影响 Figure 2 Effect of different concentrations of ferrihydrite on maize growth index CK2:无铁1/2 Hoagland营养液;CK3:1/2 Hoagland营养液(含EDTA-Fe);F1~F6:分别为含水铁矿10、20、50、100、200和500 mg·L-1的无铁1/2 Hoagland营养液。下同。 CK2:1/2 Hoagland solution without iron; CK3:1/2 Hoagland solution with EDTA-Fe; F1 to F6:Containing 10, 20, 50, 100, 200 and 500 mg·L-1 of ferrihydrite in 1/2 Hoagland solution without iron. The same as follows. |
从图 3可知:与CK2相比,F1~F6处理玉米叶片中超氧化物歧化酶(SOD)活性均呈降低趋势,分别降低24.28%、25.77%、26.42%、41.17%、47.16%和50.56%;过氧化物酶(POD)活性呈先上升后下降的趋势;F1和F2处理玉米叶片中POD活性分别增加39.66%和43.10%;F3~F6处理POD活性显著降低。与CK2相比,F2处理过氧化氢酶(CAT)活性差异不显著,其他处理CAT活性均显著降低。
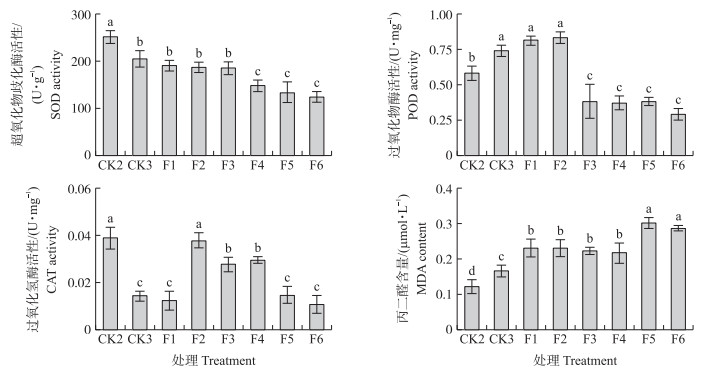
|
图 3 不同质量浓度水铁矿对玉米叶片中抗氧化酶活性和丙二醛含量的影响 Figure 3 Effect of different concentrations of ferrihydrite on autioxidant enzyme activities and MDA content in maize leaf |
与CK3相比,F1~F3处理SOD活性无显著差异;F4~F6处理SOD活性显著下降27.82%、35.16%和39.34%。F1~F2处理POD活性与CK3相比差异不显著,但F3~F6处理POD活性分别显著降低48.65%、50.04%、48.65%和60.81%。CAT活性随水铁矿质量浓度的增加呈先升高后降低的趋势,F2~F4处理CAT活性分别是CK3的2.63、1.93和2.05倍,但F5和F6处理CAT活性与对照相比无显著差异。
与CK2相比,玉米叶片中丙二醛含量随水铁矿质量浓度增加均呈上升趋势。F5和F6处理MDA含量较高,是CK2的2.50和2.38倍,是CK3的1.81和1.72倍。
2.4 水铁矿在玉米根尖细胞中的分布由图 4可见:CK2处理玉米根尖细胞原生质层与细胞壁紧贴,且未观察到水铁矿颗粒(图 4-a)。通过对比水铁矿透射电镜图(图 4-j)可知:图 4-b、c出现的颗粒物为水铁矿纳米颗粒。水铁矿在20 mg·L-1处理时,水铁矿颗粒出现在细胞间隙,且沿细胞壁分布(图 4-d、e)。图 4-e、f、g、h中未观察到水铁矿颗粒,且细胞出现质壁分离的现象。
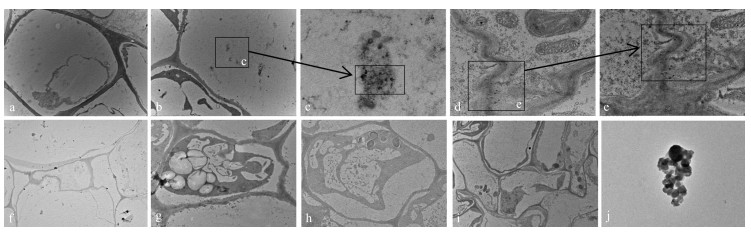
|
图 4 不同质量浓度水铁矿处理下玉米根尖细胞切片(a~i)及水铁矿(j)透射电镜图 Figure 4 TEM micrograph image of maize root cell slice treated with different concentrations of ferrihydrite(a-i) and transmission electron microscopy of ferrihydrite(j) a. CK2;b、d.分别为F1、F2处理;c是b中放大部分;e是d中放大部分;f~i分别为F3~F6处理;j为水铁矿透射电镜图(×100 000)。 a. Treated with CK2;b, d. Treated with F1 and F2;c. The magnify picture in b; e. The magnify picture in d; f-i. Treated with F3-F6;j. Image of ferrihydrite in the electron microscopy(×100 000). |
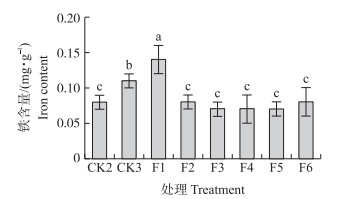
从图 5可知:F1处理地上部铁含量比CK2和CK3分别显著提高75%和27.3%,其他处理地上部铁含量与CK2无显著差异,且显著低于CK3。
|
图 5 不同质量浓度水铁矿对玉米地上部铁含量的影响 Figure 5 Effects of different concentrations of ferrihtdrite on iron content of maize |
本研究结果表明,水铁矿质量浓度为20 mg·L-1时对种子萌发促进效果最理想,且质量浓度在10~50 mg·L-1时能够替代EDTA-Fe促进玉米生长,而高质量浓度水铁矿不利于玉米植株生长。这说明纳米粒级的水铁矿可能是植物有效态铁,因此可能具有改善作物缺铁症状和促进作物生长的潜力。
水铁矿作为铁的一种自然形态,对玉米种子萌发和植株生长的影响机制可能与作物体内氧化过程及其自由基化学反应有关,但水铁矿过量施用对人体健康和植物生长影响的研究尚未见报道。许多研究表明,植物体内的许多正常生理过程如种子萌发、生长、气孔关闭、繁殖、免疫响应和对逆境的适应等均受氧自由基调节[16-17],而植物病理学失调如细胞死亡和对病原体的过敏响应等则可能是自由基生产过剩的结果[18],也可能是自由基形成不足的结果[19]。生物体内未与蛋白质等生物大分子结合的铁称为游离铁,主要由过量供给的游离铁、氧化胁迫下含铁蛋白释放出的铁和不能被去铁草酰胺螯合的铁组成[20]。由游离铁催化的自由基形成在生物体内广泛存在[21],而过量的游离铁是自由基生产过剩进而引起人体病理学失调的重要原因[22],也可能是水稻铁中毒的原因之一[23]。
超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)是植物体内重要的抗氧化保护酶类,其活性大小直接反映组织和细胞的受氧化胁迫的程度[24]。较高水平的SOD和CAT活性是优质咖啡种子的特征[25],也是苜蓿种子萌发过程耐盐性优良的原因之一[26]。本研究表明添加水铁矿有利于玉米种子萌发,这可能与维持合适的抗氧化酶系统有关。但对玉米植株生长而言,随水铁矿质量浓度的增加,叶片组织中SOD、POD和CAT活性显著降低,说明不同于过量施用亚铁离子导致水稻铁中毒现象[23],施用过量水铁矿并没有造成自由基生产过剩,从而避免了过量施用亚铁离子对玉米植株的病理性损害。
本研究中,在低质量浓度条件下水铁矿能够进入玉米根细胞,因此低质量浓度水铁矿对玉米铁养分的有效性,可能与细胞中水铁矿被活化为Fe3+或被还原为Fe2+从而成为能够被植物利用的有效态有关。Shankramma等[13]报道,纳米磁赤铁矿(Fe2O3)中Fe3+在植物体内能够被还原为Fe2+,供植物吸收,本研究的结果与之相一致。
高浓度水铁矿对玉米生长的抑制作用,可能与高浓度水铁矿在根表沉积有关。当水铁矿质量浓度大于等于50 mg·L-1时,根细胞有明显的质壁分离现象,表明根的结构受到高浓度水铁矿的影响,从而阻碍根系对养分的吸收,造成玉米生长受到抑制。有报道表明,根细胞壁沉积和渗透圧下降是小麦根毛细胞质壁分离的主要原因[27]。Martínez-Fernández等[28]研究表明,50~100 mg·L-1纳米磁赤铁矿颗粒显著降低向日葵根系导水率;40 mg·L-1纳米磁赤铁矿颗粒易形成聚合体,附着在根表面抑制水分和营养元素的传输,显著降低芸豆的根系活力[29]。综上,低质量浓度水铁矿可替代EDTA-Fe,有矫正作物缺铁和促进作物生长的潜力,而高质量浓度水铁矿对玉米有抑制作用,相关机制尚待进一步研究。
| [1] |
刘秀梅, 张夫道, 冯兆滨, 等. 纳米氧化铁对花生生长发育及养分吸收影响的研究[J].
植物营养与肥料学报, 2005, 11(4): 551-555.
Liu X M, Zhang F D, Feng Z B, et al. Effects of nano-ferric oxide on the growth and nutrients absorption of peanut[J]. Plant Nutrition and Fertilizer Science, 2005, 11(4): 551-555. DOI: 10.3321/j.issn:1008-505X.2005.04.021 (in Chinese with English abstract) |
| [2] | Colombo C, Iorio E D, Liu Q S, et al. Iron oxide nanoparticles in soils:environmental and agronomic importance[J]. J Nanosci Nanotechno, 2018, 18(1): 761. DOI: 10.1166/jnn.2018.15294 |
| [3] | Rico C M, Majumdar S, Duarte-Gardea M, et al. Interaction of nanoparticles with edible plants and their possible implications in the food chain[J]. J Agric Food Chem, 2011, 59(8): 3485-3498. DOI: 10.1021/jf104517j |
| [4] | Hu J, Guo H Y, Li J L, et al. Comparative impacts of iron oxide nanoparticles and ferric ions on the growth of Citrus maxima[J]. Environ Pollut, 2017, 221: 199-208. DOI: 10.1016/j.envpol.2016.11.064 |
| [5] | Askary M, Amirjani M R, Saberi T. Comparison of the effects of nano-iron fertilizer with iron-chelate on growth parameters and some biochemical properties of Catharanthus roseus[J]. J Plant Nutr, 2016, 40(7): 974-982. |
| [6] | Alidoust D, Isoda A. Effect of γ-Fe2O3 nanoparticles on photosynthetic characteristic of soybean[Glycine gax(L.)Merr.]:foliar spray versus soil amendment[J]. Acta Physiol Plant, 2013, 35(12): 3365-3375. DOI: 10.1007/s11738-013-1369-8 |
| [7] | Pariona N, Martínez A I, Hernandez-Flores M, et al. Effect of magnetite nanoparticles on the germination and early growth of Quercus macdougallii[J]. Sci Total Environ, 2017, 575: 869-875. DOI: 10.1016/j.scitotenv.2016.09.128 |
| [8] | Wang H H, Kou X M, Pei Z G, et al. Physiological effects of magnetite(Fe3O4)nanoparticles on perennial ryegrass(Lolium perenne L.)and pumpkin(Cucurbita mixta)plants[J]. Nanotoxicology, 2044, 5(1): 30-42. |
| [9] | Mushtaq Y K. Effect of nanoscale Fe3O4, TiO2 and carbon particles on cucumber seed germination[J]. Journal of Environmental Science and Health, 2011, 46(14): 1732-1735. DOI: 10.1080/10934529.2011.633403 |
| [10] | Michel Marc F, Ehm L, Antao S M, et al. The structure of ferrihydrite, a nanocrystalline material[J]. Science, 2007, 316(5832): 1726-1729. DOI: 10.1126/science.1142525 |
| [11] | Feizi H, Rezvani M P, Shahtahmassebi N, et al. Impact of bulk and nanosized titanium dioxide(TiO2)on wheat seed germination and seedling growth[J]. Biol Trace Elem Res, 2012, 146(1): 101-106. DOI: 10.1007/s12011-011-9222-7 |
| [12] |
黄玉梅, 张杨雪, 刘庆林, 等. 水杨酸对盐胁迫下百日草种子萌发及幼苗生理特性的影响[J].
草业学报, 2015, 24(7): 97-105.
Huang Y M, Zhang Y X, Liu Q L, et al. Effects of salicylic acid on seed germination and seedling physiological characteristics of Zinnia elegans under salt stress[J]. Acta Prataculturae Sinica, 2015, 24(7): 97-105. (in Chinese with English abstract) |
| [13] | Shankramma K, Yallappa S, Shivanna M B, et al. Fe2O3 magnetic nanoparticles to enhance S.lycopersicum(tomato)plant growth and their biomineralization[J]. Appl Nanosci, 2015, 6(7): 983-990. |
| [14] |
王学奎.
植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2006.
Wang X K. Principles and Techniques of Plant Physiology and Biochemistry Experiment[M]. Beijing: Higher Education Press, 2006. (in Chinese with English abstract) |
| [15] | Lin D H, Xing B S. Root uptake and phytotoxicity of ZnO nanoparticles[J]. Environ Sci Technol, 2008, 42(15): 5580-5585. DOI: 10.1021/es800422x |
| [16] | Calvo P, Friston K. Predicting green:really radical(plant)predictive processing[J]. J R Soc Interface, 2017, 14(131): 1-11. |
| [17] | Pottosin I, Zepeda-Jazo I, Bose J, et al. An anion conductance, the essential component of the hydroxyl-radical-induced ion current in plant roots[J]. Int J Mol Sci, 2018, 19(3): 897. DOI: 10.3390/ijms19030897 |
| [18] | Hiltscher H, Rudnik, Shaikhali J, et al. The radical induced cell death protein 1(RCD1) supports transcriptional activation of genes for chloroplast antioxidant enzymes[J]. Front Plant Sci, 2014, 5(475): 1-14. |
| [19] | Asai S, Yoshioka H. The role of radical burst via MAPK signaling in plant immunity[J]. Plant Signaling & Behavior, 2008, 3(11): 920-922. |
| [20] | Repka T, Hebbel R P. Hydroxyl radical formation by sickle erythrocyte membranes:role of pathologic iron deposits and cytoplasmic reducing agents[J]. Blood, 1991, 78(10): 2753-2758. |
| [21] | Bhattacharjee S, Chatterjee S, Jiang J J, et al. Detection and imaging of the free radical DNA in cells-site-specific radical formation induced by Fenton chemistry and its repair in cellular DNA as seen by electron spin resonance, immuno-spin trapping and confocal microscopy[J]. Nucleic Acids Res, 2012, 40(12): 5477-5486. DOI: 10.1093/nar/gks180 |
| [22] | Imam M U, Zhang S, Ma J, et al. Antioxidants mediate both iron homeostasis and oxidative stress[J]. Nutrients, 2017, 9(7): 671. DOI: 10.3390/nu9070671 |
| [23] | Wu L B, Ueda Y, Lai S K, et al. Shoot tolerance mechanisms to iron toxicity in rice(Oryza sativa L.)[J]. Plant Cell Environ, 2017, 40(4): 570-584. |
| [24] | Li J, Hu I, Ma C, et al. Uptake translocation and physiological effects of magnetic iron oxide(γ-Fe2O3)nanoparticles in corn(Zea mays L.)[J]. Chemosphere, 2016, 159: 326-334. DOI: 10.1016/j.chemosphere.2016.05.083 |
| [25] | Santos F C, Caixeta F, Clemente A C, et al. Gene expression of antioxidant enzymes and coffee seed quality during pre-and post-physiological maturity[J]. Gene Mol Res, 2014, 13(4): 10983-10993. DOI: 10.4238/2014.December.19.21 |
| [26] | Wang W B, Kim Y H, Lee H S, et al. Analysis of antioxidant enzyme activity during germination of alfalfa under salt and drought stresses[J]. Plant Physiol Bioch, 2009, 47(7): 570-577. DOI: 10.1016/j.plaphy.2009.02.009 |
| [27] | Volgger M, Lang I, Ovecka M, et al. Plasmolysis and cell wall deposition in wheat root hairs under osmotic stress[J]. Protoplasma, 2010, 243(1/2/3/4): 51-62. |
| [28] | Martínez-Fernández D, Barroso D, Komárek M. Root water transport of Helianthus annuus L. under iron oxide nanoparticle exposure[J]. Environ Sci Pollut R, 2016, 23(2): 1732-1741. DOI: 10.1007/s11356-015-5423-5 |
| [29] | Ren H X, Liu L, Liu C, et al. Physiological investigation of magnetic iron oxide nanoparticles towards Chinese mung bean[J]. J Biomed Nanotechno, 2011, 7(5): 677-684. DOI: 10.1166/jbn.2011.1338 |




