文章信息
- 崔梦杰, 王晨, 冷翔鹏, 吴伟民, 汤崴, 张文颖, 朱旭东, 贾海锋, 沈文飚, 房经贵
- CUI Mengjie, WANG Chen, LENG Xiangpeng, WU Weimin, TANG Wei, ZHANG Wenying, ZHU Xudong, JIA Haifeng, SHEN Wenbiao, FANG Jinggui
- 葡萄SBP-box转录因子家族的生物信息学分析及其应答激素调控葡萄果实成熟的作用
- Bioinformatic analysis of the SBP-box transcription factor and function of their regulation modes on berry ripening process by responding to hormones
- 南京农业大学学报, 2018, 41(3): 429-439
- Journal of Nanjing Agricultural University, 2018, 41(3): 429-439.
- http://dx.doi.org/10.7685/jnau.201706045
-
文章历史
- 收稿日期: 2017-06-29
2. 江苏省农业科学院, 江苏 南京 210014;
3. 南京农业大学生命科学学院, 江苏 南京 210095
2. Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China;
3. College of Life Sciences, Nanjing Agricultural University, Nanjing 210095, China
葡萄(Vitis vinifera L.)是世界四大水果之一, 其栽培面积和产量位居世界第二[1], 是我国主要栽培果树。葡萄果实发育与成熟是果树生长发育的重要阶段, 是果实品质形成的生物学基础。所以, 利用分子生物学手段改善和改良葡萄外在和内在品质应该是今后的重点发展趋势。SBP-box是植物特有的调控生长发育的重要转录因子家族, 它最早是从金鱼草(Antirrhinum majus)花序cDNA文库中筛选到的, 因其能够识别并结合到SQUAMOSA(SQ-UA)的启动子上而得名[2-3]。SPL(SQUAMOSA promoter-binding protein-like)是类似SBP-box的一类转录因子的总称。SPL基因编码了一个高度保守的SPL区, 该区域含有约80个氨基酸残基, 包括2个锌指结构和1个核定位信号, 2个锌指结构域Zn2+的顺序结合模式, Zn2+和核定位信号在蛋白与DNA结合过程中是必需的[4]。研究表明SBP-box转录因子在植物中广泛存在, 且在植物生长发育的多个方面起着重要作用[5-8]。据报道, SBP-box转录因子在植物花的形成及后期发育, 植物的育性, 营养生长向生殖生长的转型, 叶的形态建成, 环境信号应答等方面均发挥重要作用[7-8]。目前, 模式植物中已鉴定出大量的SBP-box家族成员, 但不同物种间家族成员的数量与功能存在重要差异, 且该类转录因子的研究主要集中在花器官形成与开花时间的发育调控方面。相比之下, 葡萄方面相关研究很少, 有关SBP-box调控葡萄果实成熟的研究更无报道。本研究对葡萄SBP-box基因进行系统分类并分析其在果实发育过程中的表达情况及其应答激素的模式, 旨在从转录因子角度认识葡萄果实成熟发育过程, 也为开展葡萄果实发育与成熟过程的分子调控提供一定的理论依据。
1 材料与方法 1.1 试验处理及指标测定试验于2016年5月31日—2016年9月4日在江苏省农博园葡萄园内进行。园区位于句容市, 属于亚热带季风气候, 年均气温15.4 ℃, 年降雨量1 150 mm。供试材料为5年生、欧亚种葡萄'魏可'(Muscat Bailey A×Rubel Muscat X), 株距为1.0 m, 行距为2.5 m, 双十字V型架, 避雨栽培。
选取生长势、负载量较为一致的'魏可'葡萄, 根据前人研究[9-11]和预试验结果, 用100 mg · L-1脱落酸(ABA)和200 mg · L-1萘乙酸(NAA)水溶液进行处理, 以清水处理作为对照。每个处理选定6株长势较为一致的植株, 每2株为1个重复, 共设3次重复。于果实转色前1周(7月28日)进行喷施果穗处理, 从上午08:00开始, 每小时喷施1次, 共喷施3次, 每次均喷施果穗至完全淋湿状态。
于葡萄幼果期(花后3 d, 5月31日)、第1次果实膨大期(花后13 d, 6月10日)、硬核期(花后37 d, 7月4日)、果皮褪绿期(花后47 d, 7月14日)、转色前1周(花后61 d, 7月28日)、转色初期(花后69 d, 8月5日)、转色中期(花后84 d, 8月20日)和完熟期(花后99 d, 9月4日)进行取样, 分别从对照与处理的植株中随机选择4果穗, 每穗上、中、下3个部位随机采取3个果粒。样品采集后立即投入液氮中速冻后带回实验室于-70 ℃冰箱中保存备用。
1.2 葡萄SBP-box基因在果实发育过程中的表达采用CTAB方法[12]提取葡萄果实8个发育时期样品, 以及ABA和NAA处理及对照果实样品的总RNA。cDNA的合成以提取的果实总RNA为模板, 参考Prime ScriptTM RT-PCR试剂盒(TaKaRa)说明书进行反转录。采用葡萄VvActin(登录号:XM_002273532)作为内参基因。从葡萄转录因子数据库(http://planttfdb.cbi.pku.edu.cn/index.php?sp=Vvi)下载葡萄的19个SBP-box家族成员的基因序列, 通过NCBI中Nucleotide Blast(https://blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM=blastn&PAGE_TYPE=BlastSearch&LINK_LOC=blasthome)找到每个基因对应的功能, 并对其编号为VvSBP1~19。根据定量PCR引物的设计原则, 利用Primer3 Input(http://primer3.ut.ee/), 对上述家族成员设计定量PCR引物(表 1)。按照SYBR Premix Ex TaqTM试剂盒(宝生物工程有限公司)操作指导, 采用实时荧光定量PCR(RT-qPCR)方法, 检测基因的相对表达量。扩增体系20 μL:1 μL cDNA, 上、下游引物各0.4 μL, 10 μL 2×TransStart® Tip Green qPCR SuperMix, 8.2 μL ddH2O。反应程序为:94 ℃ 30 s; 94 ℃ 5 s, 60 ℃ 15 s, 72 ℃ 10 s, 40个循环。试验3次重复。反应结束后分析荧光值变化曲线以及熔解曲线[13-14]。试验数据用ΔΔCT法[15]分析, 采用Excel 2013软件绘图。
| 基因名称Gene name | 引物对序列(5′→3′) Primer pairs sequence |
| VvSBP1-like1 | CCTTGCTGGGAAAGTCGAAC/TTGGGATGCACGTTGGAAAG |
| VvSBP1-like2 | CCTTGCTGGGAAAGTCGAAC/TTGGGATGCACGTTGGAAAG |
| VvSBP1-like3 | TGCACTGCTGATCTCACTGA/TCATTGTGTCCTGCCAAACG |
| VvSBP1-like4 | TGGGTTAGGGTTTGGAGAGG/GTGCCGCTTGTGGTATCTTT |
| VvSBP1-like5 | TGCTTGATGGTACTGTGGGT/ATCCCTACCAGCTGCAATGT |
| VvSBP2 | GCCAACAGTGTAGCAGGTTC/TGCTGCTTCCCACCATAGAA |
| VvSBP3-like1 | AGAGGTACCACAGAAGGCAC/CTTCTGCGCTGGTTATGTCC |
| VvSBP3-like2 | CCAAGTCTTCTACCACCCCA/CTTAAACAGCGCCCTACCAC |
| VvSBP6 | TGCTTCCCAGTAACCCAAGT/ACAATCAGCCAATCTCCCCA |
| VvSBP7-like1 | GAGGAGATTAGCAGGGCACA/AGTTCTGCTGAGGAAACCCA |
| VvSBP7-like2 | ATCATCGACGGCATAGGGTT/TTCCTTTTCAACCGTGCCTC |
| VvSBP8 | CCCGCTCATATTCACTCCCT/AATTCTCGCCGTGAAATCCG |
| VvSBP9 | CGGGTTGAAATTTGGGCAGA/TGACCGTTGGAGACTTCGAA |
| VvSBP10 | TTTGTCAACAGTGCAGCAGG/GGAGTTGCAACAGGGATTGG |
| VvSBP12 | TGGGTTGGCTGCTTCATAGA/ATGAAGGAGGCACATGTCCA |
| VvSBP13 | AAGGCTCGGGATTGTTACCA/GGTGGTCAGCTTGCAAGAAA |
| VvSBP14 | TGAGGGAAAGAGAAGCTGCA/TGTTCCCTTGTGTACGAGCT |
| VvSBP16 | AGCTTAGGAGGAGGACAGGA/CAGACTTTATGGCGACGGTG |
| VvSBP18 | TTCCTCGGACTGTGCTTTCT/CTGGACTGATTGGCATGCTC |
利用序列分析软件ClustalX 2[16]、DNAMAN 6[17]和在线软件WebLogo 3(http://weblogo.threeplusone.com/create.cgi)分析VvSBP基因保守序列。利用同样的方法从转录因子数据库中得到拟南芥和杨树SBP-box蛋白。利用进化树分析软件MEGA 4.1(https://mega.co.nz/) [18]对VvSBP进行亚组分类。葡萄SBP-box基因内含子、外显子和基因组定位均下载自葡萄功能基因组数据库(http://www.genoscope.cns.fr/cgi-bin/ggb/vitis/12X/gbrowse/vitis/)。葡萄SBP-box基因内含子和外显子结构利用在线软件Gene Structure Display Server(http://gsds.cbi.pku.edu.cn/)制作完成。
1.4 葡萄SBP-box基因家族成员启动子作用元件分析从葡萄转录因子数据库(http://planttfdb.cbi.pku.edu.cn/)下载SBP-box家族成员的基因编号, 再在Grape Genome Browser(http://www.genoscope.cns.fr/externe/GenomeBrowser/Vitis/)中, 寻找到每一个基因序列上游1 500 bp的片段, 即获得基因的启动子序列, 将其放入PlantCARE中(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/), 即可查找到每个基因的启动子所对应的作用元件, 从而预测每一个基因潜在的生物学功能。
1.5 数据处理对所有数据进行方差分析, 采用新复极差法进行显著性检验, 并采用Excel 2013软件绘图。
2 结果与分析 2.1 葡萄SBP-box转录因子家族成员序列分析通过转录因子数据库得到葡萄SBP-box基因, 已在转录因子数据库中注册的葡萄SBP-box基因有19个, 下载其编码区并获得基因登录号。根据基因登录号, 在葡萄基因组数据库获得其相关的蛋白序列, 详细信息见表 2。
| 基因名称 Gene name |
登录号 Accession No. |
染色体定位Chromosome localization | 开放阅读框/bp Opening reading frame |
氨基酸 Amino acid |
|
| 位置Location | 染色体Chromosome | ||||
| VvSBP1-like1 | GSVIVT01020050001 | 11 124 690~11 127 549 | 1 | 351 | 116 |
| VvSBP1-like2 | GSVIVT01020051001 | 11 080 253~11 083 113 | 1 | 348 | 115 |
| VvSBP1-like3 | GSVIVT01020578001 | 4 108 297~4 110 237 | 12 | 510 | 160 |
| VvSBP1-like4 | GSVIVT01021087001 | 1 346 397~1 348 752 | 10 | 423 | 140 |
| VvSBP1-like5 | GSVIVT01028208001 | 4 628 142~4 637 596 | 7 | 2 583 | 860 |
| VvSBP2 | GSVIVT01010496001 | 21 064 305~21 071 687 | 1 | 1 257 | 418 |
| VvSBP3-like1 | GSVIVT01003836001 | 20 536 349~20 537 931 | 4 | 624 | 207 |
| VvSBP3-like2 | GSVIVT01014302001 | 2 484 297~2 485 658 | 19 | 615 | 204 |
| VvSBP6 | GSVIVT01012247001 | 230 334~235 218 | 1 | 1 497 | 499 |
| VvSBP7-like1 | GSVIVT01018205001 | 13 245 041~13 249 262 | 15 | 1 215 | 404 |
| VvSBP7-like2 | GSVIVT01017835001 | 3 885 149~3 896 071 | 5 | 2 079 | 693 |
| VvSBP8 | GSVIVT01018204001 | 13 256 865~13 259 160 | 15 | 1 167 | 388 |
| VvSBP9 | GSVIVT01033519001 | 20 046 489~20 051 103 | 8 | 1 050 | 350 |
| VvSBP10 | GSVIVT01032239001 | 13 588 595~13 606 856 | 11 | 981 | 326 |
| VvSBP12 | GSVIVT01017678001 | 2 565 343~2 574 143 | 5 | 2 943 | 981 |
| VvSBP13 | GSVIVT01008556001 | 904 847~907 405 | 17 | 1 134 | 378 |
| VvSBP14 | GSVIVT01013452001 | 347 645~353 985 | 18 | 2 766 | 922 |
| VvSBP16 | GSVIVT01010522001 | 21 412 776~21 417 820 | 1 | 1 266 | 422 |
| VvSBP18 | GSVIVT01033064001 | 25 486 818~25 489 754 | 14 | 1 137 | 378 |
利用ClustalX 2、DNAMAN 6序列分析软件和在线软件WebLogo3对葡萄SBP-box保守结构域进行分析, 结果发现, 17个SBP-box基因的SBP-box保守结构域含有74个氨基酸序列, 且大部分成员具有较高保守性; VvSBP 1-like1和VvSBP1-like2不包含完整的SBP-box结构域, 其只含有完整结构域中的28个氨基酸, 缺少其他46个氨基酸(图 1和图 2)。在SBP-box保守结构域中, 氨基酸1~4(CQVE)、6(C)、9~10(DL)、13~14(AK)、16~24(YHRRHKVCE)、26~28(HSK)、32(V)、34(V)、36(G)、39(Q)、40~49(QRFCQQCSRFH)、51(L)、53~55(EFD)、53~69(EFDEGKRSCRRRLAGHN)、71~74(RRRK)多达61个位点具有较高的保守性(图 1和图 2)。

|
图 1 葡萄SBP-box蛋白家族的SBP-box保守结构域分析 Figure 1 Sequence analysis of the SBP-box conserved domain in grape SBP-box proteins |

|
图 2 葡萄SBP-box蛋白家族的SBP-box保守结构域序列标签 Figure 2 The conserved domain logo of the SBP-box in grape SBP-box proteins |
通过进化树分析软件MEGA 4.1对已知19个葡萄SBP-box、30个拟南芥SBP-box、杨树32个SBP-box蛋白结构域序列进行进化分析。基于进化树亚组的分类标准, 即根据进化树中成员的聚类分支, 若成员位于同一分支, 具有较近的亲缘关系, 即定义为同一个亚组; 从进化树分析结果可以看出, 葡萄SBP-box家族共分为3个亚组。VvSBP1-like1、VvSBP1-like2、VvSBP2、VvSBP3-like1、VvSBP6、VvSBP8、VvSBP10、VvSBP13、VvSBP16、VvSBP18属于第1亚组; VvSBP1-like3、VvSBP1-like4、VvSBP1-like5、VvSBP3-like2、VvSBP7-like1、VvSBP9、VvSBP12、VvSBP14属于第2亚组; VvSBP7-like2属于第3亚组(图 3)。
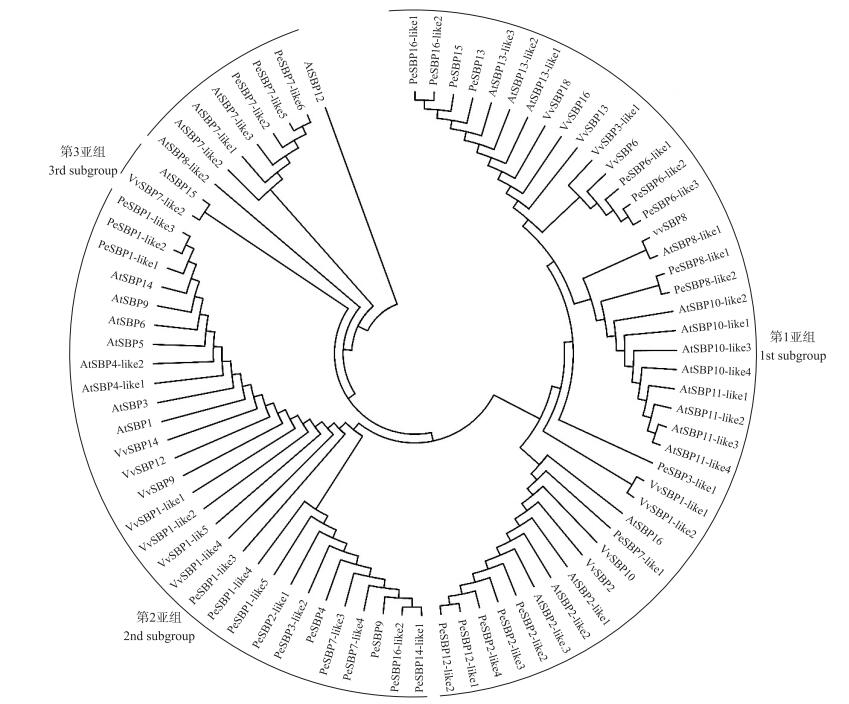
|
图 3 葡萄、拟南芥和杨树SBP-box保守域进化关系和亚组分类 Figure 3 Phylogenetic relationship and subgroup division of SBP-box conserved domain of grape, Arabidopsis thaliana and Populus euphratica |
通过葡萄功能基因组数据库下载SBP-box家族每个基因的编码区序列及基因组信息, 并利用在线软件Gene Structure Display Server(http://gsds.cbi.pku.edu.cn/)绘图。从图 4可以看出:葡萄SBP-box家族的外显子和内含子数量各异, 且结合图 3发现, 第2亚组中基因成员的外显子和内含子数量普遍多于第1和第3亚组。
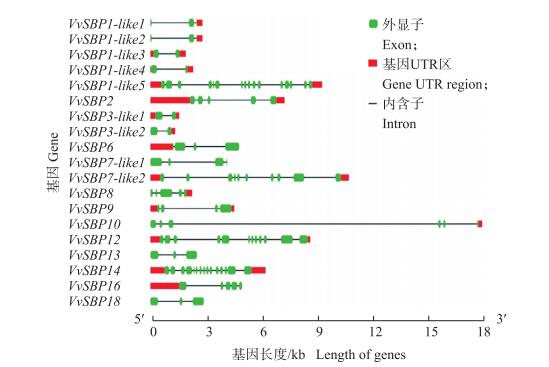
|
图 4 葡萄SBP-box基因内含子和外显子结构图 Figure 4 Intron-extron structures of grape SBP-box genes |
通过葡萄功能基因组数据库下载葡萄SBP-box相关染色体定位信息, 绘制染色体定位分布图。从图 5可以看出:葡萄SBP-box基因分布于葡萄13条染色体上, 呈不均匀分布。其中, 染色体1分布最多, 为5个; 其次是染色体5和15, 均分布2个; 染色体4、7、8、10、11、12、14、17、18和19均分布1个; 染色体2、3、6、9、13和16则没有分布。
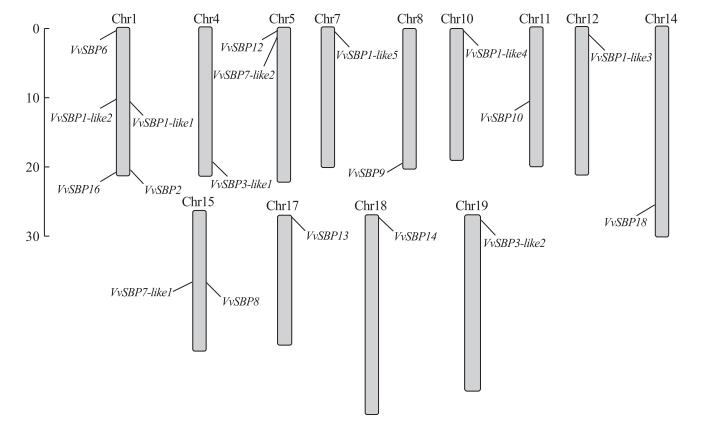
|
图 5 葡萄SBP-box基因染色体定位 Figure 5 Chromosome locations of grape SBP-box genes |
由表 3可见:SBP-box启动子元件可分为5个类型, 分别为光反应相关响应元件、激素相关的响应元件、胁迫相关响应元件、组织特异性响应元件、周期节律相关的元件。葡萄SBP-box基因家族中每一个成员均含有这5种作用元件类型, 其中光响应元件数量最多, 激素相关响应元件和胁迫相关响应元件的数量次之, 再次是组织特异性响应元件, 周期节律性相关元件数量最少, 甚至个别基因为0。不同转录因子不仅含有不同数量的激素相关响应元件, 如VvSBP 7-like1有14个, VvSBP 8和VvSBP18分别有2个, 而且元件的类型也存在一定差异, 如VvSBP2分别含有脱落酸类(如ABRE)、乙烯类(如ERE)、赤霉素类(如GARE)等作用元件, 而VvSBP 3-like2则含有乙烯类(如ERE)、生长素类(如TGA-box)、赤霉素类(如GARE、TATC)等作用元件, 且各类型作用元件的数量不同(图 6), 说明它们可能通过响应不同的激素信号, 在果实发育成熟过程起不同的调控作用。
| 基因名称 Gene name |
光响应元件 Light-relatedelements |
激素响应元件 Hormone-relatedelements |
胁迫响应元件 Stress-relatedelements |
组织特异性元件 Tissue specificelements |
周期节律相关元件 Circadian-relatedelements |
| VvSBP1-like1 | 11 | 7 | 10 | 5 | 2 |
| VvSBP1-like2 | 10 | 6 | 8 | 4 | 2 |
| VvSBP1-like3 | 18 | 7 | 8 | 4 | 0 |
| VvSBP1-like4 | 18 | 13 | 9 | 6 | 0 |
| VvSBP1-like5 | 16 | 6 | 7 | 3 | 0 |
| VvSBP2 | 13 | 3 | 5 | 2 | 2 |
| VvSBP3-like1 | 15 | 8 | 6 | 2 | 1 |
| VvSBP3-like2 | 19 | 10 | 8 | 4 | 1 |
| VvSBP6 | 21 | 11 | 0 | 6 | 2 |
| VvSBP7-like1 | 33 | 14 | 3 | 4 | 0 |
| VvSBP7-like2 | 27 | 9 | 4 | 8 | 3 |
| VvSBP8 | 19 | 2 | 3 | 1 | 1 |
| VvSBP9 | 11 | 5 | 7 | 5 | 1 |
| VvSBP10 | 16 | 8 | 6 | 2 | 0 |
| VvSBP12 | 14 | 7 | 7 | 9 | 0 |
| VvSBP13 | 24 | 4 | 9 | 3 | 0 |
| VvSBP14 | 20 | 7 | 6 | 7 | 3 |
| VvSBP16 | 29 | 5 | 14 | 8 | 1 |
| VvSBP18 | 14 | 2 | 6 | 3 | 3 |
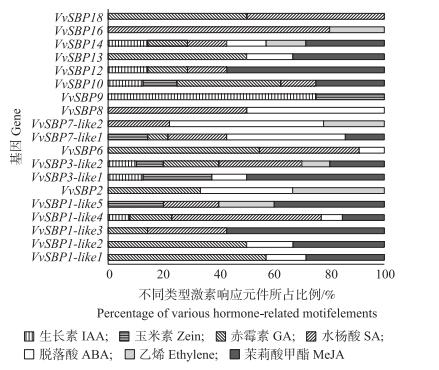
|
图 6 SBP-box基因家族不同成员激素相关启动子元件的功能分析 Figure 6 Functional analysis of hormone-related motif elements of SBP-box gene family members |
进一步分析SBP-box家族成员启动子激素响应元件的类型发现, 总共有7类元件, 这些元件可分为萘乙酸(NAA)、赤霉素(GA)、水杨酸(SA)、细胞分裂素(CTK)、脱落酸(ABA)、乙烯(Ethylene)和茉莉酸甲酯(MeJA), 其中前4类主要促进生长发育列为第1组, 而后3类主要促进转色成熟列为第2组。VvSBP 7-like2、VvSBP8和VvSBP16只含有第2组元件, 表明其可能在促进果实成熟方面的潜在作用较强, 正调控果实的成熟过程; 相比之下, VvSBP 1-like1和VvSBP9含有较多的第1组元件, 表明其可能起着抑制果实成熟而促进果实生长发育的作用。
2.6 SBP-box家族不同成员在葡萄果实发育不同时期的表达图谱 2.6.1 葡萄SBP-box家族基因在果实发育不同时期的表达葡萄SBP-box家族基因的RT-qPCR结果表明, 它们在果实发育不同时期的表达具有时空特异性(图 7), 所有的家族成员在果实发育的不同阶段均有一定的表达。综合分析其表达图谱可以归为4类:1)VvSBP 1-like4、VvSBP3-like2和VvSBP9在果实膨大期具有表达高峰; 2)VvSBP 7-like1、VvSBP7-like2、VvSBP12、VvSBP13和VvSBP14在第2次果实膨大期和转色中期具有表达高峰; 3)VvSBP 2、VvSBP3-like1、VvSBP8和VvSBP18 只在果实转色中期高表达; 4)VvSBP 1-like1、VvSBP1-like2、VvSBP6和VvSBP10在幼果中高表达, 硬核期表达出现低谷, 之后随着果实的发育及成熟, 表达量逐渐升高, 但在果实完熟期表达量骤降。与上述4种表达模式不同, VvSBP 16在果实转色前, 其表达量逐渐降低, 果实转色前1周, 出现表达量低谷, 之后表达量骤然升高, 完熟期降至最低; VvSBP 1-like3只在果实生长发育前期具有较高的表达, 其余时期的表达量均很低; VvSBP1-like5在整个果实发育期, 表达量呈现递减的趋势。SBP-box家族基因的差异表达图谱表明, 不同成员在葡萄果实发育成熟过程中起不同的调控作用, 个别基因在果实的特定发育时期具有组织特异性的调控作用。
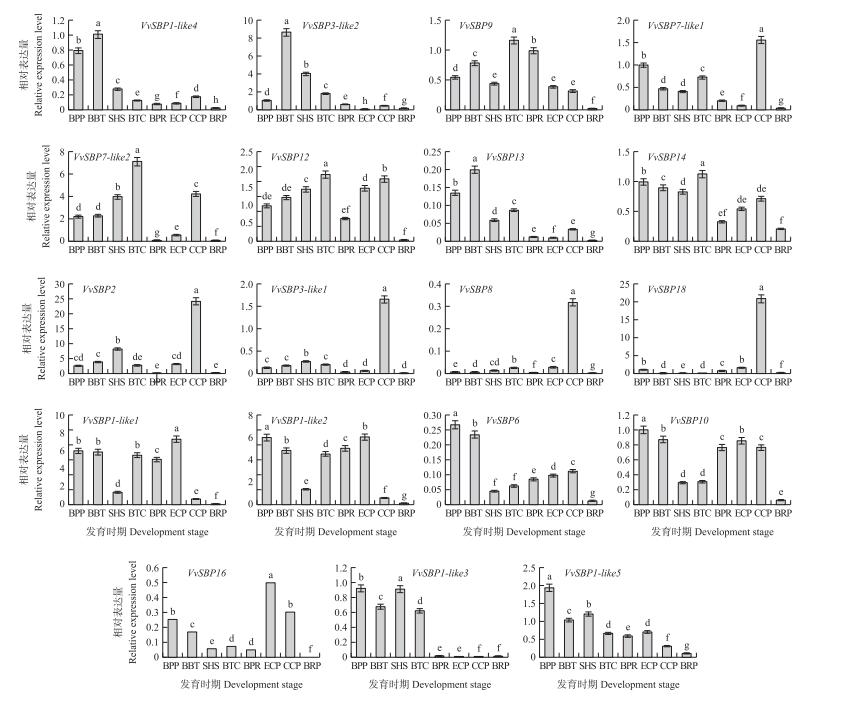
|
图 7 19个SBP-box家族不同成员基因在'魏可'葡萄果实8个典型生长时期的表达模式 Figure 7 Expression modes of 19 SBP-box family members genes during'Wink'eight typical developments stages 1)BPP:幼果期, 花后3 d; BBT:第1次果实膨大期, 花后13 d; SHS:硬核期, 花后37 d; BTC:果皮褪绿期, 花后47 d; BPR:转色前1周, 花后61 d; ECP:转色初期, 花后69 d; CCP:转色中期, 花后84 d; BRP:完熟期, 花后99 d。2)不同小写字母表示在0.05水平差异显著。下同。 1)BPP:Berry pea size period/young berry, 3 days after anthesis; BBT:Stage of the first enlargement of berry, 13 days after an athesis; SHS:Stone hardening stage/small hard, 37 days after anthesis; BTC:Berry touch complete/peel green fading stage, 47 days after anthesis; BPR:Initial period of ripening/one week before veraison, 61 days after anthesis; ECP:Early color-change period, 69 days after anthesis; CCP:Mid color-change period, 84 days after anthesis; BRP:Berry ripening period, 99 days after anthesis. 2)Values followed by different small letters are significantly different at 0.05 level. The same as follows. |
在果实转色前1周利用ABA或NAA处理葡萄果穗, 结果发现NAA处理葡萄果实后, 果实转色进程慢于对照组, 而ABA处理促进果实转色和成熟。由图 8可见:果实经过ABA和NAA处理后, 所有的SBP-box转录因子成员的表达量与对照相比均有较大的差异。ABA在果实转色初期促进了SBP-box家族中VvSBP 1-like1、VvSBP3-like1、VvSBP6、VvSBP13和VvSBP16的表达, 在果实转色中期促进了SBP-box家族中VvSBP 7-like1、VvSBP7-like2、VvSBP12和VvSBP14的表达, 而NAA则分别在相应时期抑制了这些基因的表达; 此外, NAA在果实转色初期, 促进了SBP-box家族中VvSBP 1-like2和VvSBP9的表达, 在果实转色中期, 促进了SBP-box家族中VvSBP 1-like3、VvSBP1-like5、VvSBP3-like2、VvSBP10和VvSBP18的表达, 而ABA则抑制这些基因的表达。结合ABA、NAA对葡萄果实的生理作用, 可推测SBP-box家族大部分成员可能参与调控葡萄果实的转色与成熟。
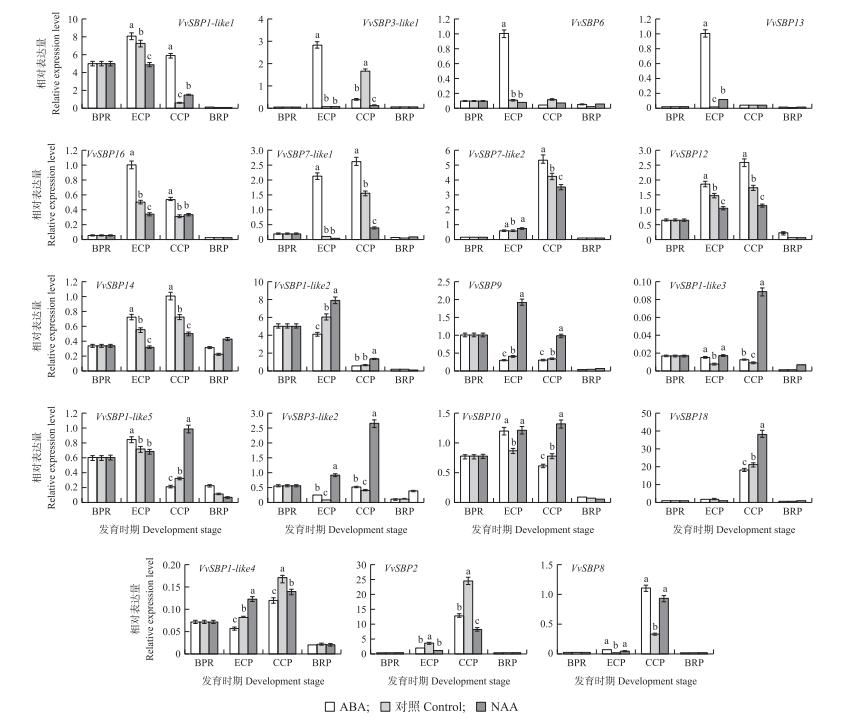
|
图 8 ABA和NAA处理'魏可'葡萄果实SBP-box家族不同成员基因的表达 Figure 8 Expression level of SBP-box family members genes after the treatment of ABA and NAA |
SBP-box是植物特有的一类转录因子, 广泛存在于植物中, 并在植物生长发育的多个方面起着非常重要的调控作用, 除了调控花器官的发育、植物育性、叶形态建成等, 还参与调节果实的发育与成熟过程, 并且同一家族中不同成员之间的功能存在差异[19-21]。
随着不同物种全基因组测序的相继完成, 转录因子数据库(http://planttfdb.cbi.pku.edu.cn/)中, 在拟南芥中发现30个SBP-box基因, 杨树中发现32个SBP-box基因, 水稻中发现29个SBP-box基因, 大豆中发现111个SBP-box基因, 苹果中发现42个SBP-box基因[22], 葡萄发现的SBP-box基因相对较少, 远低于上述5种物种, 且这些SBP-box基因均含有SPL保守结构域。本研究在进化树分析中, 加入拟南芥和杨树SBP-box基因对VvSBP进行系统鉴定并分类, 说明不同物种间SPL结构域保守性较高。
迄今为止, 对已知葡萄SBP-box基因参与果实发育成熟的研究很少。因此, 本文结合VvSBP的基因组基本信息、保守结构域、进化关系、内含子与外显子、染色体定位等信息对VvSBP参与葡萄果实发育与成熟进行了详细分析, 结果显示, 葡萄转录因子SBP-box家族成员在果实的生长发育与成熟的特定时期起着重要的调控作用。葡萄转录因与SPB-box中有9个成员(VvSBP 1-like1、VvSBP3-like1、VvSBP6、VvSBP7-like1、VvSBP7-like2、VvSBP12、VvSBP13、VvSBP14和VvSBP16), 多属于第1亚组和第3亚组, 在果实转色特定时期可能对葡萄果实的转色与成熟起促进作用; SBP-box家族中7个成员(VvSBP 1-like2、VvSBP1-like3、VvSBP1-like5、VvSBP3-like2、VvSBP9、VvSBP10和VvSBP18), 多属于第2亚组, 可能在果实转色特定时期抑制果实的转色与成熟。该研究为进一步探讨已知葡萄SBP-box基因在植物果实发育过程中相关功能的了解奠定了基础。
| [1] |
王发明. 我国鲜食葡萄生产现与发展趋势[J].
西北园艺, 2003(8): 7-8.
Wang F M. Production status and development trend of fresh grape in China[J]. Northwest Horticulture, 2003(8): 7-8. (in Chinese with English abstract) |
| [2] | Huijser P, Klein J, Lönnig W E, et al. Bracteomania, an inflorescence anomaly, is caused by the loss of function of the MADS-box gene squamosa in Antirrhinum majus[J]. EMBO Journal, 1992, 11: 1239-1249. |
| [3] | Klein J, Saedler H, Huijser P. A new family of DNA binding proteins includes putative transcriptional regulators of the Antirrhinum majus floral meristem identity gene SQUAMOSA[J]. Molecular and General Genetics, 1996, 250: 7-16. |
| [4] | Birkenbihl R P, Jach G, Saedler H, et al. Functional dissection of the plant-specific SBP-domain:overlap of the DNA-binding and nuclear localization domains[J]. Journal of Molecular Biology, 2005, 352: 585-596. DOI: 10.1016/j.jmb.2005.07.013 |
| [5] | Wang J W, Czech B, Weigel D. miR156-regulated SPL transcription factors define an endogenous flowering pathway in Arabidopsis thaliana[J]. Cell, 2009, 138(4): 738-749. DOI: 10.1016/j.cell.2009.06.014 |
| [6] | Wang Y, Hu Z L, Yang Y X, et al. Bioinformatics analysis of SBP-box gene family in rice[J]. China Journal of Bioinformatics, 2011, 9(1): 82-71. |
| [7] | Shikata M, Koyama T, Mitsuda N, et al. Arabidopsis SBP-box genes SPL10, SPL11 and SPL2 control morphological change in association with shoot maturation in the reproductive phase[J]. Plant & Cell Physiology, 2009, 50(12): 2133-2145. |
| [8] | Gandikota M, Bitkenbihl R P, Hohmann S, et al. The miRNA156/157 recognition element in the 3'UTR of the Arabidopsis SBP box gene SPL3 prevents early flowering by translational inhibition in seedlings[J]. Plant Journal, 2007, 49: 683-693. DOI: 10.1111/j.1365-313X.2006.02983.x |
| [9] |
晁无疾, 陆家云. 脱落酸(ABA)对葡萄上色和果实品质的影响[J].
中外葡萄与葡萄酒, 2008(5): 285-287.
Chao W J, Lu J Y. Effects of abscisic acid(ABA)on grape color and fruit quality[J]. Sino-Overseas Grapevine and Wine, 2008(5): 285-287. (in Chinese with English abstract) |
| [10] |
王延书. 葡萄果实着色前后ABA代谢合成关键酶的基因表达分析[D]. 泰安: 山东农业大学, 2011.
Wang Y S. Transcriptional analysis of key enzymes for ABA metabolism and biosynthesis around the veraison of grape berry ripening[D]. Tai'an: Shandong Agricultural University, 2011(in Chinese with English abstract). |
| [11] |
周莉, 王军. NAA和ABA处理对'京优'葡萄花色苷生物合成相关基因表达的影响[J].
中国农业大学学报, 2011, 16(4): 30-37.
Zhou L, Wang J. Effects of NAA and ABA treatments on the expression of anthocyanin biosynthetic genes in 'Jingyou' grape berry skin[J]. Journal of China Agricultural University, 2011, 16(4): 30-37. (in Chinese with English abstract) |
| [12] |
张彦苹, 王晨, 于华平, 等. 适于葡萄不同组织RNA提取方法的筛选[J].
西北农业学报, 2010, 19(11): 135-140.
Zhang Y P, Wang C, Yu H P, et al. Screening of RNA extraction methods for various grapevine organs and tissues[J]. Agriculturae Boreali-Occidentalis Sinica, 2010, 19(11): 135-140. DOI: 10.3969/j.issn.1004-1389.2010.11.027 (in Chinese with English abstract) |
| [13] | Matsui K, Tanaka H, Ohme-Takagi M. Suppression of the biosynthesis of proanthocyanidin in Arabidopsis by a chimeric PAP1 repressor[J]. Plant Biotechnology Journal, 2004, 2(6): 487-493. DOI: 10.1111/pbi.2004.2.issue-6 |
| [14] |
吴蓓, 李梦瑶, 王广龙, 等. 芹菜肉桂酰辅酶A还原酶基因的克隆与表达分析[J].
南京农业大学学报, 2016, 39(6): 907-914.
Wu B, Li M Y, Wang G L, et al. Cloning and the expression profiles analysis of an AgCCR gene encoding cinnamoyl-CoA reductase from different cultivars of Apium graveolens[J]. Journal of Nanjing Agricultural University, 2016, 39(6): 907-914. DOI: 10.7685/jnau.201603028 (in Chinese with English abstract) |
| [15] | Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25: 402-408. DOI: 10.1006/meth.2001.1262 |
| [16] |
贾海锋, 刘众杰, 赵鹏程, 等. 转录因子ABI4调控草莓果实成熟的分子机制[J].
南京农业大学学报, 2015, 38(6): 908-914.
Jia H F, Liu Z J, Zhao P C, et al. The molecular mechanism of transcription factors ABI4 in regulation of strawberry fruit ripening[J]. Journal of Nanjing Agricultural University, 2015, 38(6): 908-914. DOI: 10.7685/j.issn.1000-2030.2015.06.006 (in Chinese with English abstract) |
| [17] | Zhu X, Leng X, Sun X, et al. Discovery of conservation and diversification of miR171 genes by phylogenetic analysis based on global genomes[J]. The Plant Genome, 2015, 8(2): 1-11. |
| [18] | Tamura K, Dudley J, Nei M, et al. MEGA4:molecular evolutionary genetics analysis(MEGA)software version 4.0[J]. Molecular Biology and Evolution, 2007, 24(8): 1596-1599. DOI: 10.1093/molbev/msm092 |
| [19] |
曹雪, 王晨, 房经贵, 等. 葡萄SPL9和SPL10基因全长cDNA克隆、亚细胞定位和表达分析[J].
园艺学报, 2011, 38(2): 240-250.
Cao X, Wang C, Fang J G, et al. Cloning, subcellular localization and expression analysis of SPL9 and SPL10 genes from grapevine[J]. Acta Horticulturae Sinica, 2011, 38(2): 240-250. (in Chinese with English abstract) |
| [20] | Kandori A, Miyashita T, Ogata K, et al. A naturally occurring epigenetic mutation in a gene encoding an SBP-box transcription factor inhibits tomato fruit ripening[J]. Nature Genetics, 2006, 38(8): 948-952. DOI: 10.1038/ng1841 |
| [21] | Chen W, Kong J, Lai T, et al. Tuning LeSPL-CNR expression by SlymiR157 affects tomato fruit ripening[J]. Scientific Reports, 2015, 5: 7852. DOI: 10.1038/srep07852 |
| [22] | Yamasaki K, Kigawa T, Inoue M, et al. A novel zinc-binding motif revealed by solution structures of DNA-binding domains of Arabidopsis, SBP-family transcription factors[J]. Journal of Molecular Biology, 2004, 337(1): 49-63. DOI: 10.1016/j.jmb.2004.01.015 |




