文章信息
- 石利朝, 曾爱松, 李家仪, 王金香, 宋立晓, 严继勇
- SHI Lichao, ZENG Aisong, LI Jiayi, WANG Jinxiang, SONG Lixiao, YAN Jiyong
- 牛心甘蓝蜡粉缺失突变体410M特征的研究
- Studies on characteristics of a heart-shaped glossy cabbage mutants 410M
- 南京农业大学学报, 2018, 41(1): 57-63
- Journal of Nanjing Agricultural University, 2018, 41(1): 57-63.
- http://dx.doi.org/10.7685/jnau.201705001
-
文章历史
- 收稿日期: 2017-05-02
2. 江苏省农业科学院蔬菜研究所/江苏省高效园艺作物遗传改良重点实验室, 江苏 南京 210014;
3. 中国农业大学生物学院, 北京 100083
2. Institute of Vegetable Crops, Jiangsu Academy of Agricultural Sciences/Jiangsu Key Laboratory for Horticultural Crop Genetic Improvement, Nanjing 210014, China;
3. College of Biological Sciences, China Agricultural University, Beijing 100083, China
结球甘蓝(Brassica oleraca L. var. capitata)简称甘蓝, 是十字花科芸薹属甘蓝种中的一个变种。其叶色绿至深绿, 外叶及外层球叶表面均有一层蜡粉覆盖。蜡粉的主要作用是减少非气孔的水分散失, 降低水分消耗[1], 保护植物抵御过量紫外线辐射、低温冻伤等逆境[2-3], 还可有效抵御细菌和真菌病原体的入侵, 防止食草昆虫的侵害等[4-5]。同时, 甘蓝植株表面的蜡粉多少还是决定商品品质的一个重要指标。蜡粉少的甘蓝叶色亮绿, 感官好, 品质优良, 受到消费者欢迎。亮叶甘蓝由普通甘蓝突变而来, 体表无或有少量蜡粉覆盖, 叶色亮绿, 品质优良, 对于丰富甘蓝种质资源、培育优质甘蓝新品种具有重要的意义[6]。关于无蜡粉缺失突变体甘蓝的相关研究, 在国内、外仅有少量报道[6-8], 而且发现的均是圆球和扁球型突变体。
在我国长江流域及以南地区, 牛心(尖球)类型甘蓝一直是大家喜欢种植和消费的品种类型。牛心甘蓝普遍存在蜡粉较多、球色不够绿的问题。为了提高特色新品种的竞争优势, 牛心甘蓝叶色的改良成为育种工作者的一个重要课题。2013年, 在优良牛心型纯合材料410W的群体中, 发现了其蜡粉缺失突变体410M。前人的研究结果表明, 芸薹属植物突变体缺失蜡粉性状遗传规律较为复杂, 不同突变体之间差异较大, 且由不同的基因控制。因此, 本文对首次发现的牛心类型甘蓝突变体410M的特征、主要营养物质含量、蜡粉结构、遗传规律进行研究, 并且对拟南芥中参与蜡粉合成、转运的基因在410M和410W中进行了表达水平分析, 以期明确该甘蓝蜡粉缺失突变体的特征特性及其在育种中的实际应用价值, 为丰富甘蓝种质资源、新品种创制和改良提供理论依据。
1 材料与方法 1.1 材料供试甘蓝野生型材料410W及其蜡粉缺失突变体410M由江苏省农业科学院蔬菜研究所叶菜类蔬菜研究室提供。供试材料分别于2015年7月和2016年7月中旬播种, 8月中旬定植于江苏省农业科学院六合实验基地, 8至12月进行田间取样和田间性状调查; 12月上旬每份材料各选取4株移栽于大棚, 翌年3至5月进行授粉留种。
1.2 农艺性状观察于叶球成熟期对熟性、叶色、株高、开展度、外叶数、球形、单球质量、球径、中心柱等农艺性状按常规方法进行调查。
1.3 营养品质测定于叶球成熟期, 分别选取大小相近、成熟度一致、无病害、无创伤的球叶和外叶, 对其主要营养成分维生素C、粗纤维、总糖、干物质含量按常规方法进行测定。每重复取3株叶球及相应外叶, 3次重复。
1.4 蜡粉的扫描电镜观察于叶球成熟期, 取各材料的外叶, 避开叶脉用直径10 mm打孔器进行取样, 然后将样品置于50 ℃烘箱中干燥12 h。烘干后, 用银胶固定在样品台上, 喷金, 置于扫描电子显微镜下观察。
1.5 RNA的提取及实时荧光定量PCR(RT-qPCR)测定于叶球成熟期, 取各材料的外叶, 采用Trizol试剂盒(北京百泰克生物技术有限公司)分别提取野生型和突变体材料总RNA, 提取方法参照试剂盒说明书。按照RT-qPCR要求将RNA反转录成cDNA, 根据中国农业科学院网站(http://ocri-enomics.org/bolbase/components.htm)公布的甘蓝基因序列, 利用拟南芥各个基因序列进行比对, 选择同源性较高的保守序列, 使用Primer Premier 5.0软件设计RT-qPCR引物(表 1), 以甘蓝的actin基因作为内参基因。所用染料为SYBR(TaKaRa), 配制20 μL的体系:SYBR Premix Ex Taq(2×)10 μL、正向引物(10 μmol·L-1)0.8 μL、反向引物(10 μmol·L-1)0.8 μL、模板(cDNA)1 μL, 加ddH2O至20 μL。采用两步法荧光定量PCR进行扩增。扩增程序:95 ℃ 30 s, 循环1次; 95 ℃ 5 s, 60 ℃ 20 s, 循环40次, 72 ℃单点检测信号。熔解程序:95 ℃ 0 s, 65 ℃ 15 s, 95 ℃ 0 s, 连续检测信号。每个样品重复3次。采用2-ΔΔCT法对数据进行相对定量分析。
| 基因 Gene |
甘蓝基因组序列编号 Cabbage genome accession No. |
拟南芥中蛋白家族名称 Protein family name in Arabidopsis |
引物对序列(5′→3′) Primer pairs sequence |
| BolECR10 | Bol044348 | 反式烯脂酰-CoA还原酶 trans-2, 3-enoyl-coenzyme A reductase |
AGTGGCTCTGGAGGGTATCA/ GCGATGTTGAACCCTAGCCA |
| BolFATB | Bol021081 | 酰基ACP硫酯酶 Fatty acyl-ACP thioesterase B |
ACTGGAGAAATTTTAACAAGAGCA/ CTCGGCAAGGATAGGGTCAG |
| BolKCR1 | Bol010474 | β-酮酰-CoA还原酶 β-ketoacyl-coenzyme A reductase |
AACAACGCTGGGGTTTCGTA/ CCAACACAGCCTGAGTAACCT |
| BolCER2 | Bol037661 | BAHD酰基转移酶 BAHD acyltransferase |
AAGTCGAAGGGTTCACGGTC/ GGCCCAACTTAGCCCTACTG |
| BolLCAS1 | Bol002590 | 长链酰基-CoA合成酶 Long chain acyl-CoA synthetase |
AAGGGCTTCTTGAGCCAGAC/ TAGGCGGGGTAGTCTCTTCC |
| BolKCS1 | Bol018447 | β-酮酰-CoA合成酶 β-ketoacyl-coenzyme A synthase |
CCGTTATACGAATCCGGCGA/ GGAGAAGGTCTCGAACGTCA |
| BolACBP1 | Bol017188 | 酰基-CoA结合蛋白 Acyl-CoA binding protein |
TGGTATCACCTCGCTCAGTCT/ TGCGGTGGTAGTCGTTCTCC |
| BolGNL1 | Bol012162 | 囊泡转运 Vesicle trafficking |
TGGAGGAGACGAAGCCATTAT/ TTGCAGAGACTCAGCTTGGA |
| BolCER5 | Bol031593 | ABC转运器 ABC transporter |
ATGGAGTTGGACAGTGCGAG/ AGTCCATCGAGCAACCTTCG |
| BolLTPG1 | Bol002099 | GPI锚定脂质转移蛋白 GPI-anchored lipid transfer protein |
CAACTTCCAACGGCTTGTCAG/ CCGGTGTTATTGTTGTGGCA |
| BolMYB30 | Bol032289 | R2R3类MYB转录因子 R2R3-type MYB |
GGAAGATGGAGCACTGTTGC/ CCGGGATCTTTTGTTACCCCA |
| BolDEWAX | Bol007787 | AP2-ERF类基因 AP2-ERF-type gene |
TGCAAGCCAAGATCACCACC/ AGAGACCGGAACGGATAGGT |
| BolDCL4 | Bol035827 | TCGGCATTCAGTTCTGGAGT/ CGCCAACTTTAGTGGCAACC |
|
| BolHUB1 | Bol030141 | TGGTTCTAGCAGTGGGTCTG/ CGAGCAGATACTGGATGAGGA |
所得数据采用SAS 8.1软件进行差异显著性分析, 在0.05水平上进行邓肯氏多重比较。
2 结果与分析 2.1 突变体410M与野生型410W的特征特性由图 1可见:突变体410M与野生型410W表型相比, 除了蜡粉缺失性状外, 其他表型均无明显差异。对2个材料整个生育期的特征特性进行观察发现, 从苗期、营养生长结球期至生殖生长期, 其蜡粉缺失性状均保持稳定; 而且, 突变体410M连续自交2代后, 未出现蜡粉性状分离现象, 说明其蜡粉缺失性状为纯合性状。对2个材料营养生长结球成熟期的农艺性状调查结果显示, 突变体410M与野生型410W成熟期(定植到叶球成熟的时间)均为65 d左右, 株高、开展度、外叶数、球形、单球质量、球径、中心柱长等农艺性状指标均无显著差异(表 2)。410W球叶和外叶的维生素C含量分别为0.48和0.68 mg·g-1, 而410M球叶和外叶的维生素C含量分别为0.54和0.78 mg·g-1, 410M维生素C含量较410W有显著提高。而在粗蛋白、粗纤维、总糖、干物质成分含量方面, 二者无明显差异(表 3)。

|
图 1 野生型410W和突变体410M表型 Figure 1 Phenotypic characterization of wild type 410W and mutant 410M A.幼苗期; B.结球期; C.生殖生长期花序。 A.Seedling stage; B.Heading stage; C.Inflorescences at reproductive growth stage. |
| 材料 Material |
株高/cm Plant height |
开展度/cm Plant breadth |
外叶数 Outer leaf No. |
球形 Head shape |
叶色 Leaf color |
单球质量/kg Head weight |
叶球纵径/cm Head length |
叶球横径/cm Head width |
中心柱长/cm Core length |
中心柱长/球高 Core length/ head height |
| 410W | 28.83±1.24a | 44.87±1.20a | 9±0.50a | 尖 Heart-shaped |
绿 Green |
0.52±0.02a | 20.11±1.43a | 12.68±1.24a | 9.03±0.46a | 0.45±0.01a |
| 410M | 28.12±1.45a | 43.50±0.48a | 9±0.50a | 尖 Heart-shaped |
亮绿 Glossy-green |
0.53±0.02a | 20.06±0.46a | 12.56±0.30a | 9.02±0.38a | 0.45±0.02a |
| 注:同列数据后不同小写字母表示差异显著(P < 0.05)。下同。 Note:The data within a column followed by different small letters indicate significant difference at 0.05 level. The same as follows. |
||||||||||
| mg·g-1 | ||||||
| 叶片 Leaf |
材料 Material |
维生素C Vitamin C |
粗蛋白 Crude protein |
粗纤维 Crude fiber |
总糖 Total sugar |
干物质 Dry matter |
| 球叶Head leaf | 410W | 0.48±0.03d | 14.7±0.12b | 5.9±0.07b | 39.5±0.18a | 81.2±0.24b |
| 410M | 0.54±0.02c | 14.6±0.07b | 5.4±0.08b | 40.2±0.11a | 80.1±0.36b | |
| 外叶Outer leaf | 410W | 0.68±0.01b | 17.6±0.10a | 8.7±0.05a | 28.6±0.08b | 105.6±0.92a |
| 410M | 0.75±0.05a | 18.8±0.08a | 8.4±0.04a | 29.4±0.24b | 99.2±0.38a | |
扫描电镜观察(图 2)表明, 野生型和突变体蜡粉覆盖度差异显著, 与牟香丽等[7]、唐俊等[8]的研究结果一致。在500倍视野下, 野生型甘蓝叶片背面、腹面均覆盖有较多的蜡粉, 且分布致密; 在5 000倍视野下, 可观察到其蜡粉结构为片状和线状。而突变体叶面光滑, 叶背面和腹面均几乎无蜡粉覆盖, 只有零星颗粒状结构。
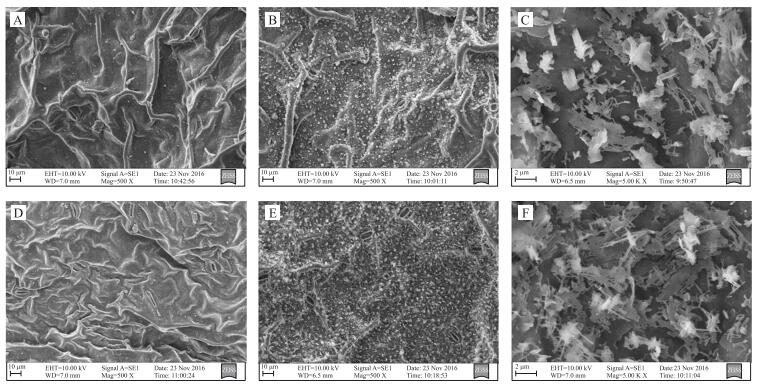
|
图 2 野生型和突变体叶片腹面和背面微观结构观察 Figure 2 Microstrure observation of leaf blade ventral and leaf blade abaxial of wild-type and mutant A.突变体叶片腹面(×500);B.野生型叶片腹面(×500);C.野生型叶片腹面(×5 000);D.突变体叶片背面(×500);E.野生型叶片背面(×500);F.野生型叶片背面(×5 000)。 A. Leaf ventral surface of mutant(×500);B. Leaf ventral surface of wild type(×500);C. Leaf ventral surface of wild type(×5 000);D. Leaf abxial surface of mutant(×500);E. Leaf abxial surface of wild type(×500);F. Leaf abxial surface of wild type(×5 000). |
以410M和410W为亲本构建6世代群体, 正交与反交F1群体192株单株全部表现为叶面有蜡粉; F2群体有蜡粉的植株532株, 蜡粉缺失的植株155株, 分离比例为3.43 : 1, 经χ2测验符合3 : 1(χ2=1.957 < χ0.052=3.841)的分离比例; 以有蜡粉的410W为回交亲本获得的回交群体中, 208株单株全部表现为叶面有蜡粉; 而与蜡粉缺失亲本410M回交获得的回交群体中, 有蜡粉的植株158株, 蜡粉缺失的植株136株, 分离比例为1.16 : 1, 经χ2测验符合1 : 1(χ2=1.500 < χ0.052=3.841)的分离比例(表 4)。表明410M的蜡粉缺失性状由隐性单基因控制。
| 世代 Generations |
总株数 No. of plants |
有蜡粉单株数 No. of wax plants |
无蜡粉亮绿单株数 No. of glossy plants |
有蜡粉:无蜡粉亮绿 Wax plants:glossy plants |
χ2 | χ0.052 |
| P1(410W) | 100 | 100 | 0 | |||
| P2(410M) | 94 | 0 | 94 | |||
| F1(410W×410M) | 100 | 100 | 0 | |||
| F1(410M×410W) | 92 | 92 | 0 | |||
| F2 | 687 | 532 | 155 | 3.43:1 | 1.957 | 3.841 |
| BC1P1 | 208 | 208 | 0 | |||
| BC1P2 | 294 | 158 | 136 | 1.16:1 | 1.500 | 3.841 |
筛选出14个在拟南芥中参与蜡粉合成、转运的基因, 对其在野生型和突变体中的表达进行实时荧光定量分析。其中ECR10、FATB、KCR1、CER2、LCAS1和KCS1为参与表皮蜡质生物合成的基因, ACBP1、GNL1、CER5、LTPG1为参与蜡质传输的基因, MYB30、DEWAX、DCL4、HUB1为参与蜡质合成和传输的调控基因。在这14个基因中, 410M中CER2、LCAS1、ACBP1、CER5、HUB1的表达高于其野生型, KCR1、LTPG1在2个材料中表达差异不显著, 其余7个基因均为410W高于410M, 而且均差异显著。
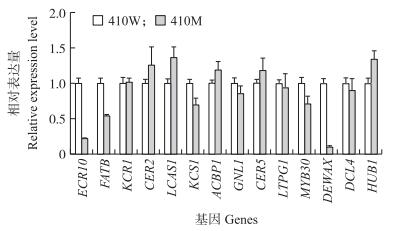
|
图 3 410W和410M相关蜡质合成、转运基因的表达模式分析 Figure 3 Expression pattern comparison of genes involved in wax formation and transport of 410W and 410M |
扁球类型和圆球类型的蜡粉缺失突变体均有报道[6-8], 牛心类型的蜡粉缺失突变体为首次报道。前人研究表明, 蜡粉缺失突变体营养生长期生长滞后, 生长势小于野生型; 而且, 蜡粉缺失材料结种能力减弱, 不易结籽。但本研究中的牛心突变体410M, 在营养生长期与生殖生长期, 除了蜡粉缺失性状外, 在生长势和结种能力方面与野生型均无明显差异, 表明蜡粉缺失对植株生长发育方面产生的影响大小与不同突变体材料有关。在品质测定中, 突变体410M球叶和外叶的维生素C含量高于野生型。研究表明大部分植物中的AsA(维生素C)含量与抗逆性呈正相关, 可通过提高AsA含量或促进氧化态的AsA还原来提高植物的抗逆性[9]。植物表面覆盖的蜡粉可抵御外界逆境、病虫害等伤害, 而蜡粉的缺失使得植物对外部各种逆境承受力减弱, 猜测植物会应激性调动自身的防御系统, 比如提高AsA含量来增强对逆境的抵御。至于蜡粉缺失是否与甘蓝AsA含量的变化之间存在某种相关性, 还需进一步深入研究。
国内外关于芸薹属蜡粉缺失性状的研究多有报道。芸薹属作物的蜡粉缺失性状遗传规律较为复杂, 不同突变体之间存在多样性, 且由不同的基因控制, 其中大多数突变体蜡粉缺失性状受单个基因控制, 其中以单基因隐性遗传最为常见[10-11], 显性遗传和不完全显性遗传较少[12-13]; 少数突变体受双基因控制[14]。在甘蓝蜡粉缺失突变体中, 初莲香等[6]在甘蓝品种‘迎春’中发现了一株蜡粉缺失突变体, 对其遗传效应分析表明, 这一蜡粉缺失性状是由一对隐性纯合基因控制[15]。李景涛[16]对2份圆球蜡粉缺失突变体10Q-961和LD10的遗传规律进行分析, 结果表明这2份突变体蜡粉缺失性状均为隐性单基因遗传, 但其无蜡粉亮绿基因位于不同的遗传位点。其后该研究团队又报道了受单基因显性控制的无蜡粉材料10Q-974的发现[8]。本试验中, 突变体410M配制的6世代群体的分离比例符合单基因隐性遗传的分离比例。
植物外表皮蜡粉成分主要为特长链脂肪酸(VLCFAs)及其衍生物, 包括烷烃、初级醇、次级醇、醛、酮和烷基脂等[17-18]。近年来, 参与植物蜡粉生物合成的许多基因已经被鉴定, 其中模式作物拟南芥的蜡粉合成途径已初步被阐明:质体从头合成延伸形成C16/C18脂肪酸, 作为蜡质形成的前体延伸为特长链脂肪酸, 然后VLCFAs通过醇合成途径和烷烃合成途径合成外表皮蜡粉[19]。本研究选取了参与拟南芥蜡粉生物合成、传输和调控并在甘蓝基因组数据库中表达的14个基因, 对其在野生型和突变体中的表达进行了比较分析。在14个甘蓝基因中, 共有7个基因在野生型中的表达显著高于突变体。其中ECR10、FATB和KCS1为参与表皮蜡质生物合成的基因[20-22], GNL为参与蜡质传输基因[23], MYB30、DEWAX、DCL4为参与蜡质合成和传输的调控基因。在突变体中, CER2、LCAS1、ACBP1、CER5和HUB1的表达高于其野生型。其中CER2和LCAS1为参与表皮蜡质生物合成途径的基因, ACBP1和CER5为参与蜡质传输基因, HUB1为参与蜡质合成和传输的调控基因。以上基因在蜡粉代谢的过程中均扮演着重要的角色[24-26], 也正是因它们的存在和差异表达, 导致了不同突变体之间基因控制的多样性, 使得蜡粉合成和转运的过程变得格外复杂。在芸薹属作物上与蜡粉相关的分子研究方面的报道较少, 希望本研究能起到抛砖引玉的作用, 为今后的甘蓝蜡粉研究提供一些分子理论基础。
在甘蓝育种研究中, 蜡粉缺失性状可作为一代杂种利用的标记性状。而且, 蜡粉缺失性状还可转育到所有的甘蓝材料中, 扩大甘蓝类作物的类型和品种, 加速优质新品种的创制。
| [1] | Riederer M, Schreiber L. Protecting against water loss:analysis of the barrier properties of plant cuticles[J]. Journal of Experimental Botany, 2001, 52(363): 2023-2032. DOI: 10.1093/jexbot/52.363.2023 |
| [2] | Holmes M G, Keiller D R. Effects of pubescence and waxes on the reflectance of leaves in the ultraviolet and photosynthetic wavebands:a comparison of a range of species[J]. Plant Cell and Environment, 2002, 25(1): 85-93. DOI: 10.1046/j.1365-3040.2002.00779.x |
| [3] |
倪郁, 宋超, 王小清. 低温胁迫下拟南芥表皮蜡质的响应机制[J].
中国农业科学, 2014, 47(2): 252-261.
Ni Y, Song C, Wang X Q. Investigation on response mechanism of epicuticular wax on Arabidopsis thaliana under cold stress[J]. Scientia Agricultura Sinica, 2014, 47(2): 252-261. DOI: 10.3864/j.issn.0578-1752.2014.02.005 (in Chinese with English abstract) |
| [4] | Jenks M A, Joly R J, Peters P J, et al. Chemically-induced cuticle mutation affecting epidermal conductance to vapor and disease susceptibility in Sorghum bicolor(L.) Moench[J]. Plant Physiology, 1994, 105: 1239-1245. DOI: 10.1104/pp.105.4.1239 |
| [5] | EigenbrodeI S D, Espelie K E. Effects of plant epicuticular lipids on insect Herbivores[J]. Annual Review of Entomology, 1995, 40(1): 171-194. DOI: 10.1146/annurev.en.40.010195.001131 |
| [6] |
初莲香, 王余文. 无蜡粉亮叶结球甘蓝的发现及其利用[J].
辽宁农业科学, 1993(3): 49-50.
Chu L X, Wang Y W. The discovery and utilization of wax-less light green cabbage[J]. Liaoning Agricultural Sciences, 1993(3): 49-50. (in Chinese with English abstract) |
| [7] |
牟香丽, 王超, 王帅. 甘蓝无蜡粉突变体叶表皮蜡粉超微结构观察[J].
中国蔬菜, 2013(4): 32-37.
Mu X L, Wang C, Wang S. Observation of ultra microstructure of wax-less mutant epicuticular wax on cabbage[J]. China Vegetable, 2013(4): 32-37. (in Chinese with English abstract) |
| [8] |
唐俊, 刘东明, 刘泽洲, 等. 几份甘蓝蜡粉缺失突变体特征特性的研究[J].
园艺学报, 2015, 42(6): 1093-1102.
Tang J, Liu D M, Liu Z Z, et al. Studies on characteristics of several glossy mutants in cabbage[J]. Acta Horticulturae Sinica, 2015, 42(6): 1093-1102. (in Chinese with English abstract) |
| [9] |
李妍, 王雪花, 陈忠文, 等. 不结球白菜抗坏血酸合成基因BcGME的同源克隆及胁迫下的表达分析[J].
南京农业大学学报, 2016, 39(2): 205-212.
Li Y, Wang X H, Chen Z W, et al. Homologous cloning and expression analysis of ascorbic acid biosynthesis gene BcGME under stress from non-heading Chinese cabbage[J]. Journal of Nanjing Agricultural University, 2016, 39(2): 205-212. DOI: 10.7685/jnau.201507026 (in Chinese with English abstract) |
| [10] |
冯辉, 杨晓飞, 辛彬, 等. 无蜡粉型青梗菜核基因雄性不育系转育研究[J].
沈阳农业大学学报, 2010, 41(2): 142-146.
Feng H, Yang X F, Xin B, et al. Obtaining of a waxless male sterile line in Pakchoi(Brassica rapa L.)[J]. Journal of Shenyang Agricultural University, 2010, 41(2): 142-146. (in Chinese with English abstract) |
| [11] | Farnham M W. Glossy and nonglossy near-isogenic lines USVL115-GL, USVL115-NG, USVL188-GL, and USVL188-NG of broccoli[J]. HortScience, 2010, 45(4): 660-662. |
| [12] | Mo J G, Li W Q, Wang J S. Inheritance and agronomic performance of the waxless character in Brassica napus L.[J]. Plant Breeding, 1992, 108(3): 256-259. DOI: 10.1111/pbr.1992.108.issue-3 |
| [13] |
赵建锋, 沈向群, 张海楼, 等. 菜薹无蜡粉性状遗传规律初探[J].
园艺学报, 2006, 33(3): 538.
Zhao J F, Shen X Q, Zhang H L, et al. Studies on inheredity of leaf and stalk waxless character of flowering chinese cabbage[J]. Acta Horticulturae Sinica, 2006, 33(3): 538. (in Chinese with English abstract) |
| [14] |
周熙荣, 周志疆, 李树林. 甘蓝型油菜无蜡粉性状的遗传性[J].
上海农业学报, 1995, 11(3): 87-89.
Zhou X R, Zhou Z J, Li S L. Inheritance of waxless character in rapeseed(B. napus L.)[J]. Acta Agriculturae Shanghai, 1995, 11(3): 87-89. (in Chinese with English abstract) |
| [15] |
初莲香, 张晓红, 王余文. 甘蓝类无蜡粉亮叶性状遗传规律及其利用的研究[J].
遗传, 1996, 18(1): 26-28.
Chu L X, Zhang X H, Wang Y W. Study on inheritance of the character glassy waxless and its utilization in cabbage(Brassica oleracea L.)[J]. Hereditas(Beijing), 1996, 18(1): 26-28. (in Chinese with English abstract) |
| [16] |
李景涛. 结球甘蓝无蜡粉亮绿性状遗传分析及分子标记研究[D]. 北京: 中国农业科学院, 2012.
Li J T. Genetic analysis and molecular marker on glossy waxless character in cabbage[D]. Beijing: Chinese Academy of Agricultural Sciences, 2012(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-82101-1012415686.htm |
| [17] | Islam M A, Du H, Ning J, et al. Characterization of glossy1-homologous genes in rice involved in leaf wax accumulation and drought resistance[J]. Plant Molecular Biology, 2009, 70(4): 443-456. DOI: 10.1007/s11103-009-9483-0 |
| [18] | Lee S B, Suh M C. Advances in the understanding of cuticular waxes in Arabidopsis thaliana and crop species[J]. Plant Cell Reports, 2015, 34(4): 557-572. DOI: 10.1007/s00299-015-1772-2 |
| [19] | Bernard A, Joubès J. Arabidopsis cuticular waxes:advances in synthesis, export and egulation[J]. Progress in Lipid Research, 2013, 52(1): 110-129. DOI: 10.1016/j.plipres.2012.10.002 |
| [20] | Zheng H, Rowland O, Kunst L. Disruptions of the Arabidopsis enoyl-CoA reductase gene reveal an essential role for very-longchain fatty acid synthesis in cell expansion during plant morphogenesis[J]. Plant Cell, 2005, 17: 1467-1481. DOI: 10.1105/tpc.104.030155 |
| [21] | Bonaventure B, Salas J J, Pollard M R, et al. Disruption of the FATB gene in Arabidopsis demonstrates an essential role of saturated fatty acids in plant growth[J]. Plant Cell, 2003, 15: 1020-1033. DOI: 10.1105/tpc.008946 |
| [22] | Millar A A, Kunst L. Very-long-chain fatty acid biosynthesis is controlled through the expression and specificity of the condensing enzyme[J]. Plant Journal, 1997, 12(1): 121-131. DOI: 10.1046/j.1365-313X.1997.12010121.x |
| [23] | McFarlane H E, Watanabe Y, Yang W, et al. Golgi-and trans-Golgi network-mediated vesicle trafficking is required for wax secretion from epidermal cells[J]. Plant Physiology, 2014, 164: 1250-1260. DOI: 10.1104/pp.113.234583 |
| [24] | Raffaele S, Vailleau F, Leger A, et al. A MYB transcription factor regulates very-long-chain fatty acid biosynthesis for activation of the hypersensitive cell death response in Arabidopsis[J]. Plant Cell, 2008, 20: 752-767. DOI: 10.1105/tpc.107.054858 |
| [25] | Go Y S, Kim H, Kim H J, et al. Arabidopsis cuticular wax biosynthesis is negatively regulated by the DEWAX gene encoding an AP2/ERF-type transcription factor[J]. Plant Cell, 2014, 26: 1666-1680. DOI: 10.1105/tpc.114.123307 |
| [26] | Lam P, Zhao L, Eveleigh N, et al. The exosome and trans-acting small interfering RNAs regulate cuticular wax biosynthesis during Arabidopsis inflorescence stem development[J]. Plant Physiology, 2014, 167: 323-336. |




