文章信息
- 施金彤, 韩开顺, 明珂, 陈云, 杜红旭, 胡元亮, 王德云, 武毅, 刘家国
- SHI Jintong, HAN Kaishun, MING Ke, CHEN Yun, DU Hongxu, HU Yuanliang, WANG Deyun, WU Yi, LIU Jiaguo
- 三氯卡班诱导小鼠乳腺上皮细胞癌变的研究
- The research of the carcinogenic effect of triclocarban in mice breast cells
- 南京农业大学学报, 2017, 40(5): 888-893
- Journal of Nanjing Agricultural University, 2017, 40(5): 888-893.
- http://dx.doi.org/10.7685/jnau.201704040
-
文章历史
- 收稿日期: 2017-04-28
2. 山东省平原县畜牧兽医局, 山东 德州 253100
2. Animal Husbandry and Veterinary Bureau of Pingyuan Country, Shandong Province, Dezhou 253100, China
三氯卡班(triclocarban, TCC), 其化学名称为3, 4, 4-三氯均二苯脲, 作为一种广谱抗菌剂被广泛使用。TCC主要被用在抗菌皂、洗衣液、沐浴露等日常生活用品中, 它对革兰氏阳性菌、阴性菌、真菌、病毒等具有广谱高效的杀灭和抑制作用[1-2]。近年来, 人们发现TCC在各种环境介质和生物体中被频繁检出, 这种现象引起了国内外环境科学工作者的关注。有报道指出, TCC能够在水环境和水生生物, 如:水草、鱼类及螺类等生物中富集, 且状态稳定, 降解率低[3-4]。但是, TCC真正给动物体健康带来的潜在危害还鲜有报道。
大量的研究调查显示, TCC能够在哺乳动物的乳腺中累积, 从而对动物体的乳腺组织造成损害[5]。乳腺是哺乳动物最易患病的部位之一, 人和犬都是哺乳动物中比较易患乳房疾病的物种[6-7]。近年来, 随着人们对伴侣动物的重视, 调查发现, 犬乳腺肿瘤是母犬较为常发的疾病, 约占母犬肿瘤的40%~50%, 犬乳腺肿瘤的恶性病变约占50%, 严重威胁到犬的健康[5]。如今, 大量动物用品成分中均含有TCC, 因此, 有理由怀疑TCC是引起动物高发乳腺肿瘤的原因之一, 故而有必要进一步深入研究TCC对动物乳腺上皮细胞的诱癌作用, 以防止其在动物用品中的滥用, 为降低动物乳腺肿瘤的发生提供良好的理论依据。
1 材料与方法 1.1 试验细胞正常小鼠乳腺上皮细胞系(EpH4-Ev), 购自美国ATCC细胞公司。
1.2 主要试剂DMEM完全培养基、胎牛血清、胰蛋白酶粉剂, 均购自Gibco Invitrogen公司(USA); 磷酸盐缓冲液(PBS), 购于Solarbio(Beijing)公司; 青霉素和链霉素(双抗)均购自南京丁贝生物公司; 二甲亚砜(DMSO), 分析纯, 购于上海凌峰化学试剂有限公司; 低熔点琼脂糖, Biosharp; 活性氧簇试剂盒、蛋白质标准品购自上海生工生物工程有限公司; 组蛋白H2AX、磷酸化H2AX(p-H2AX)抗体, 均购于Cell Signaling公司(USA); β-actin抗体购于Santa Cruz Biotechnology公司(USA)。
1.3 TCC工作浓度的测定采用MTT法检测TCC工作浓度[8]。将细胞瓶中的EpH4-Ev细胞用2.5 mg·mL-1胰酶消化3 min, 加入含10%血清的DMEM稀释细胞至浓度为1.5×104mL-1, 取200 μL EpH4-Ev细胞加入96孔细胞培养板中, 37 ℃、5% CO2培养箱中培养24 h。用含4% FBS的DMEM将TCC倍比稀释成6个浓度梯度, 向上述含EpH4-Ev细胞的96孔板中每孔各加入100 μL稀释后的TCC; 同时设置细胞对照组(Ep组), 每孔只加入含4% FBS的DMEM 100 μL。37 ℃、5% CO2培养箱中培养48 h, MTT法检测细胞活性。
1.4 TCC对EpH4-Ev细胞增殖的影响通过MTT法检测细胞活性测得TCC的工作浓度为0.195 μmol·L-1后, 用2.5 mg·mL-1胰酶消化EpH4-Ev细胞3 min, 加入含10%血清的DMEM稀释细胞至浓度为1×106 mL-1, 取5 mL加入细胞培养瓶中, 加入1 mL TCC, 37 ℃、5% CO2培养箱中培养, 以48 h为1个药物作用循环, 分别作用3和6个循环[9], 命名为T3和T6细胞, 并设置细胞对照。
取Ep、T3和T6细胞用含10% FBS的DMEM稀释至浓度为3×103 mL-1, 分别取200 μL加入96孔细胞培养板中, 于含T3和T6细胞的96孔板中每孔各加入100 μL含4% FBS的DMEM, 37 ℃、5% CO2培养箱中培养48 h, MTT法检测细胞活性。
1.5 TCC对EpH4-Ev细胞内ROS水平的影响用2.5 mg·mL-1胰酶消化Ep、T3及T6细胞3 min, 分别加入含10% FBS的DMEM稀释细胞至浓度为8×105 mL-1, 37 ℃、5% CO2培养箱中培养24 h。之后用PBS润洗细胞2次, 每孔加入含4% FBS的DMEM 2 mL, 37 ℃、5% CO2培养24 h。取出细胞培养板, 用ROS试剂盒中提供的DCFH-DA染料对细胞染色。按照1:1 000用无血清的DMEM培养液对DCFH-DA染料进行稀释, 使其终浓度达到10 μmol·L-1后, 向每孔中加入1 mL, 使之充分覆盖细胞表面。另设阴性对照孔, 加入等量的无血清培养基, 37 ℃、5% CO2孵育30 min。孵育结束后, 将含有DCFH-DA的培养基倒掉, 用无血清培养基润洗细胞3次。用2.5 mg·mL-1胰酶消化细胞, 将消化后的细胞分别加入2 mL的EP管中, 1 200 r·min-1离心5 min, 弃上清液, 加入无血清培养基, 1 200 r·min-1离心5 min, 反复3次。将收集好的细胞避光保存, 2 h内用流式细胞仪检测细胞内的ROS水平。
1.6 TCC对EpH4-Ev细胞DNA损伤的影响DNA损伤试验用H2AX转化为p-H2AX的量来表示, 以β-actin作为内参蛋白。蛋白表达量用Western blot法来检测。具体步骤如下:
用2.5 mg·mL-1胰酶消化Ep、T3及T6细胞3 min, 加入含10% FBS的DMEM稀释EpH4-Ev细胞至浓度8×105 mL-1, 37 ℃、5% CO2培养箱中培养24 h。取出细胞培养板, PBS漂洗2次, 加入含蛋白酶抑制剂(PMSF)的RIPA裂解细胞后移至离心管内, 每个样品超声匀浆2次, 4 ℃、12 000 r·min-1离心20 min, 收集上清液, 按照BCA蛋白浓度测定试剂盒说明书(碧云天公司), 绘制标准曲线并根据标准曲线计算浓度。根据变性后样品的蛋白浓度等质量上样至电泳凝胶加样孔内, 在边缘孔内加入蛋白质标准品, 用浓缩胶80 V、30 min, 分离胶120 V、120 min进行电泳。使用半干式转印法20 V转膜60 min后, 将PVDF膜放入TBST缓冲液中, 漂洗3次。弃去TBST, 加入5%的脱脂奶粉封闭液, 室温封闭2 h, 然后向膜上加一抗稀释液(1:1 000稀释), 4 ℃孵育过夜。加TBST漂洗3次后, 再加6 mL 5%的脱脂奶粉稀释的二抗溶液(1:5 000稀释), 室温孵育1 h, 加TBST漂洗3次后曝光。利用Image-Pro Plus软件(version 6.0.0.260) 进行蛋白条带的光密度值测定并计算其相应的数值。
1.7 TCC处理对EpH4-Ev细胞的非停泊性生长的影响用三蒸水分别制备20 mg·mL-1和4 mg·mL-1的低熔点琼脂糖液体, 115 ℃高压灭菌30 min, 放进水浴锅维持温度为40 ℃, 使之保持溶解状态。无菌制备2×DMEM, 按照1:1(体积比)的比例混合2%的琼脂糖和2×DMEM, 取3 mL混合液注入细胞培养皿中, 待其冷却凝固后, 置入37 ℃培养箱中备用。将Ep、T3及T6细胞用0.25%胰酶消化, 加入含10% FBS的DMEM分别稀释至浓度为1×103mL-1, 制成细胞悬液备用。按照1:1(体积比)的比例将4 mg·mL-1的低熔点琼脂糖与2×DMEM混合, 分别向其中加入0.2 mL混匀的细胞悬液, 吹打混匀, 注入已铺有20 mg·mL-1的底层琼脂糖的培养皿中, 每个培养皿中注入3 mL, 待其凝固后, 置入37 ℃、5%的细胞培养箱中, 连续培养14 d, 记录细胞集落大于0.1 mm的细胞集落数。
1.8 TCC处理对T6细胞划痕试验的影响用记号笔在6孔板背后均匀的划几道横线, 每道横线之间大约间隔1 cm。将Ep及T6细胞分别用2.5 mg·mL-1胰酶消化, 加入含10%血清的DMEM稀释至浓度为8×105mL-1, 37 ℃、5% CO2培养12 h。用无菌的10 μL移液器均匀地在铺满细胞的6孔板内沿着垂直于记号笔在外部的痕迹划痕, 2条划痕之间间隔2 mm, 每孔5条划痕。用无菌的PBS冲洗划下的细胞2次, 分别向Ep及T6细胞加入无血清的DMEM培养基饥饿培养8 h和16 h, 在显微镜下(×40) 拍照, 按照比例放大, 以细胞对照组(Ep)划痕的距离为基准, 计算T6细胞各时间点的细胞迁移率。
1.9 数据分析试验数据均以x±SE表示, 用软件SPSS 20.0进行方差分析和多重比较, 所有的柱状图均用GraphPad Prism绘制。
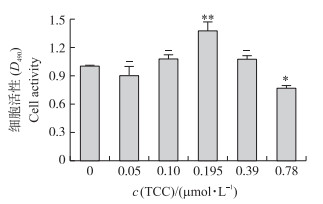
2 结果与分析 2.1 TCC工作浓度的测定结果如图 1所示, TCC浓度为0.195 μmol·L-1时, EpH4-Ev细胞的细胞活性极显著高于细胞对照组(P < 0.01)。因此, 以0.195 μmol·L-1作为TCC的工作浓度。
|
图 1 三氯卡班(TCC)工作浓度的测定 Figure 1 The efficient concentration of triclocarban(TCC) *P < 0.05, * *P < 0.01. The same as follows. |
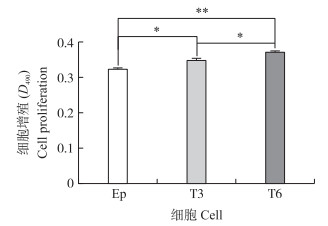
如图 2所示: T3和T6细胞组EpH4-Ev细胞的增殖水平均显著高于细胞对照组(P < 0.05), 且T6细胞组的增殖水平显著高于T3细胞组(P < 0.05)。表明, TCC作用时间越长, EpH4-Ev细胞的增殖能力越高。
|
图 2 TCC处理对EpH4-Ev(Ep)细胞增殖的影响 Figure 2 Effect on cell proliferation of EpH4-Ev(Ep)cells after treatment with TCC Ep和T3、T6分别表示正常细胞和TCC分别处理3、6个循环的细胞。 Ep and T3, T6 represented the untreated cells and the cells treated with TCC for 3, 6 cycles. The same as follows. |
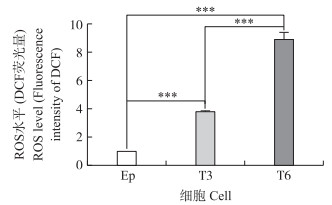
如图 3所示:Ep、T3和T6细胞组经DCFH-DA探针标记后, T3和T6细胞的荧光强度均极显著高于细胞对照组(P < 0.001);且T6细胞组的荧光强度极显著高于T3细胞组(P < 0.001)。表明, TCC作用时间越长, EpH4-Ev细胞内ROS水平越高。
|
图 3 TCC处理对EpH4-Ev细胞ROS水平的影响 Figure 3 Effect on cellular ROS level of EpH4-Ev cells after treatment with TCC * * *P < 0.001. The same as follows. |
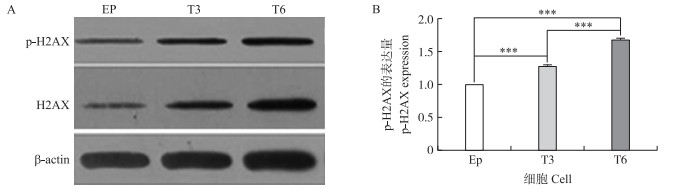
如图 4所示:T3、T6细胞组H2AX转化为p-H2AX蛋白的量均极显著高于细胞对照组(P < 0.001), 且T6细胞组H2AX转化为p-H2AX蛋白的量极显著高于T3细胞组(P < 0.001)。表明, TCC作用时间越长, EpH4-Ev细胞内DNA双链断裂程度越高, DNA损伤越严重。
|
图 4 TCC处理对EpH4-Ev细胞内DNA损伤的影响 Figure 4 Effect on DNA damage of EpH4-Ev cells after treatment with TCC A.p-H2AX蛋白的表达条带The stripes of the expression of p-H2AX; B.p-H2AX蛋白灰度值的柱状图The bar graph of the expression of p-H2AX. |
如图 5所示:T3、T6细胞组形成的细胞集落数极显著多于细胞对照组(P < 0.001), T6细胞组形成的细胞集落数极显著高于T3细胞组(P < 0.001)。表明:TCC作用时间越长, 细胞形成的集落数越多, 细胞与细胞之间的黏合力以及细胞的贴壁能力都显著降低。
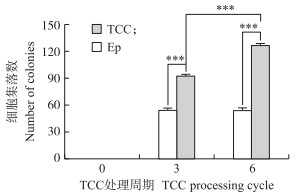
|
图 5 TCC长期处理EpH4-Ev细胞对细胞非停泊性生长能力的影响 Figure 5 Anchorage-independent growth(AIG)of EpH4-Ev cells after treatment with TCC for a long time |
如图 6所示:T6细胞在划痕后8 h和16 h, 细胞之间的距离极显著小于同期细胞对照(P < 0.001)。表明:TCC作用时间越长, 细胞的迁移能力越强, 因此, 可以进一步说明T6细胞已经发生癌变。
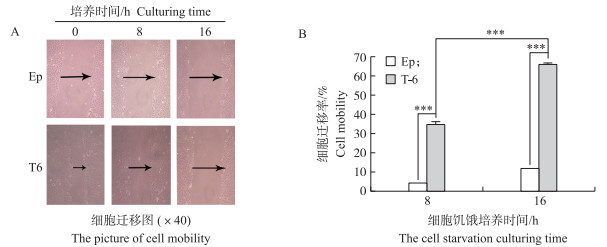
|
图 6 TCC长期处理EpH4-Ev细胞对细胞迁移能力的影响 Figure 6 Cell mobility of EpH4-Ev cells after treatment with TCC for a long time |
氧化应激是多数癌细胞的一个重要特征, 这是癌细胞发生、发展的一个必要过程[9-10]。癌细胞的强代谢能力使得其能够产生大量的ROS, ROS又能够激活细胞内的某些信号通路, 干扰细胞内线粒体的代谢, 从而造成细胞的异常增殖和氧化损伤[11-13]。因此, 在癌细胞中, ROS是一个重要的示病性指标[14]。本试验结果显示, TCC处理时间越长, 产生ROS量越多。由于ROS水平的升高, 使得癌细胞的代谢增强, 引起了细胞的异常增殖, 故而癌细胞的增殖速度远高于正常细胞[12]。本试验中, TCC处理时间越长, 细胞的增殖能力越强。表明长时间TCC作用造成了细胞代谢加快, 细胞增殖速度异常加快。
DNA是生命体最重要的遗传物质, DNA分子的稳定性和完整性, 对于机体内所有细胞的存活和正常代谢都起着重要的作用[15]。正常情况下, 当DNA遭到外源性理化因素的破坏时, 会进行自我修复。但是, 当DNA损伤累积达到一定程度时, 就会达到一种无法自我修复的状态, 对细胞造成不可逆的伤害, 进而导致基因突变或细胞发生恶性转化, 产生肿瘤[16]。研究显示, 细胞内ROS的大量产生可以导致细胞内发生DNA损伤[15, 17-18]。ROS的大量产生会引起DNA出现如双链断裂、位点突变、原癌基因与肿瘤抑制基因发生突变等一系列损伤, 同时, DNA损伤会进一步加剧细胞内ROS的大量产生[16, 19]。因此, ROS和DNA损伤是同时存在又相互影响的。有研究显示[20], TCC能够引起人肝细胞(LO2) DNA的损伤, 当肝细胞暴露于低剂量TCC下时就可以引起其DNA损伤断裂, 这表明LO2对TCC敏感, 由此说明TCC对人体有危害。H2AX是组蛋白H2A的亚型, 在其组成末端是由4个氨基酸SQ(E、D、I、L)组成的高度保守的序列, 简称SQE基序, 当DNA由于药物或辐射而发生损伤时, SQE基序能够迅速发生磷酸化, 形成磷酸化H2AX, 特异性地提示DNA损伤[19]。本试验用Western blot测定p-H2AX的表达量来表示DNA损伤程度, 结果显示:TCC作用时间越长, 细胞内p-H2AX蛋白的表达量越高。这表明TCC作用于EpH4-Ev细胞时间越长, 细胞内的DNA双链断裂越多, DNA损伤愈严重。这与细胞内ROS水平的升高趋势相同, 也从侧面反映了ROS和DNA损伤之间是有相互促进作用的。
长时间的致癌剂作用会使得正常细胞ROS水平升高和DNA损伤加剧, 使得细胞内环境变得极不稳定, 从而引起正常细胞变为癌细胞[21-23]。非停泊性生长是肿瘤细胞的标识之一, 也是检测恶性转化细胞最准确和严谨的标识[9]。细胞的迁移力虽然是肿瘤细胞和正常细胞都有的一种能力, 但是, 肿瘤细胞的生长速度快, 对外源生长刺激因子的依赖减少, 使得它的迁移能力要远远大于正常细胞。这两个标识能够作为检测癌变细胞最直观、最简便、最本质的指标[11]。本试验测定了细胞的非停泊性生长能力和细胞迁移率, 结果显示:TCC作用时间越长, 细胞形成的集落数越多。这表明细胞与细胞之间的黏合力以及细胞的贴壁能力都显著降低, 说明细胞内部发生了变化, 正常的EpH4-Ev细胞变成了具有癌变特征的细胞。细胞划痕试验的结果显示:T6细胞在划痕后8 h和16 h, 细胞之间的距离显著小于同期细胞对照。表明:TCC作用时间越长, EpH4-Ev细胞的迁移能力越强, 进一步说明了T6细胞已经发生癌变。
TCC长时间作用于正常的小鼠乳腺上皮细胞, 可以诱导其转化为具有癌细胞特征的非正常细胞, 从而引发患乳腺癌的风险。小鼠是很好的试验模型, 常用于人和动物体外试验的相关指标检测, 因此, 本试验结果可以为之后进行相关体内试验提供相应的数据支持, 同时使社会关注到TCC对于动物体产生的危害, 并及时采取有效的预防和治疗措施, 严格控制TCC在动物用品中的应用, 降低动物乳腺癌的发生。
| [1] |
缪宏豪. 三氯卡班在水生生物中的吸收与积累[D]. 济南: 济南大学, 2014.
Miao H H. The absorption and accumulation of triclocarban in aquatic organisms[D]. Jinan:Jinan University, 2014(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10427-1014357235.htm |
| [2] |
刘湘. TCC在洗涤用品和化妆品中的应用[J].
中国洗涤用品工业, 2004(3): 68–70.
Liu X. The application in cleaning products and cosmetics of TCC[J]. China Surfactant Soap and Detergent Industries, 2004(3): 68–70. (in Chinese with English abstract) |
| [3] | Miura Y, Chen X, Yamada S, et al. Triclocarban-induced change in intracellular Ca2+ level in rat thymocytes:cytometric analysis with Fluo-3 under Zn2+-free conditions[J]. Environmental Toxicology and Pharmacology, 2014, 37(2): 563–570. DOI: 10.1016/j.etap.2014.01.013 |
| [4] | Heidler J, Sapkota A, Halden R U. Partitioning, persistence, and accumulation in digested sludge of the topical antiseptic triclocarban during wastewater treatment[J]. Environmental Science and Technology, 2006, 40(11): 3634–3639. DOI: 10.1021/es052245n |
| [5] | Hernando M D, Ferrer C, Ulaszewska M, et al. Application of high-performance liquid chromatography-tandem mass spectrometry with a quadrupole/linear ion trap instrument for the analysis of pesticide residues in olive oil[J]. Analytical and Bioanalytical Chemistry, 2007, 89(3): 1815–1831. |
| [6] |
杨倩. 犬乳腺肿瘤组织病理学变化与分子生物学诊断[D]. 南京: 南京农业大学, 2014.
Yang Q. Histopathological changes and molecular biologial diagnosis of canine mammary gland tumors cases[D]. Nanjing:Nanjing Agricultural University, 2014(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10307-1016041570.htm |
| [7] |
姚华, 林德贵, 乔富强, 等. p63和Calponin蛋白在犬乳腺肿瘤中的表达及意义[J].
中国农业大学学报, 2006, 11(3): 31–35.
Yao H, Lin D G, Qiao F Q, et al. Expression and significance of p63 and Calponin proteins in canine mammary tumors[J]. Journal of China Agricultural University, 2006, 11(3): 31–35. (in Chinese with English abstract) |
| [8] |
刘丽, 季辉, 彭麟, 等. 鸡肝原代细胞药物代谢模型的建立与优化[J].
南京农业大学学报, 2015, 38(1): 127–133.
Liu L, Ji H, Peng L, et al. The establishment and optimization of the drug metabolic model of adult chicken primary hepatocytes[J]. Journal of Nanjing Agricultural University, 2015, 38(1): 127–133. DOI: 10.7685/j.issn.1000-2030.2015.01.019 (in Chinese with English abstract) |
| [9] | Choudhary S, Sood S, Donnell R L, et al. Intervention of human breast cell carcinogenesis chronicallyinduced by 2-amino-1-methyl-6-phenylimidazo[4, 5-b]pyridine[J]. Carcinogenesis, 2012, 33(4): 876–885. DOI: 10.1093/carcin/bgs097 |
| [10] | Jung S, Shin D, Kim H, et al. Sugiol inhibits STAT3 activity via regulation of transketolase and ROS-mediated ERK activation in DU145 prostate carcinoma cells[J]. Biochemical Pharmacology, 2015, 97(1): 38–50. DOI: 10.1016/j.bcp.2015.06.033 |
| [11] |
丁逍, 刘琳, 陈迪, 等. 过氧化氢诱导原代大鼠睾丸间质细胞氧化损伤模型的建立[J].
南京农业大学学报, 2014, 37(2): 99–104.
Ding X, Liu L, Chen D, et al. Establishment of an oxidative damage model induced by H2O2in primary rat Leydig cells[J]. Journal of Nanjing Agricultural University, 2014, 37(2): 99–104. DOI: 10.7685/j.issn.1000-2030.2014.02.016 (in Chinese with English abstract) |
| [12] | Kastl L, Sauer S W, Ruppert T, et al. TNF-α mediates mitochondrial uncoupling and enhances ROS-dependent cell migrationviaNF-κB activation in liver cells[J]. FEBS Letters, 2014, 588(1): 175–183. DOI: 10.1016/j.febslet.2013.11.033 |
| [13] | de Souza-Grinevicius V M A, Kviecinski M R, Santos-Mota N S R, et al. Piper nigrum ethanolic extract rich in piperamides causes ROS overproduction, oxidative damage in DNA leading to cell cycle arrest and apoptosis in cancer cells[J]. Journal of Ethnopharmacology, 2016, 189: 139–147. DOI: 10.1016/j.jep.2016.05.020 |
| [14] | Clerkin J S, Naughton R, Quiney C, et al. Mechanisms of ROS modulated cell survival during carcinogenesis[J]. Cancer Letters, 2008, 266(1): 30–36. DOI: 10.1016/j.canlet.2008.02.029 |
| [15] |
冉茂良, 高环, 尹杰, 等. 氧化应激与DNA损伤[J].
动物营养学报, 2013, 25(10): 2238–2245.
Ran M L, Gao H, Yin J, et al. Oxidative stress and DNA damage[J]. Chinese Journal of Animal Nutrition, 2013, 25(10): 2238–2245. DOI: 10.3969/j.issn.1006-267x.2013.10.007 (in Chinese with English abstract) |
| [16] |
李小峰. 多氯联苯126对苯并[a]芘致HepG2细胞氧化应激及DNA损伤的影响[D]. 武汉: 华中科技大学, 2007.
Li X F. A thesis submitted in partial fulfillment of the requirements for the degree of master of medicine[D]. Wuhan:Huazhong University of Science and Technology, 2007(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10487-1011275956.htm |
| [17] | Ježek P, Hlavatá L. Mitochondria in homeostasis of reactive oxygen species in cell, tissues, and organism[J]. The International Journal of Biochemistry and Cell Biology, 2005, 37(12): 2478–2503. DOI: 10.1016/j.biocel.2005.05.013 |
| [18] | Singh R, Shankar B S, Sainis K B. TGF-β1-ROS-ATM-CREB signaling axis in macrophage mediated migration of human breast cancer MCF7 cells[J]. Cellular Signaling, 2014, 26(7): 1604–1615. DOI: 10.1016/j.cellsig.2014.03.028 |
| [19] |
周学贤, JonesP, CarmichaelP, 等. p53和γ-H2AX作为乙醛引起DNA损伤早期生物标记物的实验研究[J].
癌变·畸变·突变, 2014, 26(2): 81–93.
Zhou X X, Jones P, Carmichael P, et al. Changes of p53 and γ-H2AX of TK6 cells caused by acetaldehyde[J]. Carcinogenesis, Teratogenesis and Mutagenesis, 2014, 26(2): 81–93. (in Chinese with English abstract) |
| [20] |
李林朋, 马慧敏, 胡俊杰, 等. 三氯生和三氯卡班对人体肝细胞DNA损伤的研究[J].
生态环境学报, 2010, 19(12): 2897–2901.
Li L P, Ma H M, Hu J J, et al. The research of the DNA damage of TCS and TCC in human liver cells[J]. Ecology and Environmental Sciences, 2010, 19(12): 2897–2901. DOI: 10.3969/j.issn.1674-5906.2010.12.022 (in Chinese with English abstract) |
| [21] | Sood S, Choudhary S, Wang H R. Induction of human breast cell carcinogenesis by triclocarban and intervention by curcumin[J]. Biochemical and Biophysical Research Communications, 2013, 438(4): 600–606. DOI: 10.1016/j.bbrc.2013.08.009 |
| [22] | Rathore K, Choudhary S, Odoi A, et al. Green tea catechin intervention of reactive oxygen species-mediated ERK pathway activation and chronically induced breast cell carcinogenesis[J]. Carcinogenesis, 2012, 33(1): 174–183. DOI: 10.1093/carcin/bgr244 |
| [23] | Nkrumah-Elie Y M, Reuben J S, Hudson A, et al. Diallyl trisulfide as an inhibitor of benzo(a)pyrene-induced precancerous carcinogenesis in MCF-10A cells[J]. Food and Chemical Toxicology, 2012, 50(7): 2524–2530. DOI: 10.1016/j.fct.2012.04.010 |




