文章信息
- 徐漫, 蔡翰林, 张克云
- XU Man, CAI Hanlin, ZHANG Keyun
- 昆虫病原线虫共生菌Serratia nematodiphila DR186对果蝇致病机制的研究
- Pathogenesis of entomopathogenic nematode symbiotic bacterial strain Serratia nematodiphila DR186 against fruit flies
- 南京农业大学学报, 2017, 40(5): 827-834
- Journal of Nanjing Agricultural University, 2017, 40(5): 827-834.
- http://dx.doi.org/10.7685/jnau.201611037
-
文章历史
- 收稿日期: 2016-11-30
绿色农业是目前的农业发展趋势和整个社会对农产品的要求。实现绿色农业的瓶颈在于用无公害方法实现对害虫的有效控制。昆虫病原线虫(entomopathogenic nematodes, EPNs)作为一种新型生物杀虫剂, 具有选择性强, 对人畜安全, 对生态环境影响小, 害虫不易产生抗性等优点, 有望成为控制作物虫害、保障食品安全的根本途径之一[1-4]。昆虫病原线虫的杀虫原理是侵染期幼虫(infective juveniles, IJs)消化道内携有引起昆虫致病的共生菌, 可导致昆虫患败血症死亡[5-7]。昆虫病原线虫是当前国际生防领域研究的热点, 自20世纪70年代以来, 昆虫病原线虫-共生菌共生体的研究进展迅速, 许多新种、新品系被开发利用, 大规模工厂化离体培养技术的发展, 活跃了昆虫病原线虫-共生菌共生体的实际应用研究, 昆虫病原线虫-共生菌共生体作为生物杀虫剂已经广泛用于害虫的综合治理中, 并在欧美一些国家已经实现商品化, 可以豁免注册生产和释放[3, 8-9]。目前已发现的昆虫病原线虫-共生菌共生体有3类, 分别为拟异小杆属(Heterorhabditidoides)-嗜线虫沙雷氏菌(Serratia nematodiphila)共生体[10-11]、异小杆科(Heterorhabditidae)-发光杆状菌(Photorhabdus)共生体[12-13]和斯氏线虫科(Steinernematidae)-致病杆菌(Xenorhabdus)共生体[14-15]。
在昆虫体内存在具有抗病原微生物的先天性免疫系统。其中体液免疫存在2种病原体识别信号通路:Imd途径和Toll途径[16-17]。Imd途径对革兰氏阴性菌敏感。Imd途径的重要组成部分有PGRP-LC脂多糖识别受体[18]、dFADD受体[19]、Dredd半胱天冬酶[20]、Relish转录因子[21]等。这些因子发生突变将会造成类似与Imd缺陷的效果, 而抗菌肽中Diptericin的表达依赖于Imd途径。Toll途径对真菌和革兰氏阳性菌敏感。Toll途径上的Dif位点主要功能为激活抗菌肽Drosomycin的表达[18-19]。Aymeric等[22]研究发现Photorhabdus luminescens和Xenorhabdus nematophila可以通过逃避果蝇Imd免疫途径杀死宿主昆虫。Nehme等[23]的研究证实了昆虫病原菌可以通过肠道侵染致死果蝇。仇汝龙等[24]的研究发现Serratia nematodiphila R187的肠道和血腔侵染可以激活果蝇的Toll途径和Imd途径, 但其中起主要抵抗作用的是Imd途径。这些相关的基础研究为本研究提供了理论基础与方法参考。
Serratia nematodiphila DR186为Heterorhabditidoides类昆虫病原线虫的共生菌。本研究选择果蝇Imd途径具有代表性的PGRP-LC、Dredd、Relish突变体和Toll途径的Dif突变体为靶标昆虫, 通过肠道与血腔侵染的方法, 探究S.nematodiphila DR186对黑腹果蝇的致病力, 及其与果蝇体液免疫的互作机制。为深入研究Heterorhabditidoides-Serratia类昆虫病原线虫共生体的杀虫机制提供参考, 为这一共生体在生物防治中的实际应用提供理论依据。
1 材料与方法 1.1 试验材料 1.1.1 试验样品Heterorhabditidoides rugaoensis共生菌Serratia nematodiphila DR186, 由本实验室鉴定并保存。大肠杆菌DH5α由本实验室保存。野生型黑腹果蝇、PGRP-LC突变体黑腹果蝇、Dredd突变体黑腹果蝇、Relish突变体黑腹果蝇和Dif突变体黑腹果蝇均购自于Bloomington Drosophila Stock Center(USA)。
1.1.2 试验试剂及仪器试验试剂为:酵母提取物(分析纯)、胰蛋白胨(分析纯)、氯化钠(分析纯)、琼脂粉(分析纯)、Trizol(Invitrogen公司)、无水乙醇(分析纯)、氯仿(分析纯)、异丙醇(分析纯)、乙醚(分析纯)、蔗糖、玉米粉、酵母粉、丙酸(分析纯)、琼脂条、琼脂糖(agarose)(BIOWEST公司)、DEPC(Ameresco公司)、反转录试剂盒BioTeke supermoⅢ RT Kit(百泰克公司)、PCR试剂盒(TaKaRa公司)、荧光定量试剂UltraSYBR Mixture(With ROXⅠ)(康为世纪公司)。
仪器为:智能人工气候箱(PRX-450B, 宁波海曙赛福实验仪器厂)、恒温培养箱(PSX-280H型恒温恒湿培养箱, 浙江宁波莱福科技有限公司)、ABI7500荧光定量PCR仪(Applied Biosystems公司)、普通PCR仪、高速冷冻离心机(Eppendorf公司)。
1.2 果蝇培养与扩繁以实验室购买并保存的野生型以及PGRP-LC、Dredd、Relish和Dif突变体黑腹果蝇为种蝇。在经过灭菌处理的果蝇培养指管中注入约1 cm高的无菌果蝇培养基, 在管身注明该管培养的果蝇类型及接种时间。每只培养指管放入10只左右性别大致对等的与管身标记对应的野生型或突变体种蝇, 以灭菌棉塞塞住管口以防止果蝇逃逸及外界杂菌污染并保证空气流通。将接种好的培养管放入果蝇培养箱培养, 培养温度为25 ℃、湿度75%、光照度2 000 lx、光照周期12 h。待培养基中出现大量肉眼可见的果蝇幼虫时, 即可将管中成虫转移至新的培养管。依此重复, 直至培养数量可满足试验要求为止。
1.3 S.nematodiphila DR186对果蝇肠道的侵染 1.3.1 共生菌对果蝇的肠道侵染根据Nehme等[23]描述的方法对果蝇饲喂共生菌DR186进行肠道侵染, 用蔗糖水重悬菌体沉淀并调整D600为0.1。每管接入1 mL菌悬液到滤纸片上, 从供试的野生型或突变体果蝇中选取孵化6~7 d的雌性个体15只, 用乙醚麻醉后转移到对应果蝇培养管中, 置于培养箱中培养。以相同处理得到的D600值相同的E.coli菌悬液处理的果蝇作为对照, 每个试验至少进行3组重复。
1.3.2 果蝇的存活率和体内菌体CFU统计每12 h观察接受试验的野生型Imd途径PGRP-LC、Dredd、Relish突变体和Toll途径Dif突变体黑腹果蝇的存活率情况, 并记录数据。每24 h取尚幸存果蝇, 麻醉后用70%乙醇淋洗除去体表细菌, 切除腹部, 取头胸部研磨, 匀浆梯度稀释涂布于含20 μg · mL-1氨苄青霉素的平板观察菌落生长情况, 每个梯度试验至少进行3组重复。
1.4 S.nematodiphila DR186对果蝇血腔的侵染 1.4.1 共生菌对果蝇的血腔侵染根据Apidianakis等[25]描述的试验方法针刺果蝇背胸部进行血腔侵染。用保存的DR186菌种划线, 37 ℃培养12 h后, 取单菌落接入LB液体培养基, 于37 ℃、180 r · min-1振荡培养24 h。将发酵的菌液以5 000 r · min-1离心10 min, 重悬菌体沉淀并调整D600为0.1。将滤纸折叠后放入果蝇培养管底部, 加上棉塞后, 进行高压灭菌, 灭菌后烘干, 使滤纸片干燥。从供试的野生型或突变体果蝇中选取孵化6~7 d的雌性个体15只, 用乙醚麻醉, 放置在放大镜下, 用灭菌的钨丝针沾取D600值为0.1的菌悬液轻刺果蝇背胸部一侧, 将处理完的果蝇先转移到干净的空管, 待其苏醒后转移15只到果蝇培养管中。以相同处理得到的D600值相同的E.coli菌悬液处理的果蝇作为对照, 每个试验至少进行3组重复。
1.4.2 果蝇的存活率和体内菌体CFU统计每6 h观察野生型Imd途径PGRP-LC、Dredd、Relish突变体和Toll途径Dif突变体黑腹果蝇的存活情况, 并记录数据。每6 h取存活果蝇, 麻醉后用70%乙醇淋洗除去体表细菌, 切除腹部, 取头胸部研磨, 匀浆梯度稀释涂布于含20 μg · mL-1氨苄青霉素的平板观察菌落生长情况, 每个梯度试验至少进行3组重复。
1.5 总RNA提取与荧光定量PCR试验于处理后6和12 h分别取血腔侵染的野生型及Dredd、Dif突变体果蝇10只, 用Trizol法提取总RNA, 同时提取未处理果蝇的总RNA用于荧光定量试验的结果校正。将提取得到的总RNA进行反转录得到cDNA。将反转录后的cDNA稀释10倍, 以管家基因RP49 和2种抗菌肽基因进行荧光定量测定, 引物序列见表 1。荧光定量PCR反应体系20 μL:10 μL的UltraSYBR Mixture(With ROX), 0.4 μL的上、下游引物(10 μmol · L-1), 2 μL cDNA模板, 7.2 μL ddH2O。荧光定量PCR反应程序:95 ℃ 10 min; 95 ℃ 15 s, 60 ℃ 1 min, 40个循环。结果分析采用2-ΔΔCT法[26]。
| 引物 Primer | 引物序列(5′→3′) Primer sequence |
| RP49-f | GACGCTTCAAGGGACAGTATCTG |
| RP49-r | AAACGCGGTTCTGCATGAG |
| Diptericin-f | GCTGCGCAATCGCTTCTACT |
| Diptericin-r | TGGTGGAGTGGGCTTCATG |
| Drosomycin-f | CGTGAGAACCTTTTCCAATATGATG |
| Drosomycin-r | TCCCAGGACCACCAGCAT |
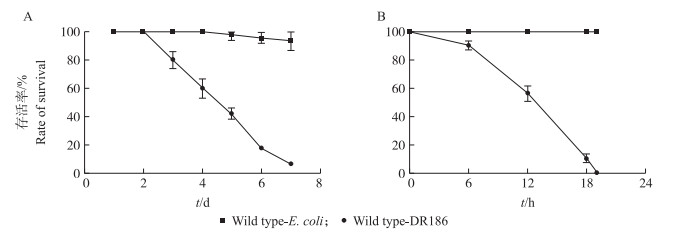
昆虫病原线虫共生菌株DR186的肠道侵染与血腔侵染都可导致受试果蝇的死亡, 而对照组大肠杆菌在2种侵染条件下对果蝇的生存没有显著影响(图 1)。比较DR186菌株不同侵染方式的结果可以发现, 其肠道侵染的致死速率要远远慢于血腔侵染。
|
图 1 Serratia nematodiphila DR186不同侵染方式对野生型果蝇存活率的影响 Figure 1 The survival rate of wild-type flies after S.nematodiphila DR186 infection A.野生型果蝇分别在DR186与E.coli肠道侵染下的存活率; B.野生型果蝇分别在DR186与E.coli血腔侵染下的存活率。 A.The survival rate of wild-type flies infected by DR186 and E.coli in intestine; B.The survival rate of wild-type flies infected by DR186 and E.coli in hemocoel. |
存活率统计结果显示, 在肠道侵染条件下, 果蝇的死亡速率较为缓慢, 经过7 d存活率降至0(图 2-A)。Imd途径的Relish和Dredd突变体对DR186的敏感性强于野生型, 但是Imd途径的PGRP-LC突变体存活率变化更类似于Toll途径Dif突变体和野生型(图 2-A)。由于PGRP-LC在Imd途径中位于起始位置, 作用是识别由革兰氏阴性菌释放的DAP类型的PGN, 从而诱导抗菌肽的生成, 这或许说明在肠道侵染过程中存在其他识别病原菌的因子或途径可以诱导免疫反应, 从而对果蝇形成了保护。不同的体液免疫突变体和野生型果蝇在肠道侵染条件下对DR186的敏感程度虽然存在差异, 但差异幅度已较血腔侵染时明显缩小。
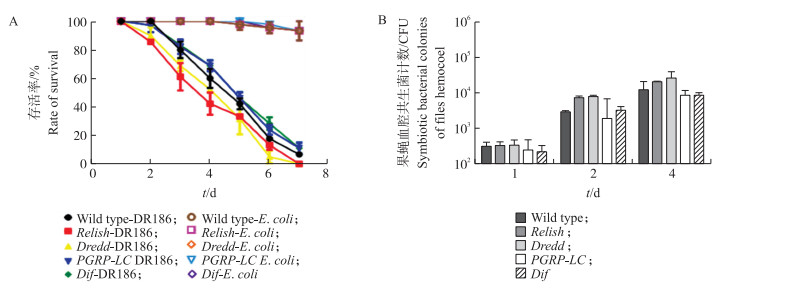
|
图 2 S.nematodiphila DR186肠道侵染对体液免疫突变体果蝇存活及自身繁殖的影响 Figure 2 Effects of the intestinal infection by S.nematodiphila DR186 on the survival rate and reproduction of flies A.S.nematodiphila DR186肠道侵染条件下野生型与突变体果蝇的存活率; B.S.nematodiphila DR186肠道侵染条件下野生型与突变体果蝇的血腔共生菌计数。 A.The survival rate of wild-type and mutant flies infected by DR186 and E.coli in intestine; B.Hemocoel CFU of DR186 in wild-type and mutant flies infected by DR186 in intestine. |
菌落计数的结果表明, 在肠道侵染条件下, 果蝇血腔中共生菌数量的上升比较缓慢(图 2-B)。对DR186更敏感的Imd途径Relish和Dredd突变体果蝇体内的共生菌数量均高于野生型及Toll途径Dif突变体与Imd途径的PGRP-LC突变体同一时期血腔的共生菌数量。通过对比血腔侵染的菌落数及存活率可以看出:在肠道侵染4 d与血腔侵染12 h后, 果蝇均进入快速死亡期, 且这2个时间段受试果蝇的存活率接近。但降至同一存活率的同一突变体在肠道侵染下的血腔菌落数水平要低于血腔侵染。说明在肠道侵染条件下共生菌对果蝇的致死方式可能不止进入血腔造成败血症这一条途径。在肠道侵染条件下不同突变体间的存活率差距变化相近, 说明S.nematodiphila DR186存在某种对免疫系统的逃逸机制或其通过与宿主对细菌免疫无关的方式杀死侵染对象。
2.3 S.nematodiphila DR186血腔侵染对体液免疫突变体果蝇存活的影响S.nematodiphila DR186的血腔侵染可使果蝇的存活率迅速降低, 24 h内所有的受试果蝇均全部死亡(图 3-A)。其中Imd途径的PGRP-LC、Dredd、Relish突变体果蝇对DR186非常敏感, 12 h的存活率就已经降到50%, 12 h过后短时间内迅速全部死亡。Toll途径的Dif突变体果蝇敏感度介于野生型与突变体之间。野生型的抗性最好, 在12 h存活率高于50%。Toll途径的Dif突变体和野生型果蝇在18 h均有少数存活, 超过18 h后, 少数存活的果蝇也都快速死亡。从以上结果可以看出, 在果蝇抵抗S.nematodiphila DR186的免疫反应中Imd途径突变体更容易死亡。Serratia nematodiphila DR186为革兰氏阴性菌, 这与果蝇体液免疫Imd途径主要针对革兰氏阴性菌的结论相吻合。

|
图 3 S.nematodiphila DR186血腔侵染对体液免疫突变体果蝇存活及自身繁殖的影响 Figure 3 Effects of the hemocoel infection by S.nematodiphila DR186 on the survival rate and reproduction of flies A. S.nematodiphila DR186血腔侵染条件下野生型与突变体果蝇的存活率; B. S.nematodiphila DR186血腔侵染条件下野生型与突变体果蝇血腔中的共生菌计数。 A. The survival rate of wild-type and mutant flies infected by DR186 and E.coli in hemocoel; B. Hemocoel CFU of DR186 in wild-type and mutant flies infected by DR186 in hemocoel. |
血腔侵染条件下, S.nematodiphila DR186在果蝇血淋巴中迅速繁殖(图 3-B)。前6 h不同突变体与野生型之间的差异并不明显, 当侵染时间达到12 h时Imd途径的Dredd、Relish突变体血淋巴中共生菌数量显著高于野生型与Toll途径突变体。这说明Imd途径的突变造成了DR186在果蝇血腔中增殖速度加快, 而Toll途径的突变则对DR186的增殖影响较弱, 表明Imd途径对果蝇抵抗DR186的侵染相对于Toll途径更加重要。
2.4 S.nematodiphila DR186血腔侵染对体液免疫突变体果蝇抗菌肽表达量的影响S.nematodiphila DR186血腔侵染野生型果蝇后, Diptericin和Drosomycin两种抗菌肽在侵染6 h后大量表达(图 4-A)。DR186侵入果蝇血腔后大量繁殖, 从而激活果蝇免疫系统。此时, Diptericin(Imd途径)表达水平要高于Drosomycin(Toll途径)的表达水平。这表明在免疫系统完整的野生型果蝇中, Imd免疫途径对革兰氏阴性菌DR186的侵染更为敏感。在野生型、Dredd突变体和Dif突变体被侵染的过程中, 2种抗菌肽的表达水平都呈先上调再下调的趋势, 但Drosomycin的表达水平波动很小, 而Diptericin的表达水平波动幅度明显。侵染12 h后2种抗菌肽的表达水平都下调, 这时共生菌的大量繁殖对果蝇体内组织产生破坏作用, 并且影响了抗菌肽的表达。Dredd位于Imd途径, Dredd突变体Diptericin的表达水平很低, 而Drosomycin的表达表现出一定的上调(图 4-B)。这说明其突变后Imd途径的效率降低, 结合该突变体对DR186的高敏感性死亡率, 进一步说明在对抗DR186的过程中, Imd途径起主要作用。Drosomycin的表达水平表现出一定的升高可能是果蝇机体对于Imd免疫途径缺陷的一种补偿现象, 但这一现象并未使果蝇死亡率下降, 这也从一个侧面说明Toll途径在对DR186的免疫中不起主要作用。Dif位于Toll途径, 其作用是启动下游靶基因, 也就是抗菌肽Drosomycin基因的转录。一般认为Toll途径主要与真菌感染相关, 对革兰氏阴性菌不敏感。在这一蛋白突变后, Drosomycin的表达量受到了影响(图 4-C)。Dif突变体果蝇对DR186的敏感程度比起野生型变化不大, 说明Toll途径在对DR186的免疫中不起主要作用。
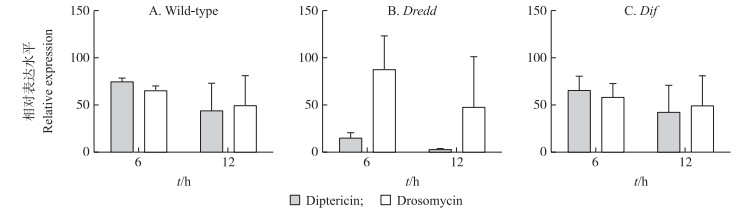
|
图 4 S.nematodiphila DR186血腔侵染对果蝇体内抗菌肽表达的影响 Figure 4 Effects of the hemocoel infection by S.nematodiphila DR186 on the expression of antimicrobial peptides in flies A. DR186血腔侵染野生型果蝇后的抗菌肽相对表达水平; B. DR186血腔侵染Imd途径Dredd突变体果蝇后的抗菌肽相对表达水平; C. DR186血腔侵染Toll途径Dif突变体果蝇后的抗菌肽相对表达水平。 A. Antimicrobial peptides expression level of wild-type flies infected by DR186;B. Antimicrobial peptides expression level of Dredd mutant flies infected by DR186;C. Antimicrobial peptides expression level of Dif mutant flies infected by DR186. |
在血腔侵染条件下, 昆虫病原线虫共生菌S.nematodiphila DR186、S.nematodiphila R187、Photorhabdus luminescens和Xenorhabdus nematophila以及非昆虫病原线虫共生菌菌株S.marcescens Db11都能导致被侵染果蝇的死亡[22-24]。但在Aymeric等[22]的研究中, P.luminescens和X.nematophila无法通过饲喂的方法致死果蝇。这些研究表明S.nematodiphila是目前发现的昆虫病原线虫共生菌中具有胃毒活性的共生菌, 因此具有较广阔的生防药剂开发潜力。Zhang等[11]研究发现去除S.nematodiphila后, 其共生线虫Heterorhabditidoides对Galleria mellonella的致死活性降低了92.2%, 表明昆虫病原线虫共生菌菌株DR186和R187的杀虫能力并不依赖于与之共生的Heterorhabditidoides, 这与Heterorhabditidoides-Serratia共生体中起主要杀虫作用的是共生菌S.nematodiphila的结论一致[10-11]。同时结合肠道侵染死亡速率远远慢于血腔侵染的试验现象, 猜想Heterorhabditidoides-Serratia共生体对宿主昆虫的侵染过程中, 昆虫病原线虫的主要作用是共生菌入侵的载体, 被侵染的昆虫主要死于共生菌造成的败血症。如此共生的2个物种都充分发挥了自身在侵染过程中的优势, 提高了致死被侵染昆虫的效率, 从而给双方都带来生存优势。
这一结果也提示:在将Heterorhabditidoides-Serratia共生体开发为生物农药研究中, 把共生体整体投放到田间进行防治的效果会好于单独使用线虫或共生菌。在开发中, 应将研究重点集中在保持共生菌对人、畜及环境安全前提下, 提高其杀虫能力也许可以更快取得突破。
3.2 果蝇体液免疫的Imd途径在抵抗共生菌S.nematodiphila的侵染中起主要作用共生菌S.nematodiphila DR186在侵染果蝇成虫时, Imd途径突变体(Toll途径健全)的敏感程度要高于野生型, 而Toll途径突变体(Imd途径健全)与野生型的敏感程度基本相同。在同一时间内果蝇血腔内共生菌计数Imd途径突变体要高于野生型, 而Toll途径突变体血腔内共生菌计数与野生型的基本相同。本研究结果与Nehme等[23]关于S.marcescens Db11的研究结果相似。荧光定量PCR分析显示, 对共生菌敏感Imd途径的Dredd突变体中Imd信号途径介导的抗菌肽Diptericin的表达水平很低, 而在野生型与Toll途径突变体中, 这一抗菌肽的表达水平波动不明显。同时, Toll途径介导的Drosomycin的正常表达并未能提高Imd途径突变体果蝇对该共生菌菌株的抗性, 这一现象与仇汝龙等[24]的研究结果类似。因此, 主要抵抗S.nematodiphila DR186作用的还是对革兰氏阴性菌敏感的Imd途径。
在肠道侵染试验中, Imd途径的PGRP-LC突变体果蝇的死亡速率与Toll途径的Dif突变体和野生型果蝇相近, 该结果与血腔侵染的不同。这与Nehme等[23]的研究结果类似。而其他Imd途径免疫突变体果蝇对共生菌则具有较高的敏感性, 这提示在果蝇的肠道中存在除PGRP-LC以外的其他肽聚糖识别受体, 或者蛋白识别病原菌的因子或途径可以诱导免疫反应, 从而对果蝇形成了保护。Imd途径的PGRP-LC下游的信号分子Dredd和转录因子Relish突变体果蝇的死亡速率快于其他突变体和野生型果蝇, 这也验证了这一推测。
3.3 同源的昆虫病原线虫共生菌之间对果蝇的致病性存在差异谭谨[27]的研究结果表明, S.nematodiphila DR186与S.nematodiphila R187虽然同为RG081015线虫体内的2种同源共生菌, 但是两者在菌落形态和生理生化特征等方面还是存在很明显的差异, 两者的单菌落在培养24 h后都会产生色素, 但S.nematodiphila DR186产生的色素为深红色, 而S.nematodiphila R187产生的色素为橘红色或浅红色; S.nematodiphila DR186可以利用丙二酸盐, 但S.nematodiphila R187则不能利用。结合仇汝龙等[24]的研究结果, 在血腔侵染过程中S.nematodiphila DR186对Imd途径突变体的致死率在14 h就可达到100%, 明显高于同时间点S.nematodiphila R187的致死率(60%)。野生型和2种突变体果蝇中抗菌肽的表达量波动也有明显差别, S.nematodiphila DR186在不到12 h就导致果蝇抗菌肽的表达量先上调后下调, 说明相对于S.nematodiphila R187来说, 其对果蝇免疫系统具有更强的破坏力, 可以在更短的时间内致死果蝇。因此, 次生代谢产物和生理生化特性方面的差异有可能是导致2种共生菌对果蝇致病性差异的重要原因。通过不同共生菌对果蝇致病力差异变化的研究, 也为研发具有更强致病力Heterorhabditidoides-Serratia共生体组合的生物农药起到指导意义。
| [1] | Crowder D W, Northfield T D, Strand M R, et al. Organic agriculture promotes evenness and natural pest control[J]. Nature, 2010, 466: 109–112. DOI: 10.1038/nature09183 |
| [2] | 吴文丹, 尹姣, 曹雅忠, 等. 我国昆虫病原线虫的研究与应用现状[J]. 中国生物防治学报, 2014(6): 817–822. |
| [3] | Ehlers R U. Entomopathogenic nematodes in the European biocontrol market[J]. Communications in Agricultural and Applied Biological Sciences, 2003, 68(68): 3–16. |
| [4] | Dubey J, Tiwary B N, Ganguly S. Biological control of insect pests using entomopathogenic nematodes[J]. Practical Tissue Culture Applications, 2013, 2013: 387–398. |
| [5] | Gatsogiannis C, Lang A E, Meusch D, et al. A syringe-like injection mechanism in Photorhabdus luminescens toxins[J]. Nature, 2013, 495(7442): 520–523. DOI: 10.1038/nature11987 |
| [6] | Hinchliffe S J. Insecticidal toxins from the photorhabdus and xenorhabdus bacteria[J]. Open Toxinology Journal, 2013, 3(1): 101–118. DOI: 10.2174/1875414701003010101 |
| [7] | Koppenhofer A M, Grewal P S, Fuzy E M. Differences in penetration routes and establishment rates of four entomopathogenic nematode species into four white grub species[J]. Journal of Invertebrate Pathology, 2007, 94(3): 184–195. DOI: 10.1016/j.jip.2006.10.005 |
| [8] | Vieux P D L, Malan A P. Prospects for using entomopathogenic nematodes to control the vine mealybug, planococcus ficus, in South African vineyards[J]. South African Journal for Enology and Viticulture, 2015, 36: 59–70. |
| [9] | Georgis R. The role of biotechnology companies in commercialization of entomopathogenic nematodes[C]//Proceedings of the International Congress of Nematology. Veldhoven, The Netherlands, 1990:294-306. |
| [10] | Zhang C X, Yang S Y, Xu M X, et al. A novel species of Serratia, family Enterobacteriaceae:Serratia nematodiphila sp.nov., symbiotically associated with entomopathogenic nematode Heterorhabditidoides chongmingensis(Rhabditida:Rhabditidae)[J]. International Journal of Systematic and Evolutionary Microbiology, 2009, 59: 1603–1608. DOI: 10.1099/ijs.0.003871-0 |
| [11] | Zhang C X, Liu J R, Xu M X, et al. Heterorhabditidoides chongmingensis gen.nov., sp.nov.(Rhabditida:Rhabditidae), a novel member of the entomopathogenic nematodes[J]. Journal of Invertebrate Pathology, 2008, 98(2): 153–168. DOI: 10.1016/j.jip.2008.02.011 |
| [12] | Fischer-Le Saux M, Viallard V, Brunel B, et al. Polyphasic classification of the genus Photorhabdus and proposal of new taxa:P.luminescens subsp.luminescens subsp.nov., P.luminescens subsp.akhurstii subsp.nov., P.luminescens subsp.laumondii subsp.nov., P.temperata sp.nov., P.temperata subsp.temperata subsp.nov.and P.asymbiotica sp.nov[J]. International Journal of Systematic Bacteriology, 1999, 4: 1645–1656. |
| [13] | Plichta K L, Joyce S A, Clarke D, et al. Heterorhabditis gerrardi n.sp.(Nematoda:Heterorhabditidae):the hidden host of Photorhabdus asymbiotica(Enterobacteriaceae:gamma-Proteobacteria)[J]. Journal of Helminthology, 2009, 83(4): 309–320. DOI: 10.1017/S0022149X09222942 |
| [14] | Kanga F N, Waeyenberge L, Hauser S, et al. Distribution of entomopathogenic nematodes in Southern Cameroon[J]. Journal of Invertebrate Pathology, 2012, 109(1): 41–51. DOI: 10.1016/j.jip.2011.09.008 |
| [15] | Forst S, Dowds B, Boemare N, et al. Xenorhabdus and Photorhabdus spp.:bugsthatkillbugs[J]. Microbiology, 1997, 51(51): 47–72. |
| [16] | 刘甜, 罗开珺. 果蝇Toll和IMD信号通路中的功能结构域[J]. 环境昆虫学报, 2011, 33(3): 388–395. |
| [17] | Atilano M L, Pereira P M, Vaz F, et al. Bacterial autolysins trim cell surface peptidoglycan to prevent detection by the Drosophila innate immune system[J]. Elife Sciences, 2014, 3(3): e02277. |
| [18] | Gottar M, Gobert V, Michel T, et al. The Drosophila immune response against Gram-negative bacteria is mediated by a peptidoglycan recognition protein[J]. Nature, 2002, 416(6881): 640–644. DOI: 10.1038/nature734 |
| [19] | Naitza S, Rosse C, Kappler C, et al. The Drosophila immune defense against gram-negative infection requires the death protein dFADD[J]. Immunity, 2002, 17(5): 575–581. DOI: 10.1016/S1074-7613(02)00454-5 |
| [20] | Leulier F, Rodriguez A, Khush R S, et al. The Drosophila caspase Dredd is required to resist gram-negative bacterial infection[J]. EMBO Reports, 2000, 1(4): 353–358. DOI: 10.1093/embo-reports/kvd073 |
| [21] | Choe K M, Werner T, Stoven S, et al. Requirement for a peptidoglycan recognition protein(PGRP)in relish activation and antibacterial immune responses in Drosophila[J]. Science, 2002, 296(5566): 359–362. DOI: 10.1126/science.1070216 |
| [22] | Aymeric J L, Givaudan A, Duvic B. Imd pathway is involved in the interaction of Drosophila melanogaster with the entomopathogenic bacteria, Xenorhabdus nematophila and Photorhabdus luminescens[J]. Molecular Immunology, 2011, 47(14): 2342–2348. |
| [23] | Nehme N T, Liegeois S, Kele B, et al. A model of bacterial intestinal infections in Drosophila melanogaster[J]. PLoS Pathogens, 2007, 3(11): e173. DOI: 10.1371/journal.ppat.0030173 |
| [24] |
仇汝龙, 刘众杰, 李岳虎, 等. 昆虫病原线虫Heterorhabditidoides rugaoensis及其共生菌Serratia nematodiphila R187与黒腹果蝇免疫系统的互作研究[J].
南京农业大学学报, 2015, 38(3): 409–416.
Qiu R L, Liu Z J, Li Y H, et al. Interaction between immune system of adult Drosophila melanogaster with entomopathogenic nematode Heterorhabditidoides rugaoensis and its symbiotic bacterium Serratia nematodiphila R187[J]. Journal of Nanjing Agricultural University, 2015, 38(3): 409–416. DOI: 10.7685/j.issn.1000-2030.2015.03.009 (in Chinese with English abstract) |
| [25] | Apidianakis Y, Rahme L G. Drosophila melanogaster as a model host for studying Pseudomonas aeruginosa infection[J]. Nature Protocols, 2009, 4(9): 1285–1294. DOI: 10.1038/nprot.2009.124 |
| [26] | Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J]. Methods, 2001, 25(4): 402–408. DOI: 10.1006/meth.2001.1262 |
| [27] |
谭谨. 拟异小杆属新种RG081015及其共生菌DDR186和R187的分类鉴定[D]. 南京: 南京农业大学, 2010.
Tan J. Identification of the novel Entomopathogenic nematodes species RG081015 of the genus Heterorhabditidoides and its symbiotic bacteria strains DR186 and R187[D]. Nanjing:Nanjing Agricultural University, 2010(in Chinese with English abstract). http://cdmd.cnki.com.cn/article/cdmd-10307-1012272768.htm |




