文章信息
- 乔策策, 王甜甜, 王若斐, 刘超, 高琦, 李荣, 沈其荣
- QIAO Cece, WANG Tiantian, WANG Ruofei, LIU Chao, GAO Qi, LI Rong, SHEN Qirong
- 高效溶磷菌的筛选及其促生效应研究
- Screening phosphate solubilizing bacterial strains from maize rhizosphere and research on their plant growth promotion effect
- 南京农业大学学报, 2017, 40(4): 664-670
- Journal of Nanjing Agricultural University, 2017, 40(4): 664-670.
- http://dx.doi.org/10.7685/jnau.201606030
-
文章历史
- 收稿日期: 2016-06-22
磷是限制植物生长的主要营养元素之一, 施入的磷肥当季作物利用率为5%~25%。大部分磷与土壤中的Ca2+、Fe3+、Fe2+、Al3+结合, 形成难溶性磷酸盐[1], 因而大部分磷肥以难溶的无效态在土壤中积累。释放这些被固定在土壤中的磷对于提高土壤磷素有效性、减少磷肥使用量具有重要意义[2]。
植物根际促生菌(PGPR)指生存于植物根际、根表并能直接或间接地促进与调节植物生长的微生物, 其中溶磷细菌能够将难溶性磷酸盐, 如磷矿粉中的磷转化为水溶性态, 从而供植物吸收利用[3-5]。该类细菌既能活化土壤中难溶性磷素, 还可以通过影响植物根系分泌物的种类和数量, 增加植物根系对周围K、Ca、Mg、Fe和Zn等营养元素的吸收, 提高植物的抗逆性, 使植物能够在酸性、缺磷等胁迫生境下生长。近年来, 国内外越来越多的学者对溶磷微生物进行深入研究[6-7], 目前的研究主要集中在溶磷微生物的分离与筛选, 溶磷微生物的溶磷能力、溶磷菌制剂的使用效果等方面[8-9]。研究表明:溶磷微生物具有显著活化难溶性无机磷的作用和促进作物生长的效果[10]。因此, 有必要从自然条件下的植株根际筛选高效溶磷菌株, 以活化土壤中难溶性磷素, 促进农作物对磷的吸收。本试验采用无机磷培养基初筛, NBRIP液体培养基定量复筛的方法, 分离玉米根际溶磷细菌, 通过盆栽和大田试验评估所分离溶磷细菌对玉米的促生与增产效果, 以期为农业生产提供高效溶磷菌株。
1 材料与方法 1.1 供试材料与培养基供试玉米品种为‘苏玉29’, 购自江苏省农业科学研究院。菌株分离用土壤样品采集于吉林省通化市玉米大田。
盆栽供试普通有机肥由江阴市联业生物科技有限公司提供。有机肥基本性质:有机质491.20 g·kg-1, 全氮17.70 g·kg-1, 全磷20.91 g·kg-1, 全钾15.97 g·kg-1。盆栽试验用土壤采集自宜兴山区草地土, 理化性质:pH值6.33, 有机质21.21 g·kg-1, 全氮2.01 g·kg-1, 全磷1.67 g·kg-1, 速效磷11.15 mg·kg-1, 速效钾131.00 mg·kg-1, 全钾12.30 g·kg-1。
普通有机肥由江阴市联业生物科技有限公司提供, 化肥选用尿素(N, 46.6%)、过磷酸钙(P2O5, 12.0%)、硫酸钾(K2O, 52.0%)。复合微生物肥料:每100 kg普通有机肥与20 L氨基酸水解液混合, 然后每20 kg添加NJAU-B8发酵液1 L, 经过二次发酵, 得到生物有机肥, 添加化学养分至总氮(N)、全磷(P2O5)和全钾(K2O)养分分别为80、40和30 g·kg-1,即为含菌株NJAU-B8复合微生物肥料, 肥料有效活菌数不少于0.5×108 CFU·g-1。不接种功能菌且采用同样工艺发酵成的混合体, 同时添加养分至与复合微生物肥料一致, 形成有机-无机复混肥。
分离培养基(改良后的PVK培养基)[11]:葡萄糖10 g, 硫酸铵0.5 g, 硫酸镁0.3 g, 氯化钠0.3 g, 氯化钾0.2 g, 硫酸铁0.03 g, 硫酸锰0.03 g, 磷酸三钙5 g, 蒸馏水1 000 mL, pH6.5~7.0。115 ℃灭菌30 min。
筛选培养基采用国际植物研究所磷酸盐生长培养基(NBRIP):葡萄糖10 g, 磷酸三钙5 g, 氯化镁5 g, 硫酸镁0.25 g, 氯化钾0.2 g, 硫酸铵0.1 g, 蒸馏水1 000 mL, pH7.0。115 ℃灭菌30 min。
1.2 溶磷菌初筛和复筛将玉米根在自来水下轻轻冲洗2 min, 去掉根际表面附着土。然后用无菌水冲洗干净, 将根剪下, 加入带玻璃珠并装有100 mL无菌水的250 mL锥形瓶中, 25 ℃、170 r·min-1振荡20 min形成土壤悬液, 分别吸取10-2、10-3、10-4、10-5稀释倍数的土壤悬液0.1 mL, 涂布于无机磷培养平板上, 每个浓度3个重复, 28 ℃培养5 d, 在平板上挑选周围产生溶磷圈的菌落, 纯化5次以上, 选取仍然有溶磷圈的菌落转至斜面培养, 4 ℃保藏备用[12]。将纯化后的菌种接种于改良的PVK培养基上, 置于30 ℃培养箱培养7 d, 测量溶磷圈和菌落直径, 并计算出溶磷圈和菌落直径的比值(D/d值)。
选择溶磷圈直径较大或其与菌落直径比值较大的菌株, 接种到NBRIP培养基中, 30 ℃、170 r·min-1培养48 h, 取样测定培养液中有效磷浓度; 7 d后测定培养液中有效磷含量[13], 设不接菌对照, 处理与对照均设3个重复。
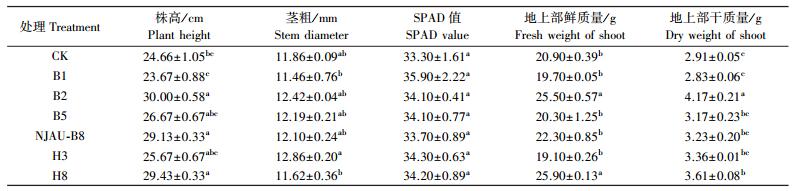
1.3 盆栽试验2季盆栽试验于2014年6月2日至10月24日在江苏省固体有机废弃物资源化利用高技术研究重点实验室温室内进行。共设2个处理:1) 不接菌对照; 2) 单菌处理, 接种量为1×108 CFU·g-1, 每个处理6个重复, 每个盆钵装土2.0 kg, 添加1.5%(质量分数)的普通有机肥与土拌匀作为基肥; 选取长势均一的种苗移栽, 于42 d时测定各处理的株高、茎粗、叶绿素相对含量测量值(SPAD值)、地上部鲜质量和地上部干质量。
1.4 菌株的鉴定菌落形态及生理生化特征鉴定参照《伯杰细菌鉴定手册》(第8版)进行。基于16S rDNA序列的分子生物学鉴定参照文献[14]进行。
1.5 田间试验设计田间试验于2015年3月至2016年4月在南通市海安县基本农田中进行。供试土壤为黄壤土, 理化性质:pH值7.31, 有机质含量24.13 g·kg-1, 全氮含量2.29 g·kg-1, 全磷含量4.08 g·kg-1, 速效磷含量21.1 mg·kg-1, 速效钾含量119 mg·kg-1, 全钾含量7.94 g·kg-1。田间试验连续轮作种植3季作物:玉米、白菜和土豆。共设置3个处理:1) 化肥对照(CF); 2) 有机-无机复混肥处理(AOF); 3) 含菌株NJAU-B8复合微生物肥料处理(BIO)。每个处理3个重复, 每个小区面积为30 m2。3季大田各处理按照等养分施肥, 施入总氮(N)含量为240 kg·hm-2, 全磷(P2O5)含量为120 kg·hm-2, 全钾(K2O)含量为90 kg·hm-2。每季有机-无机复混肥和生物有机肥均施入3 000 kg·hm-2, 其余养分用尿素、过磷酸钙和硫酸钾按总养分补齐; 化肥处理直接施入相应养分的尿素、过磷酸钙和硫酸钾。肥料分2次施用, 种苗前施入总养分的50%作为基肥(包括有机-无机复混肥或复合微生物肥料及相应养分的化肥), 剩余的50%养分于初果期追肥施用。
1.6 数据分析采用Excel 2007和SPSS 22.0软件进行数据统计分析, 使用最小显著差异法(least significant difference, LSD)检验进行多重比较(P < 0.05)。
2 结果与分析 2.1 溶磷细菌的平板初筛结果利用改良的PVK培养基, 从玉米大田根际土壤中初步筛选获得8株具有解无机磷能力的菌株, 分别命名为:B1、B2、B5、B6、NJAU-B8、B9、H3和H8。从表 1可知:PVK培养基上培养5 d后产生的溶磷圈直径为0.9~2.6 cm, 其中菌株B2的溶磷圈直径最大, 达到2.6;溶磷圈直径与菌落直径比值为2.2~12.3, 菌株B2、B5、NJAU-B8、H3、H8溶磷的D/d值大于5.0, 其中菌株B5的比值最大, 达到12.3。
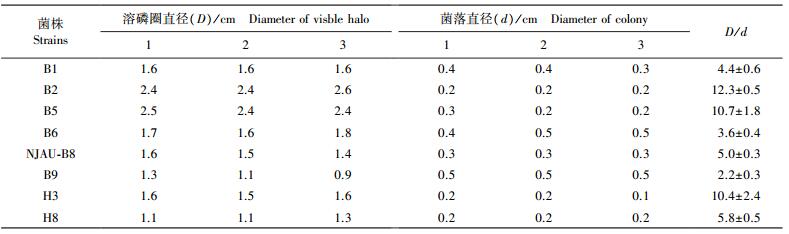
|
在初筛的基础上, 对溶磷菌株进行摇瓶复筛试验。由表 2可以看出:相对于不接菌对照, 菌株NJAU-B8有效磷增加量在接种后6 d最高, 达到482.25 mg·L-1, 菌株B2、NJAU-B8、H3的有效磷增加量大于200.00 mg·L-1。
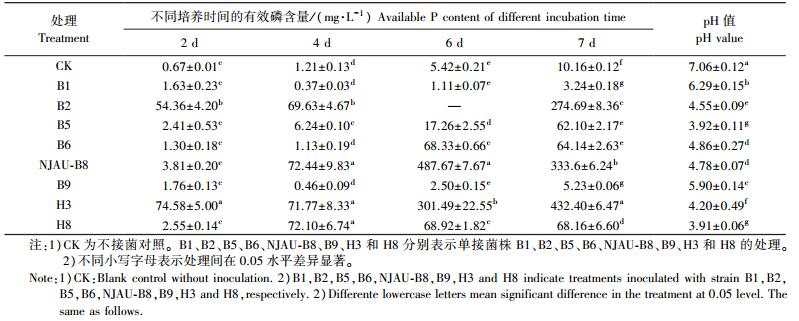
|
从溶磷菌株有效磷含量随时间变化来看, 在7 d的培养过程中, 前4 d的溶磷效果比较平稳。在4~6 d, 菌株H3、NJAU-B8、B6溶磷效果明显增加; CK、B1、B6、B9、H8的溶磷效率变化趋势不大; H3、B5在试验中的溶磷效果在6~7 d持续增加; 菌株NJAU-B8的有效磷含量在培养6 d时高于其他菌株, 达到487.67 mg·L-1。培养7 d后所有菌株培养液的pH值均有所下降, 为3.91~6.29。
2.3 菌株的鉴定菌株NJAU-B8在LB平板上的菌落较小, 呈淡黄色, 并能产生黄色色素, 边缘平滑, 具有一定的黏性, 不易挑起。革兰氏染色阴性, 菌体着色均匀, 呈杆状, 两端钝平, 呈不规则形状。淀粉水解反应、VP反应、接触酶反应、利用柠檬酸盐反应、硝酸盐还原、石蕊牛奶还原胨化、甲基红反应、明胶液化反应均呈阳性, D-果糖、麦芽糖、阿拉伯糖、木糖、乳糖利用均呈阳性, 发酵葡萄糖产酸不产气, 厌氧条件下不生长, 7% NaCl生长。利用NJAU-B8菌株的16S rDNA序列(登录号为KX421207) 所构建发育树如图 1所示, 菌株NJAU-B8与唐菖蒲伯克霍尔德菌Bukhdderia gladioli(EU024168) 同源性达到99%。结合菌株的形态特征、理化特性和16S rDNA序列分析, 将菌株NJAU-B8初步鉴定为伯克霍尔德菌属细菌。
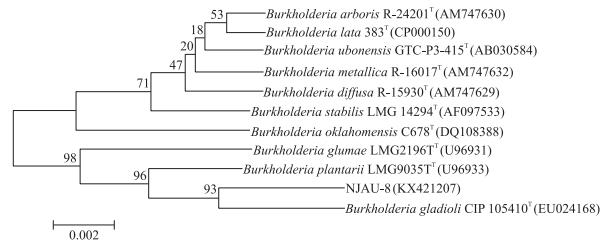
|
图 1 菌株NJAU-B8的系统发育树 Figure 1 The phylogenetic tree of strain NJAU-B8 |
相比于不接菌处理, 第1季玉米盆栽试验中, 除菌株B1处理外, 接种不同菌株处理均对玉米植株苗期有促生效果(表 3)。其中菌株NJAU-B8处理的促生效果除H8处理最优, 株高、茎粗、SPAD值、地上部鲜质量和地上部干质量较不接菌处理(CK)分别增加40.37%、18.74%、1.32%、46.67%和4.08%。另外, NJAU-B8处理的株高高于菌株B1、B2、B5、H3处理。第2季玉米盆栽试验中, 菌株NJAU-B8处理的株高、茎粗、SPAD值、地上部鲜质量和地上部干质量较CK分别增加22.18%、2.02%、1.20%、16.26%和35.53%(表 4)。各处理株高由高到底依次为:NJAU-B8、B2、H8、B5、H3、B1、CK。除菌株B1处理外, 接种功能菌的处理玉米株高均优于CK, 其中菌株NJAU-B8处理的地上部鲜质量和干质量也达到较高水平。
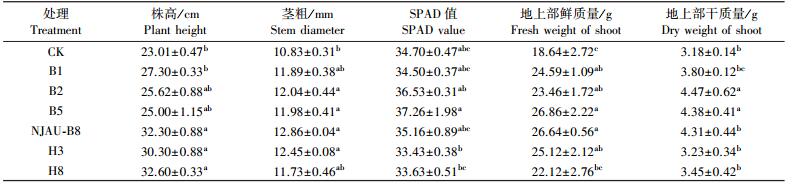
|
|
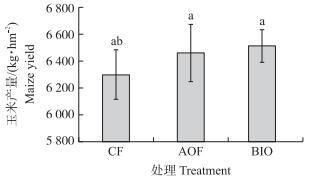
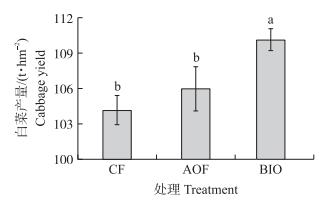
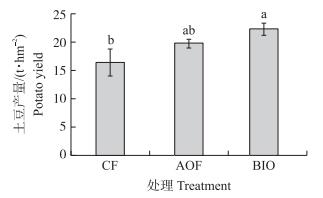
据以上盆栽试验效果, 选择菌株NJAU-B8研制成生物有机肥并进一步进行田间试验。如图 2所示:第1季田间试验, 各处理间玉米产量无显著性差异, 但BIO和AOF处理分别比CF处理增产3.26%和2.46%;第2季田间试验中, BIO处理的白菜产量显著高于CF和AOF处理(图 3); 第3季田间试验结果显示, BIO处理的土豆产量比AOF和CF处理分别增产11.29%和26.41%(图 4)。
|
图 2 第1季大田试验玉米产量 Figure 2 Maize yield in the first season field experiment CF:化肥处理Chemical fertilizer treatment; AOF:有机-无机复混肥处理Organic-inorganic compound fertilizer treatment; BIO:复合微生物肥料处理Compound microbial fertilizer treatment. The same as follows. |
|
图 3 第2季大田试验白菜产量 Figure 3 Cabbage yield in the second season field experiment |
|
图 4 第3季大田试验土豆产量 Figure 4 Potato yield in the third season field experiment |
磷是植物重要的营养元素之一, 研究结果表明:植物根际微生物的活动对植物磷素营养影响很大[15]。其中, 溶磷菌或解磷菌能够将植物难以吸收利用的难溶性或不溶性磷转化为可利用的形态, 还能改善植物营养, 分泌生长调节物质, 促进根系生长等[16]。
本研究首先从大田玉米根际土壤中分离筛选了8株具有溶磷能力的细菌, 将溶磷菌株在含有难溶性磷酸盐的固体培养基上培养, 测定菌落周围产生的透明圈大小; 然后进行NBRIP液体培养, 测定培养液可溶性磷含量, 结果显示菌株NJAU-B8在接种6 d时的有效磷含量达到487.67 mg·L-1, 在所选菌种中最高。与现有资料报道[17-18]相比, NJAU-B8溶解无机磷的能力很高。将筛选出的菌株保活进行灌根盆栽试验, 从两季盆栽试验结果可知, 根际促生菌处理(NJAU-B8) 与对照处理(CK)相比, 能够显著促进植株的生长。这个结果与申莉莉等[19]筛选的芽孢杆菌Ba33发酵液在烟草上灌根的应用结果相同; 此外, 朱培淼等[20]筛选的玉米根际促生菌K3采用同样的方式同样表明根际促生菌对玉米具有显著的促生作用。施用溶磷菌剂后蓖麻和海滨锦葵的株高、茎粗、鲜质量、干质量以及叶片的叶绿素含量均高于CK[21]。本研究中, 大田试验第1季玉米产量各处理间差异不显著, 但复合微生物肥料处理产量要高于其他2个处理; 第2季白菜、第3季土豆增产显著, 其中BIO处理的土豆比AOF处理增产11.29%, 表明含功能菌NJAU-B8的复合微生物肥料(BIO)具有很好的田间增产效果。吴海燕[22]发现施入溶磷生物肥对玉米整个生育期的营养生长以及生物产量和籽实产量有促进作用; 李晓举等[23]亦发现施用溶磷菌肥的烤烟产量比对照提高4.31%。本研究虽在第1季复合微生物肥料处理的产量增加效应不显著, 但第2季和第3季连续施用后, 增产效果明显, 表明利用NJAU-B8研制成的复合微生物肥料具有田间应用价值。
基于溶磷能力的初筛和玉米盆栽促生试验的复筛以及玉米-白菜-土豆轮作大田试验的验证, 最终得到1株效果最优的菌株NJAU-B8, 通过分子生物学及形态特征初步鉴定菌株NJAU-B8为伯克霍尔德菌属细菌。伯克霍尔德菌具有易筛选培养、易保存等优点[24-25]。因此, 本研究分离获得的解磷菌株及利用其研制的复合微生物肥料具有很好的应用前景。
| [1] | Tao G C, Tian S J, Cai M Y, et al. Phosphate-solubilizing and mineralizing abilities of bacteria isolated from soils[J]. Pedosphere, 2008, 18: 515–523. DOI: 10.1016/S1002-0160(08)60042-9 |
| [2] | Adesemoye A O, Torbert H A, Kloepper J W. Plant growth promoting rhizobacteria allow reduced application rates of chemical fertilizers[J]. Microbial Ecology, 2009, 58: 921–929. DOI: 10.1007/s00248-009-9531-y |
| [3] |
朱颖, 姚拓, 李玉娥, 等. 红三叶根际溶磷菌分离及其溶磷机制初探[J].
草地学报, 2009, 17(2): 259–263.
Zhu Y, Yao T, Li Y E, et al. Screening of phosphate-solubilizing bacteria and their acting mechanisms in the rhizosphere of Red Clover[J]. Acta Agrestia Sinica, 2009, 17(2): 259–263. DOI: 10.11733/j.issn.1007-0435.2009.02.024(in Chinese with English abstract) |
| [4] |
林启美, 王华, 赵小蓉, 等. 一些细菌和真菌的解磷能力及其机理初探[J].
微生物学通报, 2001, 28(2): 26–30.
Lin Q M, Wang H, Zhao X R, et al. Capacity of some bacteria and fungi in dissolving phosphate rock[J]. Microbiology China, 2001, 28(2): 26–30. (in Chinese with English abstract) |
| [5] | Rudresh D L, Shivaprakash M K, Prasad R D. Effect of combined application of Rhizobium, phosphate solubilizing bacterium and Trichoderma spp. on growth, nutrient uptake and yield[J]. Applied Soil Ecology, 2005, 28: 139–146. DOI: 10.1016/j.apsoil.2004.07.005 |
| [6] |
陶涛, 叶明, 刘冬, 等. 无机解磷细菌的筛选、鉴定及其溶磷能力研究[J].
合肥工业大学学报(自然科学版), 2011, 34(2): 304–308.
Tao T, Ye M, Liu D, et al. On isolation and identification of inorganic Phosphbacteria and its phosphate-solubilizing capacity[J]. Journal of Hefei University of Technology(Natural Science Edition), 2011, 34(2): 304–308. (in Chinese with English abstract) |
| [7] | Oliveira C A, Alves V M C, Marriel I E, et al. Phosphate solubilizing microorganisms isolated from rhizosphere of maize cultivated in an oxisol of the Brazilian Cerrado Biome[J]. Soil Biology and Biochemistry, 2008, 41(9): 1782–1787. |
| [8] |
胡晓峰. 溶磷菌的筛选、溶磷条件优化及对玉米的促生作用研究[D]. 南京: 南京农业大学, 2010.
Hu X F. Screening of phosphate solubilizing bacteria optimization of phosphate dissolving conditions and ITS promotion to maize growth[D]. Nanjing:Nanjing Agricultural University, 2010(in Chinese with English abstract). |
| [9] |
戴沈艳, 申卫收, 贺云举, 等. 一株高效解磷细菌的筛选及其在红壤性水稻土中的施用效果[J].
应用与环境生物学报, 2011, 17(5): 678–683.
Dai S Y, Shen W S, He Y J, et al. Screening of efficient phosphate-solubilizing bacterial strain and its application in red paddy soil to rice cultivation[J]. Chinese Journal of Applied and Environmental Biology, 2011, 17(5): 678–683. (in Chinese with English abstract) |
| [10] | Akhtar M S, Siddiqui Z A. Effects of phosphate solubilizing microorganisms and Rhizobium sp.on the growth, nodulation, yield and root-rot disease complex of chickpea under field condition[J]. African Journal of Biotechnology, 2009, 8: 3489–3496. |
| [11] |
中国科学院南京土壤研究所微生物室.
土壤微生物研究法[M].北京: 科学出版社, 1985: 51.
Microbilogy Lab, Institute of Soil Science, Chinese Academy of Sciences. Microorganism Research[M].Beijing: Science Press, 1985: 51. (in Chinese with English abstract) |
| [12] | Nautiyal C S. A method for selection and characterization of rhizosphere-competent bacteria of chickpea[J]. Current Microbiology, 1997, 34: 12–17. DOI: 10.1007/s002849900136 |
| [13] |
程宝森, 房玉林, 刘延琳, 等. 渭北旱塬葡萄根际解磷细菌的筛选及其对葡萄的促生效应[J].
西北农业学报, 2009, 18(4): 185–190.
Cheng B S, Fang Y L, Liu Y L, et al. Screening and promotion effect of phosphate-solubilizing bacteria from grapevine rhizosphere in Weibei semi-arid plateau[J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2009, 18(4): 185–190. (in Chinese with English abstract) |
| [14] | Yang C L, Li R, Song Y, et al. Identification of the biochemical degradation pathway of triazophos and its intermediate in Diaphorobacter sp. TPD-1[J]. Current Microbiology, 2011, 62: 1294–1301. DOI: 10.1007/s00284-010-9859-z |
| [15] |
肖春玲, 宋勇生, 王安萍, 等. 菜园根际土壤解磷真菌的分离筛选及初步鉴定[J].
井冈山大学学报(自然科学版), 2012, 33(4): 48–51.
Xiao C L, Song Y S, Wang A P, et al. Isolation and screening of phosphate-solubilizing fungi from the rhizospheric soil and its preliminary identification[J]. Journal of Jinggangshan University(Natural Science Edition), 2012, 33(4): 48–51. (in Chinese with English abstract) |
| [16] | Glick B R. Modulation of plant ethylene levels by the bacterial enzyme ACC deaminase[J]. FEMS Microbiology Letter, 2005, 251: 1–7. DOI: 10.1016/j.femsle.2005.07.030 |
| [17] |
郜春花, 卢朝东, 张强. 解磷菌剂对作物生长和土壤磷素的影响[J].
水土保持学报, 2006, 20(4): 54–56.
Gao C H, Lu C D, Zhang Q. Solubilizing agent to the growth of crops and soil phosphorus element[J]. Journal of Soil and Water Conservation, 2006, 20(4): 54–56. (in Chinese with English abstract) |
| [18] |
史国英, 莫燕梅, 岑贞陆. 一株高效解无机磷细菌BS06的鉴定及其解磷能力分析[J].
微生物学通报, 2015, 42(7): 1271–1278.
Shi G Y, Mo Y M, Cen Z L. Identification of an inorganic phosphorus-dissolving bacterial strain BS06 and analysis on its phosphate solubilization ability[J]. Microbiology China, 2015, 42(7): 1271–1278. (in Chinese with English abstract) |
| [19] |
申莉莉, 王凤龙, 钱玉梅, 等. 解淀粉芽孢杆菌Ba33对烟草的促生及抗TMV作用[J].
吉林农业大学学报, 2010, 32(4): 383–386.
Shen L L, Wang F L, Qian Y M, et al. Tobacco growth-promotion effect and TMV resistance of Bacillus amyloliquefaciens Ba33[J]. Journal of Jilin Agricultural University, 2010, 32(4): 383–386. (in Chinese with English abstract) |
| [20] |
朱培淼, 杨兴明, 徐阳春, 等. 高效解磷细菌的筛选及其对玉米苗期生长的促进作用[J].
应用生态学报, 2007, 18(1): 107–112.
Zhu P M, Yang X M, Xu Y C, et al. High effective phosphate-solubilizing bacteria:their isolation and promoting effect on corn seedling growth[J]. Chinese Journal of Applied Ecology, 2007, 18(1): 107–112. (in Chinese with English abstract) |
| [21] |
秦超琦, 吴向华, 郑琨, 等. 解磷菌剂对海滨盐土有效磷含量及耐盐油料植物生长的影响[J].
生态学杂志, 2009, 28(9): 1835–1841.
Qin C Q, Wu X H, Zheng K, et al. Effects of phosphate-solubilizing fungi on costalsaline soil available phosphorous content and salt-tolerant oil plant growth[J]. Chinese Journal of Ecology, 2009, 28(9): 1835–1841. (in Chinese with English abstract) |
| [22] |
吴海燕. 黑土磷素有效性的微生物调控技术及其机理研究[D]. 长春: 吉林农业大学, 2012: 81-93.
Wu H Y. Study on the microbial-control technique on phosphorus nutrient availability and its mechanisms in black soil[D]. Changchun:Jilin Agricultural University, 2012:81-93(in Chinese with English abstract). |
| [23] |
李晓举, 吴风光, 王豹祥, 等. 一株烤烟根际解磷细菌的鉴定及其在烤烟生产中的应用[J].
河南农业科学, 2011, 40(6): 66–70.
Li X J, Wu F G, Wang B X, et al. Identification and application of a phosphate solubilizing bacterium from flue-cured tobacco rhizosphere[J]. Journal of Henan Agricultural Sciences, 2011, 40(6): 66–70. (in Chinese with English abstract) |
| [24] |
韩超, 武贵元, 刘爱新, 等. 吡咯伯克霍尔德氏菌A12筛选鉴定及其对烟草幼苗的促生作用[J].
浙江农业学报, 2012, 24(5): 880–885.
Han C, Wu G Y, Liu A X, et al. Screening and identification of the strain A12 and its effect on tobacco seedling growth[J]. Zhejiang Journal of Agricultural Science, 2012, 24(5): 880–885. (in Chinese with English abstract) |
| [25] |
于晓庆, 郗丽君, 刘永光, 等. 洋葱伯克霍尔德氏菌株Lyc2的鉴定及对棉苗的防病促生作用[J].
植物病理学报, 2007, 37(4): 426–432.
Yu X Q, Xi L J, Liu Y G, et al. Identification of the onion holder strain Lyc2 and its effect on cotton seedling disease prevention and growth promoting[J]. Plant Pathology, 2007, 37(4): 426–432. (in Chinese with English abstract) |




