文章信息
- 周桂信, 舒自美, 张克云
- ZHOU Guixin, SHU Zimei, ZHANG Keyun
- 昆虫线虫一新种——如皋似双胃线虫的鉴定
- Identification of a novel insectivorous nematode species: Diplogasteroides rugaoensis n.sp
- 南京农业大学学报, 2017, 40(4): 618-624
- Journal of Nanjing Agricultural University, 2017, 40(4): 618-624.
- http://dx.doi.org/10.7685/jnau.201607021
-
文章历史
- 收稿日期: 2016-07-18
似双胃线虫属(Diplogasteroides)隶属于线虫门(Nematoda)、色矛纲(Chromadorea)、双胃目(Diplogasterida)、似双胃科(Diplogasteroididae)。目前, 我国对似双胃属线虫的研究未见报道。Diplogasteroides属正式发表的线虫有6种:D.halleri、D.nasuensis[1]、D.magnus[1]、D.andrassyi[2]、D.asiaticus[3]和D.luxuriosae[4]。大量的分子系统学研究发现此属线虫不是单系发生的类群, 在形态学分别对应于单子宫与双子宫2个类群。已有学者提出修正此属的分类地位[5-6], 但是属的修订工作需要物种大量的形态学与分子系统学数据支持。
本课题组于2013年12月对长江三角洲流域的昆虫线虫进行分布调查研究, 采用大蜡螟(Galleria mellonella)幼虫诱捕的方法, 从江苏省如皋市的水稻田土样中分离到1个似双胃线虫属(Diplogasteroides)虫株N3。利用形态学与分子生物学相结合的方法, 该虫株被鉴定为如皋似双胃线虫新种(Diplogasteroides rugaoensis n.sp.)。本研究提高了对昆虫线虫物种的认知丰度, 为如皋似双胃属的修订提供了数据支持, 并且该线虫新种具有一定的防治潜力, 为开发新的生物防治资源提供了理论基础。
1 材料与方法 1.1 样品采集与线虫的分离和培养 1.1.1 土壤样品采集于2013年12月在江苏省如皋市水稻农田中用五点取样法采集深度范围为5~20 cm的土样, 采集量约为1 kg, 用贴有标签(编号、地点和时间)的聚乙烯塑料袋于约15 ℃条件下密封保存并带回实验室。
1.1.2 线虫诱捕及分离根据Bedding等[7]的方法用大蜡螟幼虫诱捕土样中的昆虫线虫。将每个土样分装于5个250 mL的塑料容器中, 分别将5只5龄期的大蜡螟老熟幼虫放入容器中, 颠倒容器混合土样, 使大蜡螟幼虫包埋在土中, 置于(20±2)℃的恒温箱中诱捕。在诱捕中, 定期喷撒少量的水以保持土壤湿润。每隔2~3 d检查1次土样, 将死亡的昆虫幼虫挑出, 用新幼虫来替换已死亡的幼虫。7 d之后, 将死亡大蜡螟幼虫用蒸馏水彻底清洗干净后, 放到培养皿里培养, 直至持久幼虫(dauer juveniles)出现。
1.1.3 线虫的培养线虫均在实验室条件下以大蜡螟老熟幼虫为基质进行培养获得。在铺有2张湿润滤纸的培养皿(60 mm×15 mm)里, 放入15条大蜡螟老熟幼虫, 接入大约2 000条线虫持久幼虫, 置于智能人工气候箱(PRX-250A-30) 中于(20±3)℃培养[8]。
1.2 形态学鉴定 1.2.1 线虫形态特征观察及形态特征测计富集雌性、雄性线虫成虫以及线虫持久幼虫的混合样于1.5 mL离心管内65 ℃热水处死, 用三乙醇胺-福尔马林固定液(TAF)固定[9-10]。将固定的线虫制作成临时玻片标本, 分别随机挑选30条雌性、雄性成虫以及线虫持久幼虫, 在蔡斯显微镜(Axio Imager Alm)下观察其形态特征并拍照, 用形态学软件测量线虫各项形态特征数据, 并按照De Man公式[11]测计。数据用SPSS 20.0软件进行统计处理。
此外, 将以上固定的线虫经丙三醇-乙醇方法脱水, 挑取线虫置于载玻片中间的甘油滴中, 石蜡封片, 制成永久玻片标本[12]。在微分干涉差显微镜(Zeiss Axio Imager A1) 下观察线虫虫体内部的组织结构并拍照。
1.2.2 线虫形态特征的扫描电镜观察将雌性、雄性线虫成虫以及线虫持久幼虫的混合样充分清洗干净, 在用0.1 mol·L-1 pH7.2的PBS配制的3%戊二醛中, 4~8 ℃固定24 h[13]; 再用2%四氧化锇25 ℃固定12 h; 梯度乙醇进行脱水; 用液态CO2临界点干燥; 最后用金进行包埋处理[8, 13], 制成线虫电镜观察样品。用挑针将制备好的线虫样品粘到电镜观察砧板上, 置于扫锚电镜载物台上, 用扫描电镜(Hitachi 5-3000N)观察线虫体表的形态特征。
1.3 分子生物学鉴定单条线虫总DNA的提取方法、核糖体rDNA(rDNA)的18S与ITS片段扩增引物及程序参照Zhang等[14]的方法。PCR产物送华大基因科技有限公司测序, 用Chromas软件核查序列信息后, 将序列在GenBank(http://www.ncbi.nlm.nih.govn)数据库中进行序列同源性比对分析, ITS rDNA只检索到6条序列, 无法达到建立系统进化树的要求。下载有关相近物种的18S rDNA序列, 把所有序列利用MEGA 5软件中的ClustalW程序进行多重比对分析[15], 用Distance程序计算遗传距离。以Rhabditella axei与Caenorhabditis elegans为外群, 通过贝叶斯方法基于虫株N3的18S rDNA序列构建系统发育树。用MrBayes v3.0b4软件建立系统进化树, 采用模型GTR+I+G, 马尔可夫链蒙特卡罗(MCMCMC)运行100万次, 获得10 000个树, 每100次取样1次。去除10%的老化样本, 最后获得的9 000棵树合意为最终树。每个节点上方数值为贝叶斯后验概率[14, 16]。
2 结果与分析 2.1 线虫形态特征测计如皋似双胃线虫的形态特征测计值见表 1。
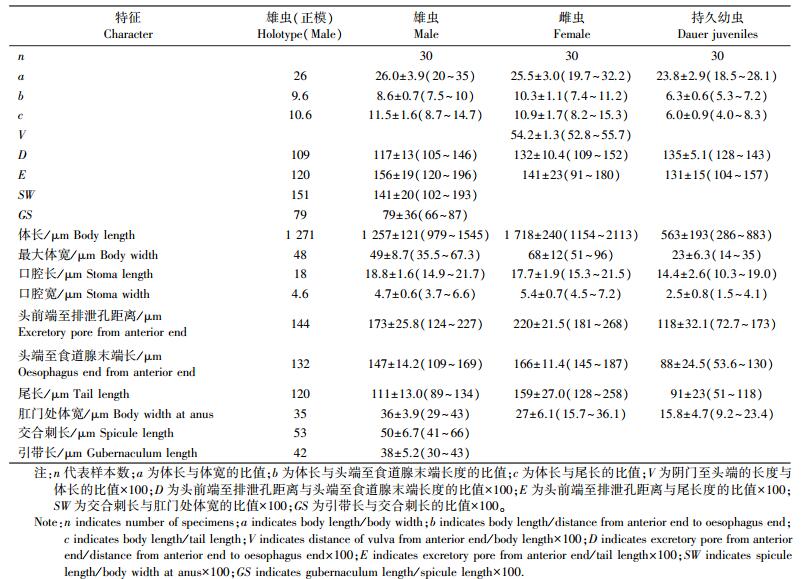
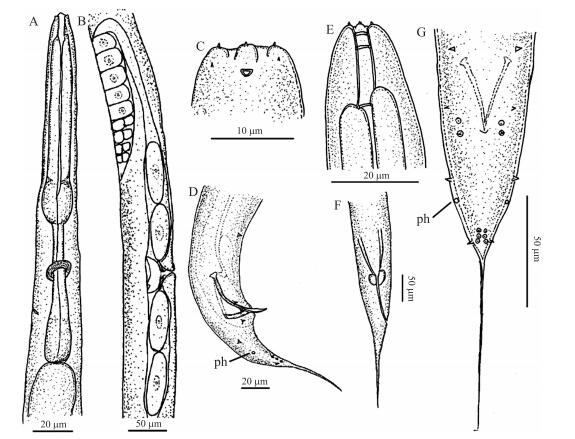
雄虫:65 ℃热杀死后, 尾部向腹侧弯曲, 呈“J”形。虫体圆柱形, 头部和尾部呈锥状; 体表有横向和纵向的条纹, 纵纹发达; 唇区和虫体连续, 没有明显的缢缩; 口腔开口呈六边形; 唇区有6个发育完善且相互分开的唇片, 相互对称, 围绕口孔1圈; 其中4个唇片各有内、外2个锥形乳头状的唇乳突, 内侧唇乳突较外侧唇乳突更加发达, 形态上更大、更尖锐, 另外2个唇片分别具有1个唇乳突; 侧器(头感器)呈椭圆形开口; 有2个“胃”:中食道球与食道基球; 食道前体部圆柱形, 中部膨大形成中食道球, 膨大明显, 发育完善; 中食道球后的体部狭窄, 有神经环环绕, 末端的食道基球退化, 膨大不明显, 与食道后半部分之间区分不明显(图 1-A)。排泄孔位于食道基球中部(图 1-A); 交合刺成对, 向腹部整体均匀弯曲, 刺尖比较圆润(图 1-D、F、G, 图 2-B、D)。交合刺基部从侧面看, 呈弧形弯曲(图 1-D, 图 2-D)。有1对相互平行的骨质化引带, 依交合刺走向弯曲, 与交合刺呈60°左右夹角(图 1-D, 图 2-D)。交合刺两侧各有9个生殖乳突, 相互对称(图 1-G, 图 2-C)。自身体头部开始依次排序为P1~P9。P1距离其他乳突较远, P2~P4和P6~P8相互之间位置相距较近。P1~P3位于泄殖腔前, P4~P9位于泄殖腔后。P2、P4相对于P3远离身体腹部, 靠近身体外侧。P3近身体腹部, 远外侧, 与泄殖腔位置很近。尾感器位于P5和P6中间略靠近P5的位置。P5~P8生殖乳突体积明显小于P1~P4和P9。生殖乳突基部附着表皮, 形成蜡烛形结构(图 1-G, 图 2-A~C)。尾感器明显(图 1-D、G, 图 2-A、C)。尾部细长, 且尾长远大于泄殖腔处身体的宽度(图 1-D、G, 图 2-A、D)。
|
图 1 如皋似双胃线虫新种模式图 Figure 1 New species model map of D.rugaoensis n.sp. A.雄性前部(左侧观); B.雌性生殖管(右侧观); C.雄性前端(侧面观); D.雄性尾(右侧观); E.口(左侧观); F.雌性尾(右侧观); G.雄性尾(腹面观); ph:尾感器 A.Anterior part of the male in left lateral view; B.Right lateral view of the anterior female gonad; C.Anterior end of the male(lateral view); D.Right lateral view of the male tail; E.Left lateral view of the stoma; F.Right lateral view of the female tail; G.Ventral view of the male tail; ph:Phasmid |
|
图 2 如皋似双胃线虫新种雄虫尾部的形态 Figure 2 Morphology of male tail of D.rugaoensis n.sp. A.单侧交合刺及生殖乳突分布图; B、C.A的局部放大图(A~C为扫描电镜照片); D.交合刺与引带(微分干涉显微镜照片)。S.交合刺, 1~9.生殖乳突 A.The distribution of spicules and unilateral bursal papillae; B, C.Enlarged view of A(A-C for scanning electron microscope photos); D.Spicules and gubernaculum(Differential interference contrast microscope photo). S.Spicules; 1-9.Bursal papillae |
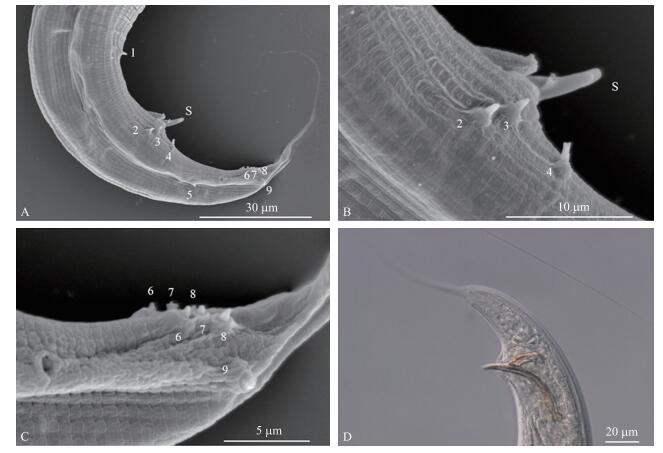
雌虫:65 ℃热杀死后, 虫体弯曲呈“C”形; 体前部、食道等结构与雄虫相似(图 3-A)。阴门位于虫体中部, 覆细密条纹向上隆起高于体表, 形成一个类似于旋涡状椭圆形的开口(图 3-B, 3-C)。生殖管回折。卵母细胞位于生殖管反折部分(图 1-B)。受精后, 卵被挤压进输卵管向着阴门移动, 卵变形拉长并开始胚胎发育(图 1-B, 图 3-F)。输卵管部分形成精囊, 将子宫与卵巢分开。营养不足时, 生殖存在弑母现象, 线虫在雌虫体内孵化, 以母体为营养发育。具有2个子宫(图 1-B)。肛门横向弧形开口(图 3-D)。尾细长, 尾长大于肛门处身体的宽度, 但是短于雄虫(表 1, 图 3-D)。
|
图 3 如皋似双胃线虫新种雌虫的形态 Figure 3 Morphology of female of D.rugaoensis n.sp. A.头部(1:唇乳突, a:头感器); B、C.阴门; D.肛门(A~D为扫描电镜照片); E.体前部, 食道中球发达, 食道基球不发达; F.阴门卵的排列(E、F为微分干涉显微镜照片) A.Head(1:Lip mastoid, a:Sensor head); B, C.Vulva pattern; D. Anus(A-D for scanning electron microscope photos); E.Head region, median bulb is more developed than terminal bulb; F.Distribution of eggs near the vulva(E, F for differential interference contrast microscope photos) |
似双胃属线虫主要形态特征是:口腔细长, 开口呈六边形, 6个唇片。具有2个胃, 中食道球与食道基球; 中食道球后的体部狭窄, 有神经环环绕。雌虫子宫具有双子宫与单子宫之分。雄虫尾部无交合伞, 具有9对生殖乳突与骨质引带。通过形态学分析发现如皋似双胃线虫符合似双胃属线虫的基本特征, 且主要形态鉴别特征如下:1) 末端的食道基球退化, 膨大不明显, 与食道后半部分之间区分不明显; 2) 交合刺向腹部整体弧形弯曲, 交合刺基部愈合弯曲; 3) 引带呈“V”形, 一端附着于交合刺基部。骨质端附着于近交合刺基部, 全长2/3处; 4) 生殖乳突P3近泄殖腔, P2、P4远泄殖腔, 从左腹侧看, 呈“>”形; 5) 双子宫。
如皋似双胃线虫与双子宫类群D.magnus[1]的主要区别:1) 如皋似双胃线虫的雄虫、雌虫、幼虫的身体长度都长于D.magnus, 但是身体宽度小于D.magnus; 2) 如皋似双胃线虫的雄虫口腔长度略长于雌虫, D.magnus与之相反; 3) 食道基球与食道后部区分不明显, 退化更加明显; 4) 如皋似双胃线虫引带近腹部端, 附着于交合刺基部, D.magnus引带近腹部附着于离交合刺基部1/3处。
如皋似双胃线虫与双子宫类群D.nasuensis[1]的主要区别:1)~4) 同D.magnus。5) 如皋似双胃线虫交合刺基部愈合弯曲, 而D.nasuensis基部呈开放半环状。
如皋似双胃线虫与单子宫类群D.andrassyi[2]和D.asiaticus[3]的主要区别:1) 单子宫类群线虫单子宫; 2) 单子宫类群引带呈小水滴形; 3) 单子宫类群交合刺在近交合刺基部, 全长1/3处弯曲; 4) 单子宫类群生殖乳突P3远泄殖腔, P2、P4近泄殖腔, 从左腹侧看, 呈“ < ”形。
2.4 基于18S rDNA序列的如皋似双胃线虫系统发育分析如皋似双胃线虫的18S rDNA基因和ITS序列的长度分别为1 561 bp(420 A、399 T、328 C和414 G)和824 bp(217 A、191 T、230 C和186 G), GenBank登录号分别为KX503242和KX503243。从18S rDNA序列的进化树(图 4)中可以看到:如皋似双胃线虫所在的Diplogasteroides属双子宫类群群成员之间系统进化关系非常清晰和稳定, 各个树枝节点的贝叶斯后验概率很高。通过计算遗传距离, 发现如皋似双胃线虫的18S rDNA与D.nasuensis[1]具有最高的相似性, 达到了93.2%, 与Diplogasteroides属其他种D.magnus[1]、D.asiaticus[3]和D.luxuriosae[4]的相似性次之, 分别为92.4%、85.9%和85.8%。D.nasuensis与D.magnus 18S rDNA序列之间存在22个碱基差异; 如皋似双胃线虫与D.nasuensis差异显著, 具有103个碱基差异。如皋似双胃线虫的ITS rDNA序列BLAST比对结果表明:其与D.magnus的相似性最高, D.nasuensis次之。
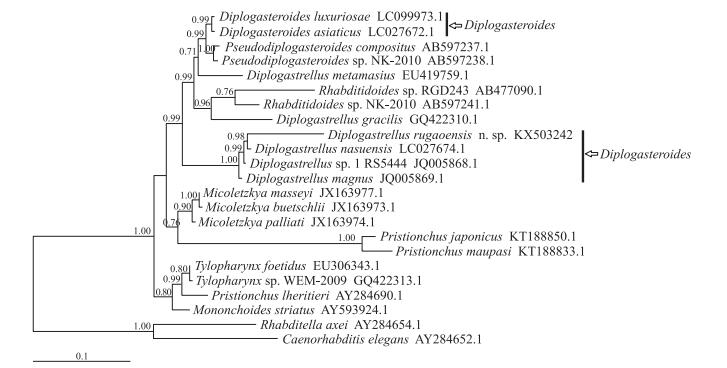
|
图 4 基于18S rDNA基因序列构建的如皋似双胃线虫贝叶斯系统进化关系树 Figure 4 Phylogenetic tree of D.rugaoensis n.sp.and its closely related nematodes based on 18S rDNA sequences data |
似双胃属(Diplogasteroides)线虫主要形态特征为口腔细长, 开口呈六边形, 6个唇片; 有2个胃(中食道球与食道基球); 雌虫子宫有双子宫与单子宫之分; 雄虫尾部无交合伞, 有9对生殖乳突与骨质引带。综合形态学特征和分子生物学分析的结果, 从如皋水稻田采集到的虫株N3鉴定为似双胃属双子宫类群的新种, 根据产地命名为如皋似双胃线虫(Diplogasteroides rugaoensis n.sp.)。其与相近物种形态上的主要区别:食道基球退化, 与食道后半部分之间区分不明显; 交合刺基部愈合弯曲; 引带一端附着于交合刺基部。
目前国内对似双胃属线虫的研究尚未见报道。国外对此属的研究集中于分类学地位的探讨。分子系统学研究发现此属线虫不是单系发生的类群, 在形态学分别对应于单子宫与双子宫2个类群。如皋似双胃线虫的分子生物学与形态学数据印证了这一理论, 并且单子宫与双子宫2个类群的引带形态与P2、P3、P4生殖乳突的排列方式存在不同。此新种的发现为此属分类地位的修正提供了数据支持。
目前, 国外对双胃目线虫的生物防治能力已有一定研究, 但是对似双胃属线虫生物防治方面的研究尚未见报道。双胃目的一些线虫种类能够侵入寄主体内并在寄主体内繁殖, 导致寄主死亡或者通过抑制根结线虫从而发挥其生物防治能力。例如Micoletzkya aerivora可以寄生散白蚁(Reticulitermes tibialis)、悲食叶鳃金龟(Phyllophaga anxia)和棉铃虫(Heliothis obsoleta)的幼虫, 摄食产在土壤中的蝗卵[17]; Mononchoides fortidens能够通过抑制田间土壤盆栽中花生根结线虫Meloidogyrre arenariao发挥其生物防治功能等[18]。通过对如皋似双胃线虫致病力的初步研究, 发现虫株N3在72 h时对大蜡螟老熟幼虫的半致死率为LC50=169 L-1, 具有一定的生物防治能力。但是还需进一步研究, 比如:此线虫是否携带共生菌, 与共生菌有无共生关系, 共生菌的致病力测定等。如皋似双胃线虫的发现可以为开发新的生物防治资源提供了一定的理论基础。
| [1] | Kiontke K, Manegold A, Sudhaus W. Redescription of Diplogasteroides nasuensis Takaki, 1941 and D.magnus Völk, 1950(Nematoda:Diplogastrina)associated with Scarabaeidae(Coleoptera)[J]. Nematology, 2001, 3(8): 817–832. DOI: 10.1163/156854101753625317 |
| [2] | Kanzaki N, Tanaka R, Hirooka Y, et al. Description of Diplogasteroides andrassyi sp.n.(Rhabditida, Diplogastridae), associated with Monochamus grandis and Pinaceae trees in Japan[J]. Journal of Nematode Morphology and Systematics, 2013, 16(1): 35–47. |
| [3] | Kanzaki N, Woodruff G C, Akiba M, et al. Diplogasteroides asiaticus n.sp. is associated with Monochamus alternatus in Japan[J]. Journal of Nematology, 2015, 47(2): 105. |
| [4] | Kanzaki N, Ide T. Diplogasteroides luxuriosae n.sp.associated with Acalolepta luxuriosa(Coleoptera:Cerambycidae)from Japan[J]. Nematology, 2016, 18(2): 221–233. DOI: 10.1163/15685411-00002955 |
| [5] | Susoy V, Ragsdale E J, Kanzaki N, et al. Rapid diversification associated with a macroevolutionary pulse of developmental plasticity[J]. eLIFE, 2015, 4: e05463. |
| [6] | Kanzaki N, Giblin-Davis R M. Diplogastrid systematics and phylogeny[J]. Nematology Monographs and Perspectives, 2015, 11: 43–76. |
| [7] | Bedding R A, Akhurst R J. A simple technique for the detection of insect paristic rhabditid nematodes in soil[J]. Nematologica, 1975, 21(1): 109–110. DOI: 10.1163/187529275X00419 |
| [8] | Adams B J. Heterorhabditis floridensis n.sp.(Rhabditida:Heterorhabditidae)from Florida[J]. Zootaxa, 2006, 1177: 1–19. |
| [9] | Courtney W D, Polley D, Miller V L. TAF, an improved fixative in nematode technique[J]. Plant Disease Reporter, 1955, 39: 570–571. |
| [10] | Franklin M T, Goodey J B. A cotton blue-lactophenol technique for mounting plant-parasitic nematodes[J]. Journal of Helminthology, 1949, 23(3/4): 175–178. |
| [11] | Nguyen K B, Smart G C, Jr. Morphometrics of infective juveniles of Steinernema spp. and Heterorhabditis bacteriophora(Nemata:Rhabditida)[J]. Journal of Nematology, 1995, 27(2): 206. |
| [12] |
段玉玺, 陈立杰. 植物寄生线虫标本制作方法简介[J].
中国寄生虫学与寄生虫病杂志, 2006, 24(Suppl): 65–68.
Duan Y X, Chen L J. Processing methods of plant nematode slides[J]. Chinese Journal of Parasitology and Parasitic Diseases, 2006, 24(Suppl): 65–68. (in Chinese with English abstract) |
| [13] | Nguyen K B, Smart G C. Scanning electron microscope studies of Steinernema glaseri(Nematoda:Steinernematidae)1[J]. Nematologica, 1995, 41(1): 183–190. DOI: 10.1163/003925995X00152 |
| [14] | Zhang C, Liu J, Xu M, et al. Heterorhabditidoides chongmingensis gen.nov., sp.nov.(Rhabditida:Rhabditidae), a novel member of the entomopathogenic nematodes[J]. Journal of Invertebrate Pathology, 2008, 98(2): 153–168. DOI: 10.1016/j.jip.2008.02.011 |
| [15] |
王宁, 顾建锋, 王暄, 等. 进境鸡爪槭中日本短体线虫的鉴定[J].
南京农业大学学报, 2014, 37(4): 76–82.
Wang N, Gu J F, Wang X, et al. Identification of pratylenchus japonicus intercepted in acer palmatum from Japan[J]. Journal of Nanjing Agricultural University, 2014, 37(4): 76–82. DOI: 10.7685/j.issn.1000-2030.2014.04.011(in Chinese with English abstract) |
| [16] | Huelsenbeck J P, Ronquist F. MRBAYES:bayesian inference of phylogenetic trees[J]. Bioinformatics, 2001, 17(8): 754–755. DOI: 10.1093/bioinformatics/17.8.754 |
| [17] | Poinar G O, Jr. Redescription of Chroniodiplogaster aerivora(Cobb)gen.n., comb. n.(Rhabditida:Diplogasteridae)from Termites[J]. Journal of the Helminthological Society of Washington, 1990, 57(1): 26–30. |
| [18] | Khan Z, Kim Y H. The predatory nematode, Mononchoides fortidens(Nematoda:Diplogasterida), suppresses the root-knot nematode, Meloidogyne arenaria, in potted field soil[J]. Biological Control, 2005, 35(1): 78–82. DOI: 10.1016/j.biocontrol.2005.05.015 |