文章信息
- 张蓓, 刘同坤, 黄菲艺, 邵帅旭, 吴小婷, 侯喜林
- ZHANG Bei, LIU Tongkun, HUANG Feiyi, SHAO Shuaixu, WU Xiaoting, HOU Xilin
- 不结球白菜开花基因BcFT的亚细胞定位及其互作蛋白的筛选
- Subcellular localization and interaction proteins screening of flowering gene BcFT in non-heading Chinese cabbage
- 南京农业大学学报, 2017, 40(4): 592-600
- Journal of Nanjing Agricultural University, 2017, 40(4): 592-600.
- http://dx.doi.org/10.7685/jnau.201612034
-
文章历史
- 收稿日期: 2016-12-20
不结球白菜(Brassica campestris ssp. chinensis Makino)是我国长江中下游地区普遍种植的绿叶蔬菜, 因其生长周期短在蔬菜周年生产中占据重要地位。近年来, 日本、美国及欧洲一些国家也广泛引种栽培[1]。不结球白菜属于十字花科芸薹属植物, 营养丰富、适应性广, 但在实际生产中, 不结球白菜经常出现先期抽薹现象, 极大地降低了其产量和品质, 因此对不结球白菜开花调控机制的研究显得尤为重要。
在高等植物生命过程中, 开花是从营养生长向生殖生长转变的重要发育过程。这一过程既受植物内源发育信号(植物衰老、体内激素水平等)调控[2], 同时还受到外界环境因子(日照长短、低温春化等)影响[3-4]。通过对拟南芥的深入研究, 目前已确定了4条开花路径, 包括光周期路径[5]、春化路径[6]、赤霉素路径[7]和自主路径[8]。这些路径形成了一个错综复杂的基因调控网络, 最终汇聚到下游关键基因FT(FLOWERING LOCUS T)、SOC 1 (SUPPRESSOR OF OVEREXPRESSION OF CO 1)、LFY(LEAFY), 激活植物顶端分生组织特异基因表达, 调控植物开花。其中, FT基因编码一种磷脂酰乙醇胺结合蛋白, 与锌指转录因子FD蛋白在顶端分生组织互作, 促进SOC 1和AP1基因的表达, 进而促进花分生组织的形成和开花[9], 这一结论已在小麦中通过酵母双杂交得到了验证[10]。
对不结球白菜开花时间的研究已有大量报道[11], 但到目前为止, FT基因在不结球白菜中的研究较少, 其互作蛋白的研究在不结球白菜中也未见报道。本研究利用亚细胞定位技术研究不结球白菜BcFT基因的空间表达, 利用酵母双杂交技术对不结球白菜cDNA文库进行筛选, 得到与BcFT互作的蛋白, 有助于全面探讨BcFT基因的功能, 为深入研究不结球白菜开花调控机制、新品种的选育提供重要依据。
1 材料与方法 1.1 试验材料pEZS-NL载体为南京农业大学园艺学院郭世荣教授赠与, 酵母菌株Y2H Gold、质粒pGADT7、pGBKT7、pGADT7-T、pGBKT7-53均购自美国Clontech公司; 大肠杆菌DH5α感受态细胞购自北京Transgene公司; 酵母质粒小提试剂盒、RNA Simple Total RNA Kit试剂盒购自北京TIANGEN公司; 5×CE Ⅱ Buffer、ExnaseTM Ⅱ购自美国Vazyme公司; EcoRⅠ、BamHⅠ、SalⅠ限制性内切酶, pMD18-T simple载体, Taq DNA聚合酶, PrimeScript® 1st Stand cDNA Synthesis Kit购自大连宝生物工程有限公司; 琼脂糖凝胶回收试剂盒、大肠杆菌质粒小提试剂盒购自美国Axygen公司; 各种引物合成及测序由南京金斯瑞公司完成。
1.2 试验方法 1.2.1 亚细胞定位载体pEZS-NL-BcFT的构建采用RNA Simple Total RNA Kit试剂盒提取不结球白菜‘苏州青’5叶期总RNA, 用PrimeScript® 1st Stand cDNA Synthesis Kit将总RNA反转录成基因组cDNA。根据BcFT的cDNA序列(http://brassicadb.org/brad/)设计特异引物BcFT-F1、BcFT-R1(表 1), 以cDNA为模板进行PCR扩增, 扩增产物经胶回收后连接pMD18-T, 热激法转化大肠杆菌DH5α, 对测序正确的阳性克隆提取质粒, 命名为pMD18-BcFT。根据BcFT序列和pEZS-NL载体序列, 按照One Step Cloning Kit(Vazyme, 美国)引物要求设计含有EcoRⅠ和BamHⅠ酶切位点的特异引物BcFT-F2、BcFT-R2(表 1), 以质粒pMD18-BcFT为模板进行PCR扩增, 反应产物经10 g·L-1琼脂糖凝胶回收, EcoRⅠ、BamHⅠ酶切pEZS-NL载体, 回收其产物, 按照One Step Cloning Kit说明书进行亚细胞定位载体构建, 获得阳性克隆pEZS-NL-BcFT。
参照杨光等[12]的方法进行。
1.2.3 诱饵载体pGBKT7-BcFT的构建按照One Step Cloning Kit引物设计要求以及BcFT和pGBKT7载体序列信息, 设计含有EcoRⅠ和SalⅠ酶切位点的特异引物BcFT-F3和BcFT-R3(表 1), 根据1.2.1节的方法构建诱饵载体pGBKT7-BcFT。
1.2.4 诱饵载体转化酵母菌株与自毒性和自激活性检测采用醋酸锂方法制备酵母菌株Y2H Gold感受态细胞, 并分别转化空载体pGBKT7、诱饵载体pGBKT7-BcFT, 涂布于SD/-Trp固体培养基上, 30 ℃培养3~5 d, 观察菌落生长状态, 判断是否具有自毒性。
空载体pGADT7、诱饵载体pGBKT7-BcFT共转化酵母菌株Y2H Gold, 同时共转化载体pGADT7+pGBKT7(阴性对照)以及pGADT7-T+pGBKT7-53(阳性对照), 涂布于SD/-Trp/-Leu固体培养基上, 30 ℃培养3~5 d。挑取阳性菌落接种于SD/-Trp/-Leu液体培养基中, 30 ℃培养至D600为0.8左右, 稀释成不同浓度梯度(1、10-1、10-2、10-3), 并取10 μL悬滴在SD/-Trp/-Leu和SD/-Trp/-Leu/-His/-Ade固体培养基上, 倒置培养3~5 d, 观察菌落生长情况, 判断是否具有自激活性。
1.2.5 酵母双杂交筛选BcFT互作蛋白从已转化诱饵载体pGBKT7-BcFT的SD/-Trp固体培养基上挑取新鲜单菌落, 接种于50 mL SD/-Trp液体培养基中, 30 ℃过夜培养, 至D600为0.8左右。1 000 g离心5 min, 弃上清液, 用4 mL SD/-Trp液体培养基重悬, 再加入1 mL不结球白菜cDNA文库[13]、45 mL 2×YPDA液体培养基, 转移到2 L的锥形瓶中, 30 ℃、50 r·min-1孵育20 h左右。1 000 g离心5min, 弃上清液, 用10 mL 0.5×YPDA液体培养基重悬, 涂布于SD/-Trp/-Leu/-His/-Ade固体培养基上, 30 ℃培养3~5 d。
1.2.6 酵母质粒提取与测序观察酵母细胞在SD/-Trp/-Leu/-His/-Ade固体培养基上的生长情况, 挑取长势良好的酵母菌落接种于SD/-Trp/-Leu/-His/-Ade液体培养基中, 30 ℃振荡培养, 提取质粒。根据pGADT7-Rec载体设计通用引物AD-F和AD-R(表 1), 以酵母质粒为模板进行PCR扩增, 扩增产物经10 g·L-1琼脂糖凝胶电泳观察条带大小, 取200 bp以上的条带回收, 送南京金斯瑞公司测序。
1.2.7 全长基因的克隆及捕获载体的构建根据筛选文库的测序结果, 以不结球白菜‘苏州青’cDNA为模板进行基因全长克隆, 然后进行相应猎物载体(AD载体)的构建(方法同1.2.1节, 引物见表 1)。
1.2.8 BcFT和互作基因的共转化验证为了验证上述筛选蛋白与BcFT在酵母体内的互作情况, 将1.2.7节已构建好的捕获载体分别与诱饵载体pGBKT7-BcFT、空载体pGBKT7(阴性对照)共转化酵母菌株Y2H Gold, 并涂布于SD/-Trp/-Leu固体培养基上培养; 经菌落PCR鉴定之后, 活化阳性菌落, 稀释不同浓度梯度(1、10-1、10-2、10-3), 取10 μL菌液分别悬滴在SD/-Trp/-Leu和SD/-Trp/-Leu/-His/-Ade固体培养基上, 倒置培养3~5 d, 观察菌落生长情况。
1.2.9 筛选互作蛋白的生物信息相关分析利用ExPASy Proteomics Server(http://web.expasy.org/protparam/)上的Protparam在线分析软件对筛选蛋白进行理化性质分析, DAS(http://www.sbc.su.se/~miklos/DAS/)、PredictProtein(https://www.predictprotein.org/home)分析软件对其进行跨膜区分析, SignalP 4.0 Server(http://www.cbs.dtu.dk/services/SignalP-4.0/)进行信号肽分析, SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)进行二级结构分析, Pfam(http://pfam.xfam.org/)进行结构域分析, Phyre2在线软件(http://www.sbg.bio.ic.ac.uk/~phyre2/)进行三维结构分析。
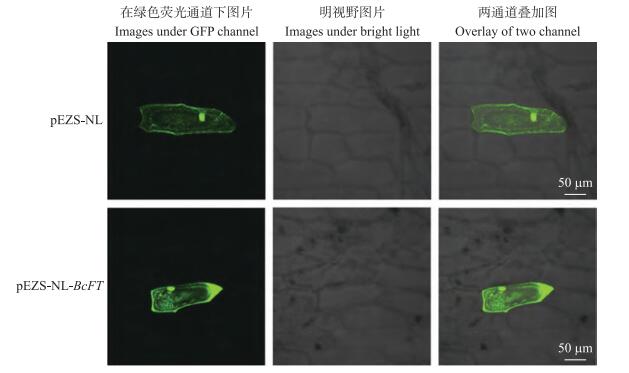
2 结果与分析 2.1 BcFT蛋白的亚细胞定位从图 1可见:阳性对照中, 细胞膜、细胞质、细胞核均可以观察到绿色荧光, BcFT蛋白的绿色荧光分布在细胞膜、细胞质、细胞核中, 说明BcFT蛋白在整个细胞中均有表达。
|
图 1 GFP蛋白和BcFT-GFP蛋白在洋葱表皮细胞中的定位 Figure 1 Subcellular locatization of GFP protein and BcFT-GFP protein in oinon epidermal cell |
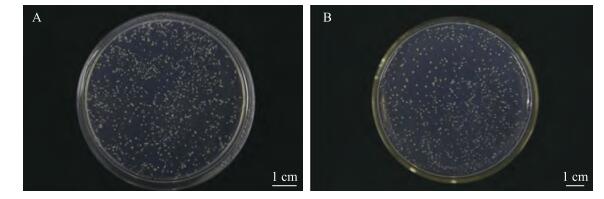
由图 2可见:转化空载体pGBKT7与转化诱饵载体pGBKT7-BcFT的平板上菌落数量并无明显差异, 说明诱饵载体pGBKT7-BcFT对酵母细胞无自毒性。
|
图 2 BcFT的自毒性检测 Figure 2 Toxicity test of BcFT A:转化质粒pGBKT7 Transfomation of pGBKT7;B:转化质粒pGBKT7-BcFT Transfomation of pGBKT7-BcFT |
如图 3所示:阳性对照(pGADT7-T+pGBKT7-53) 在SD/-Trp/-Leu和SD/-Trp/-Leu/-His/-Ade平板上均能正常生长, 阴性对照(pGADT7+pGBKT7) 以及共转化空载体pGADT7、诱饵载体pGBKT7-BcFT的酵母细胞在SD/-Trp/-Leu平板上能正常生长, 在SD/-Trp/-Leu/-His/-Ade平板上不生长, 说明BcFT并无自激活性。

|
图 3 BcFT的自激活性检测 Figure 3 Autoactivation test of BcFT |
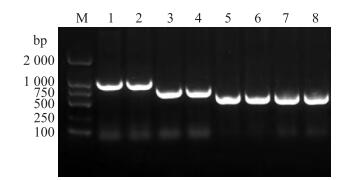
将含有诱饵载体pGBKT7-BcFT的酵母细胞与含有cDNA文库的酵母细胞进行杂交筛选, 对SD/-Trp/-Leu/-His/-Ade平板上的克隆进行测序分析, 经大白菜数据库BLAST比对, 共得到8个读码框正确的互作菌落, 进一步比对发现有2个基因片段与基因全长接近, 且重复出现, 其中2个克隆测序为BcPPD5, 2个克隆测序为BcVHA-E1, 其余几个片段占基因全长的比例较小, 结果精确度低(图 4)。
|
图 4 质粒PCR鉴定电泳图 Figure 4 Electrophoresis map of plasmids PCR identification M:DL2000 marker; 1~8:质粒PCR检测条带Detection strip of plasmids PCR |
分别构建BcPPD 5和BcVHA-E1的AD载体pGADT7-BcPPD5、pGADT7-BcVHA-E1, 与诱饵载体pGBKT7-BcFT进行共转化试验, 观察在SD/-Trp/-Leu和SD/-Trp/-Leu/-His/-Ade平板上的生长情况(图 5)。酵母细胞在2种培养基上均能生长, 说明BcPPD 5、BcVHA-E1分别与BcFT在酵母体内存在互作关系。为了增加试验的严谨性, 将pGADT7-BcPPD5、pGADT7-BcVHA-E1分别与空载体pGBKT7共转化, 观察在SD/-Trp/-Leu和SD/-Trp/-Leu/-His/-Ade平板上的生长情况。酵母细胞在SD/-Trp/-Leu平板上能正常生长, 在SD/-Trp/-Leu/-His/-Ade平板上不生长(图 5), 说明BcPPD 5、BcVHA-E1本身并无自激活性, 进一步说明上述试验结果的可靠性。

|
图 5 BcFT互作蛋白共转化验证 Figure 5 Cotransformation analysis between BcFT and the interaction proteins |
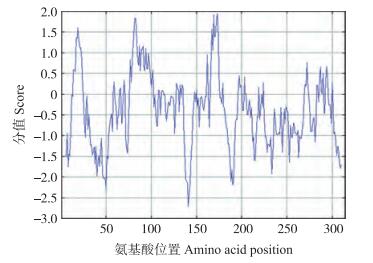
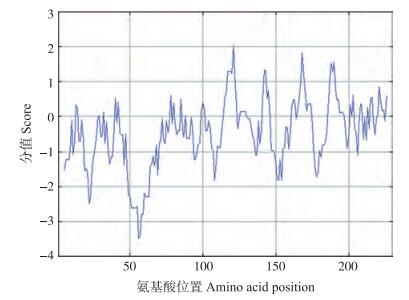
利用ExPASy的在线分析软件Protparam预测蛋白的理化性质, 结果显示:BcPPD5蛋白的分子式为C1572H2483N419O483S8, 含有314个氨基酸, 相对分子质量为35.2×103, 等电点为7.73, 其中包含正电残基(Asp+Glu)40个, 负电残基(Arg+Lys)41个, 该蛋白的不稳定系数为56.19, 脂肪系数为82.61, 平均亲水性系数为-0.413。图 6显示:该蛋白的C端和N端都偏向亲水性, 中间部分亲水性与疏水性交替出现, 总体而言该蛋白亲水性表现更强。BcPPD5蛋白的氨基酸序列存在一个跨膜区, 位于81~88(DAS)个氨基酸或78~95(PredictProtein)个氨基酸。
|
图 6 BcPPD5蛋白亲水/疏水性分析 Figure 6 Analysis of hydrophilicity and hydrophobicity for BcPPD5 protein |
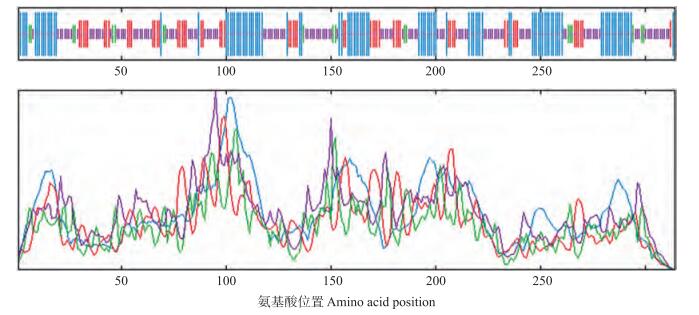
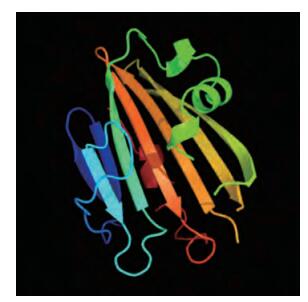
SignalP 4.0 Server软件预测BcPPD5蛋白不含信号肽。对其二级结构(图 7)和三维结构(图 8)的分析发现, BcPPD5蛋白中不规则卷曲结构所占比例最大, 为43.31%;α螺旋次之, 比例为32.48%;β转角最少, 仅为6.05%。Pfam分析该蛋白163和296氨基酸残基之间存在一个PsbP结构域。
|
图 7 BcPPD5蛋白二级结构 Figure 7 Secondary structure of BcPPD5 protein 蓝色表示α螺旋, 绿色表示β转角, 红色表示延伸链, 紫色表示不规则卷曲。 Blue represents for α-helix, green represents for β-turn, red represents for extended strand, purple represents for random coil. The same as follows. |
|
图 8 BcPPD5蛋白三维结构 Figure 8 Three-dimensional structure of deduced BcPPD5 protein |
BcVHA-E1蛋白的分子式为C1131H1858N320O356S9, 含有230个氨基酸, 相对分子质量为25.9×103, 等电点为5.32, 其中包含正电残基(Asp+Glu)40个, 负电残基(Arg+Lys)32个, 该蛋白的不稳定系数为46.08, 脂肪系数为97.09, 平均亲水性系数为-0.447。ProtScale氨基酸疏水性图谱预测表明, 该蛋白N端偏向亲水性, C端偏向疏水性, 总体而言亲水性表现较强(图 9)。DAS、PredictProtein在线软件预测均无跨膜区。
|
图 9 BcVHA-E1蛋白亲水/疏水性分析 Figure 9 Analyzed of hydrophilicity and hydrophobicity for BcVHA-E1 protein |
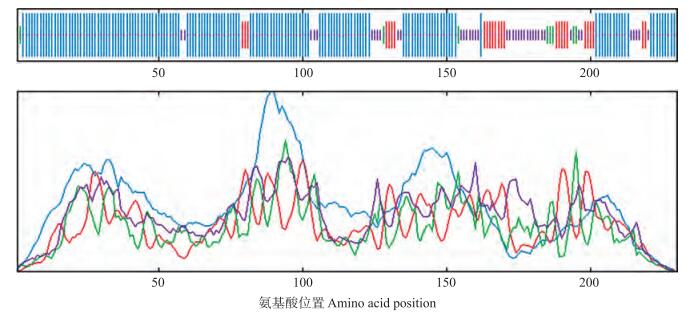
SignalP 4.0 Server软件分析BcVHA-E1蛋白不含信号肽。对其二级结构(图 10)和三维结构(图 11)的分析发现:BcVHA-E1蛋白中α螺旋所占比例最大, 为66.96%;不规则卷曲结构次之, 比例为17.83%;β转角最少, 仅为3.91%。Pfam在线软件分析表明该蛋白无特定结构域。
|
图 10 BcVHA-E1蛋白二级结构预测 Figure 10 Secondary structure of BcVHA-E1 protein |
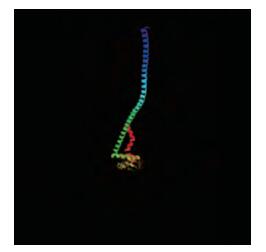
|
图 11 BcVHA-E1蛋白三维结构 Figure 11 Three-dimensional structure of deduced BcVHA-E1 protein |
很多植物基因组测序工作已经完成[14], 为我们提供了大量基因组信息, 研究热点正趋向对基因组功能的探索。
植物体内蛋白-蛋白相互作用是一个非常复杂的过程, 酵母双杂交技术是分析真核细胞内蛋白质相互作用非常有效的方法。该方法不仅可以检测已知蛋白质之间的互作, 还可以通过筛选cDNA文库得到与已知蛋白互作的未知蛋白。到目前为止, 很多与FT互作的蛋白都是通过酵母双杂交方法得到的, 如FD蛋白[10]、FTIP1(FT INTERACTING PROTEIN 1) 蛋白[15]。在玉米中, DLF1基因编码的蛋白可以与FT互作[16-17]。小麦FT与TaFDL2互作, 最终通过调控VRN1的表达来调控开花[10]。在油菜花序轴韧皮部汁液中检测到FT同源蛋白, 以及协助其在细胞间转运的伴侣蛋白[18]。
本试验首先确定了BcFT蛋白在细胞中的定位情况, 发现在整个细胞中均有表达, 为分析其生物学功能奠定了基础。利用酵母双杂交技术, 筛选出2个与BcFT互作的蛋白, 分别是BcPPD5和BcVHA-E1。
PPD5蛋白是一个由核基因编码, 定位在叶绿体类囊体上的蛋白。在拟南芥中, 通过观察PPD5的T-DNA插入突变体和RNAi株系发现, 与野生型植株相比, 功能缺失型植株的侧根和侧芽都有所增加, 侧根增多的表现型可以被外源GR24抑制, 表明PPD5与独脚金内酯的合成路径相关[19]。同时外源GR24能直接抑制不结球白菜腋芽的萌发和伸长[20]。独脚金内酯信号转导路径中, MAX2蛋白形成SCF复合体, 作为激素受体存在。在研究光形态建成的过程中发现, 光敏色素和隐花色素受光激活, 引起COP1蛋白从细胞质转移到细胞核, 导致HY5蛋白积累, 最终激活SCF复合体[21]。可见COP1基因可通过SCF复合体间接调控PPD 5, 而COP1可以通过光周期路径影响植物开花时间。
VHA-E1是V型H+-ATPase的一个亚基, V型H+-ATPase是广泛存在于内膜系统的液泡型质子泵, 被称为“生态酶”, 对细胞内物质的转运和各种新陈代谢过程具有重要作用[22]。当用茉莉酸处理拟南芥, AtVHA-E1的表达量上调[23]。虽然目前已有茉莉酸与植物开花之间的相关报道[24-25], 但具体的分子调控机制尚不清楚。我们发现的茉莉酸响应基因BcVHA-E1与BcFT互作, 从另一个方面解释了茉莉酸和植物开花时间具有一定的关联性。COP1/SPA复合体也参与茉莉酸应答[26-27]。
COP1在控制生物节律钟输出、调控光周期信号中具有重要作用[28], 作为E3泛素连接酶复合体, COP1/SPA在黑暗条件下可以特异降解CO蛋白[29]。CO蛋白也是光周期信号路径中的关键调控因子, 可以激活下游FT、SOC1基因的转录, 促进开花[30]。在不结球白菜中, BcPPD5和BcVHA-E1蛋白很有可能是通过光周期路径影响开花, 具体的调控机制还需要进一步验证。在不结球白菜中, 这2个基因在不同发育阶段均有表达[31], 同时, 对BcPPD5和BcVHA-E1蛋白的生物信息学分析也为蛋白互作提供了物理化学基础, 这为我们从不同角度了解不结球白菜BcFT蛋白功能提供了理论依据。这些工作有利于提高农作物适应外界环境的能力, 为定向调控植物开花时间奠定基础。
| [1] |
侯喜林, 宋小明. 不结球白菜种质资源的研究与利用[J].
南京农业大学学报, 2012, 35(5): 35–42.
Hou X L, Song X M. Research and utilization of Brassica campestris ssp. chinensis Makino(non-heading Chinese cabbage)germplasm resources[J]. Journal of Nanjing Agricultural University, 2012, 35(5): 35–42. DOI: 10.7685/j.issn.1000-2030.2012.05.005(in Chinese with English abstract) |
| [2] |
刘伦, 王超, 姚改芳, 等. 外源生长调节剂处理对'满天红'×'砀山酥梨'后代成花的影响[J].
南京农业大学学报, 2015, 38(3): 381–388.
Liu L, Wang C, Yao G F, et al. Effect of exogenous growth regulator treatment on floral initiation of pear progenies from hybrid'Mantianhong'×'Danhshansuli'[J]. Journal of Nanjing Agricultural University, 2015, 38(3): 381–388. DOI: 10.7685/j.issn.1000-2030.2015.03.005(in Chinese with English abstract) |
| [3] | Boss P K, Bastow R M, Mylne J S, et al. Multiple pathways in the decision to flower:enabling, promoting and resetting[J]. Plant Cell, 2004, 16(Suppl): S18–S31. |
| [4] | van Doorn W G, Kamdee C. Flower opening and closure:an update[J]. Journal of Experimental Botany, 2014, 65(20): 5749–5757. DOI: 10.1093/jxb/eru327 |
| [5] | Fernandez V, Takahashi Y, Le Gourrierec J, et al. Photoperiodic and thermosensory pathways interact through CONSTANS to promote flowering at high temperature under short days[J]. The Plant Journal, 2016, 86(5): 426–440. DOI: 10.1111/tpj.2016.86.issue-5 |
| [6] | Zhu D, Rosa S, Dean C. Nuclear organization changes and the epigenetic silencing of FLC during vernalization[J]. Journal of Molecular Biology, 2014, 427(3): 659–669. |
| [7] | Galvao V C, Collani S, Horrer D, et al. Gibberellic acid signaling is required for ambient temperature-mediated induction of flowering in Arabidopsis thaliana[J]. The Plant Journal, 2015, 84(5): 949–962. DOI: 10.1111/tpj.13051 |
| [8] | Simpson G G. The autonomous pathway:epigenetic and post-transcriptional gene regulation in the control of Arabidopsis flowering time[J]. Current Opinion in Plant Biology, 2004, 7(5): 570–574. DOI: 10.1016/j.pbi.2004.07.002 |
| [9] | Abe M, Kobayashi Y, Yamamoto S, et al. FD, a bZIP protein mediating signals from the floral pathway integrator FT at the shoot apex[J]. Science, 2005, 309(5737): 1052–1056. DOI: 10.1126/science.1115983 |
| [10] | Li C, Dubcovsky J. Wheat FT protein regulates VRN1 transcription through interactions with FDL2[J]. The Plant Journal, 2008, 55(4): 543–554. DOI: 10.1111/tpj.2008.55.issue-4 |
| [11] | Liu T, Li Y, Zhang C, et al. Basic helix-loop-helix transcription factor BcbHLHpol functions as a positive regulator of pollen developmentin non-heading Chinese cabbage[J]. Functional and Integrative Genomics, 2014, 14(4): 731–739. DOI: 10.1007/s10142-014-0390-3 |
| [12] |
杨光, 曹雪, 房经贵, 等. '藤稔'葡萄VvGAI基因的克隆、亚细胞定位及时空表达分析[J].
园艺学报, 2011, 38(10): 1883–1892.
Yang G, Cao X, Fang J G, et al. Cloning, subcellular localization and spatiotemporal expression of a VvGAI gene from grapevin'Fujiminori'[J]. Acta Horticulturae Sinica, 2011, 38(10): 1883–1892. (in Chinese with English abstract) |
| [13] |
钱瑜, 刘同坤, 侯喜林, 等. 不结球白菜Pol胞质雄性不育花酵母双杂交cDNA文库的构建及筛选[J].
南京农业大学学报, 2015, 38(1): 21–26.
Qian Y, Liu T K, Hou X L, et al. Construction and screening of yeast two hybrid cDNA library ofnon-heading Chinese cabbage flowers with Pol CMS[J]. Journal of Nanjing Agricultural University, 2015, 38(1): 21–26. DOI: 10.7685/j.issn.1000-2030.2015.01.004(in Chinese with English abstract) |
| [14] | Bruggmann R, Bharti A K, Gundlach H, et al. Uneven chromosome contraction and expansion in the maize genome[J]. Genome Research, 2006, 16(10): 1241–1251. DOI: 10.1101/gr.5338906 |
| [15] | Putterill J, Varkonyi-Gasic E. FT and florigen long-distance flowering control in plants[J]. Current Opinion in Plant Biology, 2016, 33: 77–82. DOI: 10.1016/j.pbi.2016.06.008 |
| [16] | Muszynski M G, Dam T, Li B, et al. delayed flowering1 encodes a basic leucine zipper protein that mediates floral inductive signals at the shoot apex in maize[J]. Plant Physiology, 2006, 142: 1523–1536. DOI: 10.1104/pp.106.088815 |
| [17] | Meng X, Muszynski M G, Danilevskaya O N. The FT-like ZCN8 gene functions as a floral activator and is involved in photoperiod sensitivity in maize[J]. The Plant Cell, 2011, 23: 942–960. DOI: 10.1105/tpc.110.081406 |
| [18] | Giavalisco P, Kapitza K, Kolasa A, et al. Towards the proteome of Brassica napus phloem sap[J]. Proteomics, 2006, 6(3): 896–909. DOI: 10.1002/(ISSN)1615-9861 |
| [19] | Roose J L, Frankel L K, Bricker T M. Developmental defects in mutants of the PsbP domain protein 5 in Arabidopsis thaliana[J]. PLoS ONE, 2011, 6(12): e28624. DOI: 10.1371/journal.pone.0028624 |
| [20] |
崔红米, 曹学伟, 王建军, 等. 外源GR24对不结球白菜腋芽生长的影响[J].
南京农业大学学报, 2016, 39(3): 366–372.
Cui H M, Cao X W, Wang J J, et al. Effects of exogenous GR24 on the growth of axillary bud of non-heading Chinese cabbage[J]. Journal of Nanjing Agricultural University, 2016, 39(3): 366–372. DOI: 10.7685/jnau.201510023(in Chinese with English abstract) |
| [21] |
孔令芳. 水稻条纹病毒编码的SP蛋白功能及其与寄主因子PsbP的互作研究[D]. 杭州: 浙江大学, 2014.
Kong L F. Functional analysis of SP protein encoded by Rice strive virus and its interaction with host factor PsbP[D]. Hangzhou:Zhejiang University, 2014(in Chinese with English abstract). |
| [22] | Schumacher K, Krebs M. The V-ATPase:small cargo, large effects[J]. Current Opinion in Plant Biology, 2010, 13(6): 724–730. DOI: 10.1016/j.pbi.2010.07.003 |
| [23] | Dettmer J, Liu T Y, Schumacher K. Functional analysis of Arabidopsis V-ATPase subunit VHA-E isoforms[J]. European Journal of Cell Biology, 2010, 89(2/3): 152–156. |
| [24] |
郭媛. 茉莉酸甲酯对油菜花期的调控和花器官发育的影响及其分子机制[D]. 杭州: 浙江大学, 2010.
Guo Y. The effect of exogenous methyl jasmonate on the flowering time, floral organ morphology, and transcript levels of a group of genes implicated in the development of oilseed rape flowers(Brassica napus L.)[D]. Hangzhou:Zhejiang University, 2010(in Chinese with English abstract). |
| [25] |
闫志强, 徐海, 马作斌, 等. 籼稻与粳稻花时对茉莉酸甲酯(MeJA)响应的敏感性差异[J].
中国农业科学, 2014, 47(13): 2529–2540.
Yan Z Q, Xu H, Ma Z B, et al. Differential response of floret opening to exo-methyl jasmonate between subsp. indica and subsp. japonica in rice[J]. Scientia Agricultura Sinica, 2014, 47(13): 2529–2540. DOI: 10.3864/j.issn.0578-1752.2014.13.005(in Chinese with English abstract) |
| [26] | Maier A, Schrader A, Kokkelink L, et al. Light and the E3 ubiquitin ligase COP1/SPA control the protein stability of the MYB transcription factors PAP1 and PAP2 involved in anthocyanin accumulation in Arabidopsis[J]. Plant Journal, 2013, 74(4): 638–651. DOI: 10.1111/tpj.2013.74.issue-4 |
| [27] | Li T, Jia K P, Lian H L, et al. Jasmonic acid enhancement of anthocyanin accumulation is dependent on phytochrome A signaling pathway under far-red light in Arabidopsis[J]. Biochemical and Biophysical Research Communications, 2014, 454(1): 78–83. DOI: 10.1016/j.bbrc.2014.10.059 |
| [28] | Yu J W, Rubio V, Lee N Y, et al. COP1 and ELF3 control circadian function and photoperiodic flowering by regulating GI stability[J]. Molecular Cell, 2008, 32(5): 617–630. DOI: 10.1016/j.molcel.2008.09.026 |
| [29] | Jang K, Lee H G, Jung S J, et al. The E3 ubiquitin ligase COP1 regulates thermosensory flowering by triggering GI degradation in Arabidopsis[J]. Scientific Reports, 2015, 5: 12071. DOI: 10.1038/srep12071 |
| [30] | Song Y H, Estrada D A, Johnoson R S, et al. Distinct roles of FKF1, GIGANTEA and ZEITLUPE proteins in the regulation of CONSTANS stability in Arabidopsis photoperiodic flowering[J]. Proc Natl Acad Sci USA, 2014, 111(49): 17672–17677. DOI: 10.1073/pnas.1415375111 |
| [31] | Song X M, Li Y, Liu T, et al. Genes associated with agronomic traits innon-heading Chinese cabbage identified by expression profiling[J]. BMC Plant Biology, 2014, 14(1): 71. DOI: 10.1186/1471-2229-14-71 |





