文章信息
- 蔡万存, 李向飞, 蒋广震, 刘双庆, 刘文斌
- CAI Wancun, LI Xiangfei, JIANG Guangzhen, LIU Shuangqing, LIU Wenbin
- 大米蛋白替代鱼粉对团头鲂生长、肠道消化吸收功能以及氨基酸代谢的影响
- Effects of fish meal replacement by rice protein concentrate on growth, intestinal digestive and absorptive capability and amino acid metabolism of blunt snout bream (Megalobrama amblycephala)
- 南京农业大学学报, 2017, 40(3): 529-538
- Journal of Nanjing Agricultural University, 2017, 40(3): 529-538.
- http://dx.doi.org/10.7685/jnau.201607031
-
文章历史
- 收稿日期: 2016-07-28
2. 湖北京源山生物科技股份有限公司, 湖北 荆门 431800
2. Hubei Jingyuan Mountain Biotechnology Co., Ltd., Jingmen 431800, China
鱼粉具有蛋白质含量高、氨基酸平衡性好、生物学价值高以及抗营养因子含量低等特点, 是水产饲料中不可或缺的优质蛋白源[1]。然而, 近年来, 鱼粉产量供不应求、价格急剧上涨, 使得寻求价格低廉、营养丰富和来源广泛的新型鱼粉替代蛋白迫在眉睫。大米蛋白具有蛋白质和脂肪含量高, 氨基酸含量相对平衡等特点, 是一种优质植物蛋白[2]。已有研究表明, 大米蛋白可以替代虹鳟 (Oncorhynchus mykiss)[2]饲料中的部分鱼粉, 并且不会对生长性能造成不利影响。然而, 植物蛋白常常缺乏水产动物生长所必需的赖氨酸, 而赖氨酸的缺乏往往会限制植物蛋白的利用率[3]。因此, 在使用植物蛋白替代鱼粉时, 往往需要添加部分外源性氨基酸来平衡饲料的氨基酸组成。然而, 鱼类能否有效利用外源性的晶体氨基酸, 目前尚无定论。研究发现, 塞内加尔鳎 (Solea senegalensis)[4]可以较好地利用晶体氨基酸, 而大西洋鲑 (Salmo salar)[5]对晶体氨基酸的利用率则相对较低。进一步研究表明, 晶体氨基酸在肠道中的吸收速度过快, 导致其与蛋白质来源的氨基酸吸收不同步, 进而降低了饲料的消化吸收率[5]。而对晶体氨基酸采取包埋处理可以在一定程度上提高其利用效率[6]。然而, 水产动物对包膜氨基酸的利用机制研究目前尚为缺乏。
肠道消化吸收功能决定着鱼类对营养物质的消化和吸收能力, 并且对鱼类的生长性能具有决定性作用。已有研究表明, 植物蛋白往往存在营养组成不均衡、抗营养因子含量高以及适口性差等问题。植物蛋白替代鱼粉会造成鱼体消化吸收功能受损, 甚至引起肠道组织发生病变, 进而显著降低鱼类的生长性能[7]。然而, 这种不利影响往往存在种间特异性, 且与鱼粉的替代水平及养殖周期的长短等因素密切相关。因此, 在筛选新型植物蛋白源时, 考察其对鱼类肠道消化吸收功能的影响显得尤为重要。此外, 当机体内氨基酸不平衡时, 会导致氨基酸分解代谢加剧以及蛋白质合成速率降低, 进而造成机体蛋白质沉积率下降, 最终影响鱼类的生长发育[8]。因此, 通过对体内氨基酸代谢情况的考察来评判新型植物蛋白源的营养价值和应用潜质具有重要意义。
团头鲂 (Megalobrama amblycephala) 是我国特有的经济鱼类, 具有肉质鲜美、营养价值高、存活率高、生长速度快、抗病力强等优点[9]。作为淡水草食性鱼类, 团头鲂对动物蛋白的需求量相对较低并且能够很好地利用植物蛋白[10]。其饲料中的鱼粉含量通常在10%以下, 但因其年产量达80万t, 仍旧需要消耗大量的鱼粉[11]。因此, 在团头鲂饲料中开展植物蛋白源替代鱼粉研究仍具有较大的意义。目前有关大米蛋白以及微囊赖氨酸的应用尚未见报道。本试验旨在从肠道消化吸收和氨基酸代谢的角度来探究对其机体生长的作用机制, 为大米蛋白以及晶体和微囊赖氨酸在水产饲料中的应用提供理论依据。
1 材料与方法 1.1 试验设计与试验饲料本试验配制4组等氮 (粗蛋白为30.5%)、等脂 (粗脂肪为6%) 和等能 (能量为18.45 MJ · kg-1) 的试验饲料。其中, 鱼粉组 (FM) 以5%鱼粉以及复合植物蛋白源 (豆粕、菜粕、棉粕) 为主要蛋白源, 其余3组为大米蛋白替代鱼粉组 (RPC)、大米蛋白添加硬脂酸包被微囊赖氨酸组 (MRPC) 和大米蛋白添加晶体赖氨酸组 (CRPC)。各试验组以鱼油和豆油 (体积比为1:1) 为脂肪源, 以面粉和麸皮为糖源。饲料原料来源及其蛋白源营养成分和氨基酸组成见表 1。饲料配方和营养成分组成见表 2。饲料中氨基酸组成见表 3。各种原料经粉碎后过60目筛, 然后按照逐级预混的原则, 将各饲料原料充分混匀, 然后添加适量水, 用制粒机将饲料压制成粒径为2.0 mm的颗粒饲料, 放置室温72 h阴干后于4 ℃冰箱中保存备用。
| % | |||||
| 成分 Proximate composition |
鱼粉1) Fish meal |
大米蛋白2) Rice protein concentrate |
豆粕1) Soybean meal |
菜粕1) Rapeseed meal |
棉粕1) Cottonseed meal |
| 粗蛋白Crude protein | 64.50 | 66.50 | 44.10 | 37.80 | 44.90 |
| 粗脂肪Crude lipid | 7.80 | 8.56 | 1.50 | 3.80 | 0.50 |
| 粗灰分Ash | 21.30 | 3.90 | 6.30 | 6.80 | 6.60 |
| 必需氨基酸EAA | |||||
| 苏氨酸Thr | 3.03 | 2.47 | 1.79 | 1.66 | 1.31 |
| 缬氨酸Val | 3.35 | 3.50 | 2.10 | 1.91 | 1.76 |
| 蛋氨酸Met | 2.06 | 2.02 | 0.53 | 0.70 | 0.57 |
| 异亮氨酸Ile | 2.79 | 2.57 | 2.03 | 1.49 | 1.25 |
| 亮氨酸Leu | 5.22 | 5.29 | 3.50 | 2.72 | 2.40 |
| 苯丙氨酸Phe | 2.91 | 3.62 | 2.39 | 1.64 | 2.30 |
| 赖氨酸Lys | 4.99 | 1.89 | 2.82 | 2.20 | 1.71 |
| 组氨酸His | 1.44 | 1.54 | 1.16 | 1.01 | 1.11 |
| 精氨酸Arg | 4.36 | 4.97 | 3.21 | 2.27 | 4.65 |
| 非必需氨基酸NEAA | |||||
| 天冬氨酸Asp | 6.20 | 5.90 | 5.03 | 2.60 | 3.66 |
| 丝氨酸Ser | 3.29 | 3.25 | 2.31 | 1.64 | 1.77 |
| 谷氨酸Glu | 9.48 | 11.83 | 8.59 | 6.95 | 8.53 |
| 甘氨酸Gly | 4.50 | 2.80 | 1.93 | 1.88 | 1.63 |
| 丙氨酸Ala | 3.97 | 3.85 | 1.96 | 1.67 | 1.57 |
| 半胱氨酸Cys | 1.01 | 1.37 | 0.62 | 0.76 | 0.64 |
| 酪氨酸Tyr | 2.51 | 3.24 | 1.60 | 1.11 | 1.13 |
| 脯氨酸Pro | 2.83 | 2.19 | 2.16 | 2.24 | 1.41 |
| 注: 1) 由正昌饲料有限公司 (中国淮安) 提供Supplied by Zhengchang Feed Industry Co., Ltd.(Huaian, China); 2) 由湖北京源山生物科技股份有限公司 (中国荆门) 提供Supplied by Hubei Jingyuan Mountain Biotechnology Co., Ltd.(Jingmen, China); 3) EAA:Essential amino acid, NEAA:Non-essential amino acid. The same as follows. | |||||
| % | ||||
| 组成Ingredients | FM | RPC | MRPC | CRPC |
| 原料组成Feed composition | ||||
| 鱼粉Fish meal (FM) | 5.00 | — | — | — |
| 大米蛋白Rice protein concentrate (RPC) | — | 4.85 | 4.85 | 4.85 |
| 豆粕Soybean meal | 18.00 | 18.00 | 18.00 | 18.00 |
| 菜粕Rapeseed meal | 24.00 | 24.00 | 24.00 | 24.00 |
| 棉粕Cottonseed meal | 16.00 | 16.00 | 16.00 | 16.00 |
| 鱼油Fish oil | 1.99 | 1.98 | 1.98 | 1.98 |
| 豆油Soybean oil | 1.99 | 1.98 | 1.98 | 1.98 |
| 面粉Wheat flour | 23.00 | 23.00 | 23.00 | 23.00 |
| 麸皮Wheat bran | 4.50 | 4.50 | 4.50 | 4.50 |
| 纤维素Cellulose | 2.32 | 2.49 | 2.06 | 2.26 |
| 微囊赖氨酸2) Microcapsule lysine (ML) | — | — | 0.43 | — |
| 晶体赖氨酸2) Crystalline lysine (CL) | — | — | — | 0.23 |
| 磷酸二氢钙Ca (H2PO4)2 | 1.80 | 1.80 | 1.80 | 1.80 |
| 食盐Salt | 0.40 | 0.40 | 0.40 | 0.40 |
| 预混料3) Premix | 1.00 | 1.00 | 1.00 | 1.00 |
| 营养组成Proximate composition | ||||
| 水分Moisture | 8.54 | 8.56 | 8.55 | 8.53 |
| 粗蛋白Crude protein | 30.48 | 30.50 | 30.49 | 30.50 |
| 粗脂肪Crude lipid | 6.01 | 6.02 | 5.99 | 6.00 |
| 粗灰分Ash | 6.54 | 6.49 | 6.48 | 6.52 |
| 总能4) Gross energy | 18.46 | 18.44 | 18.45 | 18.44 |
| 注: 1) FM:鱼粉组Fish meal; RPC:大米蛋白替代鱼粉组FM replaced by RPC; MRPC:大米蛋白添加微囊赖氨酸组FM replaced by RPC with ML supplementation; CRPC:大米蛋白添加晶体赖氨酸组FM replaced by RPC with CL supplementation. 2) 含38%赖氨酸的微囊赖氨酸和含70%赖氨酸的晶体赖氨酸均由广东海纳川药业股份有限公司 (中国佛山) 提供。ML containing 38% lysine and CL containing 70% lysine were provided by Hainachuan Pharmaceutical Co., Ltd.(Foshan, China).3) 每千克预混料包含:CuSO4 · 5H2O 2.0 g, FeSO4 · 7H2O 25 g, ZnSO4 · 7H2O 22 g, MnSO4 · 4H2O 7 g, Na2SeO3 0.04 g, KI 0.026 g, CoCl2 · 6H2O 0.1 g, 维生素A 900 000 IU, 维生素D 200 000 IU, 维生素E 4 500 mg, 维生素K3 220 mg, 维生素B1 320 mg, 维生素B2 1 090 mg, 维生素B5 2 000 mg, 维生素B6 500 mg, 维生素B12 1.6 mg, 维生素C 5 000 mg, 泛酸1 000 mg, 叶酸165 mg, 胆碱60 000 mg。Premix supplied the following minerals and vitamins per kilogram:CuSO4 · 5H2O 2.0 g, FeSO4 · 7H2O 25 g, ZnSO4 · 7H2O 22 g, MnSO4 · 4H2O 7 g, Na2SeO3 0.04 g, KI 0.026 g, CoCl2 · 6H2O 0.1 g, vitamin A 900 000 IU, vitamin D 200 000 IU, vitamin E 4 500 mg, vitamin K3 220 mg, vitamin B1 320 mg, vitaminB2 1 090 mg, vitamin B5 2 000 mg, vitamin B6 500 mg, vitamin B12 1.6 mg, vitamin C 5 000 mg, pantothenate 1 000 mg, folic acid 165 mg, choline 60 000 mg. 4) 总能单位是MJ · kg-1。The unit of gross energy is MJ · kg-1. | ||||
| % | ||||
| 氨基酸组成Amino acid component | FM | RPC | MRPC | CRPC |
| 必需氨基酸EAA | ||||
| 苏氨酸Thr | 1.16 | 1.16 | 1.15 | 1.14 |
| 缬氨酸Val | 1.37 | 1.44 | 1.43 | 1.41 |
| 蛋氨酸Met | 0.52 | 0.48 | 0.47 | 0.45 |
| 异亮氨酸Ile | 1.15 | 1.17 | 1.16 | 1.15 |
| 亮氨酸Leu | 2.11 | 2.16 | 2.15 | 2.13 |
| 苯丙氨酸Phe | 1.46 | 1.53 | 1.52 | 1.50 |
| 赖氨酸Lys | 1.64 | 1.55 | 1.69 | 1.68 |
| 组氨酸His | 0.77 | 0.78 | 0.77 | 0.77 |
| 精氨酸Arg | 2.15 | 2.23 | 2.20 | 2.19 |
| 总必需氨基酸tEAA | 12.33 | 12.50 | 12.55 | 12.42 |
| 非必需氨基酸NEAA | ||||
| 天冬氨酸Asp | 2.55 | 2.57 | 2.56 | 2.55 |
| 丝氨酸Ser | 1.42 | 1.45 | 1.44 | 1.43 |
| 谷氨酸Glu | 5.56 | 5.80 | 5.76 | 5.72 |
| 甘氨酸Gly | 1.41 | 1.36 | 1.35 | 1.34 |
| 丙氨酸Ala | 1.32 | 1.33 | 1.32 | 1.31 |
| 半胱氨酸Cys | 0.43 | 0.48 | 0.48 | 0.46 |
| 酪氨酸Tyr | 0.83 | 0.90 | 0.88 | 0.88 |
| 脯氨酸Pro | 1.65 | 1.69 | 1.66 | 1.68 |
| 总非必需氨基酸tNEAA | 15.16 | 15.58 | 15.45 | 15.37 |
养殖试验在南京农业大学浦口试验基地的户外网箱内进行。试验所用团头鲂取自江苏省扬州市国家团头鲂良种场。正式试验开始前, 将团头鲂暂养于网箱中, 期间投喂商品饲料, 使其适应试验条件。驯化4周后, 将240尾体格健壮、活力稳定、规格整齐、初始体质量约为108 g的团头鲂随机分成4组, 每组4个重复, 每个重复15尾鱼。试验在16个网箱 (规格为1.0 m×1.0 m×1.0 m) 中进行。正式试验期为8周, 期间每日定时饱食投喂3次 (分别为07:00、11:30、16:00), 每日观察并记录鱼摄食及死亡情况。试验期间水温24~30 ℃, pH值7.0~7.5, 溶解氧水平大于5.0 mg · L-1, 氨态氮含量小于0.01 mg · L-1。
1.3 样品采集养殖试验结束时, 在饱食投喂6 h后, 每个网箱随机选取4尾鱼, 用100 mg · L-1的间氨基苯甲酸乙酯甲磺酸盐 (MS-222, Sigma, 美国) 对鱼进行麻醉处理, 并用肝素钠润湿后的一次性医用注射器从尾静脉采血。采集后的血液置于2 mL的抗凝管中, 于4 ℃下3 000 r · min-1离心10 min。将血浆置于-40 ℃冰箱中保存, 用于血浆游离氨基酸的测定。将剩余鱼饥饿24 h, 以使肠道内容物排空, 然后, 每个网箱随机选取4尾鱼, 按上述方法将鱼麻醉并采集血液, 用于其他血液生化指标的测定。采完血后, 在冰袋上将鱼迅速解剖, 并分离出肝脏和肠道。用4 ℃预冷后的生理盐水冲洗, 再用滤纸吸干表面水分, 并快速置于-40 ℃冰箱中冷冻保存, 用于肠道和肝脏酶活性的测定。
1.4 指标测定及方法 1.4.1 饲料常规营养成分的测定饲料常规营养成分测定方法如下:饲料粗蛋白 (N×6.25) 含量采用全自动凯氏定氮仪 (FOSS KT260, 瑞士) 测定; 水分含量采用105 ℃烘干法测定; 粗脂肪含量采用索氏抽提法测定; 粗灰分含量采用550 ℃灼烧法测定; 总能采用氧弹测热仪 (Parr 1281, 美国) 测定。氨基酸含量是根据Yamamoto等[12]的方法测定, 饲料用6 mol · L-1 HCl在110 ℃下水解22 h后, 采用全自动氨基酸检测仪 (L-8900, Hitachi, 日本) 测定。
1.4.2 生长指标的测定饲养试验结束后, 统计每个网箱鱼体的总质量, 用以计算每日生长指数 (DGI) 和饲料效率 (FER)。生长指标计算公式如下:DGI=100×(W11/3-W01/3)×T-1; FER=100×(W1-W0)×FI-1。式中:W0为鱼初始体质量 (g); W1为鱼终末体质量 (g); T为饲喂时间 (d); FI为每尾鱼平均摄食饲料总量 (g)。
1.4.3 肠道消化吸收相关酶活性的测定准确称取适量肠道样品, 在冰浴条件下, 按照组织与生理盐水1:9(体积比) 的比例进行匀浆, 制成10%的匀浆液, 然后于4 ℃、3 000 r · min-1离心10 min, 取上清液, 用于蛋白酶、脂肪酶、淀粉酶、Na+, K+-ATP酶、碱性磷酸酶 (AKP)、肌酸激酶 (CK) 和γ-谷氨酰转肽酶 (γ-GT) 活性的测定。其中, 总蛋白酶活性采用福林-酚法[13]测定。脂肪酶活性参照Furne等[14]的方法进行测定。淀粉酶活性采用碘-淀粉比色法[14]测定。Na+, K+-ATP酶活性参照Mccormick等[15]的方法进行测定。AKP活性采用对硝基磷酸苯二钠法测定, 具体步骤参见Engstad等[16]的方法。CK的活性参照Weng等[17]的方法进行测定。γ-GT的活性参照Bauermeister等[18]的方法进行测定。
1.4.4 肝脏代谢酶的测定准确称取适量肝脏组织, 在冰浴条件下, 按照组织与生理盐水1:9(体积比) 的比例进行匀浆, 制成10%的匀浆液, 然后于4 ℃、3 000 r · min-1离心10 min, 取上清液, 用于肝脏中天门冬氨酸氨基转移酶 (AST)、丙氨酸氨基转移酶 (ALT)、黄嘌呤氧化酶 (XOD) 和琥珀酸脱氢酶 (SDH) 活性的测定。肝脏AST和ALT活性采用赖氏法测定, 具体步骤均参照Krajnovi Ac'-Ozreti Ac'等[19]的方法。肝脏XOD和SDH活性均采用南京建成生物工程研究所的试剂盒测定。
1.4.5 血液生化指标的测定血浆AST和ALT活性采用赖氏法测定[19]。血液生化指标中的总蛋白、白蛋白和尿素氮含量均采用南京建成生物工程研究所的试剂盒检测。其中, 总蛋白含量采用考马斯亮蓝法测定, 白蛋白含量采用溴甲酚绿比色法测定, 尿素氮含量采用脲酶法测定, 具体方法参照说明书。血糖水平采用葡萄糖氧化酶-过氧化物酶法测定[20]。血浆中游离氨基酸含量参照Karlsson等[21]的方法测定。
1.5 数据处理每个试验4个重复, 并采用平均值±标准误 (x±SE) 表示, 数据首先用Excel 2010处理后, 再用SPSS Statistics 17.0软件进行单因素方差分析 (One-Way ANOVA), 并用Tukey′s多重比较法分析结果的差异显著性。
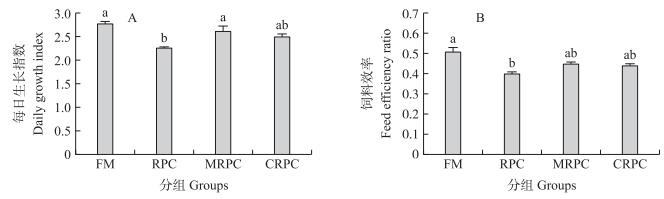
2 结果与分析 2.1 大米蛋白替代鱼粉对团头鲂生长性能和饲料利用率的影响由图 1可知:FM组每日生长指数和饲料效率显著高于RPC组 (P < 0.05), 但与其他2组间差异不显著 (P > 0.05)。
|
图 1 大米蛋白替代鱼粉对团头鲂每日生长指数和饲料效率的影响 (n=4) Figure 1 Effects of fishmeal replacement by rice protein concentrate on daily growth index and feed efficiency ratio of blunt snout bream 柱形图上不同字母表示差异显著 (P < 0.05)。 in the column with different letters mean significant difference (P < 0.05). The same as below. |
由表 4可知:RPC组肠道蛋白酶和Na+, K+-ATP酶活性显著低于FM组 (P < 0.05), 但与其他两组差异不显著 (P > 0.05)。RPC组肠道脂肪酶、AKP、CK和γ-GT活性均显著低于其他各组 (P < 0.05), 而FM、MRPC和CRPC组间差异不显著 (P > 0.05)。此外, 各试验组团头鲂肠道淀粉酶活性无显著差异 (P > 0.05)。
| 指标Parameters | FM | RPC | MRPC | CRPC |
| 蛋白酶活性/(U·mg-1) Protease activity | 130.32±2.29a | 114.32±2.69b | 126.58±2.69ab | 119.08±4.70ab |
| 脂肪酶活性/(U·g-1) Lipase activity | 63.34±1.36a | 48.18±1.39b | 60.83±1.60a | 60.75±2.50a |
| 淀粉酶活性/(U·g-1) Amylase activity | 1.36±0.07 | 1.23±0.06 | 1.30±0.02 | 1.22±0.02 |
| Na+, K+-ATP酶活性/(U·mg-1) Na+, K+-ATPase activity | 1.34±0.03a | 0.94±0.03b | 1.18±0.04ab | 1.14±0.09ab |
| 碱性磷酸酶活性/(U·g-1) Alkaline phosphatase activity | 33.07±0.97a | 25.32±1.16b | 31.61±1.35a | 30.82±0.85a |
| 肌酸激酶活性/(U·g-1) Creatine kinase activity | 192.64±6.46a | 138.67±4.57b | 188.32±6.74a | 185.12±7.44a |
| γ-谷氨酰转肽酶活性/(U·g-1)γ-glutamyl transpeptidase | 105.67±5.80a | 77.04±4.82b | 103.42±5.98a | 101.01±2.65a |
| 注:同行肩标不同小写字母表示差异显著 (P < 0.05)。 Note:In the same row, values with different small letter superscripts mean significant difference (P < 0.05). The same as below. | ||||
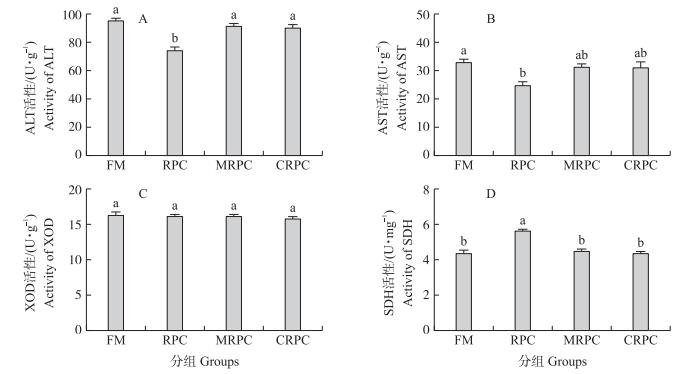
由图 2可知:RPC组肝脏ALT活性显著低于其他3组, 而SDH活性显著高于其他3组 (P < 0.05)。RPC组肝脏AST活性显著低于FM组 (P < 0.05), 但与其他2组差异不显著 (P > 0.05)。此外, 各试验组肝脏XOD活性无显著差异 (P > 0.05)。
|
图 2 大米蛋白替代鱼粉对团头鲂肝脏代谢酶活性的影响 Figure 2 Effects of fishmeal replacement by rice protein concentrate on hepatic enzymes activities of blunt snout bream ALT:丙氨酸氨基转移酶 Alanine aminotransferase; AST:天门冬氨酸氨基转移酶 Aspartate aminotransferase; XOD:黄嘌呤氧化酶 Xanthine oxidase; SDH:琥珀酸脱氢酶 Succinodehydrogenase. |
由表 5可知:RPC组血浆蛋氨酸、苯丙氨酸、赖氨酸、组氨酸以及游离总必需氨基酸含量显著低于FM组 (P < 0.05), 而MRPC和CRPC组的血浆游离必需氨基酸含量与FM组之间差异不显著 (P > 0.05)。对于血浆游离非必需氨基酸而言, FM组血浆牛磺酸含量显著高于其他3组 (P < 0.05), 而其余氨基酸含量则无显著差异 (P > 0.05)。此外, RPC组血浆总游离非必需氨基酸含量显著低于FM组 (P < 0.05), 但与MRPC和CRPC组之间差异不显著 (P > 0.05)。
| ng·μL-1 | ||||
| 氨基酸Amino acid | FM | RPC | MRPC | CRPC |
| 必需氨基酸EAA | ||||
| 苏氨酸Thr | 6.25±0.14 | 5.99±0.13 | 6.08±0.30 | 5.78±0.28 |
| 缬氨酸Val | 4.41±0.21 | 4.66±0.14 | 4.51±0.17 | 4.62±0.10 |
| 蛋氨酸Met | 3.19±0.08a | 2.15±0.10b | 3.11±0.08a | 3.01±0.07a |
| 异亮氨酸Ile | 3.51±0.16 | 3.27±0.19 | 3.38±0.22 | 3.33±0.18 |
| 亮氨酸Leu | 6.10±0.23 | 5.98±0.17 | 6.14±0.21 | 5.70±0.34 |
| 苯丙氨酸Phe | 4.55±0.05a | 3.59±0.09b | 4.49±0.17a | 4.42±0.11a |
| 赖氨酸Lys | 7.20±0.33a | 5.52±0.16b | 7.52±0.17a | 7.29±0.10a |
| 组氨酸His | 8.96±0.18a | 7.42±0.23b | 8.65±0.07a | 9.13±0.27a |
| 精氨酸Arg | 5.12±0.19 | 5.01±0.08 | 5.04±0.12 | 5.06±0.10 |
| 总必需氨基酸Total EAA | 51.45±1.18a | 42.64±1.55b | 50.22±1.24a | 49.62±1.88a |
| 非必需氨基酸NEAA | ||||
| 天冬氨酸Asp | 0.28±0.02 | 0.26±0.01 | 0.28±0.02 | 0.28±0.03 |
| 丝氨酸Ser | 1.43±0.09 | 1.53±0.16 | 1.43±0.20 | 1.55±0.13 |
| 谷氨酸Glu | 1.20±0.17 | 1.22±0.13 | 1.17±0.10 | 1.11±0.06 |
| 甘氨酸Gly | 4.05±0.26 | 3.32±0.21 | 3.53±0.47 | 3.04±0.18 |
| 丙氨酸Ala | 4.79±0.08 | 4.17±0.12 | 4.41±0.27 | 4.86±0.26 |
| 半胱氨酸Cys | 1.06±0.16 | 0.99±0.05 | 1.24±0.02 | 1.19±0.17 |
| 酪氨酸Tyr | 5.53±0.14 | 4.85±0.4 | 5.76±0.12 | 5.64±0.44 |
| 脯氨酸Pro | 1.65±0.10 | 2.03±0.15 | 2.26±0.22 | 2.20±0.41 |
| 牛磺酸Tau | 8.92±0.17a | 5.82±0.14b | 5.85±0.14b | 5.95±0.11b |
| 总非必需氨基酸Total NEAA | 28.12±0.32a | 23.19±0.26b | 25.85±0.43ab | 25.67±0.36ab |
由表 6可知:各组间血浆AST和ALT活性以及葡萄糖含量均无显著差异 (P > 0.05)。此外, RPC组血浆总蛋白和白蛋白含量显著低于其他各组 (P < 0.05), 而尿素氮含量与其相反 (P < 0.05)。另外, 其他3组间各项指标均无显著差异 (P > 0.05)。
| 指标Parameters | FM | RPC | MRPC | CRPC |
| AST活性/(U·L-1) AST activity | 7.16±0.30 | 7.38±0.21 | 7.47±0.14 | 7.28±0.35 |
| ALT活性/(U·L-1) ALT activity | 3.92±0.34 | 4.21±0.19 | 3.89±0.26 | 4.13±0.42 |
| 总蛋白含量/(mmol·L-1) Total protein content | 39.79±0.65a | 32.70±1.56b | 39.48±0.79a | 39.67±2.02a |
| 白蛋白含量/(mmol·L-1) Albumin content | 16.39±0.38a | 13.54±0.23b | 16.12±0.42a | 16.19±0.27a |
| 尿素氮含量/(mmol·L-1) Urinary nitrogen content | 1.32±0.06b | 2.15±0.07a | 1.38±0.08b | 1.34±0.06b |
| 葡萄糖含量/(mmol·L-1) Glucose content | 4.27±0.11 | 4.15±0.08 | 4.22±0.14 | 4.16±0.12 |
在本试验中, 大米蛋白完全替代鱼粉显著降低了团头鲂的生长性能和饲料效率, 而补充两种剂型的赖氨酸均能一定程度上促进团头鲂的生长发育和提高饲料利用率。这一结果与Jiang等[22]在草鱼 (Ctenopharyngodon idella) 上的研究结果一致。究其原因, 可能与植物蛋白替代鱼粉影响鱼体肠道消化吸收功能以及氨基酸代谢等因素有关。
3.2 大米蛋白替代鱼粉对团头鲂肠道消化吸收功能的影响研究表明, 肠道消化酶和刷状缘酶的活性与营养物质的消化吸收率密切相关, 且对鱼体的生长具有决定性的作用[23]。蛋白酶和脂肪酶主要参与蛋白质和脂肪在肠道中的消化, 其活性增加表明动物从饲料中获取营养物质的能力提高[24]。在本试验中, 大米蛋白完全替代鱼粉显著降低肠道蛋白酶和脂肪酶的活性, 而补充两种剂型的赖氨酸后, 肠道消化酶活性均与鱼粉组无显著差异。这表明大米蛋白完全替代鱼粉对团头鲂肠道消化功能具有一定影响, 但在饲料中补充一定量的微囊或者晶体赖氨酸后可以弥补这一缺陷。已有研究表明, 赖氨酸能够刺激鱼类胰腺组织中消化酶的合成, 并且能够影响肠道消化酶的分泌和释放[25]。基于此, 大米蛋白组肠道消化酶活性的降低可能是由于饲料中赖氨酸的缺乏所致。本试验结果与Jiang等[22]在草鱼 (Ctenopharyngodon idella) 上的研究类似。此外, 鱼类肠道营养物质的吸收和转运与肠道刷状缘处Na+, K+-ATP酶、AKP、CK以及γ-GT的活性密切相关[25]。Na+, K+-ATP酶在营养物质转运中发挥作用, 并且能够直接反映肠道的吸收能力[26]。AKP主要参与脂类、葡萄糖、钙和无机磷等营养物质的吸收[27]。CK可以催化磷酸肌酸与ADP反应, 为细胞提供所需要的ATP, 进而对营养物质的吸收具有重要作用[28]。此外, γ-GT是γ-谷氨酰循环中的关键酶, 可以促进氨基酸向细胞内转运[26]。在本试验中, 大米蛋白完全替代鱼粉显著降低了肠道各刷状缘酶活性, 而补充赖氨酸后, 负面影响得以改善。结果表明, 大米蛋白完全替代鱼粉对团头鲂肠道吸收功能具有一定影响, 而平衡饲料赖氨酸后可以弥补这一缺陷。本试验结果与Jiang等[22]在草鱼 (Ctenopharyngodon idella) 上的研究类似。尽管赖氨酸影响肠道吸收酶活性的具体作用机制尚不清楚, 但已有研究表明, 鱼类肠道吸收功能主要取决于消化器官的生长和发育, 而消化器官的生长又与蛋白质代谢相关[29]。因此, 大米蛋白组肠道吸收酶活性的降低可能是由于赖氨酸缺乏导致蛋白质代谢紊乱, 从而影响消化吸收酶活性, 具体机制有待进一步研究。此外, 在本试验中, MRPC组肠道各消化吸收酶的活性均高于CRPC组, 尽管差异并不显著。这表明微囊赖氨酸在改善鱼类肠道消化吸收功能方面的效果要优于晶体赖氨酸。
3.3 大米蛋白替代鱼粉对团头鲂肝脏代谢酶活性的影响研究表明, ALT和AST是鱼类肝脏中最为重要的氨基转移酶, 其活性与氨基酸代谢强弱有着密切联系[30]。在本试验中, 大米蛋白完全替代鱼粉显著降低了肝脏ALT和AST活性, 而补充赖氨酸后, 肝脏ALT和AST活性与鱼粉组均无显著差异。表明大米蛋白完全替代鱼粉会显著降低团头鲂肝脏中蛋白质的代谢率, 而补充外源性的赖氨酸可以在一定程度上改善这一状况。其原因可能是由于大米蛋白中赖氨酸含量相对较低, 造成饲料中氨基酸组成不平衡, 进而影响了肝脏中氨基酸的代谢稳态。此外, 在本试验中, RPC组SDH活性显著高于FM组, 而MRPC和CRPC组的SDH活性均接近FM组的水平。表明当饲料中的氨基酸不平衡时, 机体能量代谢程度将会升高, 而补充外源性的氨基酸在一定程度上减缓肝脏能量代谢程度。这是因为SDH是反映肝脏能量代谢的直观指标, 其活性升高往往伴随着机体能量分解代谢的加强[31]。此外, 在本试验中, 大米蛋白替代鱼粉并未对肝脏XOD的活性造成显著影响, 表明大米蛋白完全替代鱼粉不会对团头鲂肝脏造成病理性影响。这因为只有在毒理、病理和胁迫等非正常状态下, 机体才会分泌大量的XOD, 进而促进自由基的产生[32]。
3.4 大米蛋白替代鱼粉对团头鲂血浆游离氨基酸的影响已有研究表明, 血液中的游离氨基酸含量能够反映机体氨基酸吸收情况和蛋白质的合成情况[33]。血浆中总游离氨基酸的含量在摄食后快速升高, 并在6 h左右达到峰值[34]。因此, 为了保证不同试验中血浆游离氨基酸的可比性, 往往会选择摄食后6 h采集血液样品并进行氨基酸组成分析。在本试验中, 大米蛋白替代鱼粉后, 团头鲂血浆蛋氨酸、苯丙氨酸、赖氨酸、组氨酸和牛磺酸的含量均显著降低。当在饲料中补充一定剂量的晶体或者微囊赖氨酸后, 血浆蛋氨酸、苯丙氨酸、赖氨酸和组氨酸含量均恢复到鱼粉组水平。这表明大米蛋白完全替代鱼粉会导致饲料氨基酸不平衡, 影响血浆氨基酸的组成, 而额外添加一定量的氨基酸能够在一定程度上改善饲料的氨基酸平衡, 进而改善血浆氨基酸组成。由此可见, 饲料中赖氨酸的缺乏可能造成了外周血液循环过程中一些氨基酸的缺乏, 而造成这一结果的原因可能与消化吸收过程中某些氨基酸之间的拮抗作用有关。例如, 赖氨酸和精氨酸具有拮抗作用, 低浓度的赖氨酸能够促进精氨酸在肠道中的吸收, 而任何浓度的精氨酸都会阻碍赖氨酸在肠道中的吸收[35]。此外, 本试验中, RPC组血浆牛磺酸含量显著低于FM组, 这一结果可能与大米蛋白中的牛磺酸含量较低有关。研究表明, 在以植物蛋白为主要蛋白源的饲料中添加一定量的牛磺酸, 可以提高裸盖鱼 (Anoplopoma fimbria) 的生长性能和饲料利用效率[36]。基于此, 大米蛋白替代鱼粉后, 能否通过额外添加牛磺酸的方式改善其利用率, 值得进一步探究。
3.5 大米蛋白替代鱼粉对团头鲂血液生化指标的影响在本试验中, 各组间血浆AST和ALT活性均无显著差异, 表明大米蛋白完全替代鱼粉并未对团头鲂的肝功能造成负面影响。这是因为, 通常情况下血浆中的转氨酶活性较低, 而当机体肝脏功能受损时, 肝细胞内的转氨酶会大量释放出来进入血液中, 从而导致血浆AST和ALT活性升高[37]。已有研究表明, 饲料缺乏或过量赖氨酸对团头鲂幼鱼的肝功能具有负面影响[38]。而本试验中, 尽管大米蛋白完全替代鱼粉影响了团头鲂的蛋白质代谢, 但并未对肝功能造成显著影响。究其原因, 可能与鱼的规格、饲养模式和饲料配方等有关。此外, 在本试验中, RPC组血浆总蛋白和白蛋白含量均显著低于FM组, 而血浆尿素氮含量则与之相反。这表明大米蛋白由于缺乏赖氨酸不能够满足机体蛋白合成需要, 进而导致机体蛋白分解代谢加剧。因为血浆中总蛋白含量能够反映机体蛋白质代谢情况, 其含量下降表明动物对饲料中蛋白质的吸收能力下降[39]。此外, 尿素氮是鱼体含氮物质的代谢产物, 其含量的升高意味着蛋白质的分解代谢增强、蛋白质沉积率降低[40]。究其原因, 这一结果可能是与饲料中赖氨酸含量不足导致鱼类对蛋白质的吸收能力降低有关, 类似结果见于对褐点石斑鱼 (Epinephelus fuscoguttatus)[39]的研究。
| [1] | Hardy R W. Utilization of plant proteins in fish diets:effects of global demand and supplies of fishmeal[J]. Aquaculture Research, 2010, 41(5): 770–776. DOI: 10.1111/are.2010.41.issue-5 |
| [2] | Palmegiano G B, Daprá F, Forneris G, et al. Rice protein concentrate meal as a potential ingredient in practical diets for rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 2006, 258(1/2/3/4): 357–367. |
| [3] | Wang S, Liu Y J, Tian L X, et al. Quantitative dietary lysine requirement of juvenile grass carp Ctenopharyngodon idella[J]. Aquaculture, 2005, 249(1): 419–429. |
| [4] | Pérez-Jiménez A, Peres H, Oliva-Teles A. Effective replacement of protein-bound amino acids by crystalline amino acids in Senegalese sole (Solea senegalensis) juveniles[J]. Aquaculture Nutrition, 2014, 20(1): 60–68. DOI: 10.1111/anu.2014.20.issue-1 |
| [5] | Hauler R C, Carter C G, Edwards S J. Feeding regime does not influence lysine utilization by Atlantic salmon, Salmo salarL., parr[J]. Aquaculture, 2007, 273(4): 545–555. DOI: 10.1016/j.aquaculture.2007.10.045 |
| [6] | Yuan Y C, Gong S Y, Yang H J, et al. Effects of supplementation of crystalline or coated lysine and/or methionine on growth performance and feed utilization of the Chinese sucker, Myxocyprinus asiaticus[J]. Aquaculture, 2011, 316(1): 31–36. |
| [7] | Santigosa E, Sánchez J, Médale F, et al. Modifications of digestive enzymes in trout (Oncorhynchus mykiss) and sea bream (Sparus aurata) in response to dietary fish meal replacement by plant protein sources[J]. Aquaculture, 2008, 282(1/2/3/4): 68–74. |
| [8] | Men K, Ai Q, Mai K, et al. Effects of dietary corn gluten meal on growth, digestion and protein metabolism in relation to IGF-I gene expression of Japanese seabass, Lateolabrax japonicas[J]. Aquaculture, 2014, 428/429: 303–309. DOI: 10.1016/j.aquaculture.2014.03.028 |
| [9] |
蒋阳阳, 李向飞, 刘文斌, 等. 日粮糖水平对1龄团头鲂生长性能和体组成及血液生化指标的影响[J].
南京农业大学学报, 2016, 39(2): 281–288.
Jiang Y Y, Li X F, Liu W B, et al. Growth performance, body composition and plasma biochemical parameters of blunt snout bream (Megalobrama amblycephsla) yearlings fed practical diets differing in carbohydrate levels[J]. Journal of Nanjing Agricultural University, 2016, 39(2): 281–288. DOI: 10.7685/jnau.201506002 (in Chinese) |
| [10] | Deng W, Zhao Y H, Wang W M, et al. Anti-stress properties and two HSP70s mRNA expressions of blunt snout bream (Megalobrama amblycephala) fed with all-plant-based diet[J]. Fish Physiology and Biochemistry, 2014, 40(3): 817–825. DOI: 10.1007/s10695-013-9888-1 |
| [11] |
中华人民共和国农业部.
中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2015: 31.
Ministry of Agriculture of the People's Republic of China. China Fishery Statistical Yearbook[M]. Beijing: China Agriculture Press, 2015: 31. (in Chinese) |
| [12] | Yamamoto T, Ikeda K, Unuma T, et al. Apparent availabilities of amino acids and minerals from several protein sources for fingerling rainbow trout[J]. Fisheries Science, 1997, 63(6): 995–1001. |
| [13] | Lowry O P, Rosebrough N J, Farr A L, et al. Protein measurement with the folin-phenol reagent[J]. Journal of Biological Chemistry, 1951, 193(1): 265–275. |
| [14] | Furne M, Hidalgo M, Lopez A, et al. Digestive enzyme activities in Adriatic sturgeon Acipenser naccarii and rainbow trout Oncorhynchus mykiss:a comparative study[J]. Aquaculture, 2005, 250(1): 391–398. |
| [15] | Mccormick S D. Methods for nonlethal gill Biopsy and measurement of Na+, K+-ATPase activity[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1993, 50(3): 656–658. DOI: 10.1139/f93-075 |
| [16] | Engstad R E, Robertsen B, Frivold E. Yeast glucan induces increase in lysozyme and complement-mediated haemolytic activity in Atlantic salmon blood[J]. Fish and Shellfish Immunology, 1992, 2(4): 287–297. DOI: 10.1016/S1050-4648(06)80033-1 |
| [17] | Weng C, Wu J. Acute changes in gill Na+-K+-ATPase and creatine kinase in response to salinity changes in the euryhaline teleost, tilapia (Oreochromis mossambicus)[J]. Physiological and Biochemical Zoology, 2002, 75(1): 29–36. DOI: 10.1086/338283 |
| [18] | Bauermeister A, Lewendon A, Ramage P, et al. Distribution and some properties of the glutathione s-transferase and γ-glutamyl transpeptidase activities of rainbow trout[J]. Comparative Biochemistry and Physiology Part C:Comparative Pharmacology, 1983, 74(1): 89–93. DOI: 10.1016/0742-8413(83)90155-X |
| [19] | Krajnovi Ac'-Ozreti Ac' M, Ozreti Ac' B. Estimation of the enzymes LDH, GOT and GPT in plasma of grey mullet Mugil auratus and their significance in liver intoxication[J]. Diseases of Aquatic Organisms, 1987, 3(3): 187–193. |
| [20] | Asadi F, Hallajian A, Asadian P, et al. Serum lipid, free fatty acid, and proteins in juvenile sturgeons:Acipenser persicus and Acipenser stellatus[J]. Comparative Clinical Pathology, 2009, 18(3): 287–289. DOI: 10.1007/s00580-008-0797-0 |
| [21] | Karlsson A, Eliason E J, Mydland L T, et al. Postprandial changes in plasma free amino acid levels obtained simultaneously from the hepatic portal vein and the dorsal aorta in rainbow trout (Oncorhynchus mykiss)[J]. Journal of Experimental Biology, 2006, 209(24): 4885–4894. DOI: 10.1242/jeb.02597 |
| [22] | Jiang J, Shi D, Zhou X Q, et al. Effects of lysine and methionine supplementation on growth, body composition and digestive function of grass carp (Ctenopharyngodon idella) fed plant protein diets using high-level canola meal[J]. Aquaculture Nutrition, 2015, 132(3): 927–927. |
| [23] | Silva F C P, Nicoli J R, Zambonino-Infante J L, et al. Influence of partial substitution of dietary fish meal on the activity of digestive enzymes in the intestinal brush border membrane of gilthead sea bream, Sparus aurata and goldfish, Carassius auratus[J]. Aquaculture, 2010, 306(1/2/3/4): 233–237. |
| [24] | Xu C, Li X F, Tian H Y, et al. Feeding rates affect growth, intestinal digestive and absorptive capabilities and endocrine functions of juvenile blunt snout bream Megalobrama amblycephala[J]. Fish Physiology and Biochemistry, 2015, 42(2): 1–12. |
| [25] | Li X Y, Tang L, Hu K, et al. Effect of dietary lysine on growth, intestinal enzymes activities and antioxidant status of sub-adult grass carp (Ctenopharyngodon idella)[J]. Fish Physiology and Biochemistry, 2014, 40(3): 659–671. DOI: 10.1007/s10695-013-9874-7 |
| [26] | Wu Y, Liu W B, Li H Y, et al. Effects of dietary supplementation of fructooligosaccharide on growth performance, body composition, intestinal enzymes activities and histology of blunt snout bream (Megalobrama amblycephala) fingerlings[J]. Aquaculture Nutrition, 2013, 19(19): 886–894. |
| [27] | Villanueva J, Vanacore R, Goicoechea O, et al. Intestinal alkaline phosphatase of the fish Cyprinus carpio:Regional distribution and membrane association[J]. Journal of Experimental Zoology, 1997, 279(4): 347–355. DOI: 10.1002/(ISSN)1097-010X |
| [28] |
周秀菊, 刘党生, 蒋宇扬. 肌酸激酶结构与功能研究进展[J].
沈阳药科大学学报, 2002, 19(5): 386–390.
Zhou X j, Liu D S, Jiang Y Y. Survey of studies on the structures and functions of creatine kinase[J]. Journal of Shenyang Pharmaceutical University, 2002, 19(5): 386–390. (in Chinese) |
| [29] | Habte-Tsion H M, Ren M, Liu B, et al. Threonine influences the absorption capacity and brush-border enzyme gene expression in the intestine of juvenile blunt snout bream (Megalobrama amblycephala)[J]. Aquaculture, 2015, 448: 436–444. DOI: 10.1016/j.aquaculture.2015.06.030 |
| [30] | Cai Z, Li W, Mai K, et al. Effects of dietary size-fractionated fish hydrolysates on growth, activities of digestive enzymes and aminotransferases and expression of some protein metabolism related genes in large yellow croaker (Larimichthys crocea) larvae[J]. Aquaculture, 2015, 440: 40–47. DOI: 10.1016/j.aquaculture.2015.01.026 |
| [31] |
罗钧秋. 猪饲粮不同来源蛋白质营养代谢效应的比较研究[D]. 雅安: 四川农业大学, 2011.
Luo J Q. Study on comparative effects of protein sources on nutritional metabolic responses[D]. Yaan:Sichuan Agricultural University, 2011(in Chinese with English abstract). |
| [32] |
冯广朋, 庄平, 章龙珍, 等. 温度对中华鲟幼鱼代谢酶和抗氧化酶活性的影响[J].
水生生物学报, 2012, 36(1): 137–142.
Feng G P, Zhuang P, Zhang L Z, et al. Effects of water temperature on metabolic enzyme and antioxidase activities in juvenile Chinese sturgeon (Acipenser Sinensis)[J]. Acta Hydrobiologica Sinica, 2012, 36(1): 137–142. (in Chinese) |
| [33] | Blasco J, Fernández J, Gutiérrez J. The effects of starvation and re-feeding on plasma amino acid levels in carp, Cyprinus carpio L., 1758[J]. Journal of Fish Biology, 1991, 38(4): 587–598. DOI: 10.1111/jfb.1991.38.issue-4 |
| [34] | Yin F G, Liu Y L, Yin Y L, et al. Dietary supplementation with Astragalus polysaccharide enhances ileal digestibilities and serum concentrations of amino acids in early weaned piglets[J]. Amino Acids, 2009, 37(2): 263–270. DOI: 10.1007/s00726-008-0142-6 |
| [35] | Berge G M, Grisdale-Helland B, Helland S J. Soy protein concentrate in diets for Atlantic halibut (Hippoglossus hippoglossus)[J]. Aquaculture, 1999, 178(1): 139–148. |
| [36] | Johnson R B, Kim S K, Watson A M, et al. Effects of dietary taurine supplementation on growth, feed efficiency, and nutrient composition of juvenile sablefish (Anoplopoma fimbria) fed plant based feeds[J]. Aquaculture, 2015, 445: 79–85. DOI: 10.1016/j.aquaculture.2015.03.030 |
| [37] | Barcellos L J G, Kreutz L C, de Souza C, et al. Hematological changes in jundiá(Rhamida quelen Quoy and Gaimard Pimelodidae) after acute and chronic stress caused by usual aquacultural management, with emphasis on immunosuppressive effects[J]. Aquaculture, 2004, 237(1/2/3/4): 229–236. |
| [38] |
廖英杰, 刘波, 任鸣春, 等. 赖氨酸对团头鲂幼鱼生长、血清生化及游离必需氨基酸的影响[J].
水产学报, 2013, 37(11): 1716–1724.
Liao Y J, Liu B, Ren M C, et al. Effects of lysine on growth, physiological and biochemical indexes of blood and essential amino acids of serum in juvenile blunt snout bream (Megalobrama amblycephala)[J]. Journal of Fisheries of China, 2013, 37(11): 1716–1724. (in Chinese) |
| [39] |
王赛, 陈刚, 张健东, 等. 不同蛋白质源部分替代鱼粉对褐点石斑鱼幼鱼生长性能、体组成以及血清生化指标的影响[J].
动物营养学报, 2012, 24(1): 160–167.
Wang S, Chen G, Zhang J D, et al. Influence of partial replacement of fish meal by different protein sources on growth performance, body composition and serum biochemical indices of juvenile Epinephelus fuscoguttatus[J]. Chinese Journal of Animal Nutrition, 2012, 24(1): 160–167. (in Chinese) |
| [40] |
邓君明. 动植物蛋白源对牙鲆摄食、生长和蛋白质及脂肪代谢的影响[D]. 青岛: 中国海洋大学, 2006.
Deng J M. Effects of animal and plant protein sources on feed intake, growth and protein and lipid metabolism of Japanese flounder, Paralichthys olivaceus[D]. Qingdao:Ocean University of China, 2006(in Chinese with English abstract). |




