文章信息
- 刘宽辉, 田卫军, 高珍珍, 候冉冉, 岳婵娟, 王德云, 刘家国, 武毅, 胡元亮
- LIU Kuanhui, TIAN Weijun, GAO Zhenzhen, HOU Ranran, YUE Chanjuan, WANG Deyun, LIU Jiaguo, WU Yi, HU Yuanliang
- 多糖-硒化多糖复方增强鸡免疫功能的比较研究
- Comparative studies on polysaccharide-selenizing polysaccharide compounds in enhancing immune function of chicken
- 南京农业大学学报, 2017, 40(3): 521-528
- Journal of Nanjing Agricultural University, 2017, 40(3): 521-528.
- http://dx.doi.org/10.7685/jnau.201609043
-
文章历史
- 收稿日期: 2016-09-28
中药具有悠久的历史, 为我国畜牧业的健康发展作出了巨大贡献。与西药相比, 中药具有有效成分多、药效作用复杂等特点。近年来, 随着新技术的运用, 对中药有效成分的研究取得突破性的进展, 中药多糖作为中药有效成分之一, 成为研究的热点。研究发现, 多糖具有增强免疫、抗衰老、抗病毒、抑菌、降血糖等生物学功效[1], 可以开发为一类新型天然药物运用于畜牧兽医领域。
当归、党参和大蒜均为传统中药, 均具有增强免疫作用。当归为伞形科植物当归[Angelica sinensis(Oliv.)Diels]的干燥根, 具有补血、活血、活血止痛、润肠通便功效, 含有多糖、芳香族化合物、苯酞类、萜类等成分[2]。当归多糖(Chinese angelica polysaccharide, CAP)为主要药效成分之一, 具有增强免疫、抗氧化、抗肿瘤等生物学活性[3]。党参为桔科植物党参[Codonopsis pilosula(Franch.)Nannf.]的干燥根, 具有补中益气、健脾益肺功效, 其主要成分为多糖、苷类、甾体类等成分[4]。党参多糖(Codonopsis pilosula polysaccharide, CPP)为主要活性成分之一, 具有增强免疫、抗缺氧、补血等生物活性[5]。大蒜为百合科属植物大蒜(Allium stativum L.)的鳞茎, 具有理气开胃、解毒、止痢、杀虫功效, 含有多糖、氨基酸类、脂质类、甾体甙类等成分[6]。大蒜多糖(garlic polysaccharide, GP)为主要活性成分之一, 具有增强免疫、抗氧化等生物学活性作用[7]。硒作为生命体必需的微量元素, 具有增强免疫、抗氧化等生物学功效。因此, 将硒与多糖有机结合成为有机硒化合物——硒化多糖, 使硒和多糖的药理功能得以优化[8-9], 同时也解决了硒多糖缺乏的难题。
本试验在前期筛选出增强免疫活性较强的CAP、CPP、GP及其硒化多糖sCAP、sCPP、sGP[8-10]的基础上, 以其为组分药, 按照一定的比例组成不同复方, 比较它们的免疫增强活性, 旨在筛选出活性最强的复方, 为研制新型免疫增强剂提供试验依据。
1 材料与方法 1.1 中药和试剂当归饮片和党参饮片, 购于徐州彭祖中药饮片有限公司。大蒜, 购于南京市某农贸市场。
D(+)-葡萄糖, 分析纯, 上海源叶生物科技有限公司; 苯酚, 国药集团化学试剂有限公司; 亚硝酸钠, 山东西亚化学工业有限公司; 无水乙醇、丙酮、正丁醇等试验均为国产分析纯; 小牛血清, 杭州四季青公司; 淋巴细胞分离液, 天津市灏洋生物制品科技有限公司产品。RPMI-1640培养液, Gibco公司, 用三蒸水溶解, 0.22 μm微孔滤膜过滤除菌, 4 ℃保存; MTT, 上海瑞永生物科技有限公司产品, 用PBS溶液配成5 mg · mL-1溶液, 过滤除菌, 4 ℃保存。植物血凝素(PHA), 上海源叶生物科技有限公司产品, 用RPML-1640培养液配成100 μg · mL-1(用于体外试验)和50 μg · mL-1(用于体内试验)的溶液, 过滤除菌, -20 ℃保存; 肝素, Solarbio公司, 用PBS溶液(pH7.0) 配成2 mg · mL-1溶液, 过滤除菌, -20 ℃保存。
鸡新城疫低毒力活疫苗(La Sota株), 购于南京天邦生物科技有限公司; 新城疫检测抗原, 由江苏省农业科学院兽医研究所提供。鸡血清IL-2、IL-6、IFN-γ检测试剂盒, 购于苏州卡尔文生物技术有限公司。
1.2 多糖-硒化多糖复方的制备 1.2.1 CAP、CPP和GP的提取和纯化根据前期研究[8-10], 取当归饮片粉碎, 加95%乙醇80 ℃水浴回流脱脂, 水煎醇沉法提取粗多糖, 过Sephadex G-200柱, 得到当归多糖(CAP)。取党参饮片粉碎干燥, 加95%乙醇80 ℃水浴回流脱脂, 水煎醇沉法提取粗多糖, 过DEAE-纤维素柱, 得到党参多糖(CPP)。取大蒜去皮, 切片, 加95%乙醇80 ℃水浴回流脱脂, 水煎醇沉法提取粗多糖, 过DEAE-纤维素柱, 得到大蒜多糖(GP)。用硫酸-苯酚法测得CAP、CPP和GP的多糖含量分别为90.7%、98.19%和94.5%。
1.2.2 CAP、CPP和GP的硒化修饰用硝酸-亚硒酸钠法[8-10]。根据前期活性比较筛选的优化条件, 分别取CAP、CPP和GP按照多糖-亚硒酸钠质量比5:2、5:3、5:4的比例70 ℃分别反应8、8和6 h, 制得硒化当归多糖(sCAP)、硒化党参多糖(sCPP)和硒化大蒜多糖(sGP)。经红外光谱鉴定硒化修饰成功, 用硫酸-苯酚法测得sCAP、sCPP和sGP的多糖含量分别为50.9%、56.2%和52.6%, 用氢化物发生-原子荧光光谱法[11]测得硒含量分别为12.98、11.86和11.36 mg.g-1。
1.2.3 多糖-硒化多糖复方的制备将3种多糖与3种硒化多糖按照多糖含量9:1的比例组成6个复方, 即CAP-sCPP、CAP-sGP、CPP-sCAP、CPP-sGP、GP-sCAP和GP-sCPP。将各复方用RPMI-1640细胞培养液溶解稀释成19.538 μg · mL-1, 过滤除菌, 4 ℃保存, 用于体外试验; 分别用生理盐水溶解稀释成10和5 mg · mL-1 2个浓度, 过滤除菌, 4 ℃保存, 用于体内试验。
1.3 体外刺激试验根据3个多糖及其硒化多糖的安全浓度测定结果, 将各多糖-硒化多糖复方安全浓度统一设为19.538 μg · mL-1。取各复方用RPMI-1640培养液自19.538 μg · mL-1倍比稀释至1.221 μg · mL-1共5个浓度。取成年鸡心脏无菌采血, 肝素抗凝, 再加入等体积Hank′s液稀释, 加到淋巴细胞分离液上层, 2 000 r · min-1离心15 min; 吸取中间云雾状细胞层, 用Hank′s液洗涤2次, 活细胞计数大于90%后, 用含10%小牛血清的RPMI-1640培养液制成细胞浓度为2.5×106 mL-1细胞悬液, 加入到96孔细胞板, 每孔80 μL; 每孔再加入细胞培养液(单独刺激试验)或PHA(浓度为100 μg · mL-1, 与PHA共同刺激试验)20 μL、各浓度复方100 μL, 每浓度重复4孔; 另设4孔细胞对照组(CC, 加细胞培养液120 μL)和PHA对照组(PHA, 加细胞培养液100 μL和PHA 20 μL)。将96孔细胞培养板置于37.5 ℃、5% CO2条件下培养44 h后, 每孔加入MTT 30 μL, 继续培养4 h, 每孔加裂解液DMSO 100 μL, 立即将培养板置于微量振荡器上振荡5 min使沉淀完全溶解, 用酶联免疫检测仪(Thermo Fisher公司产品)检测吸光值(A570), 作为T淋巴细胞增殖的指标; 计算2种刺激方式5个浓度的平均淋巴细胞增殖率。增殖率=(A多糖-A对照组)/A对照组×100%(先分别计算2种刺激方式的平均淋巴细胞增殖率后再合并计算总平均淋巴细胞增殖率)。
1.4 体内刺激试验选择体外增强免疫活性作用最强的3种多糖-硒化多糖复方进行体内试验, 3种多糖-硒化多糖复方分别为CAP-sCPP、GP-sCPP和CPP-sCAP。
1.4.1 试验动物及分组处理1日龄非免疫健康罗曼蛋公鸡, 饲养至14日龄时, 测母源抗体效价为2.8(log2), 选择240羽随机均分为8组, 每组30羽。除空白对照组(BC)外均用鸡新城疫Ⅳ系疫苗免疫, 28日龄二免。在每次免疫的同时, 3个复方的高剂量组(浓度为10 mg · mL-1, CAP-sCPPH、GP-sCPPH和CPP-sCAPH)、低剂量组(浓度为5 mg · mL-1, CAP-sCPPL、GP-sCPPL和CPP-sCAPL)每羽分别肌肉注射相应多糖溶液0.5 mL, 免疫对照组(VC)和BC组注射等量生理盐水。每天1次, 连续3 d。
1.4.2 淋巴细胞增殖的测定分别于首免后7、14、21和28 d(简写为D7、D14、D21和D28), 每组随机取4羽, 心脏采血, 按1.3节制备细胞悬液, 加入到96孔细胞培养板, 每孔80 μL, 再加PHA(50 μg · mL-1)20 μL, 每个样品重复4孔, 按1.3节测定A570值, 作为T淋巴细胞增殖的指标。计算4个时间点的平均淋巴细胞增殖率:增殖率=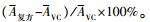
分别于以上时间点, 每组随机抽取6羽, 翼静脉采血, 分离血清, 用β-微量法测定血凝抑制(HI)效价。
1.4.4 血清免疫因子的测定分别于以上时间点, 每组随机抽取6羽, 翼静脉采血, 分离血清, 用ELISA试剂盒测定血清IL-2、IL-6、IFN-γ的含量。
1.5 数据分析数据以x±SE表示, 用SPSS 20.0软件的单因素方差法及多重比较法分析与比较各组差异的显著性。
2 结果与分析 2.1 体外试验比较 2.1.1 单独刺激时各组淋巴细胞增殖的变化CAP-sCPP、CPP-sCAP和GP-sCPP的所有浓度组, CAP-sGP在19.538~4.885 μg · mL-1组, CPP-sGP在9.769~4.885 μg · mL-1及1.221 μg · mL-1组, GP-sCAP在9.769 μg · mL-1组的A570值均显著高于CC组(P < 0.05)(表 1)。表明这些复方在相应浓度下均能显著促进淋巴细胞增殖。
| 药物浓度/(μg·mL-1) Concentration |
CAP-sCPP | CAP-sGP | CPP-sCAP | CPP-sGP | GP-sCAP | GP-sCPP |
| 19.538 | 0.334±0.001c | 0.318±0.001a | 0.282±0.003b | 0.292±0.003bc | 0.301±0.005ab | 0.371±0.007a |
| 9.769 | 0.366±0.002b | 0.306±0.006ab | 0.310±0.007a | 0.318±0.007ab | 0.309±0.000a | 0.355±0.001ab |
| 4.885 | 0.425±0.005a | 0.311±0.013a | 0.305±0.005a | 0.326±0.005a | 0.303±0.004ab | 0.344±0.003b |
| 2.442 | 0.379±0.010b | 0.286±0.006bc | 0.292±0.007ab | 0.274±0.012c | 0.287±0.008b | 0.374±0.012a |
| 1.221 | 0.337±0.008c | 0.286±0.006bc | 0.276±0.008b | 0.306±0.009ab | 0.290±0.006ab | 0.356±0.013ab |
| 0(CC) | 0.311±0.009d | 0.268±0.008c | 0.254±0.002c | 0.268±0.008c | 0.286±0.008b | 0.311±0.009c |
| 注: 1) CAP:当归多糖Chinese angelica polysaccharide; CPP:党参多糖Codonopsis pilosula polysaccharide; GP:大蒜多糖Garlic polysaccharide; -s:硒化Selenizing; 2) CC:细胞对照Cell control; 3) 同列数据肩标不同字母者表示差异显著(P < 0.05)。Column data marked without the same superscripts differ significantly(P < 0.05). The same as follows. | ||||||
CAP-sCPP和GP-sCPP在19.538~2.442 μg · mL-1组, CAP-sGP在4.885~2.442 μg · mL-1组, CPP-sCAP在所有浓度组, CPP-sGP在9.769~4.885及1.221 μg · mL-1组, GP-sCAP在9.769~1.221 μg · mL-1组的A570值均显著高于PHA对照组(P < 0.05)(表 2)。表明这些复方在相应浓度下均能协同PHA显著促进淋巴细胞增殖。
| 药物浓度/(μg·mL-1) Concentration |
CAP-sCPP | CAP-sGP | CPP-sCAP | CPP-sGP | GP-sCAP | GP-sCPP |
| 19.538 | 0.408±0.011c | 0.346±0.007ab | 0.361±0.005bc | 0.346±0.006ab | 0.338±0.003ab | 0.436±0.010a |
| 9.769 | 0.430±0.007b | 0.351±0.004ab | 0.344±0.002d | 0.360±0.008a | 0.361±0.010a | 0.428±0.011ab |
| 4.885 | 0.476±0.015a | 0.380±0.023a | 0.375±0.002ab | 0.360±0.001a | 0.359±0.010a | 0.409±0.018bc |
| 2.442 | 0.402±0.019bc | 0.380±0.010a | 0.389±0.004a | 0.347±0.003ab | 0.364±0.011a | 0.392±0.012cd |
| 1.221 | 0.384±0.013cd | 0.342±0.004b | 0.356±0.001cd | 0.358±0.002a | 0.361±0.017a | 0.378±0.007de |
| 0(PHA) | 0.354±0.007d | 0.324±0.005b | 0.320±0.010e | 0.324±0.005b | 0.309±0.003b | 0.354±0.007e |
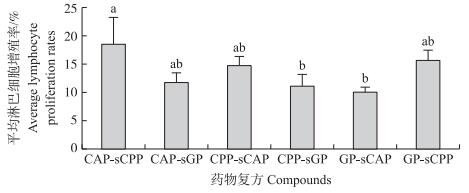
各组2种刺激方式的平均淋巴细胞增殖率由高到低依次为CAP-sCPP组(18.53%)、GP-sCPP组(15.58%)、CPP-sCAP组(14.63%)、CAP-sGP组(11.69%)、CPP-sGP组(11.05%)、GP-sCAP组(10.02%), 且CAP-sCPP组总平均淋巴细胞增殖率显著高于CPP-sGP组和GP-sCAP组(P < 0.05)(图 1)。
|
图 1 各组2种刺激方式下的平均淋巴细胞增殖率 Figure 1 Average lymphocyte proliferation rates of two stimulation modes in every group 柱上标注小写字母不同者表示差异显著(P < 0.05)。Bars marked without the same superscripts differ significantly(P < 0.05). The same as follows. |
CAP-sCPPH组在D14和D28 2个时间点的A570值均显著高于VC组和BC组(P < 0.05);GP-sCPPH组在D7~D28 4个时间点的A570值均显著高于VC组和BC组(P < 0.05);CPP-sCAPH组在D21和D28 2个时间点的A570值均显著高于VC组和BC组(P < 0.05);GP-sCPPL组在D14和D28 2个时间点的A570值均显著高于VC组和BC组(P < 0.05)(表 3)。表明CAP-sCPPH在D14和D28 2个时间点、GP-sCPPH在D7~D28 4个时间点、CPP-sCAPH在D21和D28 2个时间点和GP-sCPPL在D14和D28 2个时间点均能显著促进淋巴细胞增殖。
| 组别Groups | D7 | D14 | D21 | D28 |
| CAP-sCPPH | 0.215±0.008ab | 0.252±0.006bc | 0.236±0.011abcd | 0.252±0.019ab |
| GP-sCPPH | 0.220±0.008a | 0.290±0.006a | 0.252±0.016ab | 0.287±0.013a |
| CPP-sCAPH | 0.203±0.006b | 0.239±0.012cd | 0.249±0.020abc | 0.255±0.012a |
| CAP-sCPPL | 0.206±0.002ab | 0.216±0.010d | 0.214±0.018bcd | 0.214±0.007cd |
| GP-sCPPL | 0.211±0.004ab | 0.249±0.006c | 0.220±0.018abcd | 0.253±0.007ab |
| CPP-SCAPL | 0.202±0.004b | 0.218±0.002d | 0.210±0.012cd | 0.216±0.008bcd |
| VC | 0.200±0.004b | 0.209±0.010d | 0.204±0.008d | 0.208±0.015d |
| BC | 0.180±0.008c | 0.174±0.006e | 0.162±0.001e | 0.170±0.014e |
| 注: 1) VC:免疫对照组Vaccination control group; BC:空白对照组Blank control group. 2) H:高浓度组, 10 mg · mL-1 High concentration group, 10 mg · mL-1; L:低浓度组, 5 mg · mL-1 Low concentration group, 5 mg · mL-1. 3) D7、D14、D21、D28表示首免后7、14、21、28 d。D7, D14, D21, D28 respectively represent the time points of 7, 14, 21 and 28 d after first vaccination. The same as follows. | ||||
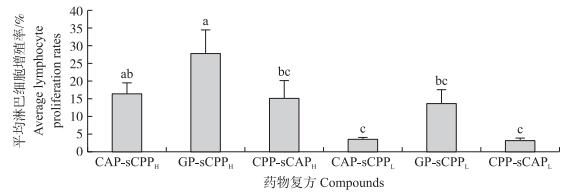
各组4个时间点的平均淋巴细胞增殖率由高到低依次为GP-sCPPH组(27.78%)、CAP-sCPPH组(16.32%)、CPP-sCAPH组(15.23%)、GP-sCPPL组(13.64%)、CAP-sCPPL组(3.53%)、CPP-sCAPL组(3.05%), 且CAP-sCPPH组平均淋巴细胞增殖率显著高于CAP-sCPPL组和CPP-sCAPL组(P < 0.05);GP-sCPPH组平均淋巴细胞增殖率显著高于CPP-sCAPH组、GP-sCPPL组、CAP-sCPPL组和CPP-sCAPL组(P < 0.05)(图 2)。
|
图 2 各组4个时间点的平均淋巴细胞增殖率 Figure 2 Average lymphocyte proliferation rates at four time points in every group |
CAP-sCPPH、CAP-sCPPL和GP-sCPPL组在D7、D14和D28 3个时间点的抗体效价均显著高于VC组和BC组(P < 0.05);GP-sCPPH组在D7~D28 4个时间点的抗体效价均显著高于VC组和BC组(P < 0.05);CPP-sCAPH组在D14和D28 2个时间点的抗体效价均显著高于VC组和BC组(P < 0.05);CPP-sCAPL组在D28的抗体效价显著高于VC组和BC组(P < 0.05)(表 4);表明CAP-sCPPH、CAP-sCPPL和GP-sCPPL在D7、D14和D28 3个时间点, GP-sCPPH在D7~D28 4个时间点, CPP-sCAPH在D14和D28 2个时间点和CPP-sCAPL在D28均能显著促进抗体的分泌。
| 组别Groups | D7 | D14 | D21 | D28 |
| CAP-sCPPH | 6.250±0.250abc | 7.250±0.250ab | 6.250±0.250abc | 6.500±0.500a |
| GP-sCPPH | 6.750±0.250a | 8.000±0.408a | 7.250±0.479a | 6.750±0.479a |
| CPP-sCAPH | 5.000±0.408def | 6.500±0.500bc | 6.000±0.408abc | 6.500±0.289a |
| CAP-sCPPL | 5.500±0.289cde | 6.750±0.479bc | 6.000±0.408abc | 6.250±0.250a |
| GP-sCPPL | 5.750±0.250bcd | 6.500±0.289bc | 6.250±0.750abc | 6.000±0.707a |
| CPP-sCAPL | 4.750±0.479ef | 6.000±0.408cd | 5.500±0.289bc | 6.000±0.707a |
| VC | 4.250±0.250f | 5.000±0.408d | 4.500±0.289c | 4.250±0.479b |
| BC | 2.750±0.479g | 3.250±0.250e | 2.500±0.289d | 2.250±0.250c |
CAP-sCPPH和GP-sCPPH组在D7~D28 4个时间点的IL-2含量均显著高于VC组和BC组(P < 0.05);CPP-sCAPH、CAP-sCPPL和GP-sCPPL组在D14~D28 3个时间点的IL-2含量均显著高于VC组和BC组(P < 0.05);CPP-sCAPL组在D21和D28 2个时间点的IL-2含量均显著高于VC组和BC组(P < 0.05)(表 5);表明CAP-sCPPH和GP-sCPPH在D7~D28 4个时间点、CPP-sCAPH、CAP-sCPPL和GP-sCPPL在D14~D28 3个时间点和CPP-sCAPL在D21和D28 2个时间点均能显著促进IL-2的分泌。
| pg · mL-1 | ||||
| 组别Groups | D7 | D14 | D21 | D28 |
| CAP-sCPPH | 192.541±7.400ab | 266.050±15.785ab | 277.932±11.148ab | 248.920±16.148ab |
| GP-sCPPH | 202.521±0.894a | 303.704±9.143a | 313.529±10.244a | 267.978±6.589a |
| CPP-sCAPH | 174.846±4.089bc | 245.911±17.091b | 280.093±12.331ab | 226.312±8.550b |
| CAP-sCPPL | 162.809±9.822c | 237.654±20.852b | 246.965±13.194b | 225.386±6.393b |
| GP-sCPPL | 172.480±9.893c | 251.235±30.222ab | 256.944±29.045b | 239.275±10.321b |
| CPP-sCAPL | 166.924±4.441c | 232.253±17.105bc | 250.154±5.479b | 239.738±9.034b |
| VC | 161.883±8.916c | 180.941±3.567c | 195.010±7.134c | 176.235±4.440c |
| BC | 120.010±3.151d | 124.614±8.920d | 153.858±1.098d | 131.327±5.642d |
CAP-sCPPH组在D7和D14 2个时间点的IL-6含量均显著高于VC组和BC组(P < 0.05);GP-sCPPH组在D7~D28 4个时间点的IL-6含量均显著高于VC组和BC组(P < 0.05);CPP-sCAPH组在D21的IL-6含量显著高于VC组和BC组; GP-sCPPL组在D14的IL-6含量显著高于VC和BC组(P < 0.05)(表 6)。表明CAP-sCPPH在D7和D14 2个时间点, GP-sCPPH在D7~D28 4个时间点, CPP-sCAPH在D21和GP-sCPPL在D14均能显著促进IL-6的分泌。
| pg · mL-1 | ||||
| 组别Groups | D7 | D14 | D21 | D28 |
| CAP-sCPPH | 33.127±0.705ab | 34.517±1.932ab | 25.035±2.313bc | 27.011±1.917bc |
| GP-sCPPH | 34.254±0.594a | 38.183±3.530a | 30.961±0.457a | 33.584±1.663a |
| CPP-sCAPH | 28.445±0.589cd | 33.826±2.214abc | 27.669±0.514ab | 24.937±1.222bc |
| CAP-sCPPL | 28.503±2.250cd | 31.203±2.302bc | 21.318±3.390c | 23.148±1.638bc |
| GP-sCPPL | 30.200±1.520bcd | 33.837±1.044ab | 22.401±0.563c | 25.584±1.856bc |
| CPP-sCAPL | 28.503±2.250cd | 31.203±2.302bc | 21.318±3.390c | 23.148±1.638bc |
| VC | 27.186±0.948d | 26.934±0.657c | 21.728±2.043c | 22.676±2.267c |
| BC | 16.168±0.358e | 16.475±0.648d | 16.398±0.388d | 17.089±1.879d |
CAP-sCPPH组在D7和D21 2个时间点的IFN-γ含量显著高于VC组和BC组(P < 0.05);GP-sCPPH组在D7~D28 4个时间点的IFN-γ含量均显著高于VC组和BC组(P < 0.05);CPP-sCAPH和GP-sCPPL组在D7~D21 3个时间点的IFN-γ含量均显著高于VC组和BC组(P < 0.05);CPP-sCAPL组在D21的IFN-γ含量显著高于VC组和BC组(P < 0.05)(表 7)。表明CAP-sCPPH在D7和D21 2个时间点, GP-sCPPH在D7~D28 4个时间点, CPP-sCAPH和GP-sCPPL在D7~D21在3个时间点, CPP-sCAPL在D21均能显著促进IFN-γ的分泌。
| pg · mL-1 | ||||
| 组别Groups | D7 | D14 | D21 | D28 |
| CAP-sCPPH | 48.261±1.343b | 61.223±8.017abc | 66.941±2.827abc | 53.475±4.064b |
| GP-sCPPH | 55.191±0.142a | 73.995±5.718a | 71.396±1.401a | 70.654±3.187a |
| CPP-sCAPH | 45.126±3.104bc | 66.792±4.044ab | 65.192±1.797abc | 51.891±1.366b |
| CAP-sCPPL | 39.911±1.069cd | 54.466±6.040bc | 60.538±0.684cd | 47.362±2.529b |
| GP-sCPPL | 49.812±1.901b | 65.010±3.701ab | 65.587±4.476abc | 59.243±4.539b |
| CPP-sCAPL | 39.944±2.439cd | 60.777±4.843abc | 64.069±3.646bc | 46.990±2.478b |
| VC | 37.304±1.727d | 49.985±1.324c | 56.479±1.062d | 47.188±4.222b |
| BC | 29.614±0.650e | 30.777±0.935d | 34.861±0.951e | 33.352±1.782c |
本研究首先用MTT法[12]比较了6个复方的体外增强免疫活性。MTT法具有检测速度快、便捷准确和灵敏度高等优点, 被广泛应用于禽类淋巴细胞功能的检测[13], 淋巴细胞A570值与淋巴细胞增殖呈正相关。本试验结果显示:单独刺激时, 6个复方分别有1~5个浓度组的A570值均显著大于细胞对照组, 表明它们在这些浓度能单独显著促进淋巴细胞增殖; 与PHA共同刺激时, 6个复方分别有2~5个浓度组的A570值均显著大于PHA对照组, 表明它们在这些浓度能协同PHA显著促进淋巴细胞增殖。Guo等[14]研究发现, 黄芪多糖-硫酸化淫羊藿多糖复方在体外能显著促进鸡外周血淋巴细胞增殖。
淋巴细胞增殖率直接反映细胞免疫的强度, 增殖率越高, 说明药物的免疫增强活性越强。试验结果显示, 两种刺激方式的平均淋巴细胞增殖率CAP-sCPP组为最高, 其次为GP-sCPP和CPP-sCAP。结果表明, CAP-sCPP的体外增强免疫活性最强, 其次为GP-sCPP和CPP-sCAP。
为了验证多糖-硒化多糖的免疫增强活性, 并筛选出活性最强的复方, 选择体外增强免疫活性排在前3位的3个复方进一步比较它们的体内增强免疫活性。T淋巴细胞增殖测定结果显示:GP-sCPPH组在4个时间点的细胞A570值均为最高, 均显著高于VC组和BC组; 4个时间点的平均淋巴细胞增殖率也为最高, 显著高于除CAP-sCPPH外的其余4组, 表明GP-sCPP高剂量促进T淋巴细胞增殖的作用最强。而T淋巴细胞主要介导细胞免疫[15], 表明GP-sCPP高剂量增强细胞免疫的作用最强。
体液免疫是由B淋巴细胞介导的抗原抗体特异性反应[16]。B淋巴细胞受到抗原刺激后增殖分化成大量的浆细胞, 浆细胞能合成和分泌与抗原发生特异性结合的抗体, 血清特异性抗体效价的高低直接反映机体的体液免疫应答状态[17]。本试验结果显示, GP-sCPPH组在4个时间点的血清抗体效价均为最高, 均显著高于VC组和BC组, 表明GP-sCPP高剂量促进体液免疫的作用强。
研究表明, 多糖可以通过诱生多种细胞因子(如干扰素、白细胞介素等)发挥免疫调节作用[18]。IL-2和IFN-γ由辅助性T细胞分泌, 反过来又能促进T细胞增殖和分化[19-20];IL-6由多种细胞产生, 在调节免疫应答、机体抗感染等方面发挥重要作用[21-22], 因此血清IL-2、IFN-γ和IL-6的含量可作为机体免疫功能的指标。本试验结果显示:GP-sCPPH组在4个时间点的血清IL-2、IL-6和IFN-γ含量均为最高, 均显著高于VC组和BC组, 表明GP-sCPP高剂量促进细胞因子分泌的作用最强。
本方是由大蒜多糖和硒化党参多糖组成的复方。大蒜既是食用蔬菜又可用作中药, 具有理气开胃、解毒、止痢等功能[23]。大蒜多糖是其主要活性成分之一, 具有增强免疫、抗氧化等生物学活性[7]。党参是常用的补气药, 具有补中益气、健脾益肺功效[23], 党参多糖为党参的主要活性成分, 具有增强免疫、抗氧化、保肝、抗肿瘤等生物活性[5], 尤其是硒化修饰后其增强免疫活性显著增强[10]。有研究证实, 硒化多糖除具有增强免疫作用外, 还具有抗肿瘤、抗氧化、保肝等生物学功效[24-26]。因此由sCPP和GP组成的复方显示很强的增强免疫功效, 可以考虑作为新型免疫增强剂的候选方。后续开发将进一步与其他免疫增强剂进行对比, 评价本方的优势并研究其作用机制。
| [1] |
王彦军. 中药多糖研究进展[J].
医学理论与实践, 2009, 22(3): 279–281.
Wang Y J. Research progress of polysaccharides of traditional Chinese medicine[J]. Journal Medical Theory and Practice, 2009, 22(3): 279–281. (in Chinese) |
| [2] |
李曦, 张丽宏, 王晓晓, 等. 当归化学成分及药理作用研究进展[J].
中药材, 2013, 36(6): 1023–1028.
Li X, Zhang L H, Wang X X, et al. Research progress on chemical constituents and pharmacological effect of Angelica sinensis[J]. Journal of Chinese Medicinal Materials, 2013, 36(6): 1023–1028. (in Chinese) |
| [3] |
温悦, 傅正毅, 赖艳, 等. 当归多糖的药理作用研究进展[J].
中国医药导报, 2012, 9(30): 27–29.
Wen Y, Fu Z Y, Lai Y, et al. Research progress of pharmacological action of angelica polysaccharides[J]. China Medical Herrald, 2012, 9(30): 27–29. DOI: 10.3969/j.issn.1673-7210.2012.30.010 (in Chinese) |
| [4] |
孙政华, 邵晶, 郭玫. 党参化学成分及药理作用研究进展[J].
安徽农业科学, 2015, 43(33): 174–176.
Sun Z H, Shao J, Guo M. Research progress of Codonopsis pilosula chemical component and pharmacological effects[J]. Journal of Anhui Agricultural Science, 2015, 43(33): 174–176. DOI: 10.3969/j.issn.0517-6611.2015.33.057 (in Chinese) |
| [5] |
陈克克, 王喆之. 党参多糖的研究进展[J].
现代生物医学进展, 2007, 7(4): 635–637.
Chen K K, Wang Z Z. Progerss in polysaeeharides from radix codonopsis[J]. Progress in Modern Biomeidicine, 2007, 7(4): 635–637. (in Chinese) |
| [6] |
贾江滨, 刘静, 谭亚非. 大蒜化学成分研究进展[J].
广东药学, 1999, 9(1): 1–5.
Jia J B, Liu J, Tan Y F. Research progress of chemical constituents of garlic[J]. Guangdong Pharmacy, 1999, 9(1): 1–5. (in Chinese) |
| [7] | Gao Z Z, Chen J, Qiu S L, et al. Optimization of selenylation modification for garlic polysaccharide based on immune-enhancing activity[J]. Carbohydrate Polymers, 2016, 136(7): 560–569. |
| [8] | Qin T, Chen J, Wang D Y, et al. Optimization of selenylation conditions for Chinese angelica polysaccharide based on immune-enhancing activity[J]. Carbohydrate Polymers, 2013, 92(1): 645–650. DOI: 10.1016/j.carbpol.2012.08.097 |
| [9] | Qiu S L, Chen J, Qin T, et al. Effects of selenylation modification on immune-enhancing activity of garlic polysaccharide[J]. PLoS ONE, 2014, 9(1): e86377. DOI: 10.1371/journal.pone.0086377 |
| [10] |
秦韬. 硒化当归多糖和硒化党参多糖的增强免疫和抗氧化的活性研究[D]. 南京: 南京农业大学, 2013.
Qin T. Immune-enhancing and antioxidant activities of selenizing Chinese angelica polysaccharide and selenizing Codonopsis pilosula polysaccharide[D]. Nanjing:Nanjing Agricultural University, 2013(in Chinese with English abstract). |
| [11] |
高建忠, 秦顺义, 黄克和. 氢化物发生-原子荧光光谱法测定富硒酵母中的有机硒和无机硒[J].
分析科学学报, 2006, 22(2): 157–160.
Gao J Z, Qin S Y, Huang K H. Assay of organic selenium and inorganic selenium of enriched yeast by hydride generation atomic fluorescence spectrometry method[J]. Journal of Analytical Science, 2006, 22(2): 157–160. (in Chinese) |
| [12] |
刘丽, 季辉, 彭麟, 等. 鸡肝原代细胞药物代谢模型的建立与优化[J].
南京农业大学学报, 2015, 38(1): 127–133.
Liu L, Ji H, Peng L, et al. The establishment and optimization of the drug metabolic model of adult chicken primary hepatocytes[J]. Journal of Nanjing Agricultural University, 2015, 38(1): 127–133. DOI: 10.7685/j.issn.1000-2030.2015.01.019 (in Chinese) |
| [13] |
林锋强, 胡奇林, 陈少莺, 等. MTT法检测番鸭外周血淋巴细胞转化功能的研究[J].
动物医学进展, 2005, 26(1): 75–77.
Lin F Q, Hu Q L, Chen S Y, et al. Studies on MTT colorimetric assay for transformation of muscovy duck peripheral blood lymphocytes[J]. Progress in Veterinary Medicine, 2005, 26(1): 75–77. (in Chinese) |
| [14] | Guo L W, Liu J G, Hu Y L, et al. Astragalus polysaccharide and sulfated epimedium polysaccharide synergistically resist the immunosuppression[J]. Carbohydrate Polymers, 2012, 90(2): 1055–1060. DOI: 10.1016/j.carbpol.2012.06.042 |
| [15] | Kapczynski D R, Afonso C L, Miller P J. Immune responses of poultry to Newcastle disease virus[J]. Developmental and Comparative Immunology, 2013, 41(3): 447–453. DOI: 10.1016/j.dci.2013.04.012 |
| [16] | Irie T, Watarai S, Kodama H. Humoral immune response of carp(Cyprinus carpio)induced by oral immunization with liposome-entrapped antigen[J]. Developmental and Comparative Immunology, 2003, 27(5): 413–421. DOI: 10.1016/S0145-305X(02)00137-4 |
| [17] |
邱妍, 胡元亮, 崔保安, 等. 怀牛膝多糖对雏鸡疫苗免疫效果的影响[J].
畜牧兽医学报, 2007, 38(7): 723–727.
Qiu Y, Hu Y L, Cui B A, et al. Effects of achyranthes bidentate polysaccharide on immune efficacy of vaccine in chickens[J]. Acta Veterinari et Zoontechnica Sinica, 2007, 38(7): 723–727. (in Chinese) |
| [18] |
邹云, 谢红兵, 禹琪芳, 等. 植物多糖对断奶仔猪淋巴细胞增殖和细胞因子分泌的影响[J].
动物营养学报, 2014, 26(1): 210–218.
Zou Y, Xie H B, Yu Q F, et al. Plant polysaccharides:effects on lymphocytes proliferation and cytokines secretion of weaner piglets[J]. Chinese Journal of Animal Nutrition, 2014, 26(1): 210–218. (in Chinese) |
| [19] |
李蕴玉, 李佩国, 张艳英, 等. 白细胞介素-2(IL-2) 在兽医中的应用进展(综述)[J].
河北科技师范学院学报, 2006, 20(4): 63–66.
Li W Y, Li P G, Zhang Y Y, et al. Applying progress on interleukin-2(IL-2) in veterinary medicine(summary)[J]. Journal of Hebei Normal University of Science and Tachnology, 2006, 20(4): 63–66. (in Chinese) |
| [20] | Schroder K, Hertzog P J, Ravasi T. Interferon-gamma:an overview of signals, mechanisms and functions[J]. Journal of Leukocyte Biology, 2004, 75(2): 163–189. |
| [21] |
李悦, 张昊, 杨敏馨, 等. 淀粉液化芽孢杆菌对脂多糖刺激肉鸡生长性能、肠道形态及免疫功能的影响[J].
南京农业大学学报, 2016, 39(4): 624–631.
Li Y, Zhang H, Yang M X, et al. Effects of Bacillus amyloliquefaciens on growth performance, intestinal morphology and immune function of lipopolysaccharide-challenge broilers[J]. Journal of Nanjing Agricultural University, 2016, 39(4): 624–631. DOI: 10.7685/jnau.201504024 (in Chinese) |
| [22] | Matthes T, Manfroi B, Huard B. Revisiting IL-6 antagonism in multiple myeloma[J]. Critical Reviews in Oncology/Hematology, 2016, 105: 1–4. DOI: 10.1016/j.critrevonc.2016.07.006 |
| [23] |
中国兽药典委员会.
中华人民共和国兽药典(2015年版二部)[M]. 北京: 中国农业出版社, 2016: 34, 416.
Commission of Chinese Veterinary Pharmacopeia. Veterinary Pharmacopoeia of the People's Republic of China, 2015 Part Ⅱ[M]. Beijing: China Agriculture Press, 2016: 34, 416. (in Chinese) |
| [24] |
陈文霞, 张培, 高霞, 等. 硒化纹党参多糖和其抗A549细胞的活性[J].
中成药, 2015, 37(11): 2408–2413.
Chen W X, Zhang P, Gao X, et al. Selenylation of polysaccharides from Codonopsis pilosula and its inhibition against A549 cells[J]. Chinese Traditional Patent Medicine, 2015, 37(11): 2408–2413. (in Chinese) |
| [25] | Gao Z Z, Zhang C, Tian W J, et al. The antioxidative and hepatoprotective effects comparison of Chinese angelica polysaccharide(CAP)and selenizing CAP(sCAP)in CCl4 induced hepatic injury mice[J]. International Journal of Biological Macromolecules, 2017, 97: 46–54. DOI: 10.1016/j.ijbiomac.2017.01.013 |
| [26] | Qiu S L, Chen J, Chen X, et al. Optimization of selenylation conditions for lycium barbarum polysaccharide based on antioxidant activity[J]. Carbohydrate Polymers, 2014, 103(1): 148–153. |




