文章信息
- 李龙龙, 彭梦玲, 王典, 俞磊, 葛重阳, 马海田
- LI Longlong, PENG Mengling, WANG Dian, YU Lei, GE Chongyang, MA Haitian
- (-)-羟基柠檬酸调控鸡胚原代肝细胞脂滴沉积的机制
- Mechanisms of (-)-hydroxycitric regulated lipid droplet deposition in primary chicken hepatocytes
- 南京农业大学学报, 2017, 40(3): 514-520
- Journal of Nanjing Agricultural University, 2017, 40(3): 514-520.
- http://dx.doi.org/10.7685/jnau.201610013
-
文章历史
- 收稿日期: 2016-10-13
肥胖是诱发糖尿病、高血脂和脂肪肝等多种疾病发生与发展的重要因素[1]。据2015年世界卫生组织(WHO)报道, 世界范围内有超过14亿成年人体质量超标, 其中4亿以上人群属于肥胖。目前, 已有多种化学药物被用于预防和改善因肥胖诱发的疾病及其并发症, 但由于一些药物存在副作用而无法在临床上应用。研究发现, 从天然植物中提取的一些活性成分具有抑制机体脂肪过度沉积的效应[2], 且因其无残留和毒副作用低而备受消费者青睐, 并成为国内外相关学者关注的焦点。
(-)-羟基柠檬酸[(-)hydroxycitric, (-)-HCA]是主要存在于藤黄果果实外壳中的一种天然有机酸[3]。已有研究表明, (-)-HCA作为柠檬酸裂解酶的竞争性抑制剂[4-5], 在降低大鼠体增重[6]、抑制脂肪合成[7-8]和增加能量消耗[9]等方面均具有重要作用。目前, 关于(-)-HCA抑制机体脂肪沉积的研究主要集中在人和啮齿动物, 有关其对家禽脂代谢的影响鲜有报道。Han等[10]研究发现, 肉鸡日粮中添加(-)-HCA可减少乙酰辅酶A的供给进而抑制脂肪酸的合成, 该结果提示(-)-HCA对家禽脂肪沉积的影响可能与其调节糖代谢有关。
与哺乳动物不同, 肝脏是禽类脂肪代谢最重要的场所[11]。因此, 本试验选用100 μmol · L-1 (-)-HCA处理鸡胚原代肝细胞, 探讨(-)-HCA对鸡胚原代肝细胞脂滴沉积、糖代谢和能量代谢关键因子表达的影响, 以期进一步阐明(-)-HCA调节肉鸡脂肪沉积的机制。
1 材料与方法 1.1 试验材料(-)-HCA购于USP Reference Standard公司; 氢化可的松、溴化噻唑蓝四氮唑(MTT)、胰蛋白酶购于Gibco公司; 基础培养液M199购于Hyclone公司(美国); 4-羟乙基哌嗪乙磺酸(HEPES)、转铁蛋白、L-谷氨酰胺和青链霉素购于Sigma公司; 甘油三酯、葡萄糖和糖原含量及油红染色试剂盒购于南京建成生物工程研究所; 乳酸脱氢酶(LDH)和BCA蛋白浓度测定试剂盒购于碧云天生物科技有限公司; 酶联免疫吸附(ELISA)检测试剂盒购于上海恒远生物科技有限公司。
1.2 试验方法 1.2.1 肝细胞的分离和培养参照唐雪等[12]报道的方法并加以改进:取9胚龄鸡胚的肝脏, 在磷酸盐缓冲液(PBS)中漂洗3次后剪成1 mm3大小的组织块, 悬浮于PBS中静置1~2 min后去除上清液, 取组织沉淀加入2.5 g · L-1胰蛋白酶解液37 ℃孵育10 min, 再用含10%胎牛血清的M199培养液漂洗, 无菌吸管吹打使细胞分散, 细胞悬液依次经100、200和400目细胞网筛过滤, 然后1 100 r · min-1离心、收集细胞, 加入无血清M199培养液, 即制备成肝细胞悬液。细胞培养液中含100 IU · mL-1青霉素、100 μg · mL-1链霉素、1 μg · mL-1氢花可的松、1.75 mmol · L-1 HEPES、2 mmol · L-1 L-谷氨酰胺和5 μg · mL-1转铁蛋白。取以上新鲜分离的肝细胞, 台盼蓝拒染法染色后观察细胞即时存活率, 细胞存活率大于95%。
1.2.2 细胞活力检测将100 μL鸡胚原代肝细胞悬浮液(1×106mL-1)接种于96孔细胞培养板, 37 ℃、5% CO2条件下培养24 h, 分别用0和100 μmol · L-1的(-)-HCA处理, 于处理1、3、6、12和24 h后向每孔加入20 μL(5 mg · mL-1)的MTT, 继续培养4 h。吸出培养液, 每孔加入150 μL二甲基亚砜(DMSO), 低速振荡10 min使结晶完全溶解, 酶标仪测定光密度值(D490)。
1.2.3 细胞死亡率检测细胞处理同1.2.2节。设对照孔、最大酶活性对照孔、(-)-HCA处理孔、背景对照孔。预定检测点前1 h, 在“最大酶活性对照孔”加入LDH释放试剂, 收集培养上清液后按照试剂盒检测方法测定上清液中LDH含量。细胞死亡率=(D(-)-HCA处理孔-D对照孔)/(D最大酶活性孔-D对照孔)×100%。
1.2.4 葡萄糖消耗量检测细胞处理同1.2.2节。分别于(-)-HCA处理1、3、6、12和24 h后收集细胞培养液, 用葡萄糖检测试剂盒测定上清液中的葡萄糖含量, 计算葡萄糖消耗量。
1.2.5 甘油三酯含量检测将2 mL鸡胚原代肝细胞(1×106 mL-1)接种于6孔细胞培养板, 培养24 h后分别用0(对照)和100 μmol · L-1的(-)-HCA处理, 于处理1、3、6、12和24 h后收集细胞, 超声破碎后, 用甘油三酯检测试剂盒检测方法测定甘油三酯含量。
1.2.6 油红染色细胞处理同1.2.5节。收集细胞, 按照油红染色试剂盒方法染色, 然后用显微镜拍照, 并随机选取10张图片利用Image-pro Plus 6.0软件分析脂滴的数目和脂滴总面积。
1.2.7 糖原含量及其相关酶活性检测细胞处理同1.2.5节。(-)-HCA处理24 h后收集细胞:一部分细胞按照糖原检测试剂盒测定糖原含量; 另一部分细胞经超声破碎后采用ELISA法检测糖原磷酸化酶和糖原合成酶活性。
1.2.8 柠檬酸裂解酶活性和乙酰辅酶A含量检测细胞处理同1.2.5节。(-)-HCA处理24 h后收集细胞:一部分细胞经超声破碎后采用ELISA法测定细胞裂解液中柠檬酸裂解酶活性; 另一部分细胞采用试剂盒分离线粒体收集细胞破碎液和细胞质, 采用ELISA法检测细胞中的总乙酰辅酶A含量和细胞质中乙酰辅酶A含量。
1.2.9 糖代谢和呼吸链关键酶活性检测细胞处理同1.2.5节。(-)-HCA处理24 h后收集细胞, 超声破碎, 采用ELISA法检测细胞裂解液中葡萄糖激酶、磷酸果糖激酶1、丙酮酸激酶、丙酮酸脱氢酶E1、柠檬酸合酶、乌头酸酶、琥珀酸脱氢酶、苹果酸脱氢酶、NADH脱氢酶和ATP合酶的活性。
1.3 数据统计与分析数据以x±SE表示, 用Graphpad prism 5.0和SPSS 16.0软件对试验数据进行One-way ANOVA方差分析。
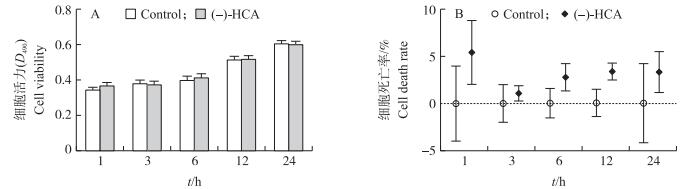
2 结果与分析 2.1 (-)-HCA对鸡胚原代肝细胞活力和细胞死亡率的影响由图 1可知:与对照组相比, (-)-HCA处理对鸡胚原代肝细胞活力和细胞死亡率均无显著影响(P > 0.05)。提示, (-)-HCA处理对鸡胚原代肝细胞无毒副作用。
|
图 1 (-)-HCA对鸡胚原代肝细胞活力和细胞死亡率的影响 Figure 1 Effect of (-)-HCA on cell viability and cell death rate in primary chicken hepatocytes |
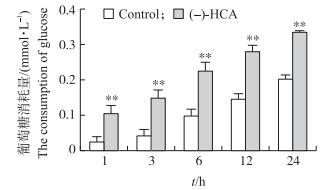
由图 2可知:与对照组相比, (-)-HCA处理极显著提高鸡胚原代肝细胞中葡萄糖的消耗量(P < 0.01)。结果提示:(-)-HCA处理促进了鸡胚原代肝细胞对葡萄糖的利用。
|
图 2 (-)-HCA对鸡胚原代肝细胞葡萄糖消耗量的影响 Figure 2 Effect of (-)-HCA on consumption of glucose in primary chicken hepatocytes 与对照相比Compared with control group: *P < 0.05,**P < 0.01. The same as follows. |
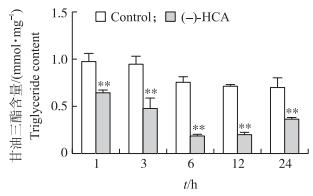
由图 3可知:与对照组相比, (-)-HCA处理极显著降低鸡胚原代肝细胞中甘油三酯含量(P < 0.01)。结果提示:(-)-HCA处理可降低鸡胚原代肝细胞中甘油三酯的合成。
|
图 3 (-)-HCA对鸡胚原代肝细胞中甘油三酯含量的影响 Figure 3 Effect of (-)-HCA on the triglyceride content in primary chicken hepatocytes |
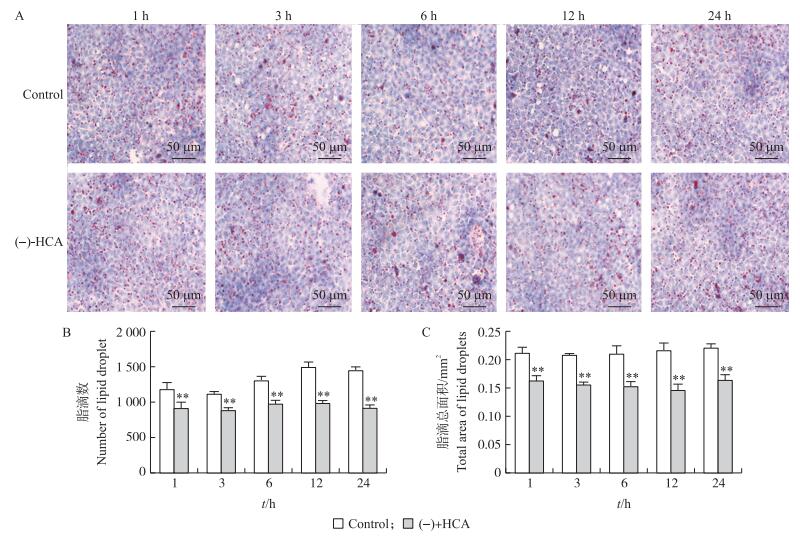
利用Image-pro Plus 6.0软件分析结果显示(图 4):(-)-HCA处理1~24 h极显著降低鸡胚原代肝细胞中脂滴总面积(P < 0.01);(-)-HCA处理3~24 h可极显著降低鸡胚原代肝细胞中脂滴数量(P < 0.01)。结果提示:(-)-HCA处理可抑制鸡胚原代肝细胞中脂滴的堆积。
|
图 4 (-)-HCA对鸡胚原代肝细胞脂滴合成的影响 Figure 4 Effect of (-)-HCA on lipid droplet synthesis in primary chicken hepatocytes A:油红染色显微照片Representative photomicrographs of oil red O stained; B:脂滴数Number of lipid droplets; C:脂滴总面积Total area of lipid droplets |
由表 1可知:(-)-HCA处理对鸡胚原代肝细胞中糖原含量、糖原合成酶和糖原磷酸化酶活性无显著影响(P > 0.05)。结果提示:(-)-HCA处理对鸡胚原代肝细胞糖原代谢无显著影响。
| 项目Items | c[(-)-HCA]/(μmol·L-1) | |
| 0 | 100 | |
| 糖原含量/(mg·g-1)Glycogen content | 5.57±0.83 | 6.26±0.88 |
| 糖原磷酸化酶活性/(IU·mg-1)Glycogen phosphorylase activity | 0.74±0.09 | 0.69±0.08 |
| 糖原合成酶活性/(U·mg-1)Glycogen synthase activity | 0.61±0.09 | 0.71±0.11 |
由图 5可知:(-)-HCA处理可显著降低鸡胚原代肝细胞中柠檬酸裂解酶的活性(P < 0.05), 极显著降低鸡胚原代肝细胞中乙酰辅酶A总量和胞质中乙酰辅酶A含量(P < 0.01)。结果提示:(-)-HCA处理可通过抑制鸡胚原代肝细胞中柠檬酸裂解酶活性, 从而降低细胞质中CoA含量。
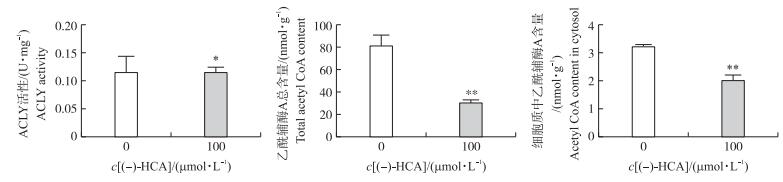
|
图 5 (-)-HCA对鸡胚原代肝细胞中柠檬酸裂解酶(ACLY)活性、乙酰辅酶A总含量和细胞质中乙酰辅酶A含量的影响 Figure 5 Effect of (-)-HCA on the ATP-citrate lyase(ACLY)activity, total acetyl CoA content and acetyl CoA content in cytosol in primary chicken hepatocytes |
由图 6可知:(-)-HCA可极显著提高鸡胚原代肝细胞中葡萄糖激酶、磷酸果糖激酶1、丙酮酸激酶、丙酮酸脱氢酶E1、乌头酸酶、琥珀酸脱氢酶、苹果酸脱氢酶和柠檬酸合酶的活性(P < 0.01)。结果提示:(-)-HCA可增强鸡胚原代肝细胞中糖代谢途径关键酶活性, 从而加快葡萄糖的氧化分解。
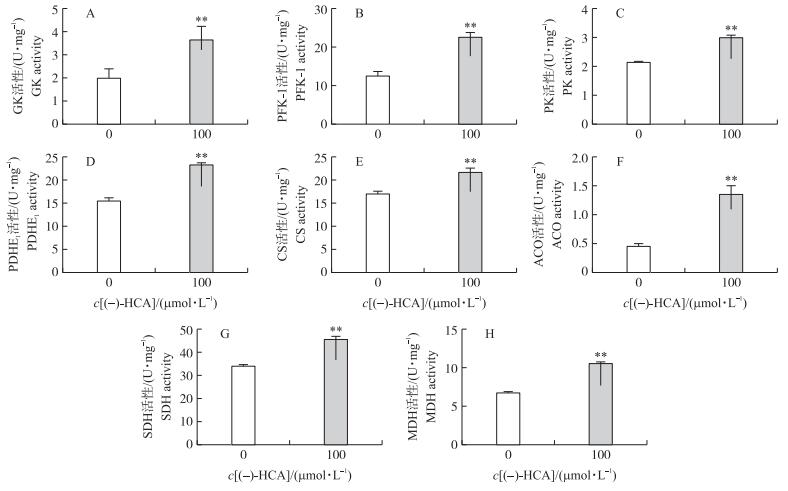
|
图 6 (-)-HCA对鸡胚原代肝细胞糖代谢关键酶活性的影响 Figure 6 Effect of (-)-HCA on the key enzyme activity of glucose catabolism in primary chicken hepatocytes GK:葡萄糖激酶Glucokinase; PFK-1:磷酸果糖激酶1 Phosphofructokinase 1;PK:丙酮酸激酶Pyruvate kinase; PDHE1:丙酮酸脱氢酶E1 Pyruvate dehydrogenas E1; CS:柠檬酸合酶Citrate synthase; ACO:乌头酸酶Aconitase; SDH:琥珀酸脱氢酶Succinate dehydrogenase; MDH:苹果酸脱氢酶Malate dehydrogenase |
由图 7可知:(-)-HCA处理可极显著增强鸡胚原代肝细胞中NADH脱氢酶和ATP合酶的活性(P < 0.01)。结果提示:(-)-HCA处理可增强鸡胚原代肝细胞线粒体中能量的产生。
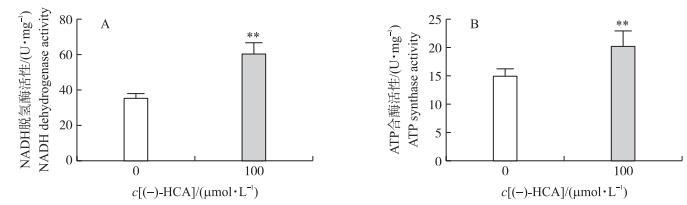
|
图 7 (-)-HCA对鸡胚原代肝细胞NADH脱氢酶和ATP合酶活性的影响 Figure 7 Effect of (-)-HCA on NADH dehydrogenase and ATP synthase activities of mitochondrial respiratory chain in primary chicken hepatocytes |
(-)-HCA是从藤黄果中提取出的一种天然有机酸, 其具有降低体增重、抑制脂肪沉积等多种生物学功效[13-14]。本试验结果表明, (-)-HCA处理对鸡胚原代肝细胞活力和细胞死亡率均无显著影响, 这一结果与Nisha等[15]报道的(-)-HCA处理不会对3T3-L1脂肪细胞造成毒性作用的研究结果相一致。本试验结果为后续探讨(-)-HCA对鸡胚原代肝细胞脂滴沉积的影响奠定了基础。
已有报道表明, 脂滴含量是评估脂肪沉积的重要参数[16]。(-)-HCA处理可显著降低鸡胚原代肝细胞中甘油三酯含量、脂滴数量和脂滴总面积, 这与Kim等[17]报道的藤黄果提取物抑制脂肪前体细胞中脂滴堆积结果相一致。大量研究证实, (-)-HCA作为柠檬酸裂解酶的竞争性抑制剂, 减少机体脂肪酸的合成[4-5]。本试验中, (-)-HCA处理显著降低鸡胚原代肝细胞中柠檬酸裂解酶活性和胞液中乙酰辅酶A含量。柠檬酸裂解酶主要是催化柠檬酸裂解为乙酰辅酶A, 为脂肪酸从头合成提供原料。结合脂滴和甘油三酯含量变化的结果提示:(-)-HCA抑制鸡胚原代肝细胞中脂滴沉积的机制可能是通过抑制柠檬酸裂解酶活性, 进而减少细胞质中乙酰辅酶A的含量, 最终抑制脂肪酸的从头合成途径。
本试验结果显示, (-)-HCA处理显著增加了葡萄糖的消耗量, 但对鸡胚原代肝细胞中糖原含量、糖原合成酶和糖原磷酸化酶活性并无显著影响。因此, 我们推测(-)-HCA处理可能增强了葡萄糖在鸡胚原代肝细胞中氧化分解代谢。葡萄糖激酶、磷酸果糖激酶和丙酮酸激酶是葡萄糖氧化分解代谢过程中重要的限速酶, 丙酮酸脱氢酶复合体是葡萄糖氧化分解代谢过程中在线粒体阶段氧化分解的第一个限速酶, 且在丙酮酸脱氢酶复合体中发挥主要作用的是E1[18]。本试验结果表明:(-)-HCA显著提高了鸡胚原代肝细胞中葡萄糖激酶、磷酸果糖激酶1、丙酮酸激酶和丙酮酸脱氢酶E1活性。已有报道表明, 乌头酸酶蛋白含量增加说明能量消耗的增加, 最终加速三羧酸循环[19]。作为三羧酸循环途径的关键酶, 鸡胚原代肝细胞中柠檬酸合酶、乌头酸酶、琥珀酸脱氢酶和苹果酸脱氢酶活性在(-)-HCA处理后显著增强。以上结果提示:(-)-HCA处理可促进鸡胚原代肝葡萄糖的氧化分解代谢。
琥珀酸脱氢酶是唯一一个存在于三羧酸循环和呼吸链中的关键酶, 其活性与细胞内能量的生成密切相关[20]。(-)-HCA处理显著提高了鸡胚原代肝细胞中琥珀酸脱氢酶、NADH脱氢酶和ATP合酶的活性。NADH脱氢酶是线粒体复合物Ⅰ最主要的递氢体[21], 而ATP合酶在线粒体呼吸链末端催化ATP的合成。因此, (-)-HCA处理可通过提高呼吸链中关键酶活性而加速能量鸡胚原代肝细胞中的能量代谢。
综上所述, (-)-HCA通过抑制柠檬酸裂解酶的活性而减少乙酰辅酶A的供给, 同时通过增强糖代谢和呼吸链中关键酶活性而加速能量代谢, 最终抑制鸡胚原代肝细胞中脂滴的堆积。本试验结果从能量代谢的角度揭示了(-)-HCA降低肉鸡脂肪沉积的机制, 并为其作为降脂调节剂的应用提供了一定的试验依据。
| [1] | Ahima R S. Digging deeper into obesity[J]. Journal of Clinical Investigation, 2011, 121(6): 2076–2079. DOI: 10.1172/JCI58719 |
| [2] | Katie J A, Michael L M, Xiao Q S, et al. Plant extracts with appetite suppressing properties for body weight control:a systematic review of double blind randomized controlled clinical trials[J]. Complementary Therapies in Medicine, 2013, 21(4): 407–416. DOI: 10.1016/j.ctim.2013.05.007 |
| [3] | Choppa T, Selvaraj C I, Zachariah A. Evaluation and characterization of malabar mamarind seed oil[J]. Journal of Food Science and Technology-Mysore, 2015, 52(9): 5906–5913. DOI: 10.1007/s13197-014-1674-2 |
| [4] | Semwal R B, Semwal D K, Vermaak I, et al. A comprehensive scientific overview of Garcina cambogia[J]. Fitoterapia, 2015, 102(7): 134–148. |
| [5] | Lowenstein J M. Effect of (-)-hydroxycitrate on fatty acid synthesis by rat liver in vivo[J]. Journal of Biological Chemistry, 1971, 3(10): 629–632. |
| [6] | Gürsel F E, Ates A, Bilal T, et al. Effect of dietary garcinia cambogia extract on serum essential minerals(calcium, phosphorus, magnesium)and trace elements(iron, copper, zinc)in rats fed with high-lipid diet[J]. Biological Trace Element Research, 2012, 148(3): 378–382. DOI: 10.1007/s12011-012-9385-x |
| [7] | Narasimha A, Shetty P H, Nanjundaswamy M H, et al. Hydroxycut-dietary supplements for weight loss:can they induce mania[J]. Australian and New Zealand Journal of Psychiatry, 2013, 47(12): 1205–1206. DOI: 10.1177/0004867413493522 |
| [8] | Cheng I S, Huang S W, Lu H C, et al. Oral hydroxycitrate supplementation enhances glycogen synthesis in exercised human skeletal muscle[J]. British Journal of Nutrition, 2012, 107(7): 1048–1055. DOI: 10.1017/S0007114511003862 |
| [9] | Han N N, Li L L, Peng M L, et al. (-)-Hydroxycitric acid nourishes protein synthesis via altering metabolic directions of amino acids in male rats[J]. Phytotherapy Research, 2016, 30(8): 1316–1329. DOI: 10.1002/ptr.v30.8 |
| [10] | Han J, Li L L, Wang D, et al. (-)-Hydroxycitric acid reduced fat deposition via regulating lipid metabolism-related gene expression in broiler chickens[J]. Lipids in Health and Disease, 2016, 15(37): 016–0208. DOI: 10.1186/S12944-016-0208-5 |
| [11] | Yeh Y Y, Leveille G A. Effect of dietary protein on hepatic lipogenesis in the growing chick[J]. Journal of Nutrition, 1969, 98(3): 356–366. |
| [12] |
唐雪, 马海田. 一种改良的鸡胚原代肝细胞的分离培养方法[J].
南京农业大学学报, 2008, 31(4): 154–156.
Tang X, Ma H T. Cultivation and identification of chicken embryo hepatocytes in primary culture[J]. Journal of Nanjing Agricultural University, 2008, 31(4): 154–156. DOI: 10.7685/j.issn.1000-2030.2008.04.029 (in Chinese) |
| [13] | Lopez A M, Kornegay J, Hendrickson R G. Serotonin toxicity associated with Garcinia cambogia over-the-counter supplement[J]. Journal of Occupational Medcine and Toxicology, 2014, 10(4): 399–401. |
| [14] | Chuah L O, Yeap S K, Ho W Y, et al. In vitro and in vivo toxicity of garcinia or hydroxycitric acid:a review[J]. Evidence-Based Complementary and Alternative Medicine, 2012: 197920. |
| [15] | Nisha V M, Priyanka A, Anusree S S, et al. (-)-Hydroxycitric acid attenuates endoplasmic reticulum stress-mediated alterations in 3T3-L1 adipocytes by protecting mitochondria and downregulating inflammatory markers[J]. Free Radical Research, 2014, 48(11): 1386–1396. DOI: 10.3109/10715762.2014.959514 |
| [16] | Mehlem A, Hagberg C E, Muhl L, et al. Imaging of neutral lipids by oil red O for analyzing the metabolic status in health and disease[J]. Nature Protocols, 2013, 8(6): 1149–1154. DOI: 10.1038/nprot.2013.055 |
| [17] | Kim M S, Kim J K, Kwon D Y, et al. Anti-adipogenic effects of Garcinia extract on the lipid droplet accumulation and the expression of transcription factor[J]. Biofactors, 2004, 22(1-4): 193–206. DOI: 10.1002/biof.v22:1/4 |
| [18] | Ciszak E M, Korotchkina L G, Dominiak P M, et al. Structural basis for flip-flop action of thiamin pyrophosphate-dependent enzymes revealed by human pyruvate dehydrogenase[J]. Journal of Biological Chemistry, 2003, 278(23): 240–246. |
| [19] | Hausladen A, Fridovich I. Measuring nitric oxide and superoxide:rate constants for aconitase reactivity[J]. Methods in Enzymology, 1996, 269(33): 37–41. |
| [20] | Rutter J, Winge D R, Schiffman J D. Succinate dehydrogenase-assembly, regulation and role in human disease[J]. Mitochondrion, 2010, 10(4): 393–401. DOI: 10.1016/j.mito.2010.03.001 |
| [21] | Nagata S. Influence of salts and pH on the growth as well as NADH oxidase of the halotolerant bacterium A505[J]. Archives of Microbiology, 1988, 150: 302–308. DOI: 10.1007/BF00407796 |




