文章信息
- 温玉玲, 王玉俭, 吴玲燕, 严若峰, 徐立新, 宋小凯, 李祥瑞
- WEN Yuling, WANG Yujian, WU Lingyan, YAN Ruofeng, XU Lixin, SONG Xiaokai, LI Xiangrui
- 捻转血矛线虫苏氨酸醛缩酶结构域包含蛋白的克隆与表达及其体外对山羊外周血单个核细胞功能的影响
- Cloning, expression and effects of Haemonchus contortus aromatic amino acid beta-eliminating lyase threonine aldolase domain containing protein on functions of goat PBMC in vitro
- 南京农业大学学报, 2017, 40(3): 502-508
- Journal of Nanjing Agricultural University, 2017, 40(3): 502-508.
- http://dx.doi.org/10.7685/jnau.201609046
-
文章历史
- 收稿日期: 2016-09-28
捻转血矛线虫病(Haemonchosis)呈世界性分布, 是由圆线目毛圆科血矛属的捻转血矛线虫(Haemonchus contortus)感染牛、羊、骆驼等反刍动物引起的一种严重的肠道寄生虫病。捻转血矛线虫主要寄生于反刍动物的真胃, 偶见于小肠, 以动物血液为其营养来源, 造成宿主贫血, 消瘦, 免疫功能低下, 甚至羔羊的死亡, 给世界范围内的畜牧业造成重大经济损失[1-2]。但是目前对捻转血矛线虫感染宿主致病机制的分子基础研究还不是很完整, 因此对捻转血矛线虫感染宿主致病机制的分子基础研究将更有助于临床上对捻转血矛线虫的防控。
笔者所在实验室前期使用免疫共沉淀与质谱分析发现了捻转血矛线虫排泄分泌蛋白——苏氨酸醛缩酶(芳香族氨基酸β-消除裂合酶)结构域包含蛋白(aromatic amino acid beta-eliminating lyase threonine aldolase domain containing protein, Uniprot蛋白登录号U6PHL6), 这个蛋白命名为TA-1[3-4]。苏氨酸醛缩酶(芳香族氨基酸β-消除裂合酶, TA)是一种磷酸吡哆醛依赖的裂合酶, 在生物界中普遍存在, 可逆转变β-羟基-α-氨基酸(如苏氨酸)为甘氨酸和乙醛或在醛类与甘氨酸下合成苏氨酸衍生物和多功能手性β-羟基-α-氨基酸, 并广泛运用于生物催化、制药与有机合成。目前, 苏氨酸醛缩酶的研究主要在细菌上, 对寄生虫的研究较少[5-6]。而笔者所在实验室发现的TA-1是否也有对应酶结构域的生理或生化作用, 是否与山羊外周血单个核细胞(PBMC)结合及其结合后对山羊PBMC的功能是否产生影响, 对上述问题的研究有助于更进一步的认识捻转血矛线虫分子致病机制。因此, 本试验克隆表达了TA-1重组蛋白(rTA-1), 并在体外观察rTA-1与山羊PBMC的结合情况, 及其对PBMC增殖、迁移、分泌细胞因子、释放NO及吞噬几个方面的影响。
1 材料与方法 1.1 试验材料 1.1.1 试验动物、虫种、菌种和质粒试验动物为3~6月龄健康山羊, 由南京农业大学动物医学院动物试验中心提供; SD大鼠购自扬州大学实验动物中心; 捻转血矛线虫虫种、大肠杆菌DH5α、BL21菌种及pET-32a (+)载体均由南京农业大学兽医寄生虫病学实验室保存。
1.1.2 工具酶和主要试剂DNA标准品(DL2000、DL5000、DL15000)、T4DNA连接酶、限制性内切酶BamHⅠ、Hind Ⅲ、2×Phanta® Master Mix、pMD19-T载体均购自大连宝生物(TaKaRa)工程有限公司; HiScript® Ⅱ 1st Strand cDNA Synthesis Kit反转录试剂盒、荧光定量PCR试剂盒均购于南京诺唯赞生物科技有限公司; RNA提取试剂盒、质粒提取试剂盒、琼脂糖凝胶回收试剂盒购于美国OMEGA公司; Pierce® BCA Protein Assay Kit蛋白定量分析试剂盒购于美国Thermo公司; 弗式完全佐剂、弗氏不完全佐剂、FITC-dextran购于美国Sigma公司; Cy3标记的山羊抗大鼠IgG (H+L)、DAPI细胞核染液、抗荧光淬灭封片液、Cell Counting Kit-8 (CCK-8) 试剂盒、总一氧化氮(NO)检测试剂盒均购于碧云天生物技术有限公司; Millcell® Hanging Cell Culture Inserts迁移小室购自Merck-Millipore公司; 淋巴细胞分离液购自天津灏洋生物公司; RPMI 1640和DMEM细胞培养液、胎牛血清(FBS)、青(链)霉素和0.25 mg · L-1胰酶消化液均购于Gibco公司。其余试剂为国产分析纯。
1.1.3 主要仪器与设备PCR扩增仪(日本TaKaRa), 5417R冷冻台式离心机(德国Eppendorf公司), ImageQuant300凝胶成像分析系统(美国GE公司), 激光共聚焦显微镜(德国Carl Zeiss), Thermo Scientific 8000 CO2细胞恒温培养箱(Thermo), ABI 7500荧光定量PCR仪(Applied Bio Systems公司), BD FACS Calibur流式细胞仪(美国Bectom Dickinson公司)。
1.2 TA-1基因的克隆与表达 1.2.1 RT-PCR反应取50条捻转血矛线虫, 参照RNA提取试剂盒说明书进行捻转血矛线虫成虫总RNA的提取。根据捻转血矛线虫TA-1基因序列(GenBank登录号:HCOI_01467900) 设计1对特异性引物:5′-GCGGATCCATGCAAAGATTGTGGCGTATCAC-3′/5′-GCGCAAGCTTCGAATTGGTTAAAGACTGGATAAATTC-3′, 下划线分别表示BamHⅠ和Hind Ⅲ酶切位点, 引物由苏州金唯智公司合成。以提取的捻转血矛线虫总RNA为模板, 应用cDNA反转录试剂盒合成第一链cDNA, 以cDNA为模板进行PCR反应, PCR产物分装后于-70 ℃保存。反应体系(50 μL):Master Mix 25 μL、引物各2 μL、模板cDNA 4 μL、ddH2O 17 μL。反应条件:94 ℃ 5 min; 94 ℃ 45 s, 55 ℃ 45 s, 72 ℃ 2 min, 35个循环; 72 ℃ 10 min。1 g · L-1琼脂糖凝胶电泳检验PCR产物[7]。
1.2.2 TA-1基因的克隆、表达与重组蛋白的纯化TA-1基因的克隆、序列分析与原核表达参照文献[7]操作。PCR产物连接到pMD19-T载体上, 经双酶切鉴定和测序, 阳性克隆命名为pMD19-T/TA-1。用DNAStar等软件分析该基因的特性, 用BLAST软件将该基因序列与GenBank中TA-1基因进行同源性比较。目的片段再亚克隆到pET-32a (+)中构建表达质粒pET-32a/TA-1。重组子用IPTG诱导后收集菌体沉淀进行超声破碎, 包涵体蛋白经镊柱纯化后用浓度梯度递减的尿素溶液连续透析复性, 聚乙二醇20000浓缩。收集分装蛋白样品, 经SDS-PAGE电泳分析后, 纯化蛋白一部分于-20 ℃保存备用, 一部分皮下免疫SD大鼠获得抗rTA-1的血清。
1.3 重组蛋白与山羊PBMC的结合及对其功能的影响 1.3.1 山羊PBMC及其单核细胞的分离与培养参照文献[8]进行山羊PBMC和单核细胞的分离与培养。用20 mL注射器抽取2 mL 3.8 g · L-1的枸橼酸钠后无菌采集山羊颈静脉抗凝血, 参照PBMC的分离步骤说明书分离获得山羊PBMC, 用含10%的胎牛血清、1%双抗的RPMI 1640培养基调整细胞浓度为1×106 mL-1。单核细胞根据其贴壁的特性进行分离。将上述分离好的PBMC按每孔2 mL的量接种于6孔细胞培养板中, 置于37 ℃、5% CO2培养2 h后, 吸弃培养液, 用37 ℃预热的PBS缓冲液清洗3次后, 用2.5 g · L-1胰酶消化液消化贴壁的细胞即为单核细胞, 再用含10%的胎牛血清、1%双抗的RPMI 1640培养基调整细胞浓度为1×106 mL-1。上述PBMC及其单核细胞分离后均通过台盼蓝排斥试验, 成活率大于95%。将分离好的PBMC或单核细胞(1×106 mL-1)分别与0、10、20和40 μg · mL-1的rTA-1或pET-32a共孵育, 置于37 ℃、5% CO2的细胞培养箱中培养。每个梯度3个重复。以不加rTA-1的PBS作为细胞空白对照。
1.3.2 重组蛋白与山羊PBMC的结合试验取12孔细胞培养板, 每孔加入1 mL的山羊PBMC细胞悬液, 加入重组蛋白rTA-1 (终浓度为10 μg · mL-1)与PBMC共孵育1 h。同时设置细胞对照组和pET-32a对照组。收集细胞, 先后用与重组蛋白抗血清结合的Cy3标记的山羊抗大鼠IgG (H+L)和细胞核染料DAPI染色PBMC, 最后用激光扫描共聚焦显微镜观察rTA-1与山羊PBMC的结合情况[9-10]。
1.3.3 重组蛋白对山羊PBMC增殖的影响取96孔细胞培养板, 每孔加入细胞悬液100 μL, 分别加入不同浓度的rTA-1, 同时设RPMI 1640培养液调零孔、pET-32a对照孔和刀豆蛋白A (ConA, 10 μg · mL-1)阳性对照孔[11]。培养72 h后, 每孔加入CCK-8溶液10 μL, 继续避光培养2 h后用酶标仪测定D450。按如下公式计算细胞增殖指数(SI)[12]:
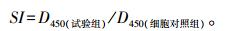
|
取24孔细胞培养板, 每孔加入细胞悬液1 mL, 分别加入不同浓度的rTA-1培养24 h后, 收集细胞, 参照文献[8]采用迁移小室检测rTA-1对山羊PBMC的迁移影响, 计算迁移后的细胞数与迁移前细胞数的百分比。
1.3.5 重组蛋白对山羊PBMC细胞因子表达的影响参照文献[10, 13]研究重组蛋白rTA-1对山羊PBMC细胞因子表达的影响。以β-actin作为内参基因, 设置细胞对照组的细胞因子mRNA转录水平为1。
1.3.6 重组蛋白对山羊PBMC分泌NO的影响分离山羊PBMC后, 用含10%胎牛血清、1%双抗的DMEM培养基重新调整细胞浓度为1×106 mL-1[8]。取12孔细胞培养板, 每孔加入细胞悬液1 mL, 分别加入不同浓度的rTA-1, 培养24 h后, 重悬细胞, 500 g离心5 min, 取上清液, 参照碧云天总NO检测试剂盒说明书测定NO分泌量。
1.3.7 重组蛋白对山羊单核细胞吞噬的影响取24孔细胞培养板, 每孔加入单核细胞1 mL, 分别加入不同浓度的rTA-1。培养48 h后收取细胞。用预冷的PBS洗涤2次后将细胞重悬为100 μL, 再与等体积的FITC-dextran (1 mg · mL-1, 相对分子质量40 000) 混匀后分别置于4 ℃、37 ℃避光孵育1 h。用含2% FBS的预冷PBS洗涤3次后, 用500 μL含2%多聚甲醛的预冷PBS重悬细胞, 上流式细胞仪测定平均荧光强度(MFI), 检测rTA-1对山羊单核细胞吞噬的影响[14-15]。按如下公式计算细胞吞噬指数(PI)[12]:
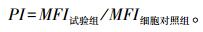
|
试验数据用Graphpad Prism 5.0软件包(San Diego, USA)分析, 并用Tukey′s法进行多重比较, 数据用x±SD表示。
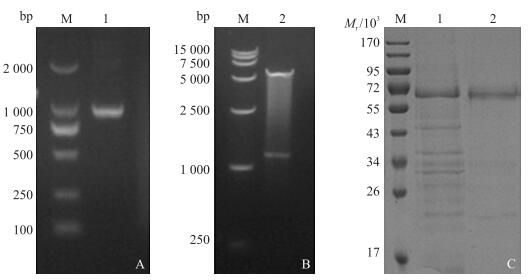
2 结果与分析 2.1 捻转血矛线虫TA-1基因的克隆与序列分析PCR产物经琼脂糖凝胶电泳后在1 194 bp处有一特异性条带(图 1-A), 与预期结果一致。回收纯化该PCR产物, 与pMD19-T载体连接, 经双酶切鉴定和测序, 构建成功的克隆质粒命名为pMD19-T/TA-1。
|
图 1 TA-1基因的克隆、原核表达与蛋白纯化 Figure 1 Cloning, expression of TA-1 and purification of recombinant TA-1 A.TA-1基因PCR产物电泳, B.重组质粒pET-32a/TA-1的双酶切鉴定:M.DNA标准分子量; 1.TA-1基因PCR产物; 2.pET-32a/TA-1经BamH Ⅰ和Hind Ⅲ双酶切产物。C.重组蛋白rTA-1的纯化:M.蛋白标准品; 1.纯化前的包涵体蛋白; 2.纯化后的包涵体蛋白。 A.Agarose gel electrophoresis of PCR products of gene TA-1, B.Identification of recombinant plasmid pET-32a/TA-1 by restriction enzyme digestion:M.DNA marker; 1.PCR product of gene TA-1; 2.pET-32a/TA-1 digested by BamH Ⅰ and Hind Ⅲ. C.Purification of recombinant TA-1:M.Protein marker; 1.Inclusion body without purification; 2.Purified protein from inclusion body. |
利用DNAstar软件分析TA-1基因的ORF, 其长度为1 194 bp, 编码397个氨基酸, 理论等电点为7.9, 相对分子质量为43.818×103。将该ORF在NCBI网站进行BLASTn对比分析, 发现与GenBank中捻转血矛线虫(HCOI_01467900)TA-1基因的相似度为95%。利用NCBI的BLASTp和Conserved Domain在线检索蛋白数据库, 检索结果表明捻转血矛线虫苏氨酸醛缩酶(芳香族氨基酸β-消除裂合酶)结构域包含蛋白在进化过程中十分保守, 具有很多保守的结构域, 如β-消除裂合酶结构域、磷酸吡哆醛结合位点、酶催化位点等。
2.2 捻转血矛线虫TA-1基因的原核表达原核表达质粒pET-32a/TA-1经BamHⅠ和Hind Ⅲ双酶切鉴定后, 得到1条载体片段和1条1 194 bp的目的片段, 大小与预期相符(图 1-B), 表明原核表达质粒构建成功。SDS-PAGE分析结果显示:重组质粒pET-32a/TA-1成功在大肠杆菌中得到表达, 融合蛋白相对分子质量约为64×103, 蛋白表达量随时间逐渐增大, 在诱导6 h后, 蛋白表达量最大。诱导表达后的融合蛋白主要以包涵体的形式存在。经镍柱纯化后, 得到了较纯净的融合蛋白rTA-1 (图 1-C)。
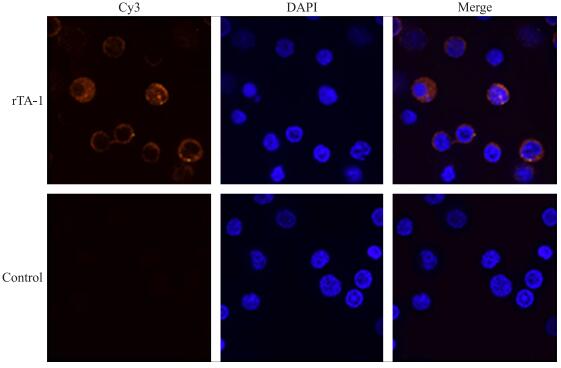
2.3 重组蛋白与山羊PBMC的结合试验如图 2所示:结合了Cy3标记抗体的重组蛋白发出红色荧光, DAPI复染的细胞核发出蓝色荧光。试验组中围绕着蓝色细胞核有重叠的红色荧光; 而对照组只有细胞核结构, 没有观察到红色荧光的出现, 说明rTA-1能够与山羊PBMC结合。
|
图 2 rTA-1与山羊外周血单个核细胞(PBMC)的结合试验观察(×100) Figure 2 Binding of recombinant TA-1 to peripheral blood mononuclear cells(PBMC)of goat |
如图 3所示:rTA-1在体外能刺激山羊PBMC的增殖(SI > 1) 并表现出一定的剂量依赖性。在适宜蛋白浓度条件下, 随蛋白浓度增大, 增殖效应逐渐增强; 超过一定蛋白浓度时刺激作用减弱, 在蛋白浓度为10和20 μg · mL-1时会显著和极显著促进山羊PBMC细胞的增殖(P < 0.05, P < 0.01)。
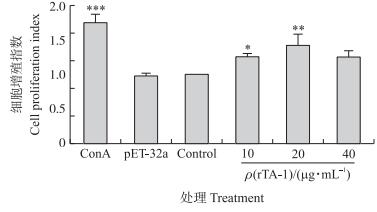
|
图 3 重组蛋白rTA-1对山羊PBMC的增殖影响 Figure 3 Effect of recombinant TA-1 on the proliferation of goat′s PBMC 与对照组相比Versus the control:*P < 0.05, * *P < 0.01, * * *P < 0.001. The same as follows. |
如图 4所示:rTA-1在体外能有效促进山羊PBMC的迁移, 3个试验组的迁移率都极显著高于细胞对照组(P < 0.01), 其中10和20 μg · mL-1的rTA-1对山羊PBMC迁移能力的促进作用最明显(P < 0.001)。
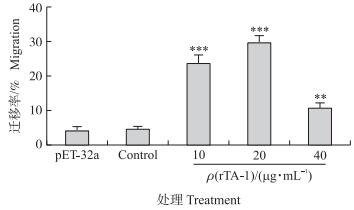
|
图 4 重组蛋白rTA-1对山羊PBMC迁移能力的影响 Figure 4 Effect of recombinant TA-1 on the migration of goat′s PBMC |
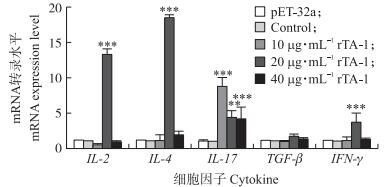
|
图 5 重组TA-1影响山羊PBMC多种细胞因子mRNA表达情况 Figure 5 The expression level of multiple cytokine mRNA in PBMC of goat stimulated by recombinant TA-1 |
山羊PBMC经不同浓度的重组蛋白rTA-1刺激后检测IL-2、IL-4、IL-17、IFN-γ及TGF-β mRNA转录情况。结果发现:IL-2、IL-4和IFN-γ mRNA转录水平在20 μg · mL-1的rTA-1刺激后与细胞对照组比较差异极极显著(P < 0.001), 而IL-17的mRNA转录水平经10、20和40 μg · mL-1的rTA-1刺激后与细胞对照组比较差异都极显著(P < 0.001)。TGF-β变化不明显(P > 0.05)。
2.7 重组蛋白对山羊PBMC分泌NO的影响如图 6所示:与细胞对照组相比, 山羊PBMC经过不同浓度rTA-1作用后细胞分泌NO的量均显著增多(P < 0.01), 其中20和40 μg · mL-1 rTA-1极显著促进山羊PBMC分泌NO (P < 0.001)。
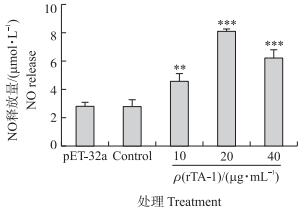
|
图 6 重组蛋白rTA-1对山羊PBMC分泌NO的影响 Figure 6 Effect of recombinant TA-1 on the NO production of goat′s PBMC |
如图 7所示:单核细胞在40 μg · mL-1 rTA-1刺激下吞噬FITC-dextran的能力极显著增加(P < 0.001), 在其余浓度的刺激下对单核细胞的吞噬功能影响较小。
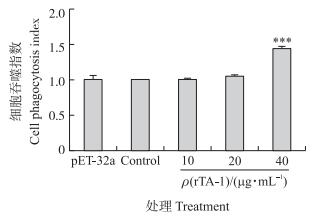
|
图 7 重组蛋白对单核细胞吞噬功能的影响 Figure 7 Effect of recombinant TA-1 on the monocyte phagocytosis |
研究表明, 寄生性线虫的排泄分泌蛋白刺激宿主机体后可产生较好的免疫保护作用, 例如捻转血矛线虫的ES-15和ES-24蛋白, 可作为较好的候选疫苗[16]。苏氨酸醛缩酶在生物界普遍存在, 主要与物质代谢相关, 目前对它的研究主要在细菌上, 对寄生虫的研究较少。本实验室前期通过免疫共沉淀与质谱的方法获得了捻转血矛线虫上与苏氨酸醛缩酶相关的苏氨酸醛缩酶结构域包含蛋白(TA-1)[3-4], 因此本试验克隆、表达了该基因TA-1, 并研究了该重组蛋白rTA-1体外对山羊PBMC功能的影响。结果发现, rTA-1能有效促进山羊PBMC的多种功能, 对PBMC细胞因子分泌的影响较为复杂, 为进一步研究捻转血矛线虫的分子致病机制提供基础。
Yuan等[8]和Li等[12]研究表明, 捻转血矛线虫的Galectin家族能与山羊PBMC的TMEM63A和TMEM147两个受体结合而调节细胞的功能。本试验结果表明, rTA-1也能与山羊PBMC结合, 表明在山羊PBMC表面上也存在相应的受体。高波等[10]和马春晓[17]研究表明, 捻转血矛线虫的HC29重组蛋白、精氨酸激酶(AK)重组蛋白等刺激后都能有效促进山羊PBMC的增殖。本试验结果也表明, rTA-1显著促进山羊PBMC的增殖。在病原体感染过程中, 宿主为了对抗病原体的入侵, 还会诱导PBMC向感染部位迁移, 这是宿主防御病原体的有效措施。本研究结果发现, rTA-1显著促进山羊PMBC的迁移。
本研究表明, 在一定的作用时间内, rTA-1在浓度为20 μg · mL-1时能显著激活IL-2、IL-4和IFN-γ的转录; 而对IL-17 mRNA转录的促进呈现剂量依赖递减, 在10 μg · mL-1时转录水平最高。IL-4由Th2细胞分泌, 能够刺激B细胞的增殖, 诱导IgE的产生, 在寄生虫免疫中起重要作用。IL-2和IFN-γ由Th1细胞分泌, IL-2促进T、B淋巴细胞、NK细胞、单核细胞的增殖, 促进其他细胞因子如干扰素等的分泌; IFN-γ诱导Th1型免疫应答, 在寄生虫的慢性感染过程中发挥重要作用。IL-17由Th17细胞分泌, 寄生虫在特异性诱导Th17细胞分化过程中, 受多种细胞因子和生物活性物质的调节, 其中TGF-β、IL-6和IL-23等发挥着决定性作用。TGF-β是由调节性T细胞(Treg)分泌的、具有抑制T淋巴细胞活性的免疫抑制细胞因子。研究表明Th2型免疫在蠕虫感染中占主要地位[18]。本试验中, 虽然IL-2、IFN-γ和IL-17都有明显的变化, 但IL-4的变化明显大于前3者, 占主要地位, 与Alba-Hurtado等18的研究结果一致。程云等[19]研究表明, 寄生虫在感染中主动通过调整Th1、Th2和Th17的平衡使寄生虫逃避宿主的免疫杀伤, 同时又不使宿主产生严重的免疫抑制从而在宿主体内寄生。本试验表明, rTA-1刺激山羊PBMC产生的细胞因子较为复杂, 表明该蛋白可能与捻转血矛线虫的免疫逃避相关。
机体在抵御感染中, 单核巨噬细胞在非特异性免疫应答中发挥了重要作用[20]。而IFN-γ和NO是单核巨噬细胞杀伤效应中的重要组分。本试验证明, 20 μg · mL-1rTA-1能显著促进IFN-γ的分泌, 进而促进单核细胞分泌NO而发挥杀伤作用。
| [1] | Martín S, Molina J M, Hernández Y I, et al. Influence of immunoprotection on genetic variability of cysteine proteinases from Haemonchus contortus adult worms[J]. International Journal for Parasitology, 2015, 45: 831–840. DOI: 10.1016/j.ijpara.2015.06.006 |
| [2] | Fawzi E M, González-Sánchez M E, Corral M J, et al. Vaccination of lambs with the recombinant protein rHc23 elicits significant protection against Haemonchus contortus challenge[J]. Veterinary Parasitology, 2015, 211: 54–59. DOI: 10.1016/j.vetpar.2015.04.029 |
| [3] | Gadahi J A, Wang S, Gao B, et al. Proteomic Analysis of the excretory and secretory proteins of Haemonchus contortus (HcESP)binding to goat PBMCs in vivo revealed stage-specific binding profiles[J]. PLoS ONE, 2016, 11(7): e0159796. DOI: 10.1371/journal.pone.0159796 |
| [4] | Laing R, Kikuchi T, Martinelli A, et al. The genome and transcriptome of Haemonchus contortus, a key model parasite for drug and vaccine discovery[J]. Genome Biology, 2013, 14(8): r88. DOI: 10.1186/gb-2013-14-8-r88 |
| [5] | Remesh S G, Ghatge M S, Ahmed M H, et al. Molecular basis of E.coli L-threonine aldolase catalytic inactivation at low Ph[J]. Biochimica et Biophysica Acta, 2015, 1854: 278–283. DOI: 10.1016/j.bbapap.2014.12.023 |
| [6] | Kurjatschij S, Katzberg M, Bertau M. Production and properties of threonine aldolase immobilisates[J]. Journal of Molecular Catalysis B:Enzymatic, 2014, 103: 3–9. DOI: 10.1016/j.molcatb.2014.01.021 |
| [7] |
马春晓, 张振超, 李祥瑞, 等. 捻转血矛线虫精氨酸激酶基因的克隆与表达及酶活性分析[J].
南京农业大学学报, 2014, 37(3): 100–106.
Ma C X, Zhang Z C, Li X R, et al. Arginine kinase in Haemonchus contortus:cloning expression and catalytic properties[J]. Journal of Nanjing Agricultural University, 2014, 37(3): 100–106. DOI: 10.7685/j.issn.1000-2030.2014.03.014 (in Chinese) |
| [8] | Yuan C, Zhang H, Wang W, et al. Transmembrane protein 63A is a partner protein of Haemonchus contortus galectin in the regulation of goat peripheral blood mononuclear cells[J]. Parasites and Vectors, 2015, 8: 211–224. DOI: 10.1186/s13071-015-0816-3 |
| [9] | Wang W, Yuan C, Wang S, et al. Transcriptional and proteomic analysis reveal recombinant galectins of Haemonchus contortus down-regulated functions of goat PBMC and modulation of several signaling cascades in vitro[J]. Science Direct, 2014, 98: 123–137. |
| [10] |
高波, 袁橙, 宋小凯, 等. 捻转血矛线虫谷胱甘肽过氧化物酶体外对山羊外周血单核细胞功能的影响[J].
畜牧与兽医, 2014, 46(5): 19–23.
Gao B, Yuan C, Song X K, et al. Effects of glutathione peroxidase in Haemonchus contortus on functions of peripheral blood mononuclear cells from goats in vitro[J]. Animal Husbandry and Veterinary Medicine, 2014, 46(5): 19–23. (in Chinese) |
| [11] | Wang W, Wang S, Zhang H, et al. Galectin Hco-gal-m from Haemonchus contortus modulates goat monocytes and T cell function in different patterns[J]. Parasites and Vectors, 2014, 7: 342–354. DOI: 10.1186/1756-3305-7-342 |
| [12] | Li Y, Yuan C, Wang L K, et al. Transmembrane protein 147 (TMEM147):another partner protein of Haemonchus contortus galectin on the goat peripheral blood mononuclear cells (PBMC)[J]. Parasites and Vectors, 2016, 9: 355–367. DOI: 10.1186/s13071-016-1640-0 |
| [13] |
蒋悦, 孙娟, 韩思迪, 等. 水稻黄叶突变体yl的遗传分析与基因定位[J].
南京农业大学学报, 2016, 39(6): 889–897.
Jiang Y, Sun J, Han S D, et al. Genetic analysis and gene mapping of a yellow leaf mutant yl in rice[J]. Journal of Nanjing Agricultural University, 2016, 39(6): 889–897. DOI: 10.7685/jnau.201604004 (in Chinese) |
| [14] | Kim M Y, Kim J H, Cho J Y, et al. Cytochalasin B modulates macrophage-mediated inflammatory responses[J]. Biomol Ther, 2014, 22(4): 295–300. DOI: 10.4062/biomolther.2014.055 |
| [15] | Xiu F M, Stanojcic M, Jeschke M G. Norepinephrine inhibits macrophage migration by decreasing CCR2 expression[J]. PLoS ONE, 2013, 8(7): e69167. DOI: 10.1371/journal.pone.0069167 |
| [16] | Vervelde L, Leeuwen M A W V, Kruidenier M, et al. Protection studies with recombinant excretory/secretory proteins of Haemonchus contortus[J]. Parasite Immunology, 2002, 24(4): 189–201. DOI: 10.1046/j.1365-3024.2002.00454.x |
| [17] |
马春晓. 捻转血矛线虫精氨酸激酶的克隆表达及其抗原特性分析[D]. 南京: 南京农业大学, 2014: 59-63.
Ma C X. Arginine kinase in Haemonchus contortus:cloning, expression and antigenic characteristics analysis[D]. Nanjing:Nanjing Agricultural University, 2014:59-63 (in Chinese with English abstract). |
| [18] | Alba-Hurtado F, Muñoz-Guzmán M A. Immune responses associated with resistance to haemonchosis in sheep[J]. BioMed Research International, 2013, 1153(10): 162158–162169. |
| [19] |
程云, 李建华, 彭景贤. 细胞因子与寄生虫感染关系研究进展[J].
中国病原生物学杂志, 2010, 5(5): 381–384.
Cheng Y, Li J H, Peng J X. Advances in research on the relationship between cytokines and parasite immunity[J]. Journal of Pathogen Biology, 2010, 5(5): 381–384. (in Chinese) |
| [20] | Paclik D, Werner L, Guckelberger O, et al. Galectins distinctively regulate central monocyte and macrophage function[J]. Cell Immunol, 2011, 271(1): 97–103. DOI: 10.1016/j.cellimm.2011.06.003 |




