文章信息
- 乔文娜, 王培永, 李翔, 马志禹, 苏娟, 雷治海
- QIAO Wenna, WANG Peiyong, LI Xiang, MA Zhiyu, SU Juan, LEI Zhihai
- 神经介素U在体外对猪树突细胞活性及功能的影响
- Effects of neuromedin U on activity and function of porcine dendritic cells in vitro
- 南京农业大学学报, 2017, 40(3): 494-501
- Journal of Nanjing Agricultural University, 2017, 40(3): 494-501.
- http://dx.doi.org/10.7685/jnau.201702020
-
文章历史
- 收稿日期: 2017-02-17
2. 江苏省徐州市铜山区禽病门诊部, 江苏 徐州 221000
2. Poultry Disease Outpatient Department, Tongshan District, Xuzhou City, Xuzhou 221000, China
神经介素U (neuromedin U, NMU) 是1985年从猪脊髓分离纯化的神经肽, 因其在体外可使大鼠子宫 (uterus) 收缩, 故加后缀U命名为NMU。NMU主要有NMU-25和NMU-8两种, 其生物学活性相似[1-2]。神经介素U有2个内源性受体:NMU1R (FM-3/GPR66) 和NMU2R (FM-4/TGR-1)[3], 均属于典型的G蛋白偶联受体 (G protein-coupled receptors, GPCR), 具有7个跨膜结构域, 且NMU通过这2个受体发挥生物学功能。研究发现, 无论是在哺乳动物 (猪、大鼠、兔、狗、豚鼠、人)[4-5], 还是在鱼类[6]、两栖动物[7]和禽类[8], NMU序列高度保守, 提示该肽发挥重要的生物学作用[9]。神经介素U及其受体在体内分布广泛, 表明其具有多种生理功能, 从食欲调节[10]、能量平衡[11], 到平滑肌收缩[12]和免疫调节及抗肿瘤作用[13]。研究还发现NMU在人的树突细胞 (dendritic cell, DC) 中表达, 而NMU受体R1在免疫效应细胞 (T细胞、NK细胞) 中表达, 提示抗原递呈细胞和免疫效应细胞群之间存在相互作用[14]。DC是目前发现功能最强的抗原递呈细胞[15], 其表面具有丰富的抗原递呈分子, 能有效激活初始T细胞[16]。DC也可通过IL-6和IFN-γ调控记忆B细胞和浆细胞[17], 从而影响体液免疫。体外研究表明, NMU促进Th2细胞分泌IL-4、IL-5、IL-13等多种细胞因子[18];体内研究发现NMU对同样具有抗原递呈功能的巨噬细胞分泌IL-6起重要作用[19]。
目前, 关于NMU调控免疫的研究已有一些报道, 主要集中在肥大细胞、粒细胞与效应细胞上, 本课题组李晓亮等[20]、李翔等[21]已克隆出猪NMU及其受体的基因, 并研究了NMU在猪体内及体外培养免疫细胞中的表达, 发现NMU及NMUR1广泛分布于猪的免疫器官 (脾、胸腺、淋巴结等) 及细胞 (脾淋巴细胞、肺泡巨噬细胞、PBL和NK细胞) 中; 进一步研究发现, NMU可显著影响猪脾淋巴细胞和肺泡巨噬细胞IL-4、IL-5与IL-13的分泌[22-23]。肺泡巨噬细胞和树突细胞均为重要的抗原递呈细胞, 提示NMU可能对猪树突细胞分泌IL-4、IL-5与IL-13也有影响, 故将这3个细胞因子作为检测NMU调节猪树突细胞免疫功能的指标。由于DC在体内单独存在的数量非常少, NMU对树突细胞的作用鲜见报道。因此, 本试验从健康猪外周血获得DC前体细胞, 经集落刺激因子 (granulocyte-macrophage colony-stimulating factor, GM-CSF) 和IL-4体外作用诱导为未成熟树突细胞 (immature dendritic cell, iDC), 加入脂多糖 (lipopolysaccharide, LPS) 促进DC成熟, 以研究NMU在体外对猪DC刺激T淋巴细胞增殖、树突细胞凋亡及其分泌细胞因子IL-4、IL-5和IL-13的影响, 为研究NMU促进免疫机制提供试验依据。
1 材料与方法 1.1 试验动物3~5月龄小梅山猪6头, 购自江苏农林职业技术学院小梅山猪育种中心, 饲养于江苏省农业科学院。
1.2 主要试剂猪源神经介素U (NMU25, GL Biochem公司), 猪重组GM-CSF (R & D公司), 猪重组IL-4 (R & D公司), FITC Annexin V凋亡检测试剂盒 (BD公司), RPMI 1640培养液 (Gibco公司), 胎牛血清 (FBS, Muticell公司), 猪外周血淋巴细胞分离液 (LTS1110, TBD公司), 脂多糖 (LPS, Sigma公司), CCK-8试剂盒 (Biosharp公司), 猪IL-4、IL-5、IL-13 ELISA检测试剂盒 (SEA077Po、SEA078Po、SEA060Po, USCN公司), 其他试剂均为国产分析纯。
1.3 树突细胞的培养无菌采集猪前腔静脉血, 加4%柠檬酸钠抗凝, 用等体积的RPMI-1640稀释抗凝血。取50 mL离心管, 底部加入20 mL猪淋巴细胞分离液, 缓慢注入20 mL上述稀释后的血液, 2 000 r · min-1离心20 min, 富集单个核细胞 (PBMC), 并以2×106 mL-1的密度接种细胞于6孔板, 置于5% CO2培养箱37 ℃培养6 h后, 用RPMI-1640基础培养液轻轻洗出悬浮细胞, 添加含GM-CSF (20 ng · mL-1) 和IL-4 (10 ng · mL-1) 及10% FBS的RPMI-1640完全培养液继续培养, 隔日半量换液1次。5 d后收集未成熟树突细胞, 加入2 μg · mL-1 LPS, 继续培养24 h后收集成熟的树突细胞 (mature dendritic cell, mDC)。
1.4 神经介素U对树突细胞活化T淋巴细胞增殖的影响 1.4.1 T淋巴细胞的分离培养Ficoll密度梯度离心法分离猪外周血淋巴细胞 (peripheral blood lymphocyte, PBL), 去除贴壁细胞, 添加100 IU · mL-1人重组IL-2置于5% CO2培养箱内孵育, 24 h后收集悬浮的细胞, 台盼蓝染色, 如果细胞活性大于95%, 可作为反应细胞。
1.4.2 神经介素U对树突细胞混合T淋巴细胞增殖的影响将1×106 mL-1成熟与未成熟的树突细胞分别置于新的6孔细胞培养板中, 每孔添加终浓度为0.01、0.1、1、10、100和1 000 nmol · L-1的NMU。另设空白对照组 (加等量RPMI-1640培养液) 与阳性对照组 (加等量的2 μg · mL-1 LPS)。24 h后分别收集数量为1×105和2×104的DC, 然后与1×105 PBL按照体积比1:1和1 : 5混合, 加入96孔板。另设PBL组作为增殖对照组。5 d后, CCK-8法检测每组的增殖变化。每处理组设4个重复孔。
1.5 神经介素U对树突细胞分泌细胞因子的影响将1×106 mL-1培养成熟的树突细胞接种于细胞培养板, 在无血清培养基中分别添加终浓度为0.01、0.1、1、10、100和1 000 nmol · L-1的NMU, 对照组加入等体积的RPMI-1640培养液, 每孔设5个重复。置于37 ℃、5% CO2培养箱中培养2、4、8和12 h后, 取细胞培养上清液, 3 000 r · min-1离心5 min后, 分装, -20 ℃冻存待测。用ELISA检测IL-4、IL-5和IL-13分泌水平。
1.6 神经介素U对树突细胞凋亡的影响将培养未成熟的树突细胞以1×106 mL-1密度加入24孔细胞培养板中, NMU组分别在每孔加入终浓度为0.1、1、10和100 nmol · L-1的NMU (用RPMI-1640培养液稀释), NMU+LPS组除加入上述浓度的NMU外, 同时每孔加入2 μg · mL-1的LPS; 阴性对照组加入等量的RPMI-1640培养液, 阳性对照组加入2 μg · mL-1 LPS。每组设置4个重复孔。5% CO2培养箱内孵育, 24 h后离心洗涤细胞3次, 再用碘化丙啶 (propidium iodide, PI) 和FITC-Annexin V共同孵育细胞15 min后, 加入200 μL工作液, 用流式细胞仪检测细胞活性, 分析细胞凋亡情况。
1.7 数据统计分析采用SPSS 19.0软件进行数据分析, 统计结果均用x±SE表示, 组间统计分析采用one-way ANOVA法。
2 结果与分析 2.1 神经介素U对DC诱导淋巴细胞增殖的作用如图 1-A所示:与对照组相比, 0.1、10、100 nmol · L-1NMU均能显著提升iDC刺激淋巴细胞增殖的作用 (P < 0.05), 而1 000 nmol · L-1NMU与2 μg · mL-1 LPS极显著促进iDC刺激淋巴细胞增殖的作用 (P < 0.01), LPS组的增殖作用最强; 在活化T淋巴细胞增殖作用方面, 除1 000 nmol · L-1 NMU组外 (P > 0.05), 其余浓度的NMU组均显著或极显著低于LPS组的增殖效果 (P < 0.05或P < 0.01)。说明1 000 nmol · L-1 NMU的作用最强。LPS作用于iDC 24 h后使其成为mDC, 不同剂量的NMU对mDC诱导淋巴细胞增殖的作用 (图 1-B)。结果显示:与对照组相比, 100和1 000 nmol · L-1 NMU可显著或极显著促进淋巴细胞的增殖 (P < 0.05, P < 0.01), 与对iDC作用效果一致。iDC与PBL按照1 : 5的体积比混合, 5 d后用CCK-8检测淋巴细胞增殖情况。结果显示:与对照组相比, 0.1~1 000 nmol · L-1 NMU均能显著或极显著促进iDC诱导的淋巴细胞增殖 (P < 0.05或P < 0.01), 且以1 nmol · L-1 NMU的作用最强 (图 1-C)。但NMU作用于mDC时, 只有10和100 nmol · L-1 NMU具有显著或极显著提高mDC刺激淋巴细胞增殖的能力 (P < 0.05或P < 0.01) (图 1-D)。
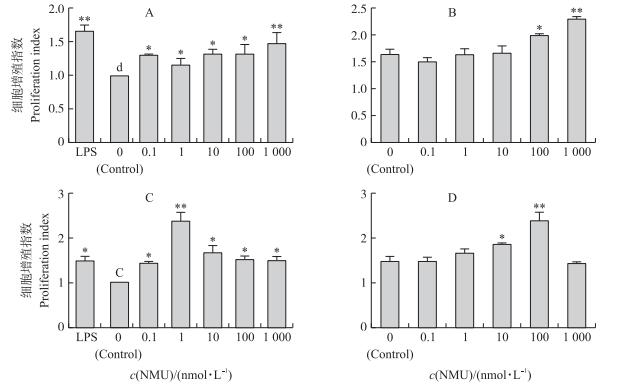
|
图 1 神经介素U (NMU) 对猪树突细胞刺激淋巴细胞增殖的影响 (n=4) Figure 1 Effect of neuromedin U (NMU) treatment on dendritic cell (DC) induced proliferation of pig allogeneic lymphocytes (n=4) 1) 未成熟DC与外周血淋巴细胞 (PBL) 分别采用1:1 (A) 、1:5 (C) 两种比例混合培养, 并且成熟DC与PBL的混合比例分别为1:1 (B) 、1:5 (D)。2) 与对照组相比Compared with the control group, *P < 0.05;* *P < 0.01. The same as follows. 1) Immature DC and peripheral blood lymphocyte (PBL) were mixed with two different ratios 1:1 (A) and 1:5 (C), respectively. And the ratios of activator mature DC to PBL were also 1:1 (B) and 1:5 (D). 2) Columns without the same superscripts are significantly different at 0.05 level, and large letters indicate significant difference at 0.01 level. The same as follows. |
以0.01~1 000 nmol · L-1 NMU作用树突细胞2~12 h, NMU刺激树突细胞分泌IL-5的量与NMU剂量和作用时间有关 (图 2)。与对照组相比, 2 h时, 仅高剂量组 (100 nmol · L-1 NMU) 极显著促进DC IL-5的分泌 (P < 0.01);随着NMU作用时间的延长, 4~12 h多个剂量显著促进IL-5的分泌, 4 h时, 中、高剂量组 (1、10、100 nmol · L-1 NMU) 可显著促进IL-5的分泌 (P < 0.05);8 h时, 1~100 nmol · L-1 NMU可极显著促进IL-5的分泌 (P < 0.01), 且1 000 nmol · L-1 NMU组IL-5的分泌显著增加 (P < 0.05);12 h时, 0.1、1、10和100 nmol · L-1 NMU极显著促进DC IL-5的分泌 (P < 0.01)。
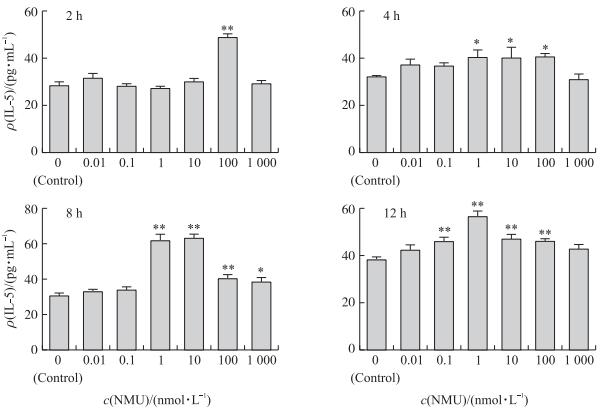
|
图 2 NMU对猪树突细胞分泌IL-5的影响 (n=5) Figure 2 Effect of NMU on secretion of IL-5 in procine DC (n=5) |
如图 3所示:NMU具有抑制树突细胞分泌IL-4的作用, 其效果与NMU的剂量和作用时间有关。与对照组相比, NMU作用于树突细胞2 h时, 中剂量 (10 nmol · L-1) NMU显著抑制IL-4的分泌 (P < 0.05), 而0.1和1 nmol · L-1 NMU则极显著抑制IL-4的分泌 (P < 0.01);4 h时, 0.01和1 nmol · L-1 NMU显著抑制IL-4的分泌 (P < 0.05), 1 000 nmol · L-1 NMU极显著抑制IL-4的分泌 (P < 0.01);8 h时, 高剂量 (100和1 000 nmol · L-1) NMU极显著抑制IL-4的分泌 (P < 0.01);12 h时, 1 000 nmol · L-1 NMU显著抑制IL-4的分泌, 而10和100 nmol · L-1 NMU则极显著抑制IL-4的分泌 (P < 0.01)。
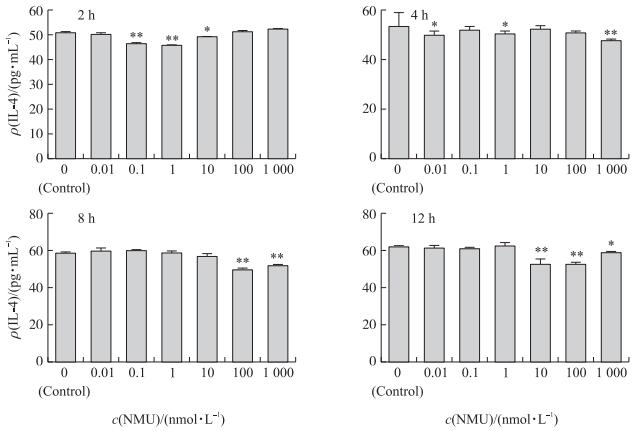
|
图 3 NMU对猪树突细胞分泌IL-4的影响 (n=5) Figure 3 Effect of NMU on secretion of IL-4 in procine DC |
由图 4可知:不同浓度的NMU影响树突细胞IL-13的分泌, 且与NMU剂量和作用时间有关 (图 4)。与对照组相比, NMU作用DC 2 h时, 低、中剂量 (0.01、1、10 nmol · L-1) NMU显著或极显著抑制IL-13的分泌 (P < 0.05或P < 0.01), 以1 nmol · L-1 NMU的抑制作用最强; 4 h时, 0.1 nmol · L-1的NMU显著抑制IL-13的分泌 (P < 0.05), 而10、100、1 000 nmol · L-1的NMU显著增加IL-13的分泌 (P < 0.05), 其中100 nmol · L-1 NMU极显著增加IL-13的分泌 (P < 0.01);8 h时, 1 nmol · L-1 NMU显著促进IL-13的分泌 (P < 0.05), 且10和100 nmol · L-1 NMU极显著增加IL-13的分泌 (P < 0.01);12 h时, 中剂量 (1和10 nmol · L-1) NMU极显著增加IL-13的分泌 (P < 0.01), 而1 000 nmol · L-1 NMU则极显著抑制IL-13的分泌 (P < 0.01)。
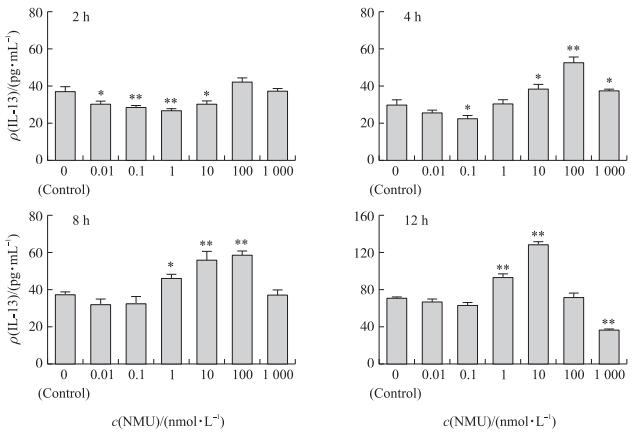
|
图 4 NMU对猪树突细胞分泌IL-4的影响 (n=5) Figure 4 Effect of NMU on secretion of IL-13 in procine DC |
NMU与NMU+LPS刺激未成熟树突细胞24 h后, 用Annexin V/PI法检测细胞凋亡情况, 结果如图 5所示:与对照组相比, 0.1、1、10和100 nmol · L-1 NMU与NMU+LPS均能极显著抑制树突细胞凋亡 (P < 0.01)。LPS作用24 h后, 能极显著降低树突细胞的凋亡率 (P < 0.01), 且NMU+LPS与NMU单独作用效果相似, 均以10 nmol · L-1 NMU与10 nmol · L-1 NMU+LPS降低凋亡的作用最强, 凋亡率最小值分别为2.383%和2.360%。与LPS组相比, 0.1~100 nmol · L-1 NMU与LPS发挥极显著的协同作用 (P < 0.01)。
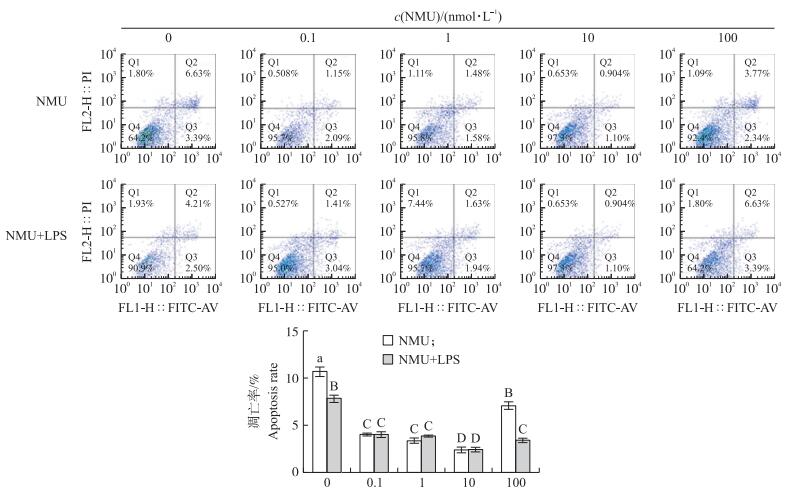
|
图 5 NMU对猪未成熟树突细胞凋亡的影响 (n=4) Figure 5 Effect of NMU treatment on apoptosis of pig immature DC (n=4) |
体内研究表明, NMU通过受体R1在肥大细胞与嗜酸性粒细胞介导的炎症反应中发挥重要作用[24-25]。最新体外研究报道, NMU可以显著增强猪PBL的活性与NK细胞杀伤K562的能力, NMUR1分布在猪的外周血淋巴细胞, 且单核细胞上也有NMUR1分布[14], 提示NMU对循环系统中免疫细胞有调控作用, 而单核细胞是骨髓系树突细胞的前体, 树突细胞是体内最重要的专职抗原递呈细胞[26], 所以研究NMU对树突细胞功能的影响, 为全面认识神经介素U免疫调节作用有重要意义。
最近研究发现, 与野生型小鼠相比, NMU-/-小鼠能够抵抗LPS介导的感染性休克, 并且其巨噬细胞的IL-6分泌急剧减少[19]。在过敏原诱导的小鼠哮喘模型中, NMU缺失小鼠气管内的嗜酸性粒细胞显著减少, 同时在P物质 (substance P, SP) 调控下, 减少气管渗出物[24]。在小鼠关节炎模型中发现了类似的现象, NMU敲除小鼠较野生型小鼠自体抗原引起的关节炎症状较轻[27]。此外, NMU通过NMUR1影响小鼠肥大细胞介导的炎症过程[25]。NMU还通过NMUR1激活嗜酸性粒细胞, 促进其迁移并附着在炎症部位, 提示NMU参与过敏性炎症[24]。NMU可刺激小鼠Th2细胞系分泌IL-4、IL-5、IL-6、IL-13等多种细胞因子[18]。综上所述, NMU可以特异性地调节机体的免疫反应。
正常状态下, 未成熟的树突细胞 (iDC) 低表达共刺激分子与黏附因子, 激活初始T细胞增殖的水平较低, 当iDC摄取抗原或受到某些刺激后, 转化为成熟的树突细胞 (mDC), 共刺激分子与黏附因子表达量升高, 能够显著刺激T细胞增殖。目前文献多以同种异体的淋巴细胞作为反应细胞, 虽然作用效果更加明显, 但无法在体外再现机体内原本的生理影响, 所以我们依据文献选取自体淋巴细胞作为混合淋巴细胞增殖的反应体系[28]。试验结果显示:在混合增殖反应体系中, 无论猪树突细胞与T淋巴细胞的数量比为1:1, 还是1:5, NMU均可以促进iDCs介导的自体淋巴细胞增殖, 提示NMU与LPS作用效果一致, 能够促进树突细胞成熟; LPS作用24 h后, DC分化为mDC, 此时NMU作用于mDC, 低剂量作用不再显著, 中、高剂量作用明显, 暗示中高剂量的NMU与LPS存在协同促进树突细胞成熟的作用。此外, 文献报道DC可以通过减少初始T细胞的增殖来实现免疫耐受[29], 提示NMU可能与一些自身免疫病的发病机制有关。
最新的研究结果表明, NMU能上调肺巨噬细胞分泌IFN-γ、IL-1β、IL-6、IL-8和TNF-α, 且能上调脾淋巴细胞分泌IL-1β、IL-5、IL-6、IL-8、TNF-α和IL-4;且低剂量NMU促进巨噬细胞分泌IL-5、IL-4、IL-13和IL-10, 却下调脾淋巴细胞分泌IL-10;高剂量NMU抑制巨噬细胞IL-5、IL-4、IL-13和IL-10的分泌, 上调脾淋巴细胞分泌IL-10;各剂量NMU均下调脾淋巴细胞IFN-γ的分泌[22]。此外, 李晓亮[23]在研究NMU对NK细胞分泌细胞因子的影响时, 发现NMU可显著上调NK细胞分泌促炎因子IFN-γ、IL-6, 但显著下调NK细胞IL-4、IL-13的分泌。本研究利用体外给予NMU刺激成熟DC, 发现NMU可以促进IL-5分泌, 且IL-5分泌量与NMU作用剂量和时间有关, 10 nmol · L-1NMU刺激8 h时, IL-5分泌量达到最大值, IL-5可以显著促进B细胞增殖并分化为浆细胞, 产生抗体, 引起体液免疫, 同时促进嗜酸性粒细胞增殖, 引发炎症反应[30]。此外, 我们还发现NMU对树突细胞分泌IL-4的抑制作用同样显著, 且随时间增加, 抑制作用越显著, 而对抗炎因子IL-13的作用呈现低剂量抑制, 中、高剂量促进, 由初期抑制, 到后期促进的现象。其中IL-4和IL-13促进抗寄生虫免疫, 也可以激活嗜酸性粒细胞引起过敏反应[31]。本试验还发现, 0.1~100 nmol · L-1 NMU可以减少DC凋亡, 从而提高树突细胞活性, NMU促进DC分泌IL-5可能与减少树突细胞凋亡有关。然而, NMU影响树突细胞分泌IL-4与IL-13的机制有待进一步研究。
综上所述, NMU能促进猪树突细胞成熟, 并引起自身淋巴细胞增殖, 在一定浓度下促进IL-5的分泌, 减少IL-4的分泌, 低浓度抑制IL-13分泌, 中、高浓度促进IL-13分泌, 且一定浓度的NMU可以减少DC凋亡, 提示NMU可作为免疫增强剂, 用于提高机体的免疫力。
| [1] | Minamino N, Kangawa K, Matsuo H. Neuromedin U-8 and U-25:novel uterus stimulating and hypertensive peptides identified in porcine spinal cord[J]. Biochem Biophys Res Commun, 1985, 130(3): 1078–1085. DOI: 10.1016/0006-291X(85)91726-7 |
| [2] | Minamino N, Sudoh T, Kangawa K, et al. Neuromedins:novel smooth-muscle stimulating peptides identified in porcine spinal cord[J]. Peptides, 1985, 6(Suppl 3): 245–248. |
| [3] | Brighton P J, Szekeres P G, Wise A, et al. Signaling and ligand binding by recombinant neuromedin U receptors:evidence for dual coupling to Galphaq/11 and Galphai and an irreversible ligand-receptor interaction[J]. Mol Pharmacol, 2004, 66(6): 1544–1556. DOI: 10.1124/mol.104.002337 |
| [4] | Helfer G, Ross A W, Morgan P J. Neuromedin U partly mimics thyroid-stimulating hormone and triggers Wnt/beta-catenin signalling in the photoperiodic response of F344 rats[J]. J Neuroendocrinol, 2013, 25(12): 1264–1272. DOI: 10.1111/jne.2013.25.issue-12 |
| [5] | Gianfagna F, Cugino D, Ahrens W, et al. Understanding the links among neuromedin U gene, beta2-adrenoceptor gene and bone health:an observational study in European children[J]. PLoS ONE, 2013, 8(8): e70632. DOI: 10.1371/journal.pone.0070632 |
| [6] | Li S, Xiao L, Liu Q, et al. Distinct functions of neuromedin u and neuromedin s in orange-spotted grouper[J]. J Mol Endocrinol, 2015, 55(2): 95–106. DOI: 10.1530/JME-15-0018 |
| [7] | Domin J, Yianyou Y G, Spokes R A, et al. The distribution, purification, and pharmacological action of an amphibian neuromedin U[J]. J Biol Chem, 1989, 264(35): 20881–20885. |
| [8] | O'Harte F, Bockmen C S, Zeng W, et al. Primary structure and pharmacological activity of a nonapeptide related to neuromedin U isolated from chicken intestine[J]. Peptides, 1991, 12(4): 809–812. DOI: 10.1016/0196-9781(91)90138-F |
| [9] | Brighton P J, Szekeres P G, Willars G B. Neuromedin U and its receptors:structure, function, and physiological roles[J]. Pharmacol Rev, 2004, 56(2): 231–248. DOI: 10.1124/pr.56.2.3 |
| [10] | Vallof D, Ulenius L, Egecioglu E, et al. Central administration of the anorexigenic peptide neuromedin U decreases alcohol intake and attenuates alcohol-induced reward in rodents[J]. Addict Biol, 2016(1): 1–12. |
| [11] | Micewicz E D, Bahattab O S, Willars G B, et al. Small lipidated anti-obesity compounds derived from neuromedin U[J]. Eur J Med Chem, 2015, 101: 616–626. DOI: 10.1016/j.ejmech.2015.07.020 |
| [12] | Nadeau-Vallee M, Boudreault A, Leimert K, et al. Uterotonic neuromedin U receptor 2 and its ligands are upregulated by inflammation in mice and humans, and elicit preterm birth[J]. Biol Reprod, 2016, 95(3): 72. DOI: 10.1095/biolreprod.116.140905 |
| [13] | Martinez V G, O'Driscoll L. Neuromedin U:a multifunctional neuropeptide with pleiotropic roles[J]. Clinical Chemistry, 2015, 61(3): 471–482. DOI: 10.1373/clinchem.2014.231753 |
| [14] | Hedrick J A, Morse K, Shan L, et al. Identification of a human gastrointestinal tract and immune system receptor for the peptide neuromedin U[J]. Mol Pharmacol, 2000, 58(4): 870–875. |
| [15] | Klechevsky E. Functional diversity of human dendritic cells[J]. Adv Exp Med Biol, 2015, 850: 43–54. DOI: 10.1007/978-3-319-15774-0 |
| [16] | Steinman R M. The dendritic cell system and its role in immunogenicity[J]. Annu Rev Immunol, 1991, 9: 271–296. DOI: 10.1146/annurev.iy.09.040191.001415 |
| [17] | Jego G, Palucka A K, Blanck J P, et al. Plasmacytoid dendritic cells induce plasma cell differentiation through type I interferon and interleukin 6[J]. Immunity, 2003, 19(2): 225–234. DOI: 10.1016/S1074-7613(03)00208-5 |
| [18] | Johnson E N, Appelbaum E R, Carpenter D C, et al. Neuromedin U elicits cytokine release in murine Th2-type T cell clone D10.G4.1[J]. J Immunol, 2004, 173(12): 7230–7238. DOI: 10.4049/jimmunol.173.12.7230 |
| [19] | Moriyama M, Matsukawa A, Kudoh S, et al. The neuropeptide neuromedin U promotes IL-6 production from macrophages and endotoxin shock[J]. Biochem Biophys Res Commun, 2006, 341(4): 1149–1154. DOI: 10.1016/j.bbrc.2006.01.075 |
| [20] |
李晓亮, 李翔, 张征, 等. 神经介素U在体外对猪淋巴细胞活性及自然杀伤细胞活性的影响[J].
南京农业大学学报, 2017, 40(1): 157–162.
Li X L, Li X, Zhang Z, et al. Effects of neuromedin U on lymphocytes and nature killer cell activities of pigs in vitro[J]. Journal of Nanjing Agricultural University, 2017, 40(1): 157–162. DOI: 10.7685/jnau.201512017 (in Chinese) |
| [21] |
李翔, 雷治海, 苏娟, 等. 猪Neuromedin U及其受体基因克隆、表达和分布[C]. 中国解剖学会第31届学术年会论文文摘汇编, 2015.
Li X, Lei Z H, Su J, et al. Cloning, distribution and expression patterns of neuromedin U and its receptors in pigs[C]. Proceedings of the 31st Annual Conference of Chinese Society for Anatomical Sciences, 2015 (in Chinese with English abstract). |
| [22] |
李翔. 神经介素U及其受体在猪体内的分布和对猪免疫调节作用的研究[D]. 南京: 南京农业大学, 2016.
Li X. The study on the distribution and immunoregulatory effect of neuromedin U and its receptor in the pig[D]. Nanjing:Nanjing Agricultural University, 2016 (in Chinese with English abstract). |
| [23] |
李晓亮. 神经介素U对猪外周血淋巴细胞和NK细胞功能的影响[D]. 南京: 南京农业大学, 2016.
Li X L. The effects of NMU on the function of peripheral blood lymphocytes and nature killer cells of pigs in vitro[D]. Nanjing:Nanjing Agricultural University, 2016 (in Chinese with English abstract). |
| [24] | Moriyama M, Fukuyama S, Inoue H, et al. The neuropeptide neuromedin U activates eosinophils and is involved in allergen-induced eosinophilia[J]. Am J Physiol Lung Cell Mol Physiol, 2006, 290(5): L971–L977. DOI: 10.1152/ajplung.00345.2005 |
| [25] | Moriyama M, Sato T, Inoue H, et al. The neuropeptide neuromedin U promotes inflammation by direct activation of mast cells[J]. J Exp Med, 2005, 202(2): 217–224. DOI: 10.1084/jem.20050248 |
| [26] |
申育萌, 赵姗姗, 杨倩. 猪扁桃体中树突状细胞的分布研究[J].
南京农业大学学报, 2014, 37(6): 125–129.
Shen Y M, Zhao S S, Yang Q. Distribution of dendritic cells in porcine tonsil[J]. Journal of Nanjing Agricultural University, 2014, 37(6): 125–129. DOI: 10.7685/j.issn.1000-2030.2014.06.018 (in Chinese) |
| [27] | Rao S M, Auger J L, Gaillard P, et al. The neuropeptide neuromedin U promotes autoantibody-mediated arthritis[J]. Arthritis Res Ther, 2012, 14(1): R29. DOI: 10.1186/ar3732 |
| [28] |
高迎, 陶志勇, 夏惠, 等. PvMSP1对树突状细胞分化成熟和功能的影响[J].
中国血吸虫病防治杂志, 2014(1): 51–55.
Gao Y, Tao Z Y, Xia H, et al. Effect of PvMSP1 on differentiation, maturation and function of dendritic cells[J]. Chin J Schisto Control, 2014(1): 51–55. (in Chinese) |
| [29] | Chung C Y, Ysebaert D, Berneman Z N, et al. Dendritic cells:cellular mediators for immunological tolerance[J]. Clin Dev Immunol, 2013, 2013(4): 865–972. |
| [30] | Takatsu K. Interleukin-5 and IL-5 receptor in health and diseases[J]. Proc Jpn Acad Ser B Phys Biol Sci, 2011, 87(8): 463–485. DOI: 10.2183/pjab.87.463 |
| [31] | Foster P S, Hogan S P, Matthaei K I, et al. Interleukin-4 and interleukin-5 as targets for the inhibition of eosinophilic inflammation and allergic airways hyperreactivity[J]. Mem Inst Oswaldo Cruz, 1997, 92(Suppl 2): 55–61. DOI: 10.1590/S0074-02761997000800009 |




