文章信息
- 李瑞霞, 陈巍, 蔡枫, 赵政, 高仁维, 隆小华
- LI Ruixia, CHEN Wei, CAI Feng, ZHAO Zheng, GAO Renwei, LONG Xiaohua
- 贵州木霉NJAU4742生物有机肥对番茄种植的影响
- Effects of Trichoderma-enriched biofertilizer on tomato plant growth and fruit quality
- 南京农业大学学报, 2017, 40(3): 464-472
- Journal of Nanjing Agricultural University, 2017, 40(3): 464-472.
- http://dx.doi.org/10.7685/jnau.201606008
-
文章历史
- 收稿日期: 2016-06-04
木霉作为土壤中一类习居真菌, 不仅对不同病原菌引起的植物连作障碍病害具有防控效果, 而且能显著促进植物生长, 提高作物产量和品质[1-2]。虽然对木霉的研究可追朔到20世纪30年代, 但很少有关于木霉活化难(微)溶性养分及其相关产品(如生物有机肥等)在盐土改良应用中的生物效应报道。随着滨海盐土面积的增加, 如何有效治理和合理利用滨海盐土成为农民和科学家关注的问题。江苏滨海盐土资源占全国滨海盐土总面积的1/4, 大丰市滨海盐土是江苏滩涂的重要组成部分, 面积达10万hm2, 是亚洲东部最大的湿地, 并且每年以50~200 m的速度向外淤涨[3]。由于滨海盐土中钠离子的竞争, 植物对钾、磷和其他营养元素的吸收减小, 磷的转移也受到抑制。此外, 大量的钠离子进入土壤胶体表面, 把土壤胶体吸附的钙离子代换出来, 致使土粒分散, 结构破坏, 土壤通透性降低, 并影响微生物的活性[4]。近年来, 施用有机肥对改良滨海盐土起到举足轻重的作用。吕丽媛等[5]研究发现使用蚯蚓肥对蓖麻苗的抗氧化酶活性、渗透调节、叶绿素含量、生物量及根系比重等生理生态特征都有很好的调控作用。谷思玉等[6]发现生物有机肥能够降低盐渍土pH值, 增加土壤有机质含量, 减缓土壤碱解氮、有效磷的消耗, 显著提高速效钾含量, 降低土壤盐分, 提高土壤阳离子含量, 降低土壤碱化度。Altomare等[7]发现哈茨木霉T-22可有效活化难溶性矿物质(如Fe2O3、MnO2、Zn、磷酸盐)。因此, 本试验研究贵州木霉NJAU4742及其生物有机肥对滨海盐土番茄种植的影响, 探究木霉在该类型土壤中的定殖情况及其对本地微生物区系的调节作用, 同时结合土壤理化性质和相关酶活性的变化, 评价木霉及其生物有机肥应用于盐土改良、土壤培肥的可行性, 为滨海盐土开发提供技术支持。
1 材料与方法 1.1 供试材料 1.1.1 供试菌株和番茄品种贵州木霉NJAU4742(中国普通微生物菌种保藏中心(CGMCC)accession No.3308) 由南京农业大学江苏省固体有机废弃物资源化高技术研究重点实验室提供。番茄品种为‘合作903’(Lycopersicon esculentum Mill), 由上海市长征良种实验场育成。
1.1.2 木霉生物有机肥的制备NJAU4742的孢子悬液制备参照文献[8], 并用血球计数板计数。试验所用有机肥是由液体氨基酸肥料和鸡粪堆肥按1:1(V:W)的比例混合而成。液体氨基酸肥料是由江阴市联业生物科技有限公司生产, 以病死猪作为主要原料, 经强酸、高温、高压处理而制成的液体氨基酸肥料。鸡粪堆肥是由江苏田娘农业科技有限公司提供, 将鸡粪原料经过30~70 ℃发酵近20 d制成。生物有机肥是由NJAU4742与有机肥二次发酵制成, 具体过程如下:将1 L NJAU4742孢子悬液接种至10 kg有机肥中, 堆置混匀发酵5 d, 每天定时搅拌保持通气并维持湿度于60%~65%。二次发酵完成后肥料中NJAU4742的最终活菌数达到106 CFU·g-1以上。各肥料的理化指标见表 1。
| 肥料Fertilizer | pH | 全氮/(g·kg-1)Total nitrogen | 全磷/(g·kg-1)Total phosphorus | 全钾/(g·kg-1)Total potassium |
| 鸡粪堆肥Chicken manure | 7.66 | 13.68 | 19.64 | 15.49 |
| 液体氨基酸Amino acid fertilizer | 5.40 | 46.53 | 1.83 | 0.38 |
| 有机肥Organic fertilizer | 7.42 | 17.38 | 19.45 | 17.59 |
| 木霉生物有机肥Biofertilizer | 6.39 | 21.36 | 20.21 | 18.58 |
试验在江苏省大丰市盐土大地海洋生物产业科技园大棚内进行, 土壤基本理化性质为:pH8.22, EC 0.54 ms·cm-1, 盐分0.136%, 硝态氮14.8 mg·kg-1, 铵态氮17.4 mg·kg-1, 速效磷3.6 mg·kg-1, 速效铁0.08 mg·kg-1, 速效铜0.04 mg·kg-1, 速效锰0.03 mg·kg-1, 速效锌0.02 mg·kg-1。
1.2 试验设计试验采用大棚种植番茄的形式, 设置5个处理, 分别为:不施用肥料处理(CK), 农户习惯用化肥量处理(CF), 75%的农户习惯用化肥量配施木霉NJAU4742生物有机肥(BF), 75%的农户习惯用化肥量配施普通有机肥(OF), 75%的农户习惯用化肥量配施木霉NJAU4742孢子液, 每株灌根5 mL(SS)。农户习惯化肥用量为:基施复合肥(N、P、K的质量分数均为15%)750 kg·hm-2, 25 d后追施复合肥375 kg·hm-2, 生育期75 d; BF和OF处理则是在此基础上减施25%化肥, 基施木霉微生物有机肥或普通有机肥1 880 kg·hm-2, 其他田间管理均保持一致。小区面积4 m2(2 m×2 m), 行距0.5 m, 株距0.5 m, 各小区栽种番茄苗16株, 采用随机区组排列, 每个处理设置5个重复, 共计20个小区, 春秋两季重复种植。
1.3 测试项目与方法 1.3.1 样品采集和产量统计从番茄始果期开始每日采摘各处理鲜果, 待75 d生育期满, 采摘其余所有番茄鲜果, 统计各处理产量, 即为本季番茄的总产量。番茄果实置于冰盒内带回, 进行品质分析。同时在番茄的苗期、花期、收获期分3次取土样:将植株小心从土中取出, 去除大部分土壤, 将根系周围的土壤收集保存入自封袋, 该土样即为根际土[9]。采集的土样一部分保存于-80 ℃用于DNA提取; 一部分存于4 ℃用于测量可培养微生物含量和铵态氮、硝态氮含量; 还有一部分风干后分别过20目和100目筛, 用于测量土壤养分。
1.3.2 番茄品质的测定采用高效液相色谱HPLC(Agilent 1200) 法分别测定番茄果实维生素C[10-11]、硝酸盐含量[12], 色谱柱为Agilent ZORBAX SB-C18反相柱(9.4 mm×150 mm, 5 μm); 采用考马斯亮蓝G-250比色法[13]测定蛋白质含量; 采用蒽酮比色法[14]测定还原糖含量。
1.3.3 土壤指标的测定采用流动分析仪(德国BRAN+LUEBBE, AutoAnalyzer3) 测定土壤铵态氮和硝态氮含量[15]; 采用0.5 mol·L-1 NaHCO3浸提-钼蓝比色法[16]测定土壤有效磷含量; 采用DTPA浸提法和ICP-OES法测定土壤有效铁、锰、铜、锌含量[16-17]; 采用pH计(Sartorius普及型, PB-10) 测定土壤pH值; 采用电导率仪(雷磁, DDS-307A)测定土壤EC值; 采用电导法[16]测定土壤盐分含量。
1.3.4 土壤酶活性的测定根据酶促反应类型将土壤酶分为水解酶、氧化还原酶、转移酶和裂合酶等。采用3, 5-二硝基水杨酸比色法[18]测定水解酶中的蔗糖酶活性; 采用靛酚比色法[19]测定脲酶活性; 采用磷酸苯二钠比色法[18]测定磷酸酶活性; 采用容量法[18]测定过氧化氢酶活性; 采用2, 2-联吡啶比色法[20]测定Fe3O2还原酶活性。脲酶、磷酸酶、铁还原酶分别用每克干土在每小时内产生的NH4+、苯酚、Fe2+的量表示; 过氧化氢酶以消耗0.000 2 mol·L-1高锰酸钾的量表示。
1.3.5 番茄根际土壤中微生物数量的测定采用实时荧光定量PCR(Real-time PCR)测定土壤总细菌及真菌数量。细菌定量PCR扩增采用引物337F(5′-GACTCCTACGGGAGGCWGCAG-3′)和518R(5′-GTATTACCGCGGCTGCTGG-3′); 真菌定量PCR扩增采用引物[21]ITS(5′-TCCGTAGGTGAACCTGCGG-3′)和5.8S(5′-CGCTGCGTTCTTCATCG-3′)。扩增条件:10 μL SYBR® Premix Ex Taq, 0.4 μL引物, 0.4 μL ROX Reference Dye Ⅱ, 2 μL模板DNA和6.8 μL无菌水。PCR扩增程序:95 ℃ 30 s; 95 ℃ 5 s, 60 ℃ 34 s, 循环40次。木霉定量PCR扩增采用引物[22]ITS1F(5′-TACAACTCCCAAACCCAATGTGA-3′)和ITS2R(5′-CCGTTGTTGAAAGTTTTGATTCATTT-3′), TaqMan探针为ITS1 TM-037 Fam(5′-AACTCTTTTTGTATACCCCCTCG-CGGGT-3′)。扩增条件:10 μL Premix Ex Taq(Probe qPCR), 0.8 μL TaqMan探针, 0.4 μL引物, 0.2 μL ROX Reference Dye Ⅱ, 2 μL模板DNA和6.2 μL无菌水。PCR扩增程序: 95 ℃ 30 s; 95 ℃ 3 s, 60 ℃ 40 s, 循环40次。样品及标线DNA设3个重复, 所有PCR反应均同时在荧光定量PCR仪(7500, Applied Biosystem, USA)上进行。根据各样品阈值(CT值)计算每纳克DNA形成的拷贝数, 结果以每纳克DNA的拷贝数对数化后的数值(lg(copies·ng-1))表示。
1.4 数据统计与分析所有试验数据用SPSS 16.0软件和ANOVA法进行数据统计和方差分析, 显著性水平设定0.05水平。荧光定量的结果采用Applied Biosystems中的7500 system SDS Software, version 1.4软件进行分析。
2 结果与分析 2.1 不同施肥处理番茄植株生物量及产量从表 2可以看出:BF处理番茄苗期各生物量指标均高于其他处理, 且除了与OF处理的茎粗和地上部干质量没有显著性差异外, 与其他处理的各项指标均差异显著。BF和OF处理番茄产量最高, 其次是CF和SS处理, 但4个处理之间没有显著性差异; 相对于CF处理, BF和OF处理分别增产15%和16%, 但SS处理则减产4%。CK番茄生物量和果实产量均显著低于其他4个处理。
| 处理 Treatments |
株高/cm Shoot height |
茎粗/mm Diameter values |
地上部鲜质量/g Fresh weight of shoot |
地上部干质量/g Dry weight of shoot |
产量/kg Yield |
| CK | 11.00±0.70c | 2.71±0.28c | 6.19±0.35c | 0.71±0.04c | 3.27±0.60b |
| CF | 12.75±0.35c | 3.77±0.11b | 8.44±0.73b | 1.14±0.03bc | 5.83±0.54a |
| BF | 20.50±1.41a | 5.57±0.09a | 14.3±1.50a | 2.93±0.99a | 6.73±0.97a |
| OF | 17.75±0.35b | 5.32±0.20a | 9.32±0.02b | 1.95±0.08ab | 6.75±0.35a |
| SS | 15.00±0.01c | 4.60±0.18b | 7.94±0.04bc | 1.00±0.02bc | 5.58±0.75a |
| 注: 1) CK:不施肥Non-fertilizer application; CF:农户习惯施肥Application of 100% recommended chemical fertilizer; BF:75%的农户习惯施肥量配施木霉NJAU4742生物有机肥Application of 75% chemical fertilizer plus Trichoderma-enriched biofertilizer; OF:75%的农户习惯施肥量配施普通有机肥Application of 75% chemical fertilizer plus organic fertilizer; SS:75%农户施肥量配施木霉孢子悬液Application of 75% chemical fertilizer plus Trichoderma spore suspension. 2) 不同小写字母表示在0.05水平差异显著。The different letters indicate significant difference at 0.05 level. The same as follows. |
|||||
从图 1可以看出:BF处理番茄果实的蛋白质含量最高且显著高于CK和CF处理, 分别为CK和CF处理的7.6和3.4倍, 其次为OF和SS处理, 但与BF处理没有显著差异; BF和SS处理番茄果实硝酸盐含量低于CF处理, 分别减少22%和23%, 且BF和SS处理可溶性糖含量高于其他3个处理, 为CK的2.6和2.0倍, 相对于CF处理分别增加43%和15%;BF和OF处理果实的维生素C含量显著高于CK和CF处理, 相对于CF处理, BF、OF和SS处理维生素C含量分别增加30%、33%和16%。
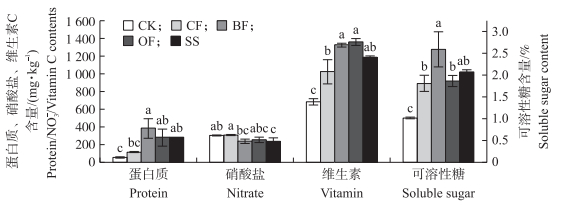
|
图 1 不同施肥处理对番茄果实品质的影响 Figure 1 Effects of different fertilizer treatments on the tomato fruit quality |
从图 2可知:不同施肥处理对番茄土壤速效养分含量有显著影响。其中苗期番茄土壤铵态氮含量远高于花期和收获期采样值, 且在番茄生长苗期BF处理铵态氮含量除与OF处理无显著差异, 均显著低于其他3个处理; 花期和收获期番茄土壤中各处理的铵态氮含量均小于5 mg·kg-1。土壤硝态氮含量随着番茄种植时间的增加和追肥的影响变化较大, 除CK不施肥处理低于土壤环境背景值外, 其他4个处理硝态氮含量均有不同程度的增加, 且3个生育期4个处理硝态氮含量均有显著性差异, 其中在番茄生长苗期土壤硝态氮含量从高到低的处理依次为BF、SS、OF、CF, 在番茄花期土壤硝态氮含量从高到低的处理依次为CF、BF、OF、SS, 在番茄收获期土壤硝态氮含量从高到低的处理依次为CF、SS、BF、OF。在番茄生长苗期和收获期BF和OF处理土壤有效磷含量显著高于其他3个处理, 其中相对于CF处理, 苗期BF和OF处理有效磷含量分别增加了70%和65%, 收获期有效磷含量分别为CF处理的2.3和2.8倍, 花期各处理有效磷含量从高到低的处理依次为SS、BF、OF、CF、CK。
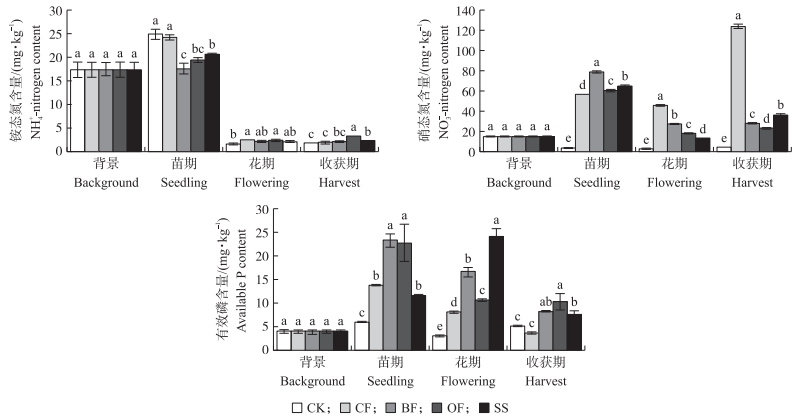
|
图 2 不同施肥处理对番茄根际土铵态氮、硝态氮及有效磷含量的影响 Figure 2 Effects of different fertilizer treatments on the soil ammonium-N, nitrate-N and available-P in tomato rhizosphere |
从图 3可知:不同施肥处理均能不同程度地增加土壤中速效微量元素的含量, CF处理增幅最小, 显著低于其他4个处理。在番茄生长苗期, 与CK相比, SS处理中除有效锌含量无差异, 其他3种微量元素均显著高于CK, 且BF和OF处理的4种微量元素均显著高于CK, 但两者之间除有效锌含量有显著差异外, 其他2种微量元素没有显著差异。花期各个处理土壤有效铁含量表现出显著性差异, 且有效铁含量从高到低的处理依次为OF、BF、CK、SS、CF; 土壤有效铜含量也表现出显著性差异, 且有效铜含量从高到低的处理依次为CK、OF、BF、SS、CF; OF处理土壤有效锰含量最高, 其次为BF和CK处理; BF和OF处理有效锌含量显著高于CK和SS处理, 但两者之间没有显著性差异。在收获期, BF和OF处理土壤有效铁和有效锌含量无差异, 且与其他3个处理差异显著; 而BF和SS处理中的有效锰和有效铜含量显著高于其他3个处理, 但两者之间差异不显著, 且相对于CK, BF和SS处理的有效锰含量分别增加了10%和22%, 有效铜含量分别增加了28%和36%。
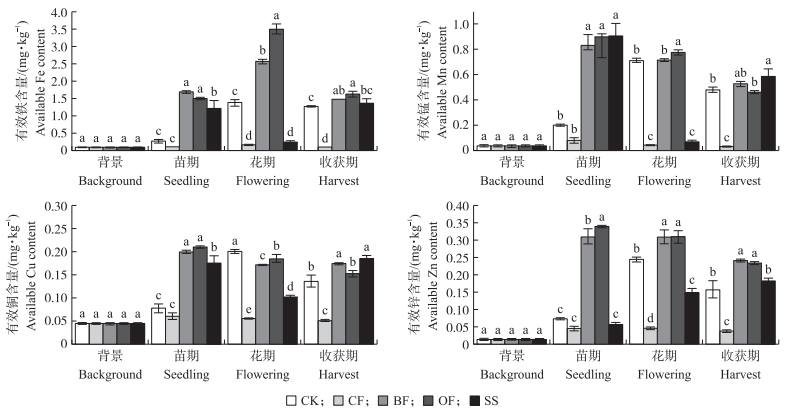
|
图 3 不同施肥处理番茄根际土速效微量养分含量的变化 Figure 3 The change of microelement in tomato rhizosphere soil in different fertilizer treatments |
从表 3可以看出:不同施肥处理均能不同程度地降低土壤pH值。电导率(EC)值随着施肥量的增加而增加, 苗期BF和OF处理的电导率高于CF处理, 收获期时CF处理的电导率最高, 而CK也随着追肥的处理其电导率值增加。土壤盐分含量与电导率呈正相关关系, 因此其变化与电导率一致。
| 处理 Treatments |
pH | EC/(ms·cm-1) | 盐分含量/% Salinity content | |||||||||||
| 背景 Background |
苗期 Seedling |
花期 Flowering |
收获期 Harvest |
背景 Background |
苗期 Seedling |
花期 Flowering |
收获期 Harvest |
背景 Background |
苗期 Seedling |
花期 Flowering |
收获期 Harvest |
|||
| CK | 8.22 | 7.45 | 8.18 | 8.14 | 0.54 | 0.46 | 0.34 | 0.73 | 0.14 | 0.12 | 0.08 | 0.18 | ||
| CF | 8.22 | 7.51 | 7.94 | 7.68 | 0.54 | 0.67 | 0.82 | 2.46 | 0.14 | 0.17 | 0.20 | 0.62 | ||
| BF | 8.22 | 7.52 | 8.00 | 7.85 | 0.54 | 1.06 | 0.80 | 1.60 | 0.14 | 0.28 | 0.20 | 0.40 | ||
| OF | 8.22 | 7.80 | 8.02 | 7.88 | 0.54 | 1.02 | 0.54 | 1.55 | 0.14 | 0.25 | 0.14 | 0.39 | ||
| SS | 8.22 | 7.84 | 8.11 | 8.04 | 0.54 | 0.83 | 0.72 | 1.36 | 0.14 | 0.21 | 0.18 | 0.34 | ||
从图 4可知:不同施肥处理抑制了土壤铁还原酶活性, 提高土壤脲酶、磷酸酶和过氧化氢酶活性。与CF处理相比, BF、OF和SS处理土壤脲酶、磷酸酶和过氧化氢酶活性均显著提高, 其中BF处理土壤脲酶活性在不同采样时期均最高, 且苗期和花期BF处理土壤磷酸酶的活性也显著高于其他处理, 收获期时OF处理的磷酸酶活性最高; 花期时BF处理过氧化氢酶活性显著高于OF和SS处理, 但在苗期和收获期三者之间差异不显著。与CK相比, 其他4个处理显著降低土壤铁还原酶活性, 花期BF处理铁还原酶活性显著高于其他3个处理; 相对于CF处理, 收获期BF、OF和SS处理均显著提高铁还原酶活性, 分别增加58.6%、41.9%和38.2%, 但三者之间没有显著性差异。
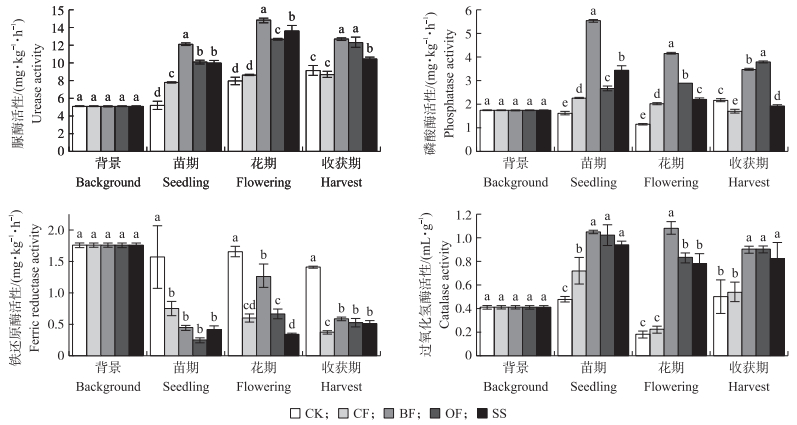
|
图 4 不同施肥处理番茄根际土土壤酶活性的变化 Figure 4 The change of soil enzyme activity in tomato rhizosphere soil in different fertilizer treatments |
由图 5可知:在番茄不同生长期不同施肥处理土壤中总细菌、总真菌和木霉的数量差异显著。各生长期的真菌总数相对于背景值均有不同程度的增加, 且各处理之间差异显著。在花期和收获期, BF和OF处理中土壤细菌总数显著低于其他3个处理。番茄不同生长时期BF木霉处理土壤的数量显著高于SS处理。
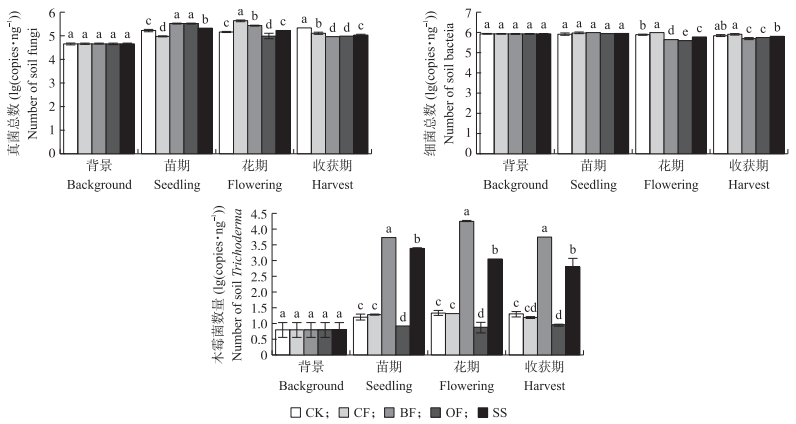
|
图 5 不同施肥处理番茄根际土真菌、细菌及木霉数量的变化 Figure 5 Change of bacteria, fungi and Trichoderma in tomato rhizosphere soil in different fertilizer treatments |
本试验研究了减少25%的化肥施用量配施贵州木霉NJAU4742生物有机肥对滨海盐土大棚番茄产量、果实品质及土壤养分、土壤酶活性、根际微生物数量的影响。田间试验表明配施生物有机肥能有效促进番茄产量的提高和果实品质的改善。这与程万莉等[23]的研究结果一致, 3 000 kg·hm-2的生物有机肥替代10%、20%、30%的化肥与当地习惯化肥施用量处理相比, 马铃薯的产量提高6%~12%。吕丽媛等[5]研究施用蚯蚓粪有机肥可以提高盐碱地蓖麻叶片的可溶性糖和可溶性蛋白含量。推断是生物有机肥中含有大量的功能微生物NJAU4742, 且外源蛋白的添加增加了肥料的养分、游离氨基酸和多肽的含量[24]。
普通化肥施用虽然可以为植物提供直接利用的氮、磷、钾等速效营养元素, 但过量施用化肥不仅增加土壤的电导率, 还会导致土壤中盐分离子积累, 并增加土壤中的盐分含量。当土壤盐分含量在0.5%以上时, 对盐分极敏感作物的产量可能受到影响。而生物有机肥施入土壤后, 因大量微生物参与活动, 吸收固定了土壤中的有机小分子和盐基离子, 会使土壤中的盐分含量不会像施入化肥一样不断增加。在土壤微生物及土壤酶活性影响下能产生大量有机酸, 土壤pH值呈下降趋势, 不断释放出土壤中的迟效态元素, 能有效改善土壤的理化性质, 提高作物根系抗逆性[25]。本试验CF处理的土壤有效磷及微量元素含量远不及BF和SS处理。与OF处理相比, BF和SS处理土壤中硝态氮和有效磷含量显著升高, 但速效微量养分含量无显著差异, 这与木霉对难(微)溶性矿物元素有一定的溶解能力相关[26]。
土壤酶活性是土壤新陈代谢的重要肥力指标[27]。其中脲酶、过氧化氢酶、磷酸酶从本质上反映了土壤中氮、碳、磷的转化强度, 以及pH和通透性等多种状态[28]。张长华等[29]研究表明有机、无机配施处理的土壤酶活性增强, 有益于土壤养分转化和保持土壤健康。本研究中配施微生物有机肥显著提高土壤脲酶、磷酸酶和过氧化氢酶活性, 且在番茄花期和收获期铁还原酶活性显著增高, 且与OF处理相比, BF土壤脲酶、磷酸酶、铁还原酶和过氧化氢酶等活性均显著升高, 表明有机肥中添加有益微生物木霉菌剂, 可以促进土壤中与氮、碳、磷及铁等相关酶活性的转化, 从而促使土壤中迟效态养分得以分解为被植物吸收利用的速效养分。这与吕卫光等[30]的研究结果一致, 施用有机肥可以提高土壤脲酶、蛋白酶及酸性磷酸酶的活性。
有机肥与无机肥配合施用能够提高土壤的微生物活性, 改变土壤微生物区系。邱登林等[31]研究应用黄绿木霉T1010制剂后, 能促进土壤中有益微生物的生长, 且樱桃番茄等的立枯病感病指数降低36.36%, 侧根数比常规化肥处理增加1.44倍。Feng等[22]研究发现, 添加木霉孢子液和木霉生物有机肥处理中, 木霉在根际土壤的定殖数达到103 copies·g-1。本试验中, BF和SS处理土壤木霉数达到103 copies·ng-1以上, 显著高于其他处理, 且相对于背景值显著提高, 功能菌木霉在根际土壤中的定殖能力可以影响根际土壤微生物群落的变化。与OF处理相比, BF处理番茄产量和部分生物量指标差异性不显著, 但土壤速效养分含量、土壤酶活性及根际土壤木霉属数量均有显著性差异。之后的研究我们会加大配施肥料的用量, 并在滨海盐土土壤中做长期定位点试验, 并将探究木霉在滨海盐土有效定殖并促进番茄生长的机制。
综上所述, 与农户习惯施肥1 125 kg·hm-2的CF处理相比, 减少25%的化肥施用量同时配施1 880 kg·hm-2的贵州木霉微生物有机肥(BF处理), 不仅能提高番茄产量, 改善番茄果实品质, 而且提高了肥料的利用率, 进而能够改善环境和培育土壤。
| [1] | Hyakumachi M. Plant growth promoting fungi from turfgrass rhizosphere with potential for disease suppression[J]. Soil Microorg, 1994, 44: 53–68. |
| [2] | Benitez T, Rincon A M, Limon M C, et al. Biocontrol mechanisms of Trichoderma strains[J]. Int Microbiol, 2004, 7(4): 249–260. |
| [3] |
顾进伟. 大丰沿海滩涂演变及驱动力研究[D]. 南京: 南京师范大学, 2014.
Gu J W. The evolution and driving force of the Dafeng coastal beach[D]. Nanjing:Nanjing Normal University, 2014(in Chinese with English abstract). |
| [4] |
董莉莉, 龚成霞, 苏卫国. 浅谈盐碱地的修复改良[J].
天津科技, 2015, 42(8): 68–70.
Dong L L, Gong C X, Su W G. On restoration and improvement of saline-alkali soil[J]. Tianjin Science and Technology, 2015, 42(8): 68–70. (in Chinese) |
| [5] |
吕丽媛, 伍玉鹏, 孙振钧, 等. 有机肥对盐碱土蓖麻苗生长的调控作用[J].
中国农业大学学报, 2013, 18(3): 73–80.
Lü L Y, Wu Y P, Sun Z J, et al. Effect of organic fertilizer on growth of castor bean seedling under saline sodic soil[J]. Journal of China Agricultural University, 2013, 18(3): 73–80. (in Chinese) |
| [6] |
谷思玉, 耿泽铭, 汪睿, 等. 不同配比生物有机肥对盐渍土改良效果的分析[J].
东北农业大学学报, 2014, 45(7): 26–30.
Gu S Y, Geng Z M, Wang R, et al. Effect of different ratio of bio-organic fertilizer on saline-alkali soil improvement[J]. Journal of Northeast Agricultural University, 2014, 45(7): 26–30. (in Chinese) |
| [7] | Altomare C, Norvell W A, Bjorkman T, et al. Solubilization of phosphates and micronutrients by the plant-growth-promoting and biocontrol fungus Trichoderma harzianum Rifai 1295-2[J]. Applied Environmental Microbiology, 1999, 65(7): 2926–2933. |
| [8] | Yedidia I, Srivastva A K, Kapulnik Y, et al. Effect of Trichoderma harzianum on microelement concentrations and increased growth of cucumber plants[J]. Plant Soil, 2001, 235: 235–242. DOI: 10.1023/A:1011990013955 |
| [9] | Hervás A, Landa B, Datnoff L E, et al. Effects of commercial and indigenous microorganisms on Fusarium wilt development in chickpea[J]. Biological Control, 1998, 13(3): 166–176. DOI: 10.1006/bcon.1998.0659 |
| [10] |
李建设, 高艳明, 李文娆, 等. 不同肥料配合对温室迷你黄瓜硝酸盐含量及品质的影响[J].
土壤肥料, 2005(4): 36–39.
Li J S, Gao Y M, Li W R, et al. Response of quality and NO3--N contents in fruits of greenhouse mini cucumber to the different fertilizer combinations[J]. Soil Fertilizer, 2005(4): 36–39. (in Chinese) |
| [11] |
宁德生, 梁小燕, 方宏. 高效液相色谱法对罗汉果中维生素C含量的检测[J].
食品科学, 2010, 31(23): 311–313.
Ning D S, Liang X Y, Fang H. Determination of the content of vitamin C in Siraitia grosvenorii fruits by HPLC[J]. Food Science, 2010, 31(23): 311–313. (in Chinese) |
| [12] |
余海兰, 方京京. 高效液相色谱法同步测定蔬菜中硝酸盐和亚硝酸盐含量[J].
湖南农业科学, 2010(7): 97–99.
Yu H L, Fang J J. Simultaneous determination of nitrate and nitrite in vegetable by HPLC[J]. Hunan Agricultural Sciences, 2010(7): 97–99. (in Chinese) |
| [13] |
胡琼英, 狄洌.
生物化学实验[M]. 北京: 化学工业出版社, 2008.
Hu Q Y, Di L. Biochemistry Experiment[M]. Beijing: Chemical Industry Press, 2008. (in Chinese) |
| [14] |
李合生, 孙群, 赵世杰.
植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.
Li H S, Sun Q, Zhao S J. Principle and Technology of Plant Physiology and Biochemistry Experiment[M]. Beijing: Higher Education Press, 2000. (in Chinese) |
| [15] | Raigon M D, Garcia M P, Maquieira A, et al. Determination of available nitrogen(nitic and ammoniacal)in soils by flow-injection analysis[J]. Analusis, 1992, 20(8): 483–487. |
| [16] |
鲍士旦.
土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2000: 178-200.
Bao S D. Soil and Agricultural Chemistry Analysis[M]. 3rd ed. Beijing: China Agriculture Press, 2000: 178-200. (in Chinese) |
| [17] |
刘雷, 杨帆, 刘足根, 等. 微波消解ICP-AES法测定土壤及植物中的重金属[J].
环境化学, 2008, 27(4): 511–514.
Liu L, Yang F, Liu Z G, et al. Determination of heavy metals in soils and plants with microwave digestion and ICP-AES[J]. Environmental Chemistry, 2008, 27(4): 511–514. (in Chinese) |
| [18] |
关松萌.
土壤酶及其研究法[M]. 北京: 中国农业出版社, 1986.
Guan S M. Soil Enzyme and Its Research Method[M]. Beijing: China Agriculture Press, 1986. (in Chinese) |
| [19] |
李振高, 骆永明, 滕应.
土壤与环境微生物研究法[M]. 北京: 科学出版社, 2008.
Li Z G, Luo Y M, Teng Y. Research Methods of Soil and Environmental Microorganism[M]. Beijing: Science Press, 2008. (in Chinese) |
| [20] |
梁永超, 马同生, 朱克贵. 水稻土的研究——Ⅺ.低湿地土壤上发育的水稻土铁还原酶活性初探[J].
南京农业大学学报, 1989, 12(1): 77–82.
Liang Y C, Ma T S, Zhu K G. On the ferric-reductase activity of paddy soils derived from the wetland[J]. Journal of Nanjing Agricultural University, 1989, 12(1): 77–82. DOI: 10.7685/j.issn.1000-2030.1989.01.014 (in Chinese) |
| [21] |
沈宗专. 香蕉抑病型土壤微生物区系研究[D]. 南京: 南京农业大学, 2015.
Shen Z Z. Characterization of microbial community in banana disease suppressive soils[D]. Nanjing:Nanjing Agricultural University, 2015(in Chinese with English abstract). |
| [22] | Feng C, Wei C, Zhong W, et al. Colonization of Trichoderma harzianum strain SQR-T037 on tomato roots and its relationship to plant growth, nutrient availability and soil microflora[J]. Plant Soil, 2015, 388: 337–350. DOI: 10.1007/s11104-014-2326-z |
| [23] |
程万莉. 有机肥替代部分化肥对马铃薯根际微生物群落功能多样性的影响[D]. 兰州: 甘肃农业大学, 2015.
Cheng W L. Effects of partial replacement of chemical fertilizer by organic manure on functional diversity of microbial community in potato rhizosphere[D]. Lanzhou:Gansu Agricultural University, 2015(in Chinese with English abstract). |
| [24] | Näsholm T, Ekblad A, Nordin A, et al. Boreal forest plants take up organic nitrogen[J]. Nature, 1998, 392: 914–916. DOI: 10.1038/31921 |
| [25] |
李北齐, 邵红涛, 孟瑶, 等. 生物有机肥对盐碱土壤养分、玉米根际微生物数量及产量影响[J].
安徽农学通报, 2011, 17(23): 99–102.
Li B Q, Shao H T, Meng Y, et al. The effect of bio-organic fertilizer on the nutrient of saline soils, number of microorganisms in rhizosphere and production of maize[J]. Anhui Agric Sci Bull, 2011, 17(23): 99–102. DOI: 10.3969/j.issn.1007-7731.2011.23.047 (in Chinese) |
| [26] | Li R X, Cai F, Pang G, et al. Solubilisation of phosphate and micronutrients by Trichoderma harzianum and its relationship with the promotion of tomato plant growth[J]. PLoS ONE, 2014, 10(6): e0130081. |
| [27] | Yuan L, Bao D J, Jin Y, et al. Influence of fertilizers on nitrogen mineralization and utilization in the rhizosphere of wheat[J]. Plant Soil, 2011, 343: 187–193. DOI: 10.1007/s11104-010-0640-7 |
| [28] |
王天平, 周连仁. 不同改良措施对盐渍化土盐分和酶活性的影响[J].
东北农业大学学报, 2011, 42(5): 91–94.
Wang T P, Zhou L R. Effect of different reclamation measures on salinity and enzyme activity in saline-alkali soil[J]. Journal of Northeast Agricultural University, 2011, 42(5): 91–94. (in Chinese) |
| [29] |
张长华, 蒋卫, 蒋玉梅, 等. 施肥对烤烟产量、品质及土壤养分、酶活性的影响[J].
中国土壤与肥料, 2012(3): 77–80.
Zhang C H, Jiang W, Jiang Y M, et al. Influence of fertilization on the yield and quality of flue-cured tobacco, soil nutrient and enayme activity[J]. Soil and Fertilizer Sciences in China, 2012(3): 77–80. DOI: 10.11838/sfsc.20120316 (in Chinese) |
| [30] |
吕卫光, 黄启为, 沈其荣, 等. 不同来源有机肥及有机肥与无机肥混施对西瓜生长期土壤酶活性的影响[J].
南京农业大学学报, 2005, 28(4): 68–71.
Lü W G, Huang Q W, Shen Q R, et al. The effect of organic fertilizer and organic-inorganic fertilizer application on soil enzymes activities during watermelon growing period[J]. Journal of Nanjing Agricultural University, 2005, 28(4): 68–71. DOI: 10.7685/j.issn.1000-2030.2005.04.015 (in Chinese) |
| [31] |
邱登林, 阴卫军, 陈建爱, 等. 黄绿木霉T1010对日光温室土壤微生物群落的影响[J].
山东农业科学, 2011(1): 59–62.
Qiu D L, Yin W J, Chen J A, et al. Effects of Trichoderma aureoviride T1010 on soil microflora in solar greenhouse[J]. Shandong Agricultural Sciences, 2011(1): 59–62. (in Chinese) |




