文章信息
- 李明振, 廖学文, 屈汶辉, 黄克和, 缪德年, 张克春
- LI Mingzhen, LIAO Xuewen, QU Wenhui, HUANG Kehe, MIAO Denian, ZHANG Kechun
- 一株抑菌型地衣芽孢杆菌的快速分离与鉴定及其对4株耐药致病菌的抑制作用
- Rapid isolation and identification of Bacillus licheniformis with bacteriostatic ability and its antibacterial activity against four resistant pathogens
- 南京农业大学学报, 2017, 40(2): 325-331
- Journal of Nanjing Agricultural University, 2017, 40(2): 325-331.
- http://dx.doi.org/10.7685/jnau.201602005
-
文章历史
- 收稿日期: 2016-02-03
2. 上海市农业科学院上海种猪工程技术研究中心, 上海 201106;
3. 上海市奶牛研究所, 上海 200436
2. Shanghai Engineering Research Center of Breeding Pig, Shanghai Academy of Agricultural Sciences, Shanghai 201106, China;
3. Shanghai Institute of Dairy Science, Shanghai 200436, China
长期以来由致病性大肠杆菌、沙门氏菌等致病菌引起的仔猪腹泻是导致仔猪生长停滞和仔猪高死亡率的重要原因之一。目前对于细菌性仔猪腹泻的防治除了加强母猪饲料管理及用多价疫苗免疫等措施外, 主要还是应用抗生素预防和治疗[1]。但抗生素的滥用已造成病原菌产生耐药性、动物性产品药物残留和环境污染等不利影响, 并已严重威胁到人类的健康和食品安全。美国及欧盟等已经对抗生素的使用做出了严格限制, 甚至是禁止使用[2]。目前抗生素替代品主要有酶制剂、有机酸、中草药类和微生态制剂等几种, 其中微生态制剂产品的研究和应用最为广泛。2006年, 农业部658号公告《饲料添加剂品种目录》中规定能够利用于微生态制剂的芽孢杆菌属种有枯草芽孢杆菌和地衣芽孢杆菌等[2-3]。芽孢杆菌在一定条件下产生芽孢, 对高温、高压、强酸碱、挤压等不良环境的抵抗力很强, 并且具有很强的蛋白酶、淀粉酶等活性, 是开发新型微生态多功能剂的首选菌种。研究人员通常先根据芽孢耐高温的特性从植物、土壤、粪便中分离获得新的解淀粉芽孢杆菌、枯草芽孢杆菌和短小芽孢杆菌等芽孢杆菌, 发酵后再测定其抗菌活性、酶解活性等生物活性, 工作量大, 耗时长, 而且仅有少部分分离菌株的发酵浓缩液表现出一定的抗菌作用[4]。本试验结合耐热和抗菌要求, 建立了一种快速筛选具有抗菌活性的芽孢杆菌的方法, 应用该方法从苏州太湖边的土壤中分离到一株具有较好抗菌活性的地衣芽孢杆菌BB11, 其发酵上清液对猪源性致病大肠杆菌K88、K99、987P和沙门氏菌C782均具有明显的抑杀作用, 为开发取代抗生素防治仔猪细菌性腹泻的多功能动物微生态制剂提供了依据。
1 材料与方法 1.1 材料 1.1.1 样品来源新鲜土壤样品采自从苏州太湖边土壤表层下10~15 cm处。
1.1.2 主要试剂DNA提取试剂盒、琼脂糖凝胶DNA回收试剂盒、pLB零背景快速克隆试剂盒购自北京天根生物科技公司; Prime STAR HS DNA聚合酶、DNA标准品 (DL2000) 等购自TaKaRa公司; 抗生素类药敏纸片 (批号080905)、葡萄糖产酸、木糖产酸、甘露醇产酸、硝酸盐还原等生化试剂购自杭州天和微生物制剂公司; 吲哚试验、柠檬酸盐试验、MR-VP试验等生化试剂购自青岛日水生物公司; 其他试剂均为国产或进口分析纯。
1.1.3 主要仪器PCR仪购自北京东林昌盛生物科技有限公司; 全自动数码凝胶图像分析系统 (Tanon-2500)、核酸电泳仪 (EPS-100) 购自上海天能科技有限公司; 电热恒温摇床培养箱 (WIS-20R) 购自DAIHAN Scientific Co. Ltd; 奥林巴斯CX21生物显微镜购自北京中显恒业有限公司。
1.1.4 主要病原菌大肠杆菌K88(C83901)、K99(C83922)、987P (C83915)、K12D31, 沙门氏菌C782购自中国兽药监察所, 并由上海市农业科学院畜牧兽医研究所保存。
1.2 具有抑菌活性芽孢杆菌的分离筛选取5 g苏州太湖边新鲜的土壤样品置于有10 mL灭菌生理盐水的玻璃瓶中, 混匀, 80 ℃水浴加热10 min, 静置后取100 μL上清液涂于混有大肠杆菌K12D31的抑菌筛选板上 (细菌浓度1.0×107 CFU·mL-1), 37 ℃培养16~24 h后, 挑取抑菌圈明显的疑似单菌落, 进一步划线培养得到纯化的单菌落。挑取单菌落于LB液体培养基中, 培养24 h后离心, 取上清液过滤除菌。将牛津杯分别放在混有沙门氏菌C782和大肠杆菌K12D31琼脂板上 (细菌浓度1.0×107 CFU·mL-1), 加入100 μL发酵上清液, 37 ℃培养24 h, 测量其抑菌圈直径。
1.3 分离菌株的初步鉴定 1.3.1 形态鉴定将抑菌活性最好的分离菌BB11株进行纯培养, 观察细菌菌落的形态特征, 并将疑似单菌落扩增后的菌液进行革兰氏染色和芽孢染色, 镜检[5]。
1.3.2 菌株生理生化试验根据《常见细菌系统鉴定手册》[6]和《伯杰细菌鉴定手册》[7]对疑似单菌落扩增后的细菌进行生化鉴定。
1.4 菌株分子生物学鉴定 1.4.1 16S rRNA和gyrB基因的PCR鉴定根据DNA提取试剂盒说明书对疑似芽孢杆菌提取DNA。由上海捷瑞生物工程公司设计并合成一对通用16S核糖体RNA基因 (16S rRNA) 引物和一对DNA促旋酶B亚基编码基因 (DNA gyrase B subunit, gyrB) 简并引物 (表 1), 进行PCR反应。PCR反应体系:模板DNA 3 μL, 上、下游引物各0.5 μL, 5×Prime STAR Buffer (Mg2+ Plus)5 μL, dNTP Mixture 2 μL, DNA聚合酶0.25 μL, 补ddH2O至25 μL。PCR反应条件:98 ℃ 2 min; 98 ℃ 10 s, 55 ℃ 10 s, 72 ℃ 1 min, 30个循环; 72 ℃ 10 min。16S rRNA和gyrB基因的预期扩增片段的长度分别约为1 500~1 700和1 200~1 300 bp。切胶后回收。
| 目的基因Target gene | 引物名称Primer name | 引物序列 (5′→3′) Primer sequence |
| 16S rRNA | BA16S1 BA16S2 |
AGAGTTTGATCATGGCTCAG GGTTACCTTGTTACGACTT |
| gyrB | GYRB1 GYRB2 |
GAAGTCATCATGACCGTTCTGCAYGCNGGNGGNAARTTYGA AGCAGGGTACGGATGTGCGAGCCRTCNACRTCNGCRTCNGTCA |
根据琼脂糖凝胶DNA回收试剂盒说明书对BB11的16S rRNA和gyrB基因的PCR琼脂凝胶DNA进行回收, 然后根据pLB零背景快速克隆试剂盒说明书把回收的PCR产物与克隆载体连接, 然后转化到大肠杆菌TOP10感受态细胞中, 挑菌, 扩增培养, 进行菌落PCR快速鉴定。将鉴定的阳性克隆菌液1 mL送至上海美吉生物医药科技有限公司进行测序。
1.4.3 16S rRNA和gyrB基因系统发育树的构建将菌株BB11的16S rRNA和gyrB基因的序列结果在GenBank数据库中进行BLAST相似性对比, 把相似度高的序列以FASTA格式下载, 用软件ClustalX进行多核酸序列对比, 最后运用软件MEGA 6.0, 采用邻接法 (neighbor-joning, N-J) 构建系统发育树[8]。
1.5 4株致病菌的药敏试验采用K-B药物纸片扩散法, 将14种药敏纸片分别紧贴到含致病性大肠杆菌K99、K88、987P和沙门氏菌C782 4株细菌的营养琼脂板 (细菌浓度1.0×107 CFU·mL-1), 每个平板贴4张药敏纸片, 37 ℃培养18~24 h后用游标卡尺测量抑菌圈直径。药敏判断标准根据美国临床和实验室标准协会 (CLSI) 标准 (2010年) 所载受试药对质控菌的抑菌环直径范围作为试验质控标准[9]。
1.6 发酵上清液的抑菌效果评价试验组:分别吸取40 μL菌液 (大肠杆菌K88、K99、987P和沙门氏菌C782) 加入到1 mL发酵上清液中, 补LB液体培养基使总体积为4 mL (细菌浓度约1.0×107 CFU·mL-1); 抗生素对照组:分别吸取40 μL菌液 (K88、K99、987P和C782), 40 μL 0.1 mg·mL-1的庆大霉素, 加入LB液体培养基使总体积为4 mL (细菌浓度约1.0×107 CFU mg·mL-1, 庆大霉素终浓度为1 μg·mL-1); 另设不加药正常对照组。各组菌均在37 ℃, 180 r·min-1条件下培养, 分别于0、4、8、12、16、20、24和28 h取样, 根据GB 4789.3—2010 《食品安全国家标准食品微生物学检验大肠菌群计》用平板菌落计数法测定每毫升菌液中的活菌数 (CFU·mL-1)。根据各组活菌浓度计算抑菌率。抑菌率=(对照组细菌数-试验组细菌数)/对照组细菌数×100%。
1.7 数据统计分析试验数据用SPSS 16.0软件统计进行方差分析, 差异显著性检验采用Duncan′s多重比较法。
2 结果与分析 2.1 菌株的分离与形态鉴定 2.1.1 菌株的分离分离菌株在指示菌大肠杆菌K12D31板上生长良好, 24 h生成灰白色无光泽、表面粗糙皱褶、边缘不整齐的菌落, 菌落周围形成透明的抑菌带。共筛选出BB11、BB12、BB21、BB22、BB23和BB24共6株具有抑菌活性的菌株。挑取单菌落培养后取上清液离心, 过滤除菌, 测定其对沙门氏菌C782和大肠杆菌K12D31的抗菌活性, 结果BB11发酵上清液对两种指示菌的抑菌圈直径最大 (表 2), 因此对BB11进行重点研究。
| 菌株 Strains |
抑菌圈直径/mm Inhibitory zone diameter | |
| 沙门氏菌C782 Salmonella C782 |
大肠杆菌K12D31 E.coli K12D31 |
|
| BB11 | 15.34 | 6.26 |
| BB12 | 8.67 | 3.12 |
| BB21 | 9.01 | 3.69 |
| BB22 | 10.11 | 4.78 |
| BB23 | 7.34 | 3.99 |
| BB24 | 9.39 | 4.04 |
将BB11单菌落扩增后的菌液进行革兰氏染色和芽孢染色, 油镜镜检, 形态为单个、成对或链状的长杆状的菌体, 革兰氏染色为阳性。对BB11进行芽孢染色, 结果观察有绿色中生的椭圆状芽孢。
2.2 BB11菌株的生理生化试验BB11菌株接触酶反应、V-P反应、糖发酵 (葡萄糖、木糖、L-阿拉伯糖) 产酸反应、甘露醇产酸反应、水解淀粉、硝酸盐还原、吲哚反应、明胶水解反应都为阳性; 菌株在50和70 g·L-1 NaCl条件下成长状况良好, 在100 g·L-1 NaCl条件下生长欠佳 (表 3)。根据《常见细菌系统鉴定手册》和《伯杰细菌鉴定手册》, 初步判定菌株BB11为芽孢杆菌属。
| 特征试验 Characteristics test |
反应结果 Result |
| 接触酶Catalase | + |
| V-P反应V-P reaction | + |
| 葡萄糖Glucose | + |
| L-阿拉伯糖L-arabinose | + |
| D-木糖D-xylose | + |
| 水解淀粉Starch hydrolysis | + |
| 硝酸盐还原Nitrate reduction | + |
| 甘露醇Mannitol | + |
| 吲哚反应Indole reaction | + |
| 明胶水解Gelatin hydrolysis | + |
| 厌氧生长Anaerobic growth | + |
| 50 g·L-1 NaCl | + |
| 70 g·L-1 NaCl | + |
| 100 g·L-1 NaCl | - |
| 注:“+、-”分别代表反应结果为阳性或阴性。“+, -”stand for positive or negative of the reaction results. | |
菌株BB11的16S rRNA条带大小在1 500 bp左右, gyrB基因条带大小在1 200 bp左右。将回收的DNA片段亚克隆到TOP10感受态细胞中, 挑菌, 进行菌落PCR快速鉴定, 将阳性菌送至公司测序。
2.3.2 基于16S rRNA序列的系统发育分析结果菌株BB11的16S rRNA序列与地衣芽孢杆菌(Bacillus licheniformis)、枯草芽孢杆菌 (B.subtilis)、解淀粉芽孢杆菌 (B.amyloliquefaciens)、短小芽孢杆菌 (B.pumilus) 和索诺拉沙漠芽孢杆菌 (B.sonorensis)的16S rRNA序列有很高的同源性, 其相似度都在99%。选其中17株参考序列以邻接法构建系统发育进化树 (图 1), 发现BB11同时与B.licheniformis BCRC 15413(DQ993676.1) 和B.subtilis IARI-JR-68(KF055012.1) 聚集在一起, 而且相似度在99%以上。通过16S rRNA基因序列分析可得BB11可能为地衣芽孢杆菌或枯草芽孢杆菌, 但不能够确定到具体的种。
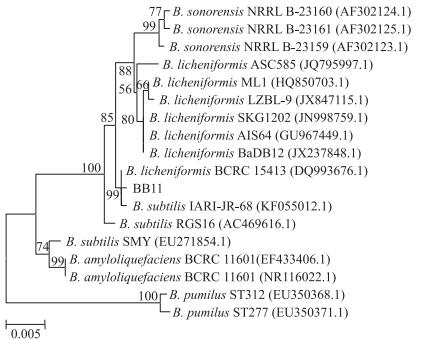
|
图 1 基于16S rRNA构建BB11与参考株的基因系统发育进化树 Figure 1 The developmental gene phylogenetic tree of BB11 with the reference strains based on 16S rRNA 地衣芽孢杆菌Bacillus licheniformis; 枯草芽孢杆菌B.subtilis; 解淀粉芽孢杆菌B.amyloliquefaciens; 短小芽孢杆菌B.pumilus; 索诺拉沙漠芽孢杆菌B.sonorensis |
同时使用16S rRNA和gyrB基因序列分析能够更准确地鉴定未知菌株[10]。菌株BB11的gyrB序列与地衣芽孢杆菌、短小芽孢杆菌和Bacillus sonorensis的gyrB序列有较高的同源性, 与枯草芽孢杆菌的相似度很低。根据以gyrB同源性为基础的基因系统发育进化树 (图 2), BB11与B.licheniformis BCRC 12826(DQ309323.1) 的相似度达到100%, 可以确定菌株BB11为地衣芽孢杆菌。
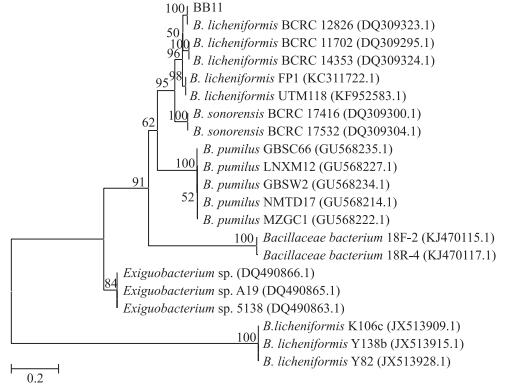
|
图 2 基于gyrB构建BB11与参考株的基因系统发育进化树 Figure 2 The developmental gene phylogenetic tree of BB11 with the reference strains based on gyrB |
致病性大肠杆菌K88、K99、987P和沙门氏菌C782对对苯唑青霉素、青霉素和氨苄青霉素都具有抗药性, 对红霉素、卡那霉素、林可霉素、克林霉素、新霉素等抗菌药物表现出不同程度的抗药性, 仅对庆大霉素、链霉素、氯霉素、四环素和环丙沙星敏感 (表 4)。
| 药名 Medicament |
病原菌菌株Pathogenic strains | |||
| 987P | K88 | K99 | C782 | |
| 庆大霉素Gentamicin | S | S | S | S |
| 链霉素Streptomycin | S | S | S | S |
| 苯唑青霉素Bristopen | — | R | S | R |
| 红霉素Erythromycin | — | — | S | — |
| 链霉素Ofloxacin | S | S | R | S |
| 氯霉素Chloramphenicol | S | S | S | S |
| 青霉素G peillin G | R | R | R | R |
| 卡那霉素Kanamycin | I | S | R | S |
| 林可霉素Lincomycin | — | — | R | R |
| 四环素Tetracycline | S | S | S | S |
| 氨苄青霉素Ampicillin | R | R | R | R |
| 新霉素Neomycin | I | I | I | I |
| 克林霉素Clindamycin | R | R | S | — |
| 环丙沙星Ciprofloxacin | S | S | S | S |
| 注:S:敏感Susecptible; R:耐药Resistance; I:中度敏感Intermediate susecptible。 | ||||
以培养时间为横坐标, 以lg[c/(CFU·mL-1)]为纵坐标作图 (图 3)。随着培养时间的延长, BB11株发酵上清液组的活菌数不断减少, 说明发酵上清液对K88、K99、987P和C782这4株致病菌具有一定的抑杀作用。培养24 h后BB11株发酵上清液对4株致病菌的抑菌率分别为99.98%、99.99%、99.99%和99.98%, 庆大霉素 (1 μg·mL-1) 对4株致病菌的抑菌率均为99.99%, 各组间无显著差异 (P>0.05)。
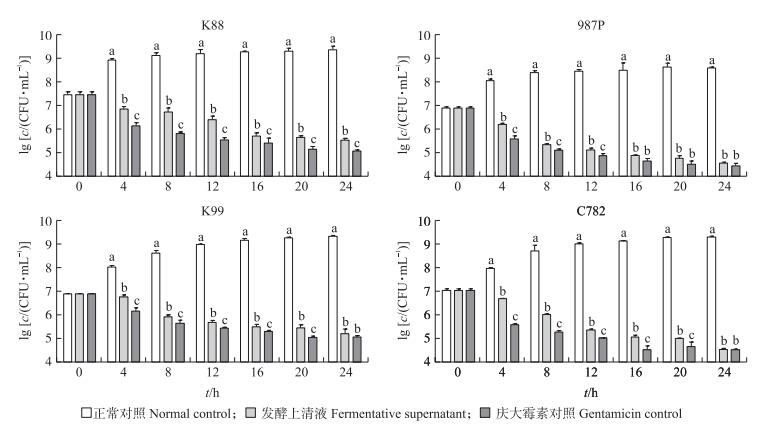
|
图 3 BB11发酵上清液的抑菌效果 Figure 3 The inhibition effect of BB11 fermentation supernatant on different bacteria 不同字母表示在相同时间点各组间存在显著差异 (P < 0.05)。 Different letters mean significant difference among the three groups at the same time point (P < 0.05). |
芽孢杆菌分布广泛, 动物肠道、粪便、土壤、湖泊海洋中都有大量存在。其传统的鉴定方法, 如菌落菌株的形态学鉴定和理化性质的鉴定等容易出现假阳性结果, 而且费时费力。单独的16S rRNA基因序列分析在细菌鉴定上效果显著, 但是由于16S rRNA的高度保守性, 对相似率极高的近缘种无法做进一步的区分[11]。在鉴定枯草群芽孢杆菌时, 如枯草芽孢杆菌、地衣芽孢杆菌、解淀粉酶芽孢杆菌和短小芽孢杆菌等, 由于其在16S rRNA序列上具有高度相似性, 检测准确性有时不太稳定[12-14]。本试验在16S rRNA基因序列分析的过程中, 菌株BB11同时与B.licheniformis BCRC 15413(DQ993676.1) 和B.subtilis IARI-JR-68(KF055012.1) 聚集在一起, 而且相似度在99%以上, 可以判定其为地衣芽孢杆菌或枯草芽孢杆菌, 与Myron等[15]所做的试验结果类似。鉴于细菌的多种功能基因在系统进化过程中具有非常保守的特点, 使用能够代表种以及种以下水平的基因序列分析方法, 如gyrA、gyrB、rpoA、rpoB等基因序列分析方法, 能够更准确对菌株的进行鉴定[12]。李献梅等[14]指出以gyrB为靶标能够在种水平上区分枯草芽孢杆菌近缘种。本试验对gyrB基因序列分析结果表明, BB11主要与地衣芽孢杆菌聚集在一起, 并且与B.licheniformis BCRC 12826(DQ309323.1) 的相似度达到100%, 确定BB11为地衣芽孢杆菌。本文结合16S rRNA和gyrB基因信息, 通过系统发育分析, 快速准确地鉴定了土壤来源的抑菌型芽孢杆菌菌株BB11为地衣芽孢杆菌。
仔猪腹泻是现代集约化养猪生产过程中最常见的一种多因素性疾病, 而以致病性大肠杆菌、沙门氏菌和猪痢疾密螺旋体为主的细菌性仔猪腹泻最为常见, 导致饲料转化率低, 成活率下降, 生长发育停滞等, 给养猪业带来巨大的经济损失[1-2]。王红宁[1]对猪场分离的495株30种不同血清型的致病性大肠杆菌进行药敏试验, 发现大肠杆菌存在广泛耐药性, 并以多重耐药性为主, 其中3耐及3耐以上的菌株占99.12%。本试验显示, 致病性大肠杆菌K88、K99、987P和沙门氏菌C782对对苯唑青霉素、青霉素和氨苄青霉素都具有抗药性, 对红霉素、卡那霉素、林可霉素、克林霉素、新霉素等抗菌菌药物表现出不同程度的抗药性。复杂的血清型和耐药性的产生导致了多价疫苗免疫和抗生素治疗的局限性, 而且抗生素药物残留和环境污染已严重威胁到人类的健康。因此, 具有抑制病原菌作用又可改善动物生长性能的芽孢杆菌微生态制剂越来越受到人们的关注。微生态制剂主要是通过优势种群作用、生物夺氧作用、生物拮抗作用和产生有益代谢产物及抑菌物质等作用来增加胃肠道有益微生物数量, 抑制有害微生物的生长, 达到减少动物疾病发生及提高动物生产性能的目的[16]。蔡雁等[4]先根据芽孢耐高温的特性分离芽孢杆菌, 发酵后根据其抗菌活性筛选抗菌菌株, 发现仅有少部分分离菌株的发酵浓缩液表现出一定的抗菌作用。本试验结合耐热和抗菌要求, 将样品热处理后直接铺在混有指示菌的琼脂平板上, 建立了一种快速筛选具有抗菌活性的芽孢杆菌的方法, 应用该方法分离到一株具有强抗菌活性的地衣芽孢杆菌BB11, 其发酵上清液经4倍稀释后仍然对具有多重耐药性的猪源性致病大肠杆菌K88、K99、987P和沙门氏菌C782表现出明显的抑杀作用, 为进一步开发防治仔猪细菌性腹泻的多功能动物微生态制剂奠定了基础。
| [1] |
王红宁. 仔猪腹泻成因及综合防治技术措施[J].
中国畜牧杂志, 2006, 42(6): 58–60.
Wang H N. The cause and integrated control of piglet diarrhea[J]. Chinese Journal of Animal Science, 2006, 42(6): 58–60. (in Chinese) |
| [2] |
魏秀丽, 丁焕忠. 饲用抗生素替代品[J].
养禽与禽病防治, 2004(9): 29–30.
Wei X L, Ding H Z. Antibiotics alternatives of fodder[J]. Poultry and Poultry Disease Prevention, 2004(9): 29–30. (in Chinese) |
| [3] |
王丽芳, 满达虎. 2株地衣芽孢杆菌抗逆性及益生性的研究[J].
饲料添加剂, 2009(4): 18–21.
Wang L F, Man D H. Study on the Stress resistance and probiotic of the two Bacillus licheniformis[J]. Feed Additives, 2009(4): 18–21. (in Chinese) |
| [4] |
蔡雁, 郝勃, 喻子牛. 抗动物病原菌芽孢杆菌的筛选、初步鉴定和抗菌活性[J].
微生物学杂志, 2005, 25(9): 19–22.
Cai Y, Hao B, Yu Z N. Creening, initial identification of anti-animal-pathogenic Bacillus strains and their antibiotic activity[J]. Journal of Microbiology Sept, 2005, 25(9): 19–22. (in Chinese) |
| [5] |
姚火春.
兽医微生物学实验指导[M]. 北京: 中国农业出版社, 2009.
Yao H C. Experimental Guidance of Veterinary Microbiology[M]. Beijing: China Agriculture Press, 2009. (in Chinese) |
| [6] |
东秀珠, 蔡妙英.
常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 43-65.
Dong X Z, Cai M Y. Identification Manual of Common Bacterial Systems[M]. Beijing: Science Press, 2001: 43-65. (in Chinese) |
| [7] |
布坎南RE, 吉本斯NE.
伯杰细菌鉴定手册[M]. 8版. 北京: 科学出版社, 1984: 729-759.
Buchanan R E, Gibbons N E. Bergey's Manual of Systematic Bacteriology[M]. 8th ed. Beijing: Science Press, 1984: 729-759. (in Chinese) |
| [8] | Tamura K, Dudley J, Nei M, et al. MEGA4:molecular evolutionary genetics analysis (MEGA) software version 4.0[J]. Mol Biol Evol, 2007, 24(8): 1596–1599. DOI: 10.1093/molbev/msm092 |
| [9] | Wayne P. Performance standards for antimicrobial susceptibility testing[C]. 9th Informational Supplement NCCLS Document M100-S9. National Committee for Clinical Laboratory Standards, 2010. |
| [10] | Kǜpfer M, Kuhnert P, Korczak BM. Genetic relationships of Aeromonas strains inferred from 16S rRNA, gyrB and rpoB genes equences[J]. Int J Syst Evol Microbiol, 2006, 5: 2743–2751. |
| [11] | Wang L, Lee F L, Tai C J, et al. Comparison of gyrB gene sequences, 16S rRNA gene sequences and DNA-DNA hybridization in the Bacillus subtilis group[J]. Int J Syst Evol Micr, 2007, 57: 1846–1850. DOI: 10.1099/ijs.0.64685-0 |
| [12] | Yamada S, Ohashi E, Agata N, et al. Cloning and nucleotide sequence analysis of gyrB of Bacillus cereus, B.thuringiensis, B.mycoides, and B.anthracis and their application to the detection of B.cereus in rice[J]. Appl Environ Microbiol, 1999, 65(4): 1483–1490. |
| [13] |
马增军, 芮萍, 张军辉, 等. 猪源多杀性巴氏杆菌分离鉴定与药敏试验[J].
畜牧与兽医, 2015, 47(7): 93–95.
Ma Z J, Rui P, Zhang J H, et al. Isolation, identification and drug sensitivity test of Pasteurella multocida isolated from swine[J]. Animal Husbandry and Veterinary Medicine, 2015, 47(7): 93–95. (in Chinese) |
| [14] |
李献梅, 王小芬, 杨洪岩, 等. 促旋酶B亚单位基因gyrB在鉴别细菌近缘种中的应用[J].
微生物学报, 2008, 48(5): 701–706.
Li X M, Wang X F, Yang H Y, et al. Application of gyrB in the identification of closely related bacteria[J]. Acta Microbiologica Sinica, 2008, 48(5): 701–706. (in Chinese) |
| [15] | Myron T, Duc L, Satomi M, et al. gyrB as a phylogenetic discriminator for members of the Bacillus anthracis-cereus-thuringiensis group[J]. Journal of Microbiological Methods, 2004, 56: 383–394. DOI: 10.1016/j.mimet.2003.11.004 |
| [16] |
尹清强, 李小飞, 常娟, 等. 微生态制剂对哺乳动物和断奶仔猪生产性能的影响及作用机理研究[J].
动物营养学报, 2011, 23(4): 622–630.
Yin Q Q, Li X F, Chang J, et al. Probiotics effects on performance and mechanisms of action in suckling and weaner piglets[J]. Chinese Journal of Animal Nutrition, 2011, 23(4): 622–630. (in Chinese) |




