文章信息
- 王育伟, 吴文达, 施志玉, 任喆, 何成华, 张海彬
- WANG Yuwei, WU Wenda, SHI Zhiyu, REN Zhe, HE Chenghua, ZHANG Haibin
- 脱氧雪腐镰刀菌烯醇对大鼠胃液组成的影响
- Effects of deoxynivalenol on the composition of gastric juice in rats
- 南京农业大学学报, 2017, 40(2): 320-324
- Journal of Nanjing Agricultural University, 2017, 40(2): 320-324.
- http://dx.doi.org/10.7685/jnau.201601015
-
文章历史
- 收稿日期: 2016-01-10
2. 南京农业大学动物医学院, 江苏 南京 210095;
3. 福建农林科技大学动物科学学院, 福建 福州 350002
2. College of Veterinary Medicine, Nanjing Agricultural University, Nanjing 210095, China;
3. College of Animal Science, Fujian Agricultural and Forestry University, Fuzhou 350002, China
脱氧雪腐镰刀菌烯醇 (deoxynivalenol, DON) 是粮食和饲料中常见的真菌毒素之一, 由禾谷镰刀菌 (Fusarium graminearum)、粉红镰刀菌 (Fusarium reseum) 等在小麦生长期间产生的单端孢霉烯B族毒素。DON在全球饲料中具有较高的检出率[1], Liu等[2]发现我国河北省DON检出率达到91.5%, 每日摄入量 (probable daily intakes, PDI) 达到了0.56 μg·kg-1。DON主要造成猪等免疫抑制、肠损伤和神经系统障碍。尤其是DON对消化系统毒性损伤的机制是目前国内、外研究热点[3]。国际癌症研究机构 (International Agency for Research on Cancer, IARC) 将DON列为三类致癌物之一, FDA/WHO推荐人类食用小麦产品中的DON每日最大耐受摄入量 (provisional maximum tolerable daily intake, PMTDI) 为1 μg·kg-1, 欧盟将人类直接食用的谷物、淀粉等中DON限量标准规定为0.75 mg·kg-1。
DON的吸收部位集中在胃、十二指肠上端和回肠等[4], 因此这些组织也是DON最主要的毒性靶组织。以往研究表明DON会降低猪肠绒毛高度、黏膜厚度等[5]; 对caco-2和IPEC-1等细胞系的研究发现染毒细胞TEER值、claudin-4表达和紧密连接蛋白明显下降[6]。有研究发现DON抑制大鼠的胃排空[7]。胃液组成不但影响排空功能, 还直接影响胃消化和营养吸收, DON是否对胃液组成影响却鲜有报道。胃液组成受“胃泌素-ECL细胞-壁细胞轴”(gastrin-ECL cell-parietal cell axis) 调控[8], 主要成分是壁细胞的氢-钾-腺苷三磷酸酶泵 (H+-K+-ATPase) 分泌的盐酸和主细胞分泌的胃蛋白酶等。本研究借助Kurasawa等[9]建立的幽门结扎模型研究DON对Wistar大鼠胃液组成的影响, 从而揭示DON对胃液分泌功能的毒性机制。
1 材料与方法 1.1 试验材料清洁级Wistar大鼠24只, 雌、雄各半 (购于扬州大学比较动物医学中心); DON标准品 (美国Sigma公司, 1 mg), 三氯乙酸、BSA (中国国药集团), 酪氨酸、福林-酚试剂 (购自南京奥多福尼生物科技有限公司), 1 mg·mL-1的K+、Na+、Ca2+和Zn2+标准溶液 (国家标准样品网)。
1.2 胃液采集将Wistar大鼠24只 (7周齡, 220 g, 雌、雄各半) 随机分为4组, 分笼饲养在恒温、恒湿的试验动物房内。移除垫料并禁食24 h, 以0、1、5和25 mg·kg-1的DON浓度按体质量对大鼠进行灌胃染毒。自由活动0.5 h后按Kurasawa等[9]推荐的方法进行幽门结扎术。4 h后处死大鼠, 沿腹白线打开腹腔收集胃液, 将其3 500 r·min-1离心10 min后吸取上清液于4 ℃保存。
1.3 胃液分泌测定胃液pH值用精密pH计进行测定。胃液体积(V总) 由胃液上清体积 (V上清) 和胃残渣内的液体体积 (V残) 按式 (1) 进行计算; V残利用烘干法根据水分丢失质量 (m) 及密度 (ρ) 进行计算 (见式 (2))。公式如下:
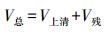
|
(1) |
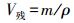
|
(2) |
胃蛋白酶活性参考Kurasawa等[9]的测定方法并进行改进, 取离心胃液0.1 mL, 加入1%牛血清白蛋白 (0.1 mol·L-1 HCl配制)1 mL。37 ℃温孵20 min, 加入1%三氯乙酸2 mL, 并在沸水中加热5 min, 冷却后过滤, 取滤液0.2 mL。加入2 mL 0.1 mol·L-1 HCl、3.5 mL NaOH溶液 (0.6 mol·L-1), 同时加入稀释后的福林-酚试剂1.5 mL, 混匀, 静置10 min, 测定光密度值 (D680)。根据酪氨酸标准曲线计算胃蛋白酶活性, 以μmol·h-1酪氨酸表示胃蛋白酶排出量。
胃蛋白酶活性 (IU)=生成的总酪氨酸 (μmol)/消化反应时间 (min)
1.5 黏蛋白含量测定黏蛋白含量利用阿利新蓝法进行测定。取胃液1 mL, 加1%阿利新蓝0.1 mL、pH5.8的柠檬酸磷酸缓冲液3.3 mL, 再加蒸馏水至5.0 mL, 混匀。设标准管1只, 内加阿利新蓝0.1 mL、pH5.8的柠檬酸磷酸缓冲液3.3 mL, 用蒸馏水稀释至5.0 mL。将样品及标准管于20 ℃室温静置24 h后, 以2 500 r·min-1离心10 min, 取上清液, 利用分光光度计测定在615 nm处的吸光值A615。所得A615值与加入胃液中阿利新蓝A615值的差值, 即胃液黏蛋白成分的结合量。
1.6 ICP法测定金属离子含量吸取1 mL胃液加入消解管内, 加入1 mL HNO3, 混匀后放入消解罐内在微波消解仪上进行微波消解。胃液的消解程序:分别在85、135、185和230 ℃消解2、4、5和15 min。将K+、Na+、Ca2+和Zn2+标准溶液 (1 mg·mL-1), 用去离子水分别稀释成0、10、50和200 μg·mL-1 4个浓度梯度, 通过ICP-AES法测定其吸光度, 分别绘制K+、Na+、Ca2+和Zn2+的浓度标准曲线。根据标准曲线分别测定0、1、5和25 mg·kg-1DON染毒组的胃液中K+、Na+、Ca2+和Zn2+的浓度。
1.7 统计分析所有数据利用SPSS 18.0软件进行单因素方差分析 (ANOVA), 数据以x±SE形式表示。
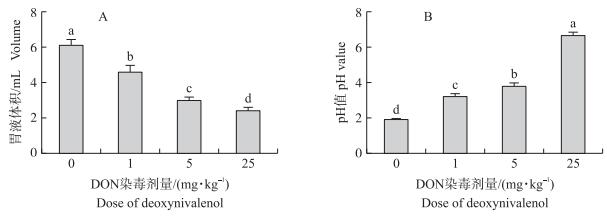
2 结果与分析 2.1 DON对胃液分泌的影响 2.1.1 DON对胃液分泌量的影响由图 1可知:随DON染毒剂量增加, 大鼠胃液分泌量显著下降 (P < 0.05), 相对于对照组的6.1 mL, 1、5和25 mg·kg-1 DON染毒组大鼠的胃液体积分别下降了24.88%、51.39%和60.88%(图 1-A), 胃液分泌与DON染毒剂量呈负相关。同时结果表明, 胃液pH值随着DON剂量增加而上升。对照组胃液pH值为1.93, 而1、5和25 mg·kg-1 DON染毒后胃液pH值分别提高到3.20、3.81和6.70(图 1-B), 说明DON染毒明显破坏了大鼠胃液的酸性环境。
|
图 1 DON对大鼠胃液体积和pH值的影响 Figure 1 Effects of deoxynivalenol on the volume and pH value of gastric juice in rats 不同小写字母表示组间在0.05水平上差异显著。 No same letters mean significantly different between groups at 0.05 level. The same as follows. |
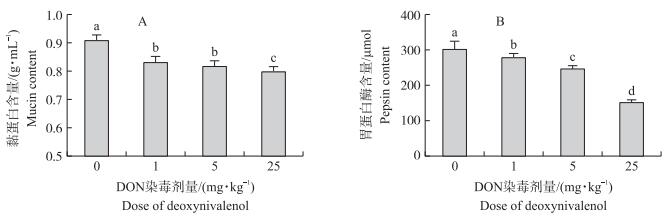
利用阿利新兰法测定胃液中黏蛋白的分泌情况, 结果 (图 2-A) 表明:与对照组相比, 1、5和25 mg·kg-1 DON染毒组胃液中黏蛋白含量分别下降了8.42%、10.02%和12.30%, 表明DON对胃液黏蛋白的分泌具有抑制作用。
|
图 2 DON对大鼠胃液黏蛋白和胃蛋白酶含量的影响 Figure 2 Effects of deoxynivalenol on the content of mucin and pepsin in gastric juice in rats |
由图 2-B可见:DON抑制了胃内胃蛋白酶的分泌。与对照组相比, 1、5 mg·kg-1 DON组胃液胃蛋白酶含量分别下降了7.96%和18.33%, 而25 mg·kg-1 DON组胃蛋白酶含量降低了50.83%。
2.2 DON对胃蛋白酶活性的影响胃蛋白酶总活性是对蛋白质消化能力的直接反映。福林-酚法测定结果表明:随DON染毒剂量增加, 大鼠胃液总胃蛋白酶活性显著降低 (图 3-A, P < 0.05)。与对照组相比, 1、5和25 mg·kg-1 DON染毒组大鼠的胃蛋白酶总活性分别下降了27.97%、55.36%和67.82%。与对照组相比, 1、5和25 mg·kg-1 DON染毒组每mL胃液胃蛋白酶活性分别下降了8.52%、10.03%和12.33%(图 3-B)。
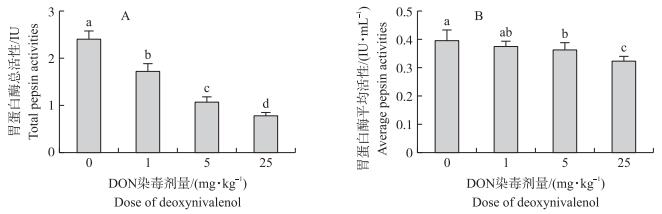
|
图 3 DON对大鼠胃液胃蛋白酶总活性 (A) 和平均活性 (B) 的影响 Figure 3 Effects of deoxynivalenol on total (A) and average (B) pepsin activities in rats |
胃液残渣质量测定结果 (图 4) 表明:DON染毒使大鼠胃液残渣干、湿质量显著升高 (P < 0.05), 且与染毒剂量呈正相关。与对照组相比, 1、5和25 mg·kg-1 DON染毒组残渣湿质量分别增加了200.25%、258.03%和540.09%(图 4-A)。类似地, 1、5和25 mg·kg-1 DON染毒组与对照组残渣干质量相比分别增加了42.97%、250.16%和2 460.32%(图 4-B)。可见25 mg·kg-1 DON染毒明显抑制了大鼠的胃消化能力。
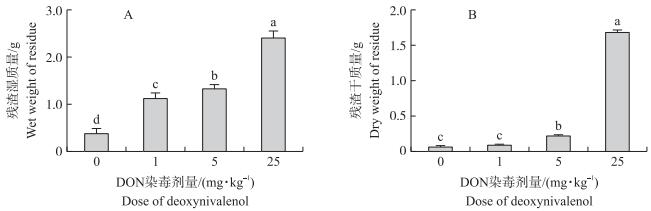
|
图 4 DON对大鼠胃液内残渣质量的影响 Figure 4 Effects of deoxynivalenol on the weight of gastric residue in rats |
利用ICP-AES法对胃液K+、Na+、Ca2+和Zn2+等常见金属离子质量浓度进行了测定 (表 1)。结果表明:5和25 mg·kg-1DON组大鼠胃液中Na+质量浓度明显升高 (P < 0.05), 1 mg·kg-1DON组大鼠胃液Na+质量浓度显著下降 (P < 0.05), 胃液中K+质量浓度变化与Na+基本一致。1 mg·kg-1DON染毒大鼠胃液内Ca2+质量浓度显著下降 (P < 0.05), 这可能与胃液酸度下降导致的钙解离下降有关; 而25 mg·kg-1DON染毒后, 大鼠胃液内的Ca2+质量浓度未发生明显变化 (P>0.05)。DON染毒增加了胃液Zn2+质量浓度, 5和25 mg·kg-1DON组Zn2+质量浓度分别增加了18.67%和122.59%(P < 0.05)。
| μg·mL-1 | ||||
| 金属离子 Ion |
DON染毒剂量/(mg·kg-1) Dose of DON | |||
| 0 | 1 | 5 | 25 | |
| Na+ | 1 817.01±30.80c | 1 234.02±32.67d | 1 982.11±31.59b | 2 139.24±57.63a |
| K+ | 663.42±21.18c | 521.77±24.14d | 1 097.86±23.21b | 1 221.09±21.75a |
| Zn2+ | 7 391.23±32.23c | 7 433.27±61.47c | 8 770.44±712.35b | 16 454.27±912.51a |
| Ca2+ | 283.92±11.63a | 194.33±14.61b | 228.59±8.77b | 304.42±10.37a |
大鼠是研究单胃动物功能的理想实验模型[10], 本研究结果对阐明DON对其他动物胃毒性损伤机制具有借鉴意义。胃液pH值是评价胃液分泌和消化功能的重要指标之一, 本研究发现DON染毒组大鼠胃液pH值明显升高, 而胃液分泌总量却显著降低, 表明DON对胃液分泌具有抑制作用。本研究利用Folin-Phenol法测定了DON对大鼠胃液内胃蛋白酶总活性的影响, 发现DON显著降低了大鼠胃蛋白酶活性, 这是胃液蛋白消化能力下降的有力证据。Lindstr等[11]认为胃蛋白酶在pH值为2时消化活性最强, 当pH值在5.0~6.0时酶活性和稳定性迅速下降。试验中DON引起的胃蛋白酶活性下降与pH值改变有关, 是否与DON抑制胃蛋白酶合成仍需进一步研究。本试验也发现DON抑制了大鼠的排空能力, 这与Fioramonti等[7]的研究结果一致。胃内容物体积是影响胃排空的重要因素[12], 而本试验中对不同组别大鼠进行了幽门结扎术, 排除了胃排空延迟导致胃内容物增多这一因素, 证明胃液组成改变是内容物增多的直接原因。
电感耦合等离子体发射光谱法 (ICP-AES法) 对于金属离子检测具有精确、快速的优点, 以往研究证实DON可导致胃黏膜损伤[13], 胃液Zn2+水平经常被作为炎症的判定指标, 试验中DON浓度与胃液Zn2+含量明显正相关, 这与以往研究结果相吻合。DON可致小鼠骨骼畸形, 这与DON抑制软骨细胞生长有关[14], 本试验中胃液Ca2+浓度变化是钙代谢紊乱的间接体现[15], 但Ca2+紊乱如何涉及骨骼畸形的机制仍有待探究。DON也能引起脑毒性损伤与抗氧化功能下降[16-17], 而胃液分泌受到ghrelin等脑肠肽的调控, 是否与此有关仍待探究。综上所述, 本研究结果表明DON改变了胃液组成, 影响了胃蛋白酶分泌和活性, 是否与DON抑制相关蛋白合成及细胞膜通透性有关仍需进一步研究。
| [1] | Tralamazza S M, Bemvenuti R H, Zorzete P, et al. Fungal diversity and natural occurrence of deoxynivalenol and zearalenone in freshly harvested wheat grains from Brazil[J]. Food Chemistry, 2016, 196: 445–450. DOI: 10.1016/j.foodchem.2015.09.063 |
| [2] | Liu Y, Lu Y, Wang L, et al. Occurrence of deoxynivalenol in wheat, Hebei Province, China[J]. Food Chemistry, 2016, 197(Pt B): 1271–1274. |
| [3] | Ghareeb K, Awad W A, Bohm J, et al. Impacts of the feed contaminant deoxynivalenol on the intestine of monogastric animals:poultry and swine[J]. Journal of Applied Toxicology, 2015, 35(4): 327–337. DOI: 10.1002/jat.v35.4 |
| [4] | Danicke S, Valenta H, Klobasa F, et al. Effects of graded levels of Fusarium toxin contaminated wheat in diets for fattening pigs on growth performance, nutrient digestibility, deoxynivalenol balance and clinical serum characteristics[J]. Archives of Animal Nutrition, 2004, 58(1): 1–17. DOI: 10.1080/0003942031000161045 |
| [5] | Awad W A, Bohm J, Razzazi-Fazeli E, et al. Effects of feeding deoxynivalenol contaminated wheat on growth performance, organ weights and histological parameters of the intestine of broiler chickens[J]. Journal of Animal Physiology and Animal Nutrition, 2006, 90(1/2): 32–37. |
| [6] | Pinton P, Nougayrede J P, Delrio J C, et al. The food contaminant deoxynivalenol, decreases intestinal barrier permeability and reduces claudin expression[J]. Toxicology and Applied Pharmacology, 2009, 237(1): 41–48. DOI: 10.1016/j.taap.2009.03.003 |
| [7] | Fioramonti J, Dupuy C, Dupuy J, et al. The mycotoxin, deoxynivalenol, delays gastric emptying through serotonin-3 receptors in rodents[J]. The Journal of Pharmacology and Experimental Therapeutics, 1993, 266(3): 1255–1260. |
| [8] | Schubert M L, Makhlouf G M. Neural and paracrine regulation of gastrin and gastric acid secretion[J]. Gastroenterology, 1996, 111(3): 837–838. DOI: 10.1053/gast.1996.v111.agast961110837 |
| [9] | Kurasawa T, Chikaraishi Y, Naito A, et al. Effect of humulus lupulus on gastric secretion in a rat pylorus-ligated model[J]. Biological and Pharmaceutical Bulletin, 2005, 28(2): 353–357. DOI: 10.1248/bpb.28.353 |
| [10] | Gill T J, Smith G J, Wissler R W, et al. The rat as an experimental animal[J]. Science, 1989, 245(4915): 269–276. DOI: 10.1126/science.2665079 |
| [11] | Lindstr M E, Chen D, Norl N P, et al. Control of gastric acid secretion:the gastrin-ECL cell-parietal cell axis[J]. Comparative Biochemistry and Physiology Part A, Molecular and Integrative Physiology, 2001, 128(3): 505–514. |
| [12] | Hunt J N, Smith J L, Jiang C L. Effect of meal volume and energy density on the gastric emptying of carbohydrates[J]. Gastroenterology, 1985, 89(6): 1326–1330. DOI: 10.1016/0016-5085(85)90650-X |
| [13] | Wang Y, Wu W, Wang X, et al. Inhibitory effects of DON on gastric secretion in rats[J]. Journal of Food Protection, 2014, 77(8): 1367–1371. DOI: 10.4315/0362-028X.JFP-13-470 |
| [14] | Zhao Y, Zhu X, Wu H, et al. Evaluation of fetal skeletal malformations in deoxynivalenol-treated mice using microarray analysis[J]. Archives of Environmental Contamination and Toxicology, 2012, 63(3): 445–452. DOI: 10.1007/s00244-012-9781-4 |
| [15] | Yunus A W, Bohm J. Serum cation profile of broilers at various stages of exposure to deoxynivalenol[J]. Mycotoxin Research, 2013, 29(2): 113–117. DOI: 10.1007/s12550-013-0159-x |
| [16] |
耿芳芳, 许伟, 范梦雪, 等. 脱氧雪腐镰刀菌烯醇对雏鸡脂质过氧化反应及脑部形态机构的影响[J].
南京农业大学学报, 2016, 39(3): 460–466.
Geng F F, Xu W, Fan M X, et al. Effects of deoxynivalenol on lipid peroxidation reaction and brain morphology in chicken[J]. Journal of Nanjing Agricultural University, 2016, 39(3): 460–466. DOI: 10.7685/jnau.201510024 (in Chinese) |
| [17] |
李茜, 岑雪, 潘顺叶, 等. 脱氧雪腐镰刀菌烯醇诱导CTLL-2细胞凋亡的信号途径研究[J].
畜牧与兽医, 2016, 48(12): 12–18.
Li Q, Cen X, Pan S Y, et al. Deoxynivalenol-induced pathway of apoptosis in CTLL-2 cells[J]. Animal Husbandry and Veterinary Medicine, 2016, 48(12): 12–18. (in Chinese) |




