文章信息
- 钱庄, 朱怀森, 吕英军, 刘红林, 鲍恩东
- QIAN Zhuang, ZHU Huaisen, LÜ Yingjun, LIU Honglin, BAO Endong
- 注射促肾上腺皮质激素对母猪断奶后新生黄体的发育及类固醇合成的影响
- Adrenocorticotropic hormone (ACTH) affects new corpus luteal development and steroidogenesis in weaned sows
- 南京农业大学学报, 2017, 40(2): 308-313
- Journal of Nanjing Agricultural University, 2017, 40(2): 308-313.
- http://dx.doi.org/10.7685/jnau.201608028
-
文章历史
- 收稿日期: 2016-08-25
2. 南京农业大学动物科技学院, 江苏 南京 210095
2. College of Animal Science and Technology, Nanjing Agricultural University, Nanjing 210095, China
应激能够引起雌性家畜生殖系统紊乱并造成繁殖障碍[1]。黄体 (CL) 作为一个临时性的内分泌腺[2], 在发情周期的特定时期生成及退化。排卵后的卵泡经过复杂的过程转变发育成为黄体, 分泌孕酮, 刺激子宫内膜细胞增殖以及维持相对稳定的子宫内环境以利于胚胎的附植及其早期发育[3]。血浆中的孕酮水平依赖于孕酮合成组织的多少、血液供应、组织合成孕酮能力的强弱等因素[4]。研究表明, 糖皮质激素能够在体内、外抑制黄体化颗粒细胞的类固醇合成[5-6], 并能在一定程度上延长黄体的存在时间[7]。为明确应激引起的高皮质醇水平对母猪新生黄体的发育和功能的影响, 本试验通过体内注射促肾上腺皮质激素 (ACTH) 的方式模拟应激诱导高皮质醇含量, 研究其对母猪新生黄体的组织内基质金属蛋白 (MMP) 系统及孕酮合成的影响, 为进一步了解应激对母猪繁殖性能的影响提供一定的理论和实验依据。
1 材料与方法 1.1 试验动物及处理苏淮母猪:10头, 经产3~5胎, 临床检查健康, 由江苏淮阴种猪场提供。为减少由运输和环境变化所造成的其他应激因素, 所有试验受试猪均饲养于由该养殖场提供的场地。按猪场正常程序进行饲喂, 自由采食、饮水。
母猪带仔40 d时断奶, 随机均分成ACTH组和对照组, 并将所有母猪统一置于同一带限位栏的猪舍内以方便管理。仔猪断奶当天 (试验的第0天), 对所有母猪行颈静脉插管手术用于后续的血液采集。手术后母猪进行1 d的适应性饲养, 并每天注射青霉素和链霉素1次, 剂量分别为400万单位和100万单位, 连续3 d, 以防感染。自试验的第2天开始, 每隔8 h注射ACTH (Sigma, SLBK8723V)1 IU·kg-1, 直至手术结束后的第9天。所有母猪均于手术后第9天屠宰, 迅速采取卵巢组织, 分别于10%中性福尔马林溶液内固定和液氮内冻存。
1.2 母猪的发情检测及血液采集采用按压静立反射结合外阴检查判定母猪发情与否[8], 每6 h检查1次。若母猪表现出按压静立反射并且出现阴户红肿、有黏液分泌者, 即判定为发情。
采用一次性负压采血管 (含肝素钠) 经颈静脉插管采血, 每次10 mL; 3 000 r·min-1离心10 min分离血浆, 用于激素水平的测定。皮质醇水平使用ELISA试剂盒测定 (南京建成生物工程研究所)。
1.3 实时荧光定量RT-PCR根据说明书, 使用Trizol (TaKaRa) 提取所有母猪卵巢黄体样品中的总RNA。取1 000 ng总RNA, 以20 μL反应体系反转录成cDNA。反转录后的cDNA于-70 ℃保存。PCR引物使用Primer Premier 5.0根据NCBI核酸数据库中相应基因mRNA的全序列设计完成, 由上海英骏生物技术有限公司合成。引物序列见表 1。20 μL qPCR反应体系:SYBR® Green Master Mix 10 μL, 上、下游引物 (10 μmol·L-1) 各0.4 μL, 模板cDNA 2 μL, 用DEPC水补足到20 μL。PCR反应程序为:95 ℃ 5 min; 95 ℃ 15 s, 65 ℃ 35 s, 共40个循环; 以95 ℃ 15 s, 60 ℃ 60 s, 95 ℃ 15 s, 循环反应一次以绘制熔解曲线。PCR结果利用2-ΔΔCT法计算各基因的相对表达量。
| 基因Gene | 引物对序列 (5′→3′) Primer pairs sequence | NCBI登录号NCBI accession No. |
| StAR | AGCCCTTTCGTGTCTACCT/ATTCTGACTGCTGCTCTGG | NM_213755 |
| P450scc | TGAACACGGAGGTAATGG/TGGTGATGGACTCAAAGG | NM_214427 |
| 3β-HSD | CGTGGATGTGGGTGTGAG/GGAAAGGGAATGAAGAGG | NM_001004049 |
| MMP-2 | CGACCACCGCCAACTACGAT/CACTGTCCGCCAGATGAACC | NM_214192 |
| MMP-9 | GCCCTGCGTGTTTCCATT/AGGTCCCCCGCCGAGTTG | NM_001038004 |
| TIMP-1 | CCCAGAGTTCAACCAGACCG/TGTGGAAGTATCCGCAGACG | NM_213857 |
| TIMP-2 | CGACCACCGCCAACTACGAT/CACTGTCCGCCAGATGAACC | FJ394384 |
| VEGFA165 | GAACTTTCTGCTCTCTTGGG/GTTTCTGGTCTCCTTCTGCC | NM_214084.1 |
| 注:StAR:类固醇激素合成急性调节蛋白Steroidogenic acute regulatory protein; P450scc:胆固醇侧链连接酶P450 P450 cholesterol side chain cleavage; 3β-HSD:3β-羟基类固醇脱氢酶3β-hydroxysteroid dehydrogenase; MMP-2:基质金属蛋白酶2 Matrix metal loproteinase 2;MMP-9:基质金属蛋白酶9 Matrix metal loproteinase 9;TIMP-1:基质金属蛋白酶组织抑制剂1 Tissue inhibitor of metal loproteinase 1;TIMP-2:基质金属蛋白酶组织抑制剂2 Tissue inhibitor of metal loproteinase 1;VEGFA165:血管内皮生长因子165 Vascular endothelial growth factor 165 | ||
从液氮冻存的卵巢组织中分离黄体组织约50 mg样品于蛋白裂解液中, 置于冰上, 用电动匀浆机匀浆。离心后取上清液置于2 mL离心管中。取少量上清液稀释10倍后, 用BCA蛋白定量分析试剂盒 (Thermo, NCI3225CH) 测定总蛋白浓度。
上述黄体蛋白提取物与上样缓冲液混合后, 取50 μg总蛋白于100 g·L-1聚丙烯酰胺 (SDS) 凝胶 (含1 g·L-1明胶) 中进行电泳, 以蛋白标准品作为指示蛋白。将电泳后的凝胶置于体积分数为2.5%的Triton-X100中洗涤3次, 每次20 min, 以去除SDS。孵育缓冲液[50 mmol·L-1 Tris (pH8.0), 5 mmol·L-1 CaCl2和1 mmol·L-1 ZnCl2]洗涤30 min, 浸入孵育缓冲液中37 ℃孵育24~48 h。考马斯亮蓝 (R-250) 染色后使用脱色液 (20%甲醇、30%乙酸) 漂洗至有清晰条带显现, 在相对分子质量 (55~72)×103和 (72~95)×103处的条带分别为MMP-2和MMP-9。凝胶成像系统 (Peiqing Science and Technology) 拍照, Quantity One (Bio-Rad) 扫描凝胶中对应条带灰度值, 计算相对活性。
1.5 组织及免疫组织化学染色卵巢组织经常规法石蜡包埋, 切5 μm厚切片, 苏木精伊红染色, 封片以观察卵巢内黄体的形态发育情况。石蜡切片经脱蜡和水化处理后, 用Tris-EDTA (pH9) 作为抗原修复液, 微波加热至98 ℃并保持10 min, 自然冷却至室温后, TBS洗涤3次, 用3% H2O2封闭内源性过氧化物酶。TBS洗涤3次后, 以5% BSA于37 ℃封闭30 min, 弃掉封闭液, 分别使用兔抗CD31抗体 (ABclonal, A3181, 1:250) 和山羊抗3β-HSD抗体 (Santa Cruz, sc-30820, 1:400) 分别作为一抗, 4 ℃孵育过夜以标记血管内皮细胞和黄体细胞, 分别使用HRP标记的羊抗兔IgG (生兴生物, sn134, 1:100) 和马抗山羊IgG (鼎国昌盛, IH-0052, 1:100) 作为二抗, 识别特异性一抗, DAB显色液显示。
1.6 统计分析所有数据以x±SD表示, 使用SPSS 19.0单因素方差分析 (ANOVA) 及独立样本t测验进行差异显著性分析。
2 结果与分析 2.1 ACTH处理后母猪的生理反应与对照组母猪相比, ACTH注射后母猪血浆中皮质醇的水平明显升高 (P < 0.05), 发情时间比对照组推迟17.8 h (图 1)。ACTH注射后, 试验组母猪中有3头发情并排卵形成新黄体 (卵巢表面形成排卵斑), 其余2头发情, 但未排卵; 对照组所有母猪均发情排卵并形成新黄体。屠宰后, 排卵卵巢 (有排卵斑) 未发现有明显异样, 卵巢质量无统计学差异。说明, ACTH注射处理后的母猪表现出了明显的应激生理反应并影响到排卵。
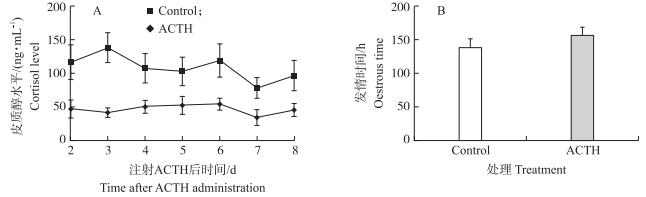
|
图 1 注射促肾上腺皮质激素 (ACTH) 后受试母猪血浆皮质醇含量及发情时间的变化 Figure 1 Blood concentrations of cortisol and the oestrus time after adrenocorticotropic hormone (ACTH) administration |
相比于对照组, ACTH组母猪新生黄体内P450scc和3β-HSD基因表达明显下调 (P < 0.05), 但是两组受试母猪之间类固醇合成快速调节蛋白 (StAR)的表达却没有明显差异 (图 2)。ACTH处理组受试母猪的黄体组织中3β-HSD蛋白的免疫组织化学染色阳性率显著低于对照组 (P < 0.05)(图 2), 这一结果与基因表达下调的结果相吻合, 说明孕酮的合成能力会受到ACTH处理的影响。
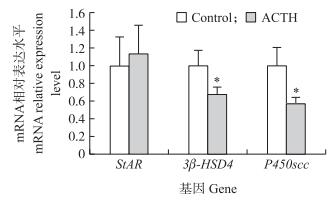
|
图 2 ACTH对新生黄体中主要孕酮合成酶基因表达量的影响 Figure 2 Effects of ACTH on the expression level of main progesterone synthases in the new corpus luteal (CL) *表示与对照相比差异显著 (P < 0.05)。 Asterisk indicate significant difference (P < 0.05).The same as follows. |
RT-qPCR检测结果显示 (图 3):ACTH处理能够下调母猪黄体中MMP-2和MMP-9基因表达, 但是对于它们的组织抑制剂TIMP-1和TIMP-2基因表达却没有任何影响。进一步使用明胶酶谱法检测MMP的酶活性, 结果显示MMP-9酶活性在ACTH处理组受试母猪黄体中显著低于对照组母猪 (P < 0.05), 而MMP-2酶活性则未受到明显影响 (P>0.05)。
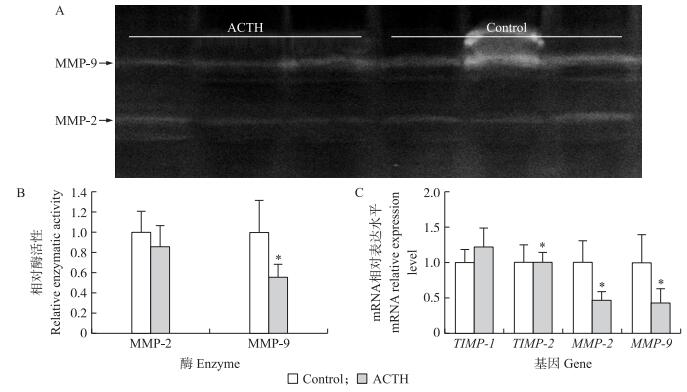
|
图 3 ACTH处理对新生黄体内部MMP酶活性及MMP和TIMP基因表达的影响 Figure 3 Activity of MMP and expression level of MMP and TIMP in new CL after ACTH treatment A.明胶酶谱分析; B.明胶酶谱条带灰度扫描统计; C.TIMP、MMP基因表达。 A.The gelatin zymography analysis of MMP-9 and MMP-2;B.Relative activity of MMP-2 and MMP-9 based on the gelatin zymography; C.Gene expression level of MMP and TIMP. |
对比ACTH组与对照组母猪新生黄体组织的组织学切片 (图 4) 发现:ACTH组母猪与对照组母猪新生黄体均处于早期快速发育时段, 黄体内部有少量出血和未填充的黄体腔。但ACTH组黄体组织细胞填充率较对照组低, 黄体腔所占比例更高。
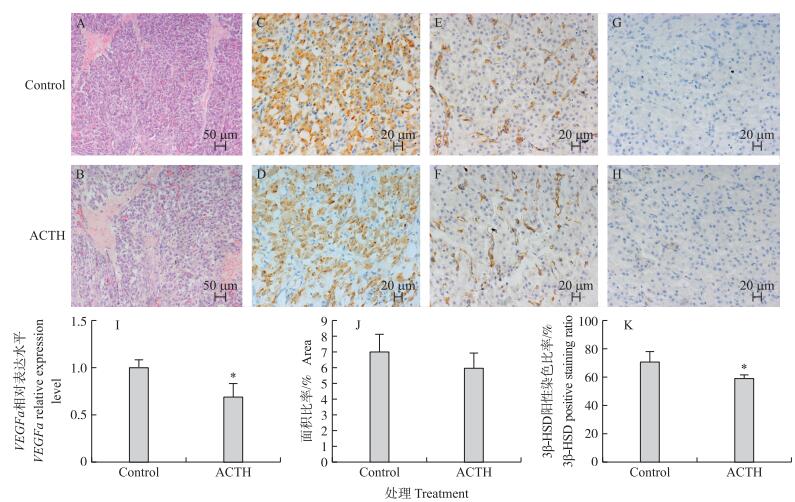
|
图 4 ACTH处理对母猪新生黄体组织影响的化学染色及分类统计图 Figure 4 Representative photographes of new CL by histological and immunohistochemistric staining and classified statistics in sows after ACTH treatment A, B.黄体组织HE染色; C, D.3β-HSD免疫组织化学染色; E, F.血管内皮细胞CD31免疫组化染色; G, H.阴性对照; I.VEGFa基因相对表达量; J.血管内皮细胞CD31免疫组化标记统计; K.3β-HSD免疫组化阳性比率统计。 A, B.HE staining results of CL; C, D.Immunohistochemistric staining results of 3β-HSD; E, F.Immunohistochemistry staining of CD31;G, H.Negative control of immunohistochemistric results; I.Gene expression of the VEGFa; J.Statistical analysis of CD31 immunohistochemistry staining; K.Statistical analysis of 3β-HSD immunohistochemistry staining. |
CD31免疫组化结果显示出卵巢组织内部的血管发展状态 (图 4-E, F), 结果显示:ACTH组母猪新生黄体内的血管密度比对照组母猪低约15%(P>0.05), 血管内皮生长因子基因 (VEGFa) 表达显著低于对照组母猪 (P < 0.05)。此结果说明ACTH处理能够影响黄体内血管的生长。
3 讨论应激能够激活下丘脑-垂体-肾上腺皮质 (HPA) 轴, 刺激下丘脑释放促肾上腺激素释放激素 (CRH) 作用垂体, 刺激促肾上腺皮质激素 (ACTH) 的合成与释放, 并最终作用于肾上腺导致肾上腺皮质分泌大量肾上腺皮质激素 (皮质醇) 进入循环系统并作用于全身组织器官[9]。ACTH作为HPA轴的一个中间促激素, 外源注射能够刺激肾上腺皮质释放过多的皮质醇模拟自然应激的生理反应。在本研究中, 注射ACTH模拟应激组母猪血浆中皮质醇含量明显高于对照组母猪, 表明动物处于应激状态下, 模型建立成功。与此同时, ACTH组母猪新生黄体组织内孕酮合成酶p450scc和3β-HSD基因表达明显下降, 其中3β-HSD的免疫组化染色结果与其基因表达相一致。现有体外试验结果表明皮质醇能够抑制体外培养的人卵巢颗粒细胞类固醇的合成, 并且具有剂量依赖性[5]。诱导原代培养的颗粒细胞黄体化之后, 高浓度的皮质醇或是地塞米松都会对类固醇和合成有抑制作用[6]。牛的体内试验表明, 排卵前卵泡形成期经颈静脉注射ACTH能够损伤卵泡的类固醇合成和血管新生, 最终造成排卵失败[10]。排卵前卵泡在LH的作用下排卵并黄体化而发育为新的黄体, 在这一转变过程中颗粒细胞的类固醇合成途径发生改变, 合成大量P450scc、3β-HSD而启动孕酮合成[11]。在本试验中, 注射ACTH引起母猪体内过高皮质醇水平, 由此损害了排卵前卵泡的类固醇合成, 影响排卵及排卵卵泡的黄体化。因此, 我们认为应激导致的高皮质醇含量能够抑制新生黄体组织的类固醇合成能力。
卵泡排卵后, 黄体的形成和发育是一个以剧烈的组织重构与血管新生为特征的过程, 并依赖于细胞外基质的重塑来实现的[12]。MMP与其组织抑制物TIMP所组成的系统在外基质重构过程发挥着重要作用[13]。在多种动物的黄体发育过程中, 明胶酶 (MMP-2和MMP-9) 的表达与活性有明显升高的趋势[14-16]。明胶酶表达与活性升高被认为与细胞迁移、血管新生以及黄体发育过程中的变化有关。现有结果表明, 黄体的早期发育与MMP和VEGF的表达和活性增强是同步的。在本试验中, 体内注射ACTH后, ACTH组母猪新生黄体内MMP和VEGFa基因表达均低于对照组, 并且MMP-9酶活性较对照组明显降低, 但是TIMP的表达却没有明显变化。与此相似, 对母羊排卵前卵泡注射MMP-2抗体导致后续的黄体发育不全以及孕酮水平下降, 进一步研究表明是由于卵泡的血管新生被阻断所致[17-18]。在肿瘤血管发育过程中MMP-9能够促进VEGFa分子结合到细胞外基质上启动血管新生[19]。结合以上结果, 黄体发育过程中的MMP和VEGF的表达及活性受到抑制时, 会造成黄体发育延迟, 其分泌功能也将受到影响。因此, 我们认为注射ACTH模拟应激能够阻碍受试母猪新生黄体内的组织重塑及血管新生, 延缓黄体发育, 影响黄体功能的发挥。
| [1] | von Borell E, Dobson H, Prunier A. Stress, behaviour and reproductive performance in female cattle and pigs[J]. Hormones and Behavior, 2007, 52(1): 130–138. DOI: 10.1016/j.yhbeh.2007.03.014 |
| [2] | Stocco C, Telleria C, Gibori G. The molecular control of corpus luteum formation, function, and regression[J]. Endocrine Reviews, 2007, 28(1): 117–149. DOI: 10.1210/er.2006-0022 |
| [3] | de Ziegler D, Fanchin R, de Moustier B, et al. The hormonal control of endometrial receptivity:estrogen (E-2) and progesterone[J]. Journal of Reproductive Immunology, 1998, 39(1/2): 149–166. |
| [4] | Bachelot A, Binart N. Current Topics in Developmental Biology (Volume 68)[M]. San Diego: Elsevier Academic Press Inc., 2005: 49-84. |
| [5] | Michael A E, Pester L A, Curtis P, et al. Direct inhibition of ovarian steroidogenesis by cortisol and the modulatory role of 11P-hydroxysteroid dehydrogenase[J]. Clinical Endocrinology, 1993, 38(6): 641–644. DOI: 10.1111/j.1365-2265.1993.tb02147.x |
| [6] | Huang T J, Li P S. Dexamethasone inhibits luteinizing hormone-induced synthesis of steroidogenic acute regulatory protein in cultured rat preovulatory follicles[J]. Biology of Reproduction, 2001, 64(1): 163–170. DOI: 10.1095/biolreprod64.1.163 |
| [7] | Duong H T, Piotrowska-Tomala K K, Acosta T J, et al. Effects of cortisol on pregnancy rate and corpus luteum function in heifers:an in vivo study[J]. Journal of Reproduction and Development, 2012, 58(2): 223–230. DOI: 10.1262/jrd.11-122T |
| [8] | Langendijk P, Soede N M, Kemp B. Effects of boar contact and housing conditions on estrus expression in weaned sows[J]. Journal of Animal Science, 2000, 78(4): 871–878. DOI: 10.2527/2000.784871x |
| [9] | Dobson H, Smith R F. What is stress, and how does it affect reproduction?[J]. Animal Reproduction Science, 2000, 60: 743–752. |
| [10] | Biran D, Braw-Tal R, Gendelman M, et al. ACTH administration during formation of preovulatory follicles impairs steroidogenesis and angiogenesis in association with ovulation failure in lactating cows[J]. Domestic Animal Endocrinology, 2015, 53: 52–59. DOI: 10.1016/j.domaniend.2015.05.002 |
| [11] | Taketa Y, Yoshida M, Inoue K, et al. The newly formed corpora lutea of normal cycling rats exhibit drastic changes in steroidogenic and luteolytic gene expressions[J]. Experimental and Toxicologic Pathology, 2012, 64: 775–782. DOI: 10.1016/j.etp.2011.01.015 |
| [12] | Duncan W C. The human corpus luteum:remodelling during luteolysis and maternal recognition of pregnancy[J]. Reviews of Reproduction, 2000, 5(1): 12–17. DOI: 10.1530/ror.0.0050012 |
| [13] | Curry T E, Osteen K G. The matrix metalloproteinase system:changes, regulation, and impact throughout the ovarian and uterine reproductive cycle[J]. Endocrine Reviews, 2003, 24(4): 428–465. DOI: 10.1210/er.2002-0005 |
| [14] | Goldberg M J, Moses M A, Tsang P C W. Identification of matrix metalloproteinases and metalloproteinase inhibitors in bovine corpora lutea and their variation during the estrous cycle[J]. Journal of Animal Science, 1996, 74(4): 849–857. DOI: 10.2527/1996.744849x |
| [15] | Nothnick W B, Keeble S C, Curry T E. Collagenase, gelatinase, and proteoglycanase messenger ribonucleic acid expression and activity during luteal development, maintenance, and regression in the pseudopregnant rat ovary[J]. Biology of Reproduction, 1996, 54(3): 616–624. DOI: 10.1095/biolreprod54.3.616 |
| [16] | Liu K, Wahlberg P, Ny T. Coordinated and cell-specific regulation of membrane type matrix metalloproteinase 1(MT1-MMP) and its substrate matrix metalloproteinase 2(MMP-2) by physiological signals during follicular development and ovulation[J]. Endocrinology, 1998, 139(11): 4735–4738. DOI: 10.1210/endo.139.11.6431 |
| [17] | Gottsch M L, van Kirk E A, Murdoch W J. Role of matrix metalloproteinase 2 in the ovulatory folliculo-luteal transition of ewes[J]. Reproduction, 2002, 124(3): 347–352. DOI: 10.1530/rep.0.1240347 |
| [18] |
杨旭, 杨笑柳, 徐亚萍, 等. 猪卵母细胞在冷应激条件下的体外发育与CIRP基因表达[J].
畜牧与兽医, 2015, 47(3): 24–28.
Yang X, Yang X L, Xu Y P, et al. Development in vitro and CIRP gene expressions in pig oocytes under cold stress[J]. Animal Husbandry and Veterinary Medicine, 2015, 47(3): 24–28. (in Chinese) |
| [19] | Bergers G, Brekken R, McMahon G, et al. Matrix metalloproteinase-9 triggers the angiogenic switch during carcinogenesis[J]. Nature Cell Biology, 2000, 2(10): 737–744. DOI: 10.1038/35036374 |




