文章信息
- 陈钰佩, 高翠民, 任彬彬, 胡香玉, 沈其荣, 郭世伟
- CHEN Yupei, GAO Cuimin, REN Binbin, HU Xiangyu, SHEN Qirong, GUO Shiwei
- 水分胁迫下氮素形态影响水稻根系通气组织形成的生理机制
- Physiological mechanism of nitrogen forms affect aerenchyma formation of rice root under water stress
- 南京农业大学学报, 2017, 40(2): 273-280
- Journal of Nanjing Agricultural University, 2017, 40(2): 273-280.
- http://dx.doi.org/10.7685/jnau.201604034
-
文章历史
- 收稿日期: 2016-04-11
水稻作为农业中的耗水大户, 每年用水量约占农业用水量的70%[1], 而其中大量的灌溉水在地表蒸发或者渗漏流失, 水资源浪费现象十分严重。随着我国水资源的日益紧缺, 开展水稻节水农业以及抗旱生理研究受到越来越多的重视[2]。在传统的水稻淹水栽培中, 铵态氮为主要氮源, 水稻转为旱作后, 土壤中的氮素形态将由以铵态氮为主转变为以硝态氮为主或者铵态氮和硝态氮混合[3]。因此, 研究氮素形态对水稻生长的影响, 对于提高水稻抗旱性具有十分重大的意义。有研究表明, 模拟干旱条件下, 与供硝态氮营养相比, 供铵态氮营养水稻维持较高的净光合速率和水分吸收能力, 表现出较高的抗旱性[4], 其原因可能与根系皮层通气组织的形成相关, 供硝态氮营养水稻根系通气组织形成增加, 抑制了水分的吸收和运输[5]。
通气组织是植物薄壁组织内一些气腔或空腔的集合, 可将氧气从地上部运输到根系及根际土壤, 对于维持植物正常生理代谢具有重要的生物学意义。通气组织按照其形成方式可分为裂生型与溶生型两种[6]。植物根内通气组织属于溶生型, 源于一些活细胞的编程性死亡和溶解[7], 其中形成气室的细胞已经死亡, 由剩余的活细胞作为界限分隔气室, 整体呈“轴轮”状结构。这些细胞死亡过程是由植物的遗传性所决定, 并受外部环境的影响。各种生物和非生物胁迫均能够影响溶生型通气组织的形成, 如缺氧、高温、干旱或者某种营养元素的缺乏[8], 乙烯、活性氧、Ca2+等均参与调控通气组织的形成[9]。我们的前期研究结果表明, 模拟水分胁迫条件下, 供应硝态氮营养促进水稻根系的通气组织形成[10], 但到目前为止, 不同氮素形态影响通气组织形成的机制尚不明确。为此, 我们通过研究不同氮素形态和水分条件对水稻幼苗根系生理生化特性及其解剖结构的影响, 探讨水分胁迫下不同氮素形态影响根系通气组织形成的可能机制。
1 材料与方法 1.1 试验材料与设计供试水稻 (Oryza sativa L.) 品种为‘汕优63’(杂交籼稻) 与‘扬稻6号’(常规籼稻)。供氮形态为铵态氮[NH4+-N, 以 (NH4)2SO4形式供应]与硝态氮[NO3--N, 以Ca (NO3)2形式供应], 供氮浓度均为40 mg·L-1。营养液采用国际水稻研究所 (IRRI) 的常规营养液配方[11], 并略作改进。此外, 添加Na2SiO3使营养液中的SiO2浓度为0.1 mmol·L-1, 并加入1 mg·L-1双氰胺 (DCD) 作为硝化抑制剂。2种水分条件:正常水分条件, 模拟水分胁迫条件[向营养液中添加100 g·L-1聚乙二醇6000(PEG6000), 渗透势约为-0.15 MPa[12]]。试验共4个处理, 即供铵态氮处理、供硝态氮处理、供铵态氮加PEG6000处理、供硝态氮加PEG6000处理, 分别以A、N、AP、NP表示, ‘汕优63’和‘扬稻6号’分别以S和Y表示。
种子消毒后均匀铺于育苗框中, 常温条件下避光发芽。待幼苗长至2叶1心时期, 选取长势一致的幼苗移栽到5 L塑料桶内 (避光), 给幼苗依次供应1/4、1/2至全量浓度的营养液 (铵、硝物质的量比为1:1的混合营养液) 预培养7 d后进行不同氮素形态处理, 7 d后再进行模拟水分胁迫处理, 胁迫14 d后进行各项指标的测定, 每个处理设置4个重复, 每项指标的测定进行3次重复试验。营养液每2 d更换1次, 每天调节营养液pH值至5.50±0.05。
1.2 测定项目 1.2.1 根系解剖结构观察用去离子水洗净水稻根系后, 选择长度为7~8 cm的新生不定根, 用双刃刀片将距根尖40、30、20和10 mm处的根系依次切成1 mm小段, 参照David等[13]的方法, 将样品置于异戊二醇中并转移至注射器, 吸打抽真空后保存在5 mL离心管中备用。采用扫描电子显微镜 (S-3000N, Hitachi Inc., Japan) 观察制备好的根系样品并成像。通过Image J软件 (National Institutes of Health) 对所得的电镜图片进行通气组织面积统计分析, 通气组织形成比例=通气组织面积/水稻根系横截面面积×100%。
1.2.2 脯氨酸含量的测定采集的植株根系用去离子水洗净、擦干后参照茚三酮-磺基水杨酸法[14]测定脯氨酸含量。称取鲜样0.5 g, 加入5 mL 3%的磺基水杨酸溶液, 沸水浴15 min, 过滤得到提取液。取2 mL提取液, 加入2 mL乙酸和2 mL酸性茚三酮试剂, 混匀后沸水浴30 min。冷却后再加入5 mL甲苯萃取, 以甲苯为空白对照, 在波长520 nm下比色测定。
1.2.3 丙二醛 (MDA) 含量的测定采集的植株根系用去离子水洗净、擦干后参照硫代巴比妥酸 (TBA) 法[15]测定丙二醛含量。称取0.5 g鲜样, 加5 mL 5%三氯乙酸 (TCA) 研磨成匀浆, 离心后取上清液2 mL, 加入2 mL 0.67%硫代巴比妥酸, 混匀后沸水浴30 min, 冷却后取上清液分别在450、532和600 nm波长下测定吸光值, 按照公式计算MDA浓度 (nmol·g-1)=6.45×(A532-A600)-0.56×A450。
1.2.4 根系呼吸速率的测定水分胁迫处理14 d后进行根系呼吸速率[16]的测定。在09:00—11:00时间段内, 将待测根系剪下放入避光的玻璃瓶中, 即刻收集瓶中气体, 2 h后再次收集。用气相色谱 (Agilent 7890 A, USA) 和氢火焰离子检测器 (FID) 检测收集所得气体中的CO2浓度。平均CO2排放速率为2次所得的浓度差值除以对应时间。计算得到的平均排放速率与单位时间相乘所得数值即为单位时间累积排放量, 累积排放量除以根系生物量 (鲜质量) 为单位时间内每克根系的CO2排放量。
1.2.5 过氧化物酶 (POD) 活性的测定采集的植株根系用去离子水洗净、擦干后参照愈创木酚法[17]测定过氧化物酶活性。称取待测鲜样0.5 g, 加入5 mL磷酸缓冲液研磨成匀浆, 离心后取上清液0.1 mL, 加入2.9 mL 0.05 mol·L-1磷酸缓冲液, 1 mL 2% H2O2及1 mL 0.05 mol·L-1愈创木酚, 混匀后在波长470 nm下比色测定。
1.2.6 过氧化氢酶 (CAT) 活性的测定采集的植株根系用去离子水洗净、擦干后参照紫外吸收法[17]测定过氧化氢酶活性。称取待测鲜样0.5 g, 加入5 mL磷酸缓冲液研磨成匀浆, 转移至25 mL容量瓶中定容。在4 ℃冰箱中静置10 min, 离心后取上清液0.2 mL, 加入1.5 mL磷酸缓冲液、1 mL蒸馏水和0.3 mL 0.1 mol·L-1 H2O2, 混匀后在波长240 nm下比色测定。
1.2.7 超氧化物歧化酶 (SOD) 活性的测定采集的植株根系用去离子水洗净、擦干后参照氮蓝四唑 (NBT) 法[17]测定超氧化物歧化酶活性。称取鲜样0.5 g, 加入5 mL磷酸缓冲液研磨成匀浆, 离心后取上清液0.05 mL, 加入1.5 mL 0.05 mol·L-1磷酸缓冲液、0.3 mL甲硫氨酸溶液、0.3 mL氮蓝四唑溶液、0.3 mL EDTA-Na2、0.3 mL核黄素和0.25 mL蒸馏水, 混匀后在4 000 lx日光下反应20 min, 最后在波长560 nm下比色测定。
1.2.8 超氧阴离子含量的测定采集的植株根系用去离子水洗净、擦干后, 参照羟胺氧化法[18]测定超氧阴离子含量。称取鲜样0.5 g, 加入3 mL磷酸缓冲液研磨成匀浆, 离心后取上清液0.05 mL, 加入0.5 mL已预热的磷酸缓冲液和0.1 mL盐酸羟胺溶液, 对照管以磷酸缓冲液代替盐酸羟胺溶液, 混匀后置于25 ℃水浴中20 min, 再加入1 mL对氨基苯磺酸和1 mL α-萘胺, 混匀后置于25 ℃水浴中20 min, 最后加入3 mL三氯甲烷萃取, 取上层水相在波长530 nm下比色测定。
1.3 数据统计与分析所有数据运用SPSS 20.0软件及Excel 2007进行统计分析, 所有数据采用LSD方法进行多重比较。
2 结果与分析 2.1 不同氮素形态及水分条件对水稻根系通气组织形成的影响由图 1可见:正常水分条件下, 2种氮素形态营养水稻距离根尖10 mm处通气组织均未明显发育, 而在模拟水分胁迫条件下供硝态氮营养水稻根系出现通气组织, 供铵态氮营养水稻根系通气组织形成不明显 (图 1-A和E)。在距离水稻根尖20 mm处, 各个处理中均可观察到通气组织的形成, NP处理的通气组织明显大于其他处理 (图 1-B和F), 在距离根尖30 mm (图 1-C和G) 和40 mm (图 1-D和H) 处也出现相同的现象。随着距离根尖的长度增加, 通气组织的面积也随之增加, 通气组织大小与距离根尖的距离呈正相关关系 (图 2)。与正常水分条件相比, 模拟水分胁迫促进水稻根系通气组织的形成。正常水分条件下, 供铵态氮营养水稻根系通气组织大于供硝态氮营养水稻, 模拟水分胁迫条件下则相反 (图 1-B~D和F~H)。通气组织在NP处理中最先生成, 其次分别为AP、A和N处理。
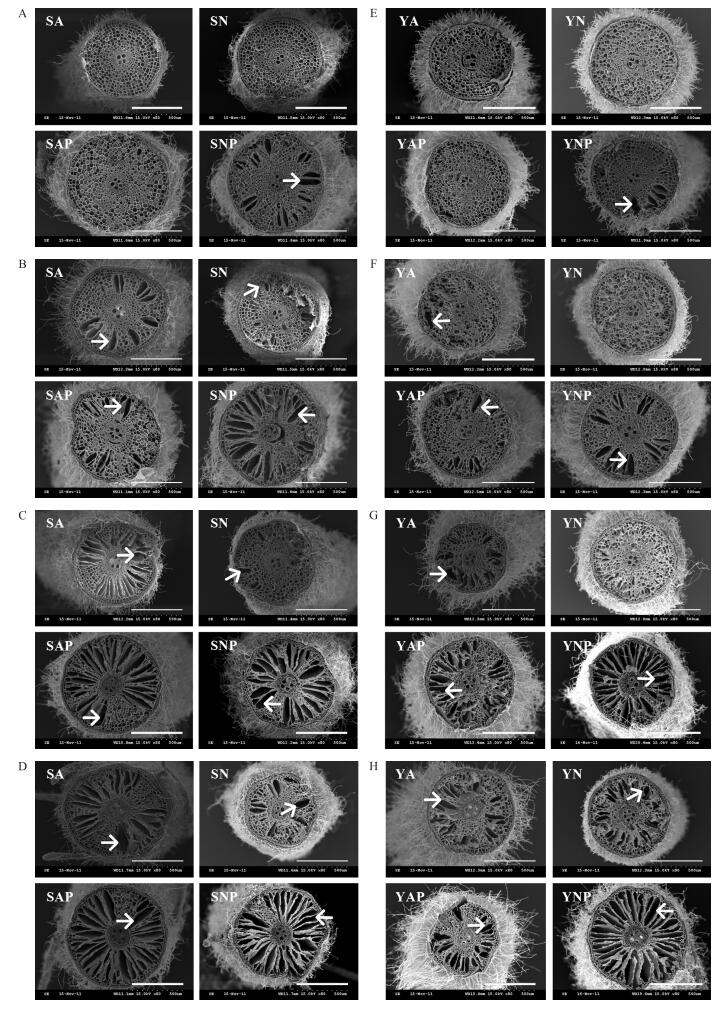
|
图 1 不同氮素形态及水分条件下水稻根系横切面扫描电镜图 Figure 1 Scanning electron micrographs of transverse section of newly formed adventitious rootsunder different nitrogen forms and water conditions A、N、AP、NP分别表示供铵态氮处理、供硝态氮处理、供铵态氮加PEG6000处理、供硝态氮加PEG6000处理, S和Y分别表示‘汕优63’和‘扬稻6号’。图A和E, B和F, C和G, D和H依次代表距离根尖10、20、30和40 mm。箭头表示通气组织, 标尺=500 μm。 A, N, AP, NP mean the treatment with ammonium nitrogen, nitrate nitrogen, ammonium nitrogen with PEG6000, nitrate nitrogen with PEG6000, respectively. S means 'Shanyou 63', Y means 'Yangdao 6'. Figure A and E, B and F, C and G, D and H successively mean from the root tip 10, 20, 30 and 40 mm. The arrows mean aerenchyma, bar=500 μm. The same as follows. |
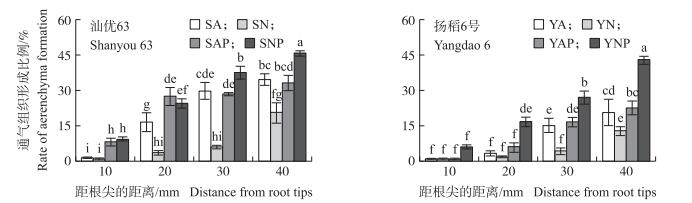
|
图 2 氮素形态及水分胁迫对水稻通气组织形成的影响 Figure 2 Effects of nitrogen forms and water stress on aerenchyma formation 不同字母表示在5%水平上差异显著。Different letters indicate significant difference at 5% level. The same as follows. |
正常水分条件下, 无论是在‘汕优63’还是在‘扬稻6号’中, 2种氮素形态营养水稻根系的脯氨酸含量没有差异 (图 3)。与正常水分条件相比, 模拟水分胁迫条件下供铵态氮营养水稻根系脯氨酸含量显著增加, ‘汕优63’和‘扬稻6号’分别增加了78%和95%, 而水分胁迫对供硝态氮营养水稻根系脯氨酸含量没有影响 (图 3)。
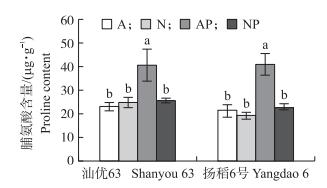
|
图 3 氮素形态及水分胁迫对水稻根系脯氨酸含量的影响 Figure 3 Effects of nitrogen forms and water stress onproline content in the root of rice seedlings |
正常水分条件下, ‘汕优63’和‘扬稻6号’的2种氮素形态营养水稻根系的丙二醛含量没有差异; 与正常水分条件相比, 模拟水分胁迫促进了水稻根系丙二醛含量的增加 (图 4)。模拟水分胁迫条件下, 在‘汕优63’中供硝态氮营养水稻根系的丙二醛含量显著高于供铵态氮营养水稻, 而在‘扬稻6号’中, 2种供氮形态水稻根系的丙二醛含量没有差异。
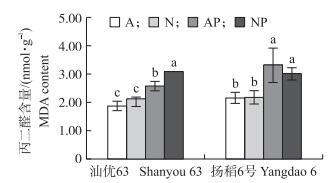
|
图 4 氮素形态及水分胁迫对水稻根系丙二醛含量的影响 Figure 4 Effects of nitrogen forms and water stress onMDA content in the root of rice seedlings |
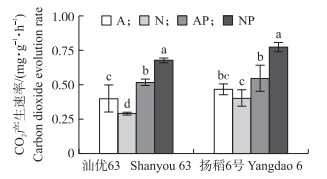
在‘汕优63’中, 模拟水分胁迫条件下, 供硝态氮营养水稻根系呼吸速率显著高于供铵态氮营养水稻; 而正常水分条件下, 供铵态氮营养水稻根系呼吸速率显著高于供硝态氮营养水稻。对于‘扬稻6号’而言, 与正常水分条件比, 模拟水分胁迫促进供硝态氮营养水稻根系呼吸速率增加, 而对供铵态氮营养水稻没有影响 (图 5)。
|
图 5 氮素形态及水分胁迫对水稻根系呼吸速率的影响 Figure 5 Effects of nitrogen forms and water stress on carbondioxide evolution rate in the root of rice seedlings |
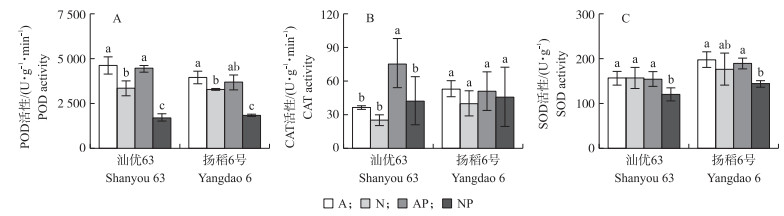
与正常水分条件相比, 模拟水分胁迫显著降低了供硝态氮营养水稻根系的POD活性, 而对供铵态氮营养水稻没有影响 (图 6-A)。模拟水分胁迫条件下, 在‘汕优63’中, 供硝态氮营养水稻根系的CAT活性显著低于供铵态氮营养水稻, 而在‘扬稻6号’中没有显著差异 (图 6-B)。无论是在‘汕优63’还是在‘扬稻6号’中, 模拟水分胁迫条件显著降低了供硝态氮营养水稻根系的SOD活性, 而对供铵态氮营养水稻没有影响 (图 6-C)。
|
图 6 氮素形态及水分胁迫对水稻根系POD (A)、CAT (B) 和SOD (C) 活性的影响 Figure 6 Effects of nitrogen forms and water stress on the activities of POD (A), CAT (B) and SOD (C) in the root of rice seedlings |
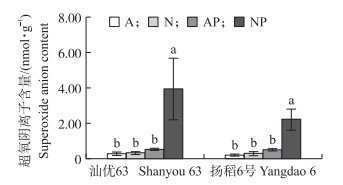
不同氮素形态及水分条件对‘汕优63’与‘扬稻6号’根系超氧阴离子含量的影响趋势是一致的 (图 7)。正常水分条件下, 2种氮素形态营养水稻根系的超氧阴离子含量没有差异。模拟水分胁迫供硝态氮营养水稻根系的超氧阴离子含量显著增加。在供铵态氮营养水稻中, 2种水分条件下超氧阴离子含量没有差异。
|
图 7 氮素形态及水分胁迫对水稻根系超氧阴离子含量的影响 Figure 7 Effects of nitrogen forms and water stress on superoxideanion content in the root of rice seedlings |
根系是水稻固定植株、吸收水分和养分的重要器官, 其生长发育对于植株地上部的生长和稻谷产量起着重要作用[19]。氮素形态以及水分条件通过改变根系的形态构成、解剖结构等生理特性等来调控水稻生长。有研究发现, 水分胁迫促进供硝态氮营养水稻根系通气组织的形成[10], 本试验研究结果与之相同。此外, 我们研究还发现, 在正常水分条件下, 供硝态氮营养水稻根系通气组织的形成会晚于供铵态氮营养水稻。这可能是因为正常水分条件下, 供应NO3--N能够促进植物根系的生长发育[20], 供硝态氮营养水稻根系生长速率比供铵态氮处理的快。在距离根尖相同位置, 供硝态氮营养水稻根系更幼嫩, 因而其通气组织面积占根系横切面面积的比例更小。在距离根尖40 mm处, SA处理的通气组织所占根系横切面的比例约为SN处理的1.75倍, 而在模拟水分胁迫条件下, 供硝态氮营养水稻根系通气组织形成的时间却较供铵态氮处理的早, 在SNP处理中的值约为SA的1.39倍, 在根系其他位置中各个处理间均表现出一致的趋势。
渗透调节是植物在干旱条件下的主要适应机制之一, 通过渗透调节可使植物在干旱条件下维持一定的膨压, 从而维持细胞生长、气孔开放和光合作用等生理过程的进行[21]。水分胁迫下, 植物体内会积累如脯氨酸、可溶性糖、游离氨基酸、甜菜碱等小分子渗透调节物质以保持细胞与环境的渗透平衡, 增强水稻渗透调节能力[22]。本研究结果表明, 模拟水分胁迫条件下, 供铵态氮营养水稻的脯氨酸含量是供硝态氮营养水稻的1.6倍, 说明供铵态氮营养水稻在模拟水分胁迫条件下渗透调节能力更强。又有研究表明, 脯氨酸具有抗氧化作用, 脯氨酸处理可显著抑制植物体内过氧化物引发的丙二醛 (MDA) 含量的增加[23]。我们的研究结果与该结论是一致的, 在脯氨酸含量高的供铵态氮营养水稻中, ‘汕优63’根系的MDA含量是供硝态氮营养水稻的84%。在‘扬稻6号’中, AP处理的MDA含量较高, 可能是由于该品种抗胁迫能力较差。MDA不仅是脂膜过氧化作用的最终分解产物, 同时还具有细胞毒性, 能与膜结构上的蛋白质和酶结合、交联, 使之失去活性, 从而破坏膜结构[24], 因此, MDA的含量可以反映植物遭受逆境伤害的程度。由此我们推断, 模拟水分胁迫条件下, 供硝态氮营养水稻渗透调节能力差, 抗氧化胁迫能力弱, 根系细胞氧化损伤程度严重, 正常的细胞代谢被破坏, 因此其根系通气组织形成早于且多于供铵态氮水稻根系。
3.2 活性氧调控通气组织的形成活性氧 (ROS) 作为植物正常代谢过程的产物, 正常条件下, 它的清除与产生系统保持一种动态平衡, 使其在植物体内的浓度维持在不引发伤害的低水平, 而外界环境引发的生物/非生物胁迫扰乱植物体内的正常代谢, 打破ROS的动态平衡。本研究结果中, 水分胁迫引发供硝态氮营养水稻根系呼吸速率显著增加134%(‘汕优63’) 和93%(‘扬稻6号’), 导致其超氧阴离子含量升高, 是供铵态氮营养水稻的7.7倍 (‘汕优63’) 和4.7倍 (‘扬稻6号’)。活性氧的积累会激活植物防御反应, 诱导非酶促清除机制 (抗坏血酸、谷胱甘肽、酚类复合物、维生素E) 和酶促清除机制 (SOD、CAT、POD、APX) 展开对ROS的清除工作。我们的试验结果表明, 模拟水分胁迫条件下, 供硝态氮营养水稻根系POD、CAT和SOD活性均显著低于供铵态氮营养水稻, 其ROS清除酶活性降低。此外, NP处理的根系呼吸速率远高于其他处理, 细胞CO2浓度升高会导致细胞质酸化、ATP含量降低, 从而抑制抗氧化剂谷胱甘肽的合成[25]。因此, 模拟水分胁迫条件下, 供硝态氮营养水稻根系的ROS酶促和非酶促清除反应均被抑制, ROS的动态平衡被打破, 可能导致ROS的大量积累。
ROS作为植物响应非生物胁迫信号传导的关键因素, 直接或间接地参与调节通气组织的形成[26]。NP处理中ROS的大量积累可能是其通气组织形成增大的原因之一。ROS积累出现在根皮层细胞DNA内切降解之前, 外皮层和内皮层中也有较强ROS信号, 这说明ROS可能参与了根皮层细胞程序化死亡和通气组织的形成[27]。Rajhi等[28]研究发现水分胁迫条件下, 在玉米根系皮层通气组织形成过程中, 编码呼吸爆发氧化酶同源物 (RBOH) 的基因显著上调, 受RBOH调节的ROS促进了玉米根系通气组织的形成。还有研究表明, 氧化胁迫时, 活性氧过度积累、脂质过氧化加剧会导致膜完整性被破坏[29]。因此, 我们推断模拟水分胁迫条件下, 供硝态氮营养水稻根系ROS大量积累后, 过度的脂质过氧化作用导致薄壁细胞膜受损, 引发细胞降解并产生大量空隙, 最终增加通气组织的形成。
| [1] |
茆智. 水稻节水灌溉及其对环境的影响[J].
中国工程科学, 2002, 4(7): 8–16.
Mao Z. Water saving irrigation for rice and its effect on environment[J]. Engineering Science, 2002, 4(7): 8–16. (in Chinese) |
| [2] |
程建平, 曹凑贵, 蔡明历, 等. 水分胁迫与氮素营养对水稻生理特性的影响[J].
干旱地区农业研究, 2007, 25(11): 149–154.
Cheng J P, Cao C G, Cai M L, et al. Effects of water stress and nitrogen nutrition on the physiological characteristics of rice[J]. Agricultural Research in the Arid Areas, 2007, 25(11): 149–154. (in Chinese) |
| [3] |
钱晓晴, 沈其荣, 徐国华. 配合施用NH4+-N和NO3--N对旱作水稻生长与水分利用效率的影响[J].
土壤学报, 2003, 40(6): 894–899.
Qian X Q, Shen Q R, Xu G H. Water utilization by rice growing in aerobic soil supplied with different ratio of NH4+-N and NO3--N[J]. Acta Pedologica Sinica, 2003, 40(6): 894–899. (in Chinese) |
| [4] | Guo S W, Chen G, Zhou Y, et al. Ammonium nutrition increases photosynthesis rate under water stress at early development stage of rice (Oryza sativa L.)[J]. Plant and Soil, 2007, 296: 115–124. DOI: 10.1007/s11104-007-9302-9 |
| [5] | Yang X X, Li Y, Ren B B, et al. Drought induced root aerenchyma formation restricts water uptake in rice seedlings supplied with nitrate[J]. Plant and Cell Physiology, 2012, 53(3): 495–504. DOI: 10.1093/pcp/pcs003 |
| [6] | Schussler E E, Longstreth D J. Aerenchyma develops by cell lysis in roots and cell separations in leaf petioles in Sagittaria lancifolia (Alismataceae)[J]. American Journal of Botany, 1996, 83(10): 1266–1271. DOI: 10.2307/2446110 |
| [7] | Evans D E. Aerenchyma formation[J]. New Phytologist, 2003, 161(1): 35–49. DOI: 10.1046/j.1469-8137.2003.00907.x |
| [8] | Drew M C, Jackson M B, Giffard S C, et al. Inhibition by silver ions of gas space (aerenchyma) formation in adventitious roots of Zea mays L. subjected to exogenous ethylene or to oxygen deficiency[J]. Planta, 1981, 153(3): 217–224. DOI: 10.1007/BF00383890 |
| [9] | Subbaiah C C, Sachs M M. Molecular and cellular adaptations of maize to flooding stress[J]. Annals of Botany, 2003, 91: 119–127. DOI: 10.1093/aob/mcf210 |
| [10] |
杨秀霞. 氮素形态和水分条件对水稻水分生理和氮素代谢影响的研究[D]. 南京: 南京农业大学, 2011.
Yang X X. Studies on the effects of nitrogen forms and water conditions on water physiological and nitrogen metabolism of rice seedlings[D]. Nanjing:Nanjing Agricultural University, 2011(in Chinese with English abstract). |
| [11] | Lu Z. Water-stressed maize, barley and rice seedlings show species diversity in mechanisms of leaf growth inhibition[J]. Journal of Experimental Botany, 1998, 49(329): 1945–1952. DOI: 10.1093/jxb/49.329.1945 |
| [12] | Michel B E, Kaufmann M R. The osmotic potential of polyethylene glycol 6000[J]. Plant Physiology, 1973, 51(5): 914–916. DOI: 10.1104/pp.51.5.914 |
| [13] | David J L, Olga N B. Root cell ultrastructure in developing aerenchyma tissues of three wetland species[J]. Annals of Botany, 2000, 86(3): 641–646. DOI: 10.1006/anbo.2000.1151 |
| [14] |
张殿忠, 汪沛洪, 赵会贤. 测定小麦叶片游离脯氨酸含量的方法[J].
植物生理学通讯, 1990(4): 62–65.
Zhang D Z, Wang P H, Zhao H X. Determination of the content of free proline in wheat leaves[J]. Plant Physlology Communlcation, 1990(4): 62–65. (in Chinese) |
| [15] |
赵世杰, 许长成. 植物组织中丙二醛测定方法的改进[J].
植物生理学通讯, 1991, 30(3): 207–210.
Zhao S J, Xu C C. Improvements of method for measurement of malondialdehvde in plant tissues[J]. Plant Physlology Communlcation, 1991, 30(3): 207–210. (in Chinese) |
| [16] | Bellaloui N, Zablotowicz R M, Reddy K N, et al. Nitrogen metabolism and seed composition as influenced by glyphosate application in glyphosate-resistant soybean[J]. Journal of Agricultural and Food Chemistry, 2008, 56(8): 2765–2772. DOI: 10.1021/jf703615m |
| [17] |
王学奎.
植物生理生化实验原理和技术[M]. 2版. 北京: 高等教育出版社, 2006: 167-173.
Wang X K. Plant Physiological and Biochemical Principles and Techniques[M]. 2nd ed. Beijing: Higher Education Press, 2006: 167-173. (in Chinese) |
| [18] | Wang A G, Luo G H. Quantitative relation between the reaction of hydroxylalmine and superoxide anion radical in plant[J]. Plant Physiology Communication, 1990, 6: 55–57. |
| [19] |
石庆华. 大穗型水稻根系生长特性与产量形成的研究[J].
江西农业大学学报, 1988, 10(S2): 52–62.
Shi Q H. Studies concerning the effects of root characteristics on the formation of yield in large-panicle type varieties[J]. Acta Agriculturae Universitis Jiangxiensis, 1988, 10(S2): 52–62. (in Chinese) |
| [20] | Suralta R R, Yamauchi A. Root growth, aerenchyma development, and oxygen transport in rice genotypes subjected to drought and waterlogging[J]. Environmental and Experimental Botany, 2008, 64(1): 75–82. DOI: 10.1016/j.envexpbot.2008.01.004 |
| [21] |
李德全, 邹琦, 程炳嵩. 抗旱性不同的冬小麦品种渗透调节能力的研究[J].
山东农业大学学报, 1991, 22(4): 377–383.
Li D Q, Zou Q, Cheng B S. Studies on the osmotic adjustment ability of winter wheat cultivars with different drought resistance[J]. Journal of Shandong Agricultural University, 1991, 22(4): 377–383. (in Chinese) |
| [22] | Ashraf M, Iram A. Drought stress induced changes in some organic substances in nodules and other plant parts of two potential legumes differing in salt tolerance[J]. Flora-Morphology, Distribution, Functional Ecology of Plants, 2005, 200(6): 533–546. |
| [23] |
赵丽英, 邓西平, 山仑. 活性氧清除系统对干旱胁迫的响应机制[J].
西北植物学报, 2005, 25(2): 413–418.
Zhao L Y, Deng X P, Shan L. The response mechanism of active oxygen species removing system to drought stress[J]. Acta Botanica Boreali-occidentalia Sinica, 2005, 25(2): 413–418. (in Chinese) |
| [24] |
张永峰, 殷波. 混合盐碱胁迫对苗期紫花苜蓿抗氧化酶活性及丙二醛含量的影响[J].
草业学报, 2009, 18(1): 46–50.
Zhang Y F, Yin B. Influences of salt and alkali mixed stresses on antioxidative activity and MDA content of Medicago sativa at seedling stage[J]. Acta Prataculturae Sinica, 2009, 18(1): 46–50. (in Chinese) |
| [25] | Blokhina O B, Virolainen E, Fagerstedt K V, et al. Antioxidant status of anoxia-tolerant and intolerant plant species under anoxia and reaeration[J]. Physiologia Plantarum, 2000, 109(4): 396–403. DOI: 10.1034/j.1399-3054.2000.100405.x |
| [26] | Suzuki N, Miller G, Morales J, et al. Respiratory burst oxidases, the engines of ROS signaling[J]. Current Opinion in Plant Biology, 2011, 14(6): 691–699. DOI: 10.1016/j.pbi.2011.07.014 |
| [27] |
邓祥宜, 李继伟, 阳超男, 等. 淹水胁迫下小麦根通气组织形成的PCD特征及活性氧作用初探[J].
麦类作物学报, 2009, 29(5): 832–838.
Deng X Y, Li J W, Yang C N, et al. A preliminary study on PCD aspects and roles of reactive oxygen species during aerenchyma formation inwheat roots under waterlogging[J]. Journal of Triticeae Crops, 2009, 29(5): 832–838. (in Chinese) |
| [28] | Rajhi I, Yamauchi T, Takahashi H, et al. Identification of genes expressed in maize root cortical cells during lysigenous aerenchyma formation using laser microdissection and microarray analyses[J]. New Phytologist, 2011, 190(2): 351–368. DOI: 10.1111/j.1469-8137.2010.03535.x |
| [29] | Blokhina O B, Fagerstedt K V. Relationships between lipid peroxidation and anoxia tolerance in a range of species during post-anoxic reaeration[J]. Physiologia Plantarum, 1999, 105: 625–632. DOI: 10.1034/j.1399-3054.1999.105405.x |




