文章信息
- 乐星星, 顾向阳
- LE Xingxing, GU Xiangyang
- 亚硝酸盐对EBPR工艺除磷效率的影响
- Effects of nitrite on phosphorus removal rate during EBPR process
- 南京农业大学学报, 2017, 40(2): 266-272
- Journal of Nanjing Agricultural University, 2017, 40(2): 266-272.
- http://dx.doi.org/10.7685/jnau.201604050
-
文章历史
- 收稿日期: 2016-04-20
强化生物除磷 (EBPR) 工艺是城市污水处理中最为经济的除磷工艺, 该工艺依赖聚磷菌 (PAO) 在厌氧-好氧或厌氧-缺氧交替条件下对磷的超量吸收实现高效的除磷效率[1-2]。在厌氧条件下PAO吸收废水中的挥发性有机酸并转化为聚羟基烷酸 (PHA) 贮存起来, 其合成PHA所需的还原力来自胞内糖原的降解, 吸收碳源所需的能量来自胞内多聚磷酸盐 (poly-P) 水解产生的ATP, 同时将磷酸根释放至胞外; 进入好氧或缺氧阶段后PAO以胞内PHA为碳源生长, 同时合成糖原并吸收废水中的磷酸根, 其超量吸收的磷又以poly-P形式在细胞内贮存起来, 因此通过排除富磷的剩余生物污泥即可实现废水中磷的去除[1-2]。
稳态运行的EBPR工艺中无需添加任何化学药剂, 其出水磷浓度可稳定在0.5 mg·L-1以下。然而, EBPR工艺运行过程中常常存在除磷效率不稳定的现象, 无论是实验室装置还是实际工程, 在运行过程中都会出现除磷功能下降甚至完全丧失的现象[2]。Mino等[3]研究认为导致EBPR工艺除磷效率下降的因素主要有负荷过高、过度曝气、缺乏K+离子和亚硝酸盐的抑制作用等, 显然前三者比较容易调整, 亚硝酸盐的控制就比较困难了。由于亚硝酸盐的产生是内源性的, 即由系统好氧池内硝化细菌的活动产生的, 因此亚硝酸盐引起的抑制作用及其控制逐渐成为该领域的研究热点[4-13]。由于不同的研究者采用的污泥特性、水质条件等试验条件不尽相同, 文献报道的亚硝酸盐的抑制浓度范围有较大差别, 例如Saito等[5]报道2 mg·L-1亚硝氮存在时PAO的好氧吸磷即可被完全抑制, Ahn等[14]报道缺氧吸磷在亚硝氮质量浓度高达40 mg·L-1时仍可进行。从进水水质来看, 有的学者以乙酸为碳源, 有的采用实际废水进行试验, 得出的结果难以比较。事实上, PAO可利用的碳源包括乙酸、丙酸等各种挥发性有机酸[15-16], 而不同的进水碳源如何影响亚硝酸盐对除磷污泥的抑制作用尚未见报道。因此本文比较2种通用碳源 (乙酸和丙酸) 条件下亚硝酸盐对EBPR污泥的抑制作用, 以期找出有利于缓解抑制作用的碳源物质, 为EBPR工艺的稳定运行提供理论与技术依据。
1 材料与方法 1.1 试验装置及其运行条件污泥驯化在序批式生物反应器 (SBR) 中进行, 反应器高30 cm, 内径15 cm, 有效容积为3.4 L。同时运行2套SBR, 分别进以乙酸 (SBR-1) 或丙酸 (SBR-2) 为唯一碳源的合成废水。2套装置除进水碳源物质不同外, 其运行周期及运行条件相同。运行周期包括进水15 min, 厌氧搅拌120 min, 好氧曝气240 min, 静置沉淀30 min, 沉淀排水15 min和闲置60 min。种子污泥取自南京市仙林污水处理厂沉淀池, 装置启动时向每个反应器中加入1.7 L种子污泥和1.7 L人工废水, 初始污泥质量浓度约为5 g·L-1, 然后按上述周期运行, 在运行周期的厌氧阶段依靠大功率磁力搅拌器使污泥保持悬浮状态, 好氧阶段则采用微型曝气头供氧, 曝气量为0.88 L·L-1·min-1。2套装置的换水比均为50%, 运行温度均为22 ℃。运行过程中每天定时排除一定量的剩余污泥, 使固体停留时间 (SRT) 控制在15 d左右, 同时每天取样测定厌氧末期混合液中以及好氧末期出水中磷酸根的质量浓度, 待系统除磷效率达到97%以上, 且稳定运行45 d后备用。
人工废水配方:CH3COOH 0.288 g·L-1或CH3CH2COOH 0.237 g·L-1(折合理论有机碳质量浓度均为9.6 mmol·L-1)、NaCl 0.1 g·L-1、NH4Cl 0.061 g·L-1、MgSO4·7H2O 0.04 g·L-1、K2HPO4·3H2O 0.09 g·L-1、CaCl2·2H2O 0.008 g·L-1、微量元素溶液0.5 mL, pH7.0。微量元素溶液:FeCl3·6H2O 1.5 g·L-1、H3BO3 0.15 g·L-1、CuSO4·5H2O 0.03 g·L-1、KI 0.18 g·L-1、MnCl2·4H2O 0.12 g·L-1、Na2MoO4·2H2O 0.06 g·L-1、ZnSO4·7H2O 0.12 g·L-1、CoCl2·6H2O 0.15 g·L-1、EDTA 10 g·L-1。
1.2 亚硝酸盐对EBPR污泥生物除磷过程的抑制作用测定从稳态运行的SBR中取好氧末期的污泥混合液, 静置沉降30 min沉淀活性污泥, 倒出部分清水使活性污泥浓度浓缩1倍。向6个120 mL血清瓶中加入60 mL浓缩污泥, 向血清瓶中通入无氧氮气5 min以除去残留的溶解氧, 依次加入含有不同质量浓度亚硝酸盐 (以乙酸驯化的EBPR污泥进行的试验中分别为0、5.0、7.5、10.0、12.5和15.0 mg·L-1, 以丙酸驯化的EBPR污泥进行的试验中分别为0、2.5、5.0、7.5、10.0和12.5 mg·L-1) 的人工废水60 mL, 立即混匀并盖上橡胶塞, 然后在密闭严格厌氧条件下置22 ℃、160 r·min-1恒温摇床振荡培养, 模拟运行周期的厌氧期, 2 h后将混合液转入500 mL三角瓶, 置22 ℃、160 r·min-1恒温摇床振荡培养, 模拟运行周期的好氧期。在上述运行周期中每隔0.5 h取出污泥混合液1 mL, 10 000 r·min-1离心沉淀污泥, 上清液用于磷酸根和亚硝氮的测定。在厌氧结束时和好氧结束时, 另外取5 mL混合液用于测定污泥中糖原的含量, 30 mL混合液用于污泥中PHA的测定。
1.3 分析与检测方法混合液或出水中磷酸根和亚硝氮的质量浓度均采用文献[17]中的国标方法测定。污泥总磷的质量浓度采用文献[18]的方法测定, 污泥中的糖原用0.6 mol·L-1HCl经沸水浴消解后采用蒽酮法[19]测定, 污泥中的PHA用氯仿-甲醇法提取后采用紫外比色法[19]测定。聚磷菌胞内poly-P用甲苯胺蓝染色法[19]检测, PHA用苏丹黑染色法[19]检测, 经染色的样品置于光学显微镜油镜下观察, 并用数码相机拍照。
2 结果与分析 2.1 EBPR污泥的驯化及SBR运行结果图 1为EBPR污泥驯化期间2个反应器的除磷效率以及厌氧、好氧末期混合液中磷酸根质量浓度的动态变化。结果显示:以乙酸为进水碳源的SBR-1中初始除磷效率仅为14.6%, 随后除磷效率迅速上升, 至第8天上升至97.5%, 反应器出水中磷酸根质量浓度则从初始的10.2 mg·L-1逐渐下降至0.3 mg·L-1, 说明经过短短8 d的运行系统已实现了EBPR功能; SBR-2的驯化效果与SBR-1相似, 除磷效率从初始的28.9%上升至97.8%经历了11 d的时间, 驯化时间仅比SBR-1多了3 d, 随后2个反应器的除磷效率均稳定在98%以上, 出水磷酸根质量浓度则稳定在0.3 mg·L-1以下, 说明乙酸和丙酸均可用作聚磷菌的碳源。从图 1还可以看出:2个反应器在厌氧末期混合液中的磷酸根质量浓度不仅始终高于好氧末期出水中磷酸根质量浓度, 而且显著高于进水中的磷酸根质量浓度 (12 mg·L-1), 说明活性污泥在厌氧阶段均存在磷的释放现象。而进水碳源不同时, 活性污泥在厌氧期释放产生的磷酸根含量及其变化趋势有明显差异。在以乙酸为进水碳源的SBR-1中厌氧释放的初始磷酸根质量浓度为27.2 mg·L-1, 随着运行时间的延长厌氧释磷量持续上升, 运行至11 d达到最大值, 之后一直稳定在70.7 mg·L-1左右 (68.4~74.7 mg·L-1); 在以丙酸为进水碳源的SBR-2中厌氧释磷的初始磷酸根浓度与SBR-1相似 (26.3 mg·L-1), 但其后的运行过程中厌氧释放的磷酸根质量浓度的增幅较为缓慢, 运行21 d后才达到最大值, 随后稳定在59.7 mg·L-1附近波动 (56.1~64.3 mg·L-1), 直至驯化期结束。

|
图 1 EBPR污泥驯化期间除磷效率的动态变化 Figure 1 Variations in phosphorus removal rate during the acclimation period of enhanced biological phosphorus removal (EBPR) sludge SBR-1为以乙酸为进水碳源; SBR-2为以丙酸为进水碳源。SBR-1 was fed with acetic acid as the influent carbon source; SBR-2 was fed with propionic acid as the influent carbon source. The same as follows. |
稳态运行的EBPR污泥表现出聚磷菌所特有的厌氧释磷和好氧吸磷的周期特征。化学分析结果显示:以乙酸、丙酸驯化所得EBPR污泥中总磷含量分别达61.2和58.5 g·kg-1, 而种子污泥的磷含量仅17.3 g·kg-1, 说明种子污泥经过驯化培养已经成为典型的富磷污泥。聚磷菌的特异性染色结果也证明2个反应器中聚磷菌均已被成功富集 (图 2), 因此可以用于下一步的试验研究。
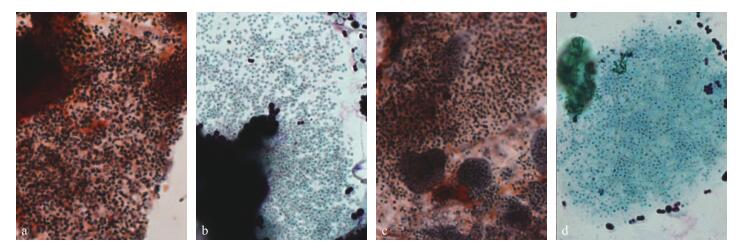
|
图 2 稳态运行时EBPR污泥的染色结果 Figure 2 Images of EBPR sludge samples at steady state operation a、c为苏丹黑染色, 示PAO胞内PHA颗粒, b、d为甲苯胺蓝染色, 示PAO胞内poly-P颗粒; a、b是以乙酸为碳源驯化的EBPR污泥, c、d是以丙酸为碳源驯化的EBPR污泥。a, c:Sudan black staining, showing PHA granules in PAOs; b, d:Toluidine blue staining, showing poly-P granules in PAOs; a, b:EBPR sludge acclimated with acetic acid as influent carbon source; c, d:EBPR sludge acclimated with propionic acid as influent carbon source. |
以2个SBR中成功驯化的EBPR污泥为材料, 各取1个运行周期测定亚硝酸盐对聚磷菌除磷过程的影响, 结果发现亚硝酸盐对聚磷菌厌氧释磷和好氧吸磷作用的影响是不同的, 较高浓度的亚硝酸盐对厌氧释磷有一定的促进作用, 对好氧吸磷则有明显的抑制作用, 而且进水碳源不同时, 亚硝酸盐对聚磷菌除磷的影响程度是不同的 (图 3)。
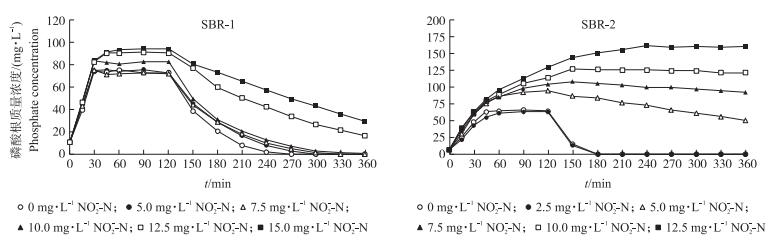
|
图 3 亚硝酸盐对EBPR污泥厌氧释磷和好氧吸磷的影响 Figure 3 Effects of nitrite on anaerobic phosphorus release and aerobic phosphorus uptake by EBPR sludge |
在以乙酸为进水碳源的SBR-1中, 亚硝酸盐对聚磷菌厌氧释磷的促进作用和好氧吸磷的抑制作用相对弱一些, 当亚硝氮质量浓度小于等于7.5 mg·L-1时, 厌氧释磷曲线基本重合, 经30 min厌氧培养即达到最大释放量 (72.7 mg·L-1); 当进水中亚硝氮质量浓度大于等于10.0 mg·L-1时厌氧释磷速率略有增加, 最大释放量也有所增加。例如在添加10.0、12.5和15.0 mg·L-1亚硝氮的处理中, 厌氧培养60 min后达到的最大释放量分别上升至82.5、90.8和93.8 mg·L-1。进入好氧阶段所有添加亚硝酸盐的处理中好氧吸磷作用均受到不同程度的抑制作用, 其中亚硝氮添加量在5.0、7.5和10.0 mg·L-1的处理中其平均吸磷速率由对照的11.2 mg·g-1·h-1分别下降至9.3、9.1和8.9 mg·g-1·h-1。由于影响程度相对较小, 好氧结束时出水中磷的质量浓度仍可下降至0.5 mg·L-1以下, 但在亚硝氮添加量为12.5和15.0 mg·L-1的处理中, 其厌氧释放的磷本来就高于其他处理, 而其平均吸磷速率反而进一步下降至7.2和6.2 mg·g-1·h-1, 结果导致好氧出水中磷酸根质量浓度大幅上升至16.4和29.2 mg·L-1, 超出了进水中磷的质量浓度, 说明污泥已经完全丧失了净吸收功能。
在以丙酸为碳源的SBR-2中除了亚硝氮添加量为2.5 mg·L-1的处理中其除磷过程未受明显影响外, 其他处理中亚硝酸盐对聚磷菌的厌氧释磷和好氧吸磷均有显著影响, 其中亚硝氮添加量为5.0、7.5、10.0和12.5 mg·L-1的处理中厌氧释磷速率明显加快, 培养至厌氧期结束时磷的释放量由对照的64.1 mg·L-1分别上升至94.0、104.5、113.9和129.4 mg·L-1, 与对照相比分别提高了46.6%、63.0%、77.7%和101.9%;而进入好氧阶段其吸磷速率则由对照的24.6 mg·g-1·h-1分别下降至4.3、1.1、-0.7和-3.1 mg·g-1·h-1。在亚硝氮添加量为10.0和12.5 mg·L-1的处理中磷吸收速率甚至出现了负值, 说明好氧阶段在高亚硝酸盐存在时也会导致磷的释放, 且释放速率已经超过了磷吸收的速率。实际上, 由于厌氧释放的磷显著上升而好氧吸磷的速率大幅下降, 结果导致亚硝氮添加量为5.0、7.5、10.0和12.5 mg·L-1的处理好氧期结束时出水中磷酸根质量浓度大幅上升至49.7、92.8、121.3和161.7 mg·L-1, 完全丧失了磷的净吸收功能, 由此可见, 以丙酸为进水碳源时亚硝酸盐对聚磷菌生物除磷过程的影响都要比SBR-1中强得多。
2.3 EBPR污泥对亚硝酸盐的脱氮作用在本研究中虽然驯化期间2个反应器中从未人为添加过亚硝酸盐, 但2个反应器中驯化而成的EBPR污泥均有一定的脱氮能力, 但不同碳源驯化EBPR污泥其脱氮能力有明显差异 (图 4)。取自SBR-1的EBPR污泥在添加亚硝氮质量浓度为5.0~10.0 mg·L-1时, 厌氧培养60 min即可完全降解, 脱氮速率均为3.8 mg·g-1·h-1, 当亚硝氮添加量增至12.5~15.0 mg·L-1时, 脱氮速率下降为1.73和1.5 mg·g-1·h-1, 至厌氧期结束时分别有3.5和7.2 mg·L-1亚硝氮残留, 转入好氧阶段 (120~180 min) 略有降解, 之后仍有2.6和5.9 mg·L-1亚硝氮残留, 直至好氧期结束再无明显降解。SBR-2中EBPR污泥脱氮能力较弱, 在添加2.5 mg·L-1亚硝氮的处理中降解速率仅1.28 mg·g-1·h-1, 而亚硝氮添加量大于等于5.0 mg·L-1时对脱氮活性产生明显抑制作用, 脱氮速率下降至0.62~0.73 mg·g-1·h-1, 培养至厌氧期结束仍不能完全降解。在亚硝氮添加量为5.0、7.5、10.0和12.5 mg·L-1的处理中, 厌氧结束时分别有1.51、4.07、6.20和9.29 mg·L-1亚硝氮残留, 转入好氧期培养后虽有短暂的降解现象, 但最终仍有1.62、3.29、4.03和4.93 mg·L-1亚硝氮残留。总的来看, 在EBPR污泥活性未受亚硝酸盐抑制的情况下, 以乙酸为进水碳源驯化的EBPR污泥对亚硝酸盐的脱氮活性高于以丙酸为碳源驯化而成的EBPR污泥, 但较高的亚硝酸盐对EBPR污泥的脱氮活性有明显的抑制作用。
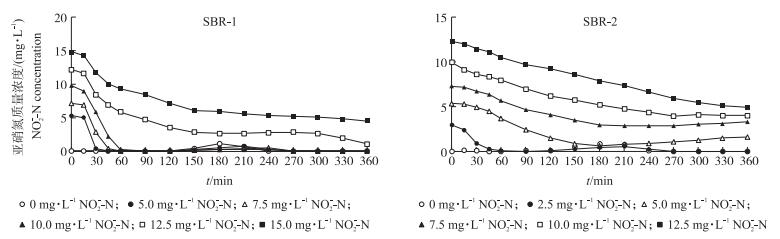
|
图 4 EBPR污泥厌氧-好氧周期中亚硝氮的动态变化 Figure 4 Variations of nitrous nitrogen during the anaerobic-aerobic cycle of EBPR sludge |
显然, 脱氮能力强的EBPR污泥可以更有效地降低亚硝氮残留从而缓解亚硝酸盐引起的抑制作用, 这可以解释图 3中乙酸驯化的EBPR污泥比丙酸驯化的EBPR污泥可以耐受更高浓度亚硝氮的现象。
2.4 亚硝酸盐对聚磷菌胞内聚羟基烷酸 (PHA) 和糖原代谢的影响为了分析亚硝酸盐抑制生物除磷的机制, 我们进一步研究了不同浓度亚硝酸盐对聚磷菌厌氧期PHA合成与糖原降解的影响以及好氧期PHA降解与糖原合成的影响。从图 5可以看出:对以乙酸驯化的聚磷菌而言, 5.0~15.0 mg·L-1亚硝氮对厌氧期聚磷菌PHA的合成量和糖原降解量无显著影响, 当亚硝氮投加量小于等于10.0 mg·L-1时对好氧期聚磷菌PHA降解量和糖原合成量也无显著影响, 但12.5~15.0 mg·L-1亚硝氮存在时好氧期聚磷菌PHA降解量和糖原合成量明显下降, 其中PHA降解量较对照分别低14.0%和17.8%, 糖原合成量较对照分别低27.2%和37.7%。对以丙酸驯化的聚磷菌而言, 添加2.5 mg·L-1亚硝氮的处理中, 无论厌氧期聚磷菌PHA的合成量和糖原的降解量, 还是好氧期聚磷菌PHA的降解量和糖原的合成量均与对照无显著差异, 而添加5.0~12.5 mg·L-1亚硝氮时除了对厌氧期聚磷菌PHA合成量无显著影响外, 对厌氧期聚磷菌糖原的降解以及好氧期聚磷菌PHA降解和糖原合成均有明显抑制作用, 但抑制程度有明显差异, 对厌氧期聚磷菌糖原降解量的影响相对较小, 在添加5.0、7.5、10.0和12.5 mg·L-1亚硝氮的处理中糖原的降解量分别比对照低14.5%、23.3%、32.4%和39.8%;而对好氧期聚磷菌PHA的降解和糖原合成影响较大, 例如在添加5.0、7.5、10.0和12.5 mg·L-1亚硝氮的处理中PHA降解量分别比对照低25.0%、34.6%、46.9%和54.3%, 糖原的合成量分别比对照低50.6%、81.8%、125.6%和143.3%。值得注意的是, 在添加10.0和12.5 mg·L-1亚硝氮的处理中, 好氧期聚磷菌胞内糖原不仅没有恢复合成, 反而继续降解, 这说明聚磷菌胞内糖原的代谢已受到严重干扰。
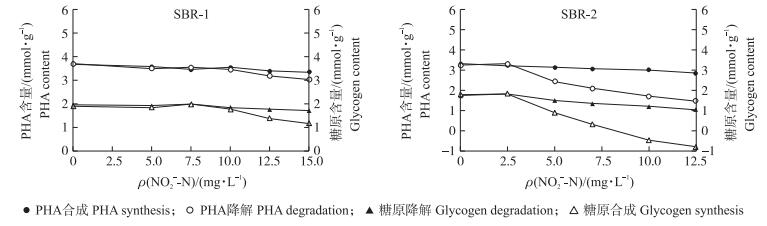
|
图 5 不同碳源条件下亚硝酸盐对聚磷菌聚羟基烷酸 (PHA) 和糖原代谢的影响 Figure 5 Effects of nitrite on metabolism of PHA and glycogen in PAOs fed with different carbon sources PHA和糖原含量均以碳计.PHA and glycogen contents are calculated by carbon. |
亚硝酸盐对EBPR工艺除磷效率的抑制作用已被大量文献[4-13]所证实, 但文献中研究较多的主要是亚硝酸盐对聚磷菌好氧或缺氧吸磷的抑制作用, 对厌氧释磷的影响报道较少。本研究结果发现:较高浓度的亚硝酸盐对EBPR污泥的厌氧释磷和好氧吸磷过程均有显著影响, 但对两个过程的影响方式截然不同, 对前者主要表现为促进作用, 对后者则主要表现为抑制作用。值得注意的是, 亚硝酸盐对厌氧释磷的促进作用并未对生物除磷过程带来有益的影响, 相反导致过高的磷负荷被带入后续好氧吸磷阶段, 由于好氧吸磷速率受亚硝酸盐的影响而显著下降, 最终导致除磷效率下降甚至除磷功能丧失。
亚硝酸盐抑制生物除磷的机制目前尚不清楚, 近年来部分研究发现影响生物除磷的真正的抑制物质并不是亚硝酸盐, 而是亚硝酸根的质子化形式即游离亚硝酸 (HNO2, FNA)[10-13]。经理论计算可知:SBR-1和SBR-2中产生抑制作用的处理中游离亚硝酸的浓度分别为0.004 12~0.008 44 mg·L-1和0.001 81~0. 011 10 mg·L-1, 确实达到或超过了文献报道的抑制浓度范围 (0.000 47~0.002 00 mg·L-1)[9-13]。有的学者认为游离亚硝酸是一种解偶联剂, 可破坏氧化磷酸化的进行, 使PAO得不到足够的能量而影响磷的吸收[6], 但是该假说与本研究的试验结果相矛盾。因为SBR-1和SBR-2中驯化的EBPR污泥均具有脱氮功能, 这意味着它们能够以亚硝酸盐为最终电子受体进行能量代谢。Zhou等[11]认为游离亚硝酸可以通过被动扩散的方式透过细胞膜, 因PAO胞内原生质呈pH中性可使之转为NO2-阴离子存在于细胞内, 为了避免由此引起的原生质酸化, PAO必须依赖耗能的ATP酶泵出质子, 同时也造成磷的释放。该理论可以很好地解释较高浓度的亚硝酸盐促进厌氧释磷的现象, 也可部分解释好氧吸磷的抑制作用。根据本研究试验结果, 较高浓度的亚硝酸盐可使好氧阶段EBPR污泥中PHA降解量明显下降, 说明亚硝酸盐可能直接抑制PHA降解酶的活性, 这一结果为亚硝酸盐抑制生物除磷的机制提供新的解释:PHA是好氧阶段PAO可利用的主要碳源物质, 其降解需为PAO胞内糖原的合成、磷的吸收乃至菌体生长提供能量, 因此亚硝酸盐引起的PHA降解量下降, 必将导致PAO能量不足, 从而影响磷的吸收。
EBPR工艺中影响聚磷菌活性的抑制物质是亚硝酸根离子还是游离亚硝酸尚无定论, 不过SBR-2中导致抑制作用发生时亚硝酸盐或游离亚硝酸的最低浓度均低于SBR-1, 说明以丙酸驯化的EBPR污泥对亚硝酸盐或游离亚硝酸更为敏感。上述差异同污泥中聚磷菌的种群类型及其脱氮能力有关, 目前文献报道的聚磷菌分为tpyeⅠ和type Ⅱ两类, 其中tpyeⅠ能利用硝酸盐或亚硝酸盐作为最终电子受体, type Ⅱ则不具脱氮能力[20]。以乙酸为进水碳源驯化的EBPR污泥显然是属于typeⅠ的聚磷菌, 其脱氮活性强, 可以更有效地降低亚硝氮残留从而缓解亚硝酸盐或游离亚硝酸引起的抑制作用, 因此在实际工程中应用乙酸为进水碳源更有利于EBPR工艺的稳定运行。
| [1] | van Loosdrecht M C M, Hooijmans C M, Brdjanovic D, et al. Biological phosphate removal processes[J]. Appl Microbiol Biotechnol, 1997, 48(3): 289–296. DOI: 10.1007/s002530051052 |
| [2] | Blackall L L, Crocetti G R, Saunders A M, et al. A review and update of the microbiology of enhanced biological phosphorus removal in wastewater treatment plants[J]. Antonie van Leeuwenhoak, 2002, 81: 681–691. DOI: 10.1023/A:1020538429009 |
| [3] | Mino T, van Loosdrecht M C M, Heijnen J J. Microbiology and biochemistry of the enhanced biological phosphate removal process[J]. Water Research, 1998, 32(11): 3193–3207. DOI: 10.1016/S0043-1354(98)00129-8 |
| [4] | Meinhold J, Arnold E, Isaacs S. Effect of nitrite on anoxic phosphate uptake in biological phosphorus removal activated sludge[J]. Water Research, 1999, 33(8): 1871–1883. DOI: 10.1016/S0043-1354(98)00411-4 |
| [5] | Saito T, Brdjanovic D, van Loosdrecht M C M. Effect of nitrite on phosphate uptake by phosphate accumulating organisms[J]. Water Research, 2004, 38(17): 3760–3768. DOI: 10.1016/j.watres.2004.05.023 |
| [6] |
曾薇, 李磊, 杨莹莹, 等. 亚硝酸盐积累对A2O工艺生物除磷的影响[J].
环境科学, 2010, 31(9): 2105–2112.
Zeng W, Li L, Yang Y Y, et al. Effects of nitrite accumulation on enhanced biological phosphorus removal in A2O process treating domestic wastewater[J]. Environmental Sciences, 2010, 31(9): 2105–2112. (in Chinese) |
| [7] | Zheng X, Sun P, Han J, et al. Inhibitory factors affecting the process of enhanced biological phosphorus removal (EBPR):a mini-review[J]. Process Biochemistry, 2014, 49(12): 2207–2213. DOI: 10.1016/j.procbio.2014.10.008 |
| [8] | Zeng W, Yang Y, Li L, et al. Effect of nitrite from nitritation on biological phosphorus removal in a sequencing batch reactor treating domestic wastewater[J]. Bioresource Technology, 2011, 102(12): 6657–6664. DOI: 10.1016/j.biortech.2011.03.091 |
| [9] | Zeng W, Li B, Yang Y, et al. Impact of nitrite on aerobic phosphorus uptake by poly-phosphate accumulating organisms in enhanced biological phosphorus removal sludges[J]. Bioprocess Biosyst Eng, 2014, 37(2): 277–287. DOI: 10.1007/s00449-013-0993-4 |
| [10] | Zhou Y, Pijuan M, Yuan Z. Free nitrous acid inhibition on anoxic phosphorus uptake and denitrification by poly-phosphate accumulating organisms[J]. Biotechnology and Bioengineering, 2007, 98(4): 903–912. DOI: 10.1002/(ISSN)1097-0290 |
| [11] | Zhou Y, Ganda L, Lim M, et al. Response of poly-phosphate accumulating organisms to free nitrous acid inhibition under anoxic and aerobic conditions[J]. Bioresource Technology, 2012, 116: 340–347. DOI: 10.1016/j.biortech.2012.03.111 |
| [12] | Pijuan M, Ye L, Yuan Z. Free nitrous acid inhibition on the aerobic metabolism of poly-phosphate accumulating organisms[J]. Water Research, 2010, 44(20): 6063–6072. DOI: 10.1016/j.watres.2010.07.075 |
| [13] | Ye L, Pijuan M, Yuan Z. The effect of free nitrous acid on key anaerobic processes in enhanced biological phosphorus removal systems[J]. Bioresource Technology, 2013, 130: 382–389. DOI: 10.1016/j.biortech.2012.11.127 |
| [14] | Ahn J, Daidou T, Tsuneda S, et al. Metabolic behavior of denitrifying phosphate-accumulating organisms under nitrate and nitrite electron acceptor conditions[J]. J Biosci Bioeng, 2001, 92(5): 442–446. DOI: 10.1016/S1389-1723(01)80293-0 |
| [15] | Puig S, Coma M, Monclus H, et al. Selection between alcohols and volatile fatty acids as external carbon sources for EBPR[J]. Water Research, 2008, 42(3): 557–566. DOI: 10.1016/j.watres.2007.07.050 |
| [16] | Pijuan M, Saunders A M, Guisasola A, et al. Enhanced biological phosphorus removal in a sequencing batch reactor using propionate as the sole carbon source[J]. Biotechnology and Bioengineering, 2004, 85(1): 56–67. DOI: 10.1002/(ISSN)1097-0290 |
| [17] |
国家环境保护总局.
水和废水检测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002.
State Environmental Protection Administration. Analytical Methods for the Monitoring of Water and Wastewater[M]. 4th ed. Beijing: China Environmental Science Press, 2002. (in Chinese) |
| [18] |
冯新长, 张黎黎. 污水处理厂剩余污泥中总磷的测定[J].
环境科学导刊, 2012, 31(3): 94–96.
Feng X Z, Zhang L L. Determination of total phosphorus in surplus sludge of sewage treatment plant[J]. Environmental Science Survey, 2012, 31(3): 94–96. (in Chinese) |
| [19] |
李夕耀, 彭永臻, 王淑莹, 等. 聚磷菌胞内多聚物的分析检测方法[J].
四川环境, 2009, 28(2): 106–111.
Li X Y, Peng Y Z, Wang S Y, et al. Analytical method for intracellular polymers of polyphosphate accumulating organisms[J]. Sichuan Environment, 2009, 28(2): 106–111. (in Chinese) |
| [20] | Zeng W, Li B X, Wang X D, et al. Influence of nitrite accumulation on "Candidatus Accumulibacter" population structure and enhanced biological phosphorus removal from municipal wastewater[J]. Chemosphere, 2016, 144: 1018–1025. DOI: 10.1016/j.chemosphere.2015.08.064 |




