文章信息
- 顾少涵, 潘俏, 李子昂, 陈洁, 陈劲枫, 娄群峰
- GU Shaohan, PAN Qiao, LI Zi'ang, CHEN Jie, CHEN Jinfeng, LOU Qunfeng
- 黄瓜耐低温突变体材料的筛选与鉴定
- Screening and identification of cold tolerant mutants of cucumber
- 南京农业大学学报, 2017, 40(2): 219-224
- Journal of Nanjing Agricultural University, 2017, 40(2): 219-224.
- http://dx.doi.org/10.7685/jnau.201606025
-
文章历史
- 收稿日期: 2016-06-19
黄瓜 (Cucumis sativus L.) 又称胡瓜、青瓜, 原产于喜马拉雅山南麓的热带雨林地区和中国的云南地区, 为葫芦科甜瓜属植物。黄瓜是世界重要的蔬菜作物之一, 是设施栽培的主要蔬菜作物, 在生产和消费上有着重要的地位。
黄瓜作为起源于热带的蔬菜, 是一种喜温作物, 适宜生长的温度范围为日温25~30 ℃, 夜温13~15 ℃。黄瓜对低温敏感, 在冬季和早春栽培黄瓜时, 经常会遇到0~13 ℃的低温伤害。设施环境中低温、弱光等环境因素极大的影响了瓜类作物的早熟、高产及品质[1]。随着蔬菜反季节栽培面积的不断扩大, 如何提高黄瓜耐低温性已成为目前品种选育的研究重点[2]。
黄瓜幼苗在低温胁迫下, 细胞通过感知低温引起的细胞膜流动性及膜蛋白和构象的变化来感受低温胁迫[3]。严重的低温胁迫破坏了膜结构的完整性, 从而导致细胞质溶液外渗。在适宜生长的温度条件下, 黄瓜体内的活性氧的产生和清除处于平衡状态, 当胁迫发生时, 活性氧会迅速升高[4], 最终使膜脂过氧化, 产生丙二醛。除此之外, 在低温胁迫下黄瓜叶绿体的超微结构会发生类囊体膜膨胀甚至检测不到类囊体膜的存在; 叶绿体的合成能力降低[5], 而且降解加剧, 导致总含量下降, 黄瓜的生长受到抑制。在分子水平方面, 植物细胞膜上的受体感受到环境的冷害胁迫的信号后, 通过依赖于ABA途径和不依赖于ABA途径两条通路, 从而激活了细胞核中转录因子的表达。之后转录因子调控功能基因COR47、RD29A及KIN1等抗性基因的表达, 从而使植物表现出抗寒的表型[6-7]。
黄瓜耐低温材料的筛选主要分为发芽期和苗期两个阶段。根据种子低温发芽能力来鉴定材料的耐低温性不仅简单、可靠而且周期短。于栓仓等[8]依据低温条件下种子的综合活力、超弱发光指标和胚根伸长指标来评价黄瓜种质发芽期低温耐受性。刘雪梅[9]利用13 ℃发芽期各指标相对变化率并运用极点排序法, 快速评价黄瓜品种耐低温性。黄瓜苗期的耐低温性鉴定通常选用形态指标和生理指标相结合的方法。苗永美等[10]用冷害指数、电导率和抗氧化酶等12个耐低温指标对13份黄瓜材料进行筛选, 通过聚类分析将黄瓜材料耐低温性分为3个等级。
目前生产上耐低温的品种类型仍较为少见, 其主要原因是缺乏耐低温资源材料。本文通过对大量黄瓜突变体材料进行耐低温的筛选和鉴定, 旨在获得耐低温能力强的新材料。这些新材料的获得对今后生理、生化甚至分子水平上深入研究黄瓜的耐低温机制以及选育黄瓜的耐低温品种具有重要的意义和价值。
1 材料与方法 1.1 材料本试验选用的材料均由南京农业大学葫芦科作物遗传与种质创新实验室提供。前期已获得华北型黄瓜‘长春密刺’用1.5%(体积分数) 甲基磺酸乙酯处理8 h后自交三代的突变体材料。所用种子均为2015年秋季收获, 挑选饱满度和整齐度都较高的种子用于试验。
1.2 方法 1.2.1 芽期耐低温筛选对上述试验的1 818份突变体材料进行编号, 每1个编号取饱满一致的种子5粒置于相应编号的滤纸盒中, 重复3次。将滤纸盒放置于铺设双层浸湿滤纸的托盘中。在13 ℃的低温条件下进行发芽处理, 定时补加相同温度的蒸馏水以保持种子发芽的湿度。低温处理30 d后, 以野生型‘长春密刺’为对照, 依据处理种子的发芽情况及胚根生长状态, 初步筛选出耐低温黄瓜材料。
1.2.2 苗期耐低温鉴定将筛选出的材料和对照‘长春密刺’用55 ℃水浸种4 h后, 催芽并播种于15孔穴盘中。育苗基质为草炭和蛭石的混合物 (质量比为3:2), 置于南京农业大学牌楼日光温室内培养, 每份材料40粒。待黄瓜幼苗长至3叶1心时, 每份材料选取健壮整齐一致的幼苗5株移至光照培养箱。幼苗先于25 ℃/18 ℃(昼/夜) 环境下预处理1 d, 再调节至15 ℃/7 ℃(昼/夜) 进行冷胁迫处理, 光周期为12 h/12 h, 设3次重复。处理10 d后, 进行冷害指数和形态指标的统计, 同时对每个编号混合采样, 叶片剪碎并充分混匀后平行取3份进行电导率、MDA含量、SOD活性等生理生化指标的测定。
1.3 测定项目及方法 1.3.1 相对发芽率的测定统计30 d后每个突变体材料的发芽率。发芽率=发芽种子数/种子总数×100%;相对发芽率=种子发芽率-对照‘长春密刺’种子发芽率。
1.3.2 冷害指数的测定低温处理10 d后, 根据黄瓜叶片的冷害症状:0级:无受害症状; 1级:叶片轻微受害, 叶缘黄化; 2级:叶片小部分面积出现脱水斑; 3级:叶片约有一半面积出现脱水斑; 4级:叶片大部分的面积出现脱水斑; 5级:叶片几乎全部干枯。按下列公式计算冷害指数 (CII):
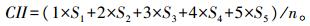
|
式中:S1~S5分别为1~5级症状的植株数量; n为总的植株数。
1.3.3 形态指标的测定茎粗 (cm):用游标卡尺在子叶着生部位向下0.5 cm处测量茎粗[11]; 株高 (cm):用直尺测量从基质表面到幼苗最高生长点部位的距离[12]; 叶片数:计算大于等于1 cm2的叶片为有效叶; 节间数:计算幼苗节间数量。
1.3.4 叶片中电导率和丙二醛 (MDA) 含量以及超氧化物歧化酶 (SOD) 活性的测定电导率的测定采用陈爱葵等[13]的浸泡法, 浸泡时间延长至24 h。MDA含量采用硫代巴比妥酸法[14]测定。SOD活性采用NBT法[15]测定, 以抑制NBT光化还原的50%为一个酶活性单位 (U)。
1.4 数据处理试验数据采用Excel 2007和SPSS 19.0软件处理。
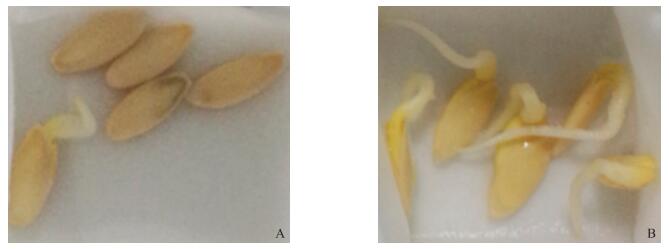
2 结果与分析 2.1 黄瓜突变体耐低温材料的初步筛选13 ℃的低温环境下, 对处理的黄瓜突变体材料进行发芽率统计和分析, 发现不同材料发芽率差异显著。部分材料的耐低温能力优于对照, 表现为发芽率高、胚根生长情况良好等 (图 1)。以相对发芽率和胚根长度作为耐低温筛选的指标, 可将1 818份突变体材料分为:耐低温型、中间型和冷敏型 (表 1)。耐低温材料的相对发芽率大于等于80%, 且平均胚根长度大于等于2.0 cm; 冷敏材料的相对发芽率小于20%, 且胚根长度小于0.5 cm; 其余为中间型突变体材料。经统计, 大部分中间型材料的相对发芽率为40%~60%, 胚根长度在0.8~1.0 cm的范围内。1 818份突变体材料中, 耐低温型材料最少, 只有22份, 占试验总数的1.21%, 中间型材料共有550份, 占30.25%, 其余为冷敏型材料, 占总数的68.54%。
|
图 1 ‘长春密刺’(A) 和耐低温材料 (B) 低温处理后种子萌发情况 Figure 1 The seed germination of 'Changchunmici'(A) and selected code (B) after the treatment of low temperature |
| 类型 Classification |
相对发芽率/% Relative germination |
胚根长度/cm Radical length |
数量 Number |
比例/% Percentage |
| 耐低温型Tolerance 冷敏型Sensitivity 中间型Middle |
≥80 < 20 40~60 |
≥2.0 < 0.5 0.8~1.0 |
22 1 246 550 |
1.21 68.54 30.25 |
选取15份相对发芽率高且胚根生长情况良好的突变体材料, 作为初步筛选的耐低温材料。
2.2 苗期耐低温材料鉴定 2.2.1 冷害指数比较由表 2可知:经低温处理的15个突变体材料, 其中8个的冷害指数小于对照‘长春密刺’。编号为4、5、6、7、10、11、13和15, 初步鉴定为耐低温材料。耐低温突变体材料在经过低温处理之后叶片黄化程度小, 出现水渍的叶片数量少, 而冷敏型材料在经过冷胁迫之后, 新生叶片大量褪绿并且边缘轻微内卷, 叶片不仅黄化, 出现大片水渍, 严重时致植株死亡 (图 2)。
| 编号 Code |
冷害指数 CII |
茎粗/cm Stem diameter | 株高/cm Plant height | 节间数Internode number | 叶片数Leaf number | |||||||
| C | T | C | T | C | T | C | T | |||||
| CK | 1.67 | 4.06 | 4.01 | 12.87 | 13.20 | 4.00 | 5.00 | 4.33 | 5.00 | |||
| 1 | 3.00 | 4.63 | 4.59 | 12.15 | 12.73 | 3.50 | 4.75 | 3.50 | 4.75 | |||
| 2 | 4.25 | 4.82 | 4.14 | 13.28 | 13.00 | 3.67 | 4.67 | 4.33 | 4.67 | |||
| 3 | 4.25 | 4.26 | 4.14 | 17.03 | 16.58 | 4.00 | 5.00 | 4.75 | 5.00 | |||
| 4 | 1.25 | 4.74 | 4.49 | 14.63 | 14.90 | 3.75 | 4.00 | 3.75 | 4.25 | |||
| 5 | 1.50 | 3.84 | 4.13 | 10.83 | 11.03 | 3.00 | 4.00 | 4.00 | 4.25 | |||
| 6 | 1.50 | 4.54 | 4.60 | 13.20 | 13.35 | 4.00 | 4.50 | 4.00 | 4.50 | |||
| 7 | 1.25 | 4.83 | 4.88 | 13.20 | 13.18 | 3.50 | 5.00 | 4.25 | 5.00 | |||
| 8 | 4.00 | 4.45 | 4.38 | 8.98 | 8.88 | 4.25 | 5.25 | 4.25 | 5.25 | |||
| 9 | 2.00 | 4.54 | 4.23 | 8.50 | 8.48 | 3.75 | 4.00 | 3.75 | 4.00 | |||
| 10 | 1.25 | 4.26 | 4.31 | 11.83 | 11.90 | 3.75 | 4.50 | 4.00 | 4.50 | |||
| 11 | 1.50 | 4.83 | 5.89 | 17.13 | 17.55 | 4.00 | 5.50 | 4.75 | 6.00 | |||
| 12 | 2.00 | 4.73 | 5.03 | 16.07 | 16.30 | 3.67 | 5.67 | 4.00 | 5.67 | |||
| 13 | 1.50 | 3.69 | 3.60 | 9.85 | 10.60 | 4.25 | 3.65 | 5.00 | 5.00 | |||
| 14 | 1.75 | 4.64 | 4.63 | 12.53 | 12.60 | 4.33 | 4.67 | 4.33 | 5.00 | |||
| 15 | 1.00 | 4.45 | 4.95 | 14.10 | 14.39 | 3.25 | 4.50 | 5.00 | 6.00 | |||
| 注:C:常温对照Normal temperature; T:低温处理Treatment of low temperature | ||||||||||||

|
图 2 ‘长春密刺’(A) 和耐低温突变体材料 (编号11)(B) 低温处理后幼苗生长情况 Figure 2 The seedling of 'Changchunmici'(A) and cold tolerant mutant materials (code 11)(B) after the treatment of low temperature |
在对初步筛选的黄瓜耐低温材料进行形态指标测定中发现, 黄瓜幼苗经低温处理后, 不同编号的黄瓜幼苗形态指标变化不同 (表 2)。对照 (CK)‘长春密刺’茎粗数值稍有下降, 其余3项指标数值都增加。15份材料中有8份材料茎粗下降, 占总数53.33%。5份突变体材料株高下降, 占总数33.33%。1份材料节间数下降, 其余15份材料的叶片数都有所增加。15份材料中有6个编号的4项形态学指标都有所增加, 分别是5、6、10、11、12和15。只有1项指标小幅度的下降, 其余指标都略有增加的编号分别是1、4、7和14。
2.2.3 生理生化指标指数比较由表 3可知:不同编号黄瓜之间, 电导率、丙二醛含量和SOD活性显著不同, 由此可以鉴定耐低温材料。15个编号黄瓜中电导率小于对照的编号为5、6、7、10、11、14和15。其中, 编号5和11的电导率与对照有显著差异; MDA含量小于对照的编号为6、10、11、和12。其中, 编号6和11的MDA含量与对照达到显著差异; SOD活性小于对照的有编号4、6、7、8、10、12、和13。其中, 编号4、6和12与对照的SOD活性达到显著差异。
| 编号Code | 电导率/% Electrical conductivity | MDA含量/(μmol·g-1) MDA content | SOD活性/(U·g-1) SOD activity |
| CK | 38cde | 2.28efg | 301.07de |
| 1 | 38cd | 2.50de | 303.50de |
| 2 | 67a | 3.29a | 498.38a |
| 3 | 44c | 2.93b | 368.79b |
| 4 | 38cd | 2.36defg | 226.48g |
| 5 | 30f | 2.59cd | 304.13de |
| 6 | 32def | 1.99h | 232.85g |
| 7 | 32def | 2.42def | 278.40ef |
| 8 | 52b | 2.87b | 286.35def |
| 9 | 43c | 3.38a | 353.65bc |
| 10 | 31ef | 2.15gh | 296.83def |
| 11 | 28f | 1.56i | 311.56de |
| 12 | 42c | 2.23fgh | 257.10fg |
| 13 | 39cd | 2.83bc | 296.36def |
| 14 | 34def | 2.81bc | 327.81cd |
| 15 | 37cde | 2.56d | 323.40cd |
| 注:不同字母表示不同处理间差异显著 (P < 0.05)。 Note:The different letters indicate significant difference at 0.05 level among different treatments. | |||
通过低温发芽试验的初步筛选以及苗期冷害指数、形态指标和生理生化指标的鉴定, 以耐低温品种‘长春密刺’为对照, 最终筛选出各项指标或多数指标优于对照的材料, 共7份。7份编号分别为4、5、6、7、10、11、15。其中, 编号5、6、10和11的4项形态指标数据均有增加, 编号4的茎粗和编号7的株高略有下降, 其余3项形态指标均增加。并且, 7份材料的冷害指数均优于对照。在生理生化指标方面, 编号4、5和15的相对发芽率分别为40%、60%和80%, 编号4的SOD活性指标优于对照, 编号5和15的电导率指标优于对照; 编号7和11的相对发芽率为60%和80%, 分别有2项生理生化指标优于对照; 编号6和10的相对发芽率为100%和60%, 分别有3项生理生化指标均优于对照。
3 讨论与结论 3.1 黄瓜发芽期耐低温评价黄瓜发芽期的耐低温性可以从两个方面评价。以低温发芽率、最低发芽温度等种子活力参数来表示低温发芽阶段的耐低温性; 以胚根长度、种芽生长量来反映种芽生长阶段的耐低温性。本次试验的耐低温突变体材料是在低温发芽率基本相同的情况下, 根据胚根长度进行的初步筛选。这是因为胚根生长情况能直观地反映突变体材料对于低温的适应能力。发芽期的筛选温度是黄瓜发芽期耐低温评价的关键。低温 (13~17 ℃) 下种子的发芽率、发芽速度明显降低, 但不同生态型品种的低温发芽力有显著差异。王红飞[16]认为在11~15 ℃的低温条件下, 13 ℃适合用于极耐低温材料的筛选, 15 ℃可作为发芽期低温耐受性评价的适宜胁迫温度。本次试验的1 818份突变体材料在13 ℃的低温条件下, 只有22份材料的相对发芽率大于80%且胚根长度大于2 cm, 占总资源的1.21%。综合种子活力和胚根生长情况两项指标, 可以对突变体材料的耐低温性进行综合评价, 避免单个指标的片面影响。为了使试验更加精确, 还需要消除种子本身活力的差别, 最好选取种子年龄、成熟度、处理方法、贮藏条件基本一致的试验材料[17]。
3.2 低温对黄瓜苗期生理指标的影响本试验选取了电导率、MDA含量和SOD活性作为黄瓜苗期耐低温评价的生理指标。其中, 电导率和MDA含量都反映了细胞膜完整程度。闫世江[12]通过与耐寒指数对比发现MDA与黄瓜耐低温性呈明显相关性。刘建辉等[18]认为黄瓜幼苗在严重伤害的低温下, 子叶电解质渗透率迅速增加, 并表现出不同抗寒品种之间的明显差异, 抗寒性较强的电解质渗透率低于抗寒性弱的品种。本试验结果同样表明筛选出的黄瓜材料的MDA含量和电导率显著低于对照, 说明筛选出的耐低温材料在低温胁迫下的细胞膜更加完整, 细胞质溶液外渗较少, 膜脂过氧化程度较小。
毛光志等[19]研究了15对杂交组合苗期低温耐受性, 认为SOD可作为鉴定评价低温耐受性的相关指标。闫世江等[12]选取低温弱光性不同的6份黄瓜材料进行处理, 结果表明耐寒性较强的品种, 保护酶和脯氨酸含量较高。但是在本次试验中, 低温处理的黄瓜叶片的SOD活性与材料的耐低温能力呈负相关, 这与逯明辉[20]试验结果相同。
3.3 黄瓜耐低温评价体系目前黄瓜耐低温性的评价没有一个统一的标准, 不同的生育时期、处理条件和评价指标都可能导致耐低温性存在差异[21]。Kozik等[22]在研究黄瓜耐低温分子遗传机制时, 待幼苗长至1叶1心时, 于4 ℃低温条件下低温胁迫7 h。王昶童[23]为验证嫁接能提高黄瓜抗冷性, 通过4 ℃低温处理1、2、3和4 d, 对嫁接苗和自根苗的POD活性、丙二醛积累量、脯氨酸积累量等抗冷性鉴定指标进行了测定。这些试验低温处理的温度都远远低于黄瓜受到的冷害胁迫的温度。结合生产实际, 本次试验选用3叶1心期的黄瓜幼苗, 处理条件选用昼/夜15 ℃/7 ℃, 12 h/12 h, 连续进行10 d。
植物的耐低温性能是植物体内经过一系列生理生化综合作用得到的结果, 并且受到相关基因的调控, 所以评价黄瓜的耐低温能力不能单独从1个指标来判断, 而需要从多个与耐低温性相关的指标综合研究其相互关系, 从而判断植物耐低温冷性的强弱[24]。本试验通过形态指标和多项生理生化指标来评价黄瓜材料的耐低温性, 最终筛选的7份耐低温材料在经过低温处理后的冷害指数都小于对照, 并且多项生理生化指标优于对照。选取多项指标表现优秀, 并且各项指标的鉴定结果基本一致的材料作为最终筛选的耐低温材料, 尽量避免不同指标之间的矛盾, 对于各项指标数据差异较大的突变体材料, 可以进一步探究。
| [1] | Yu J Q, Zhou Y H, Huang L F, et al. Chill-induced inhibition of photosynthesis:genotypic variation within Cucumis sativus[J]. Plant and Cell Physiology, 2002, 43(10): 1182–1188. DOI: 10.1093/pcp/pcf134 |
| [2] |
逯明辉, 娄群峰, 陈劲枫. 黄瓜的冷害及耐冷性[J].
植物学通报, 2004, 21(5): 578–586.
Lu M H, Lou Q F, Chen J F. A review on chilling injury and cold tolerance in Cucumis sativus L.[J]. Chinese Bulletin of Botany, 2004, 21(5): 578–586. (in Chinese) |
| [3] | Ruelland E, Vaultier M N, Zachowski A, et al. Cold signalling and cold acclimation in plants[J]. Advances in Botanical Research, 2009, 49: 35–150. DOI: 10.1016/S0065-2296(08)00602-2 |
| [4] | Miller G, Shulaev V, Mittler R. Reactive oxygen signaling and abiotic stress[J]. Physiologia Plantarum, 2008, 133(3): 481–489. DOI: 10.1111/j.1399-3054.2008.01090.x |
| [5] | Tewari A K, Tripathy B C. Acclimation of chlorophyll biosynthetic reactions to temperature stress in cucumber (Cucumis sativus L.)[J]. Planta, 1999, 208(3): 431–437. DOI: 10.1007/s004250050579 |
| [6] | Mahajan S, Tuteja N. Cold, salinity and drought stresses:an overview[J]. Archives of Biochemistry and Biophysics, 2005, 444(2): 139–158. DOI: 10.1016/j.abb.2005.10.018 |
| [7] | Browsea J, Xinb Z. Temperature sensing and cold acclimation[J]. Current Opinion in Plant Biology, 2001, 4(3): 241–246. DOI: 10.1016/S1369-5266(00)00167-9 |
| [8] |
于拴仓, 崔鸿文, 孟焕文. 黄瓜发芽期耐低温性鉴定方法与指标的研究[J].
西北农业大学学报, 2000, 28(3): 1–6.
Yu S C, Cui H W, Meng H W. Appraisal methods and indexes for low-temperature tolerance in cucumber (Cucumis sativu L.) at seed germination stage[J]. Acta Univ Agric Boreali-Occidentalis, 2000, 28(3): 1–6. (in Chinese) |
| [9] |
刘雪梅. 黄瓜、辣椒品种早期低温弱光耐受性评价方法研究[D]. 北京: 中国农业科学院, 2010: 9-13.
Liu X M.Evaluation method of low temperature and poor light tolerance of cucumber and pepper culitivars at early development stage[D]. Beijing:Chinese Academy of Agricultural Sciences, 2010:9-13(in Chinese with English abstract). |
| [10] |
苗永美, 宁宇, 曹玉杰, 等. 黄瓜萌芽期和苗期耐冷性评价[J].
应用生态学报, 2013, 24(7): 1914–1922.
Miao Y M, Ning Y, Cao Y J, et al. Evaluation of cucumber's chilling tolerance at germination and seedling stages[J]. Chinese Journal of Applied Ecology, 2013, 24(7): 1914–1922. (in Chinese) |
| [11] |
毛光志, 刘彦珍, 李建吾. 苗期黄瓜自交系耐低温弱光鉴定研究[J].
北方园艺, 2009(8): 85–87.
Mao G Z, Liu Y Z, Li J W. Identification of the resistance to low temperature and low light of inbred lines of cucumber at seedling stage[J]. Northern Horticulture, 2009(8): 85–87. (in Chinese) |
| [12] |
闫世江. 黄瓜耐低温性的遗传及生理生化特性的研究[D]. 沈阳: 沈阳农业大学, 2008: 23-37.
Yan S J. Studies on the inheritance of chilling tolerance and characteristics of physiology-biochemistry in cucumber (Cucumis sativus L.)[D]. Shenyang:Shenyang Agricultural University, 2008:23-37(in Chinese with English abstract). |
| [13] |
陈爱葵, 韩瑞宏, 李东洋, 等. 植物叶片相对电导率测定方法比较研究[J].
广东教育学院学报, 2010, 30(5): 88–91.
Chen A K, Han R H, Li D Y, et al. A comparison of two methods for electrical conductivity about plant leaves[J]. Journal of Guangdong Education Institute, 2010, 30(5): 88–91. (in Chinese) |
| [14] |
王学奎, 黄见良.
植物生理生化实验原理与技术[M]. 3版. 北京: 高等教育出版社, 2015: 276-277.
Wang X K, Huang J L. Principles and Techniques of Plant Physiological Biochemical Experiment[M]. 3rd ed. Beijing: Higher Education Press, 2015: 276-277. (in Chinese) |
| [15] |
李合生.
实验生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 167-169.
Li H S. Principles and Techniques of Plant Physiological Biochemical Experiment[M]. Beijing: Higher Education Press, 2000: 167-169. (in Chinese) |
| [16] |
王红飞. 黄瓜种质资源低温耐受性的鉴定评价及QTL初步定位研究[D]. 北京: 中国农业科学院, 2014: 12-25.
Wang H F. Germplasm identification of tolerance to low temperature and QTL mapping for low temperature adapbility in cucumber[D]. Beijing:Chinese Academy of Agricultural Sciences Dissertation, 2014:12-25(in Chinese with English abstract). |
| [17] |
齐晓花, 张萍, 徐强, 等. 黄瓜种子及幼苗期耐冷性鉴定[J].
中国蔬菜, 2011(16): 34–38.
Qi X H, Zhang P, Xu Q, et al. Evaluation of cold tolerance of cucumber seed and seedling[J]. China Vegetables, 2011(16): 34–38. (in Chinese) |
| [18] |
刘建辉, 崔鸿文. 电导法鉴定黄瓜抗寒性的研究[J].
西北农业大学学报, 1995, 23(4): 74–77.
Liu J H, Cui H W. Electrical conductivity method for chilling-resistance evaluation in cucumber[J]. Acta Universitatis Agriculturalis Boreali-Occidestalis, 1995, 23(4): 74–77. (in Chinese) |
| [19] |
毛光志, 刘彦珍. 黄瓜杂交组合苗期耐低温弱光鉴定[J].
湖北农业科学, 2009, 48(9): 2177–2180.
Mao G Z, Liu Y Z. Identification of the resistance to low temperature and low light of cross combinations of cucumber in seedling stage[J]. Hubei Agricultural Sciences, 2009, 48(9): 2177–2180. (in Chinese) |
| [20] |
逯明辉. 黄瓜耐冷生理机制、分子标记及相关基因分离的研究[D]. 南京: 南京农业大学, 2005: 32-38.
Lu M H. Studies on the physiological mechanism, molecular markers and related gene isolation of chilling tolerance in cucumber[D]. Nanjing:Nanjing Agricultural University, 2005:32-38(in Chinese with English abstract). |
| [21] |
杨国志, 齐晓花. 黄瓜种质资源耐低温性鉴定[J].
浙江农业科学, 2015, 56(8): 1221–1223.
Yang G Z, Qi X H. The identification of cold tolerant germplasm resources of cucumber[J]. Journal of Zhejiang Agricultural Sciences, 2015, 56(8): 1221–1223. (in Chinese) |
| [22] | Kozik E U, Wehner T C. A single dominant gene Ch for chilling resistance in cucumber seedlings[J]. Journal of the American Society for Horticultural Science, 2008, 133(2): 225–227. |
| [23] |
王昶童. 低温胁迫下嫁接黄瓜耐低温性双向电泳分析[D]. 郑州: 郑州大学, 2014: 18-22.
Wang C T. Proteomic analysis of grafted cucumber under cold stress for cold resistance mechanism[D]. Zhengzhou:Zhengzhou University, 2014:18-22(in Chinese with English abstract). |
| [24] |
芦露. 黄瓜幼苗对低温胁迫的响应及其耐冷性评价[D]. 哈尔滨: 东北农业大学, 2014: 1-4.
Lu L. Evaluation of cold resistance and response of cucumber seedlings to chilling stress[D]. Harbin:Northeast Agricultural University, 2014:1-4(in Chinese with English abstract) |




