文章信息
- 白五娇, 金鹏锦, 邝美倩, 魏全伟, 石放雄, 茆达干
- BAI Wujiao, JIN Pengjin, KUANG Meiqian, WEI Quanwei, SHI Fangxiong, MAO Dagan
- 热应激对黄体孕酮代谢通路的影响
- Effects of heat stress on the pathway associated with luteal progesterone metabolism
- 南京农业大学学报, 2017, 40(1): 145-150
- Journal of Nanjing Agricultural University(Social Science), 2017, 40(1): 145-150.
- http://dx.doi.org/10.7685/jnau.201601018
-
文章历史
- 收稿日期: 2016-01-11
近年来,随着畜牧业集约化和产业化的发展,热应激对动物生产带来的负面影响已受到研究者的广泛关注。热应激影响雌性动物的发情、卵泡发育、卵母细胞成熟和早期胚胎发育等[1]。虽然其机制尚未十分明确,但已有研究表明热应激通过干扰动物的生殖内分泌等发挥作用。热应激抑制促性腺激素释放激素(gonadotropin-releasing hormone,GnRH)分泌,影响了垂体活动,导致排卵障碍,黄体生成及孕酮的分泌受到抑制[2]。
孕酮在维持妊娠和调节发情周期中具有重要作用。低水平的孕酮导致卵泡发育障碍,进而引起异常卵母细胞成熟和早期胚胎死亡[3]。孕酮合成是一系列连续过程,包括胆固醇的吸收、合成、转运以及转化为孕酮,其中任一环节的异常都将影响孕酮的合成。故与孕酮合成相关的蛋白和酶的表达[4],如蛋白激酶A(protein kinase A,PKA)、类固醇合成急性调节蛋白(steroidogenic acute regulatory protein,StAR)、细胞色素P450胆固醇侧链裂解酶(cytochrome P450 cholesterol side-chain cleavage enzyme,P450scc)和3β羟基类固醇脱氢酶(3beta hydroxysteroid dehydrogenase,3βHSD),对黄体功能的维持具有关键作用。啮齿类动物血清孕酮含量还与20α-羟类固醇脱氢酶(20 alpha-hydroxysteroid dehydrogenase,20α-HSD)的表达有关,该酶将孕酮代谢为20α-羟孕酮(20 alpha-hydroxyprogesterone,20α-OHP)[5]。前列腺素F2α(PGF2α)诱导的假孕大鼠黄体退化过程中,孕酮浓度降低,同时20α-OHP浓度升高,且PGF2α诱导的 20α-HSD的升高与Nur77/NR4A1 mRNA的表达上升有关[5]。
目前,PGF2α诱导的黄体退化对孕酮水平及其代谢的影响有了广泛研究,但热应激调控黄体退化的分子机制尚不清楚。本研究以热应激对PGF诱导的黄体退化过程中孕酮水平的影响为切入点,以假孕大鼠为模型,从孕酮合成早期通路PKA活性、孕酮合成的关键蛋白及NR4A1 3个层次,探讨热应激影响孕酮水平的机制,为研究热应激对雌性生殖机能的影响提供理论依据。
1 材料与方法 1.1 试验动物体质量为(45±5) g的3周龄SD雌性大鼠50只,购于南京青龙山实验动物研究所。在人工控制条件下,分笼饲养(每笼5只);鼠房温度22~25 ℃,光照明/暗周期为12 h/12 h;自由采食、饮水。
1.2 主要试剂和仪器PMSG和hCG购自浙江省宁波三生药业有限公司;氯前列烯醇(PGF)购自辽宁省丹东何华动物制药公司;孕酮(P)酶联免疫测定(ELISA)试剂盒购自上海百蕊生物技术有限公司;HRP标记的羊抗兔IgG(SN134) 和HRP标记的羊抗小鼠IgG(SN133) 购自南京生兴生物技术有限公司;ECL试剂盒购自上海天能科技有限公司;SABC试剂盒购自武汉博士德生物工程有限公司;其他试剂均为国产分析纯。发光图像分析仪(LAS-4000) 购自日本的FUJIFILM公司。
1.3 试验分组大鼠在室温下适应性饲养1周后,经腹腔注射PMSG,每只30 IU,促进卵泡发育。48 h后,注射hCG,每只30 IU,以促进排卵及黄体化[6],记为第0天。然后按照体质量相近原则随机分为两组,非热应激(non-heat stress,NHS)组和热应激(heat stress,HS)组。每天在相同时间(11:00—13:00) 将HS组置于预先加热到设定温度的隔水式培养箱(温度40 ℃),连续热应激7 d,并在热应激前后测量直肠温度[7]。第7天,热应激结束后2 h,腹腔注射PGF,每只30 IU,分别在处理后0、1、2、8或24 h颈椎脱臼法处死大鼠。收集血清,1 000 r·min-1离心10 min,取上清液。取出大鼠双侧卵巢,一侧置于4%多聚甲醛固定液中固定,用于免疫组织化学分析;另一侧置于液氮速冻后于-80 ℃保存,用于后续试验。
1.4 测定指标和方法 1.4.1 直肠温度的测定每次热应激前、后,分别用电子体温计测定试验大鼠的直肠温度。
1.4.2 血清孕酮的测定大鼠血清中孕酮水平用ELISA试剂盒测定。
1.4.3 蛋白免疫印迹分析具体步骤参照Meng等[8]方法,用RIPA裂解法提取卵巢组织总蛋白,并用BCA法测定蛋白浓度。一抗(1:1 000) 为PKA磷酸化底物(# 9261,Cell Signaling)、StAR(sc-25806,Santa Cruz)、P450scc和3βHSD(内布拉斯加大学医学中心Davis JS博士赠予)、Nur77(NR4A1-F,554088,BD PharmingenTM)及NR4A1(NR4A1-S,CBX00289,Cosmo Bio),以α-tublin(M0203,CMC Sci)为内参,应用Image J软件进行灰度分析。
1.4.4 免疫组织化学分析选取7 d非热应激组进行检测,具体步骤参照Wang等[9]的方法,采用SABC法测定。一抗(1:200) 为NR4A1(NR4A1-F,A6676,ABclonal)及1.4.3节中的抗体。以PBS缓冲液代替一抗作为阴性对照。显微镜下观察,有棕黄色染者为阳性。
1.5 数据统计与分析试验数据用GraphPad 5.0软件进行整理,差异显著性检验采用ANOVA的Bonferroni检验法进行多重比较。统计结果以x±SE表示。
2 结果与分析 2.1 热应激对假孕大鼠直肠温度的影响测定热应激前、后大鼠的直肠温度,发现热应激后的直肠温度显著升高(P<0.05,表 1),表明热应激模型成功。
| ℃ | |||||||
| 热处理持续时间/d Duration of heat stress | |||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | |
| 热处理前Before heat stress | 35.86±0.16 | 36.18±0.17 | 36.63±0.13 | 35.64±0.15 | 35.69±0.11 | 35.56±0.14 | 35.75±0.11 |
| 热处理后After heat stress | 39.06±0.10* | 39.02±0.13* | 38.98±0.22* | 39.00±0.13* | 38.92±0.12* | 38.76±0.12* | 39.13±0.11* |
| 注: *表示与对照组(热应激前)相比,差异显著(P<0.05) 。 *means significant differences between before and after heat stress(P<0.05) . | |||||||
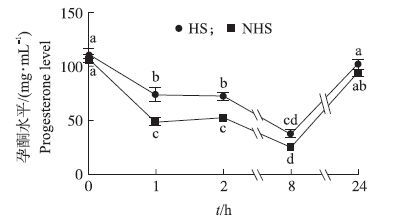
在假孕第7天,两组大鼠均用PGF(0、1、2、8和24 h)诱导黄体退化,比较不同时间点孕酮水平变化。结果(图 1)显示:与对照组(0 h)相比,PGF处理显著降低两组大鼠孕酮在处理后1、2和8 h的水平(P<0.05) ,但是在24 h又恢复到正常水平;HS组血清孕酮水平在1 h和 2 h则显著高于NHS组(P<0.05) ,表明热应激抑制了PGF诱导的假孕大鼠血清孕酮水平下降。
|
图 1 热应激对假孕大鼠氯前列烯醇(PGF)诱导的黄体退化过程中孕酮水平的影响
Figure 1 The effect of heat stress on the progesterone level during PGF-induced luteal regression in pseudopregnant rats
1) HS:热应激组 Heat stress group;NHS:非热应激组Non-heat stress group 2) 不同字母表示差异显著(P<0.05) 。The different letters mean significant differences(P<0.05) . The same as follows. |
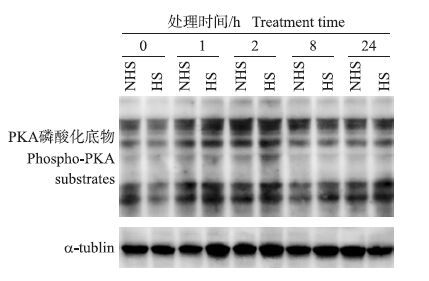
为了检测热应激对孕酮合成通路早期PKA活性的影响,本试验采用针对(Ser/Thr)位点磷酸化抗体检测PKA磷酸化底物的状态。如图 2所示:热应激对假孕大鼠PGF诱导的黄体退化过程中PKA磷酸化底物蛋白的表达无影响(P>0.05) 。
|
图 2 热应激对假孕大鼠PGF诱导的黄体退化过程中 PKA磷酸化底物蛋白水平的影响 Figure 2 The effect of heat stress on the expression of phospho-PKA substrates during PGF-induced luteal regression in pseudopregnant rats |
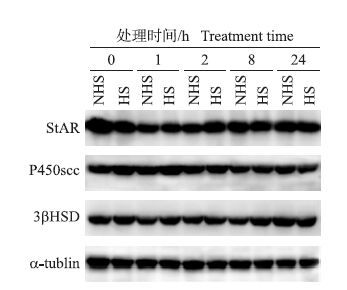
孕酮以胆固醇为底物,胆固醇在StAR的作用下进入线粒体内膜,被位于内膜的P450scc催化形成孕烯醇酮,然后在3βHSD的作用下生成孕酮[4]。为此本试验检测了促孕酮合成的StAR、P450scc和3βHSD这3种关键蛋白的表达。如图 3所示:热应激对假孕大鼠PGF诱导的黄体退化过程中StAR、P450scc和3βHSD蛋白的表达无影响(P>0.05) 。
|
图 3 热应激对假孕大鼠PGF诱导的黄体退化过程中 StAR、P450scc和3βHSD蛋白水平的影响 Figure 3 The effect of heat stress on the expression of StAR,P450scc and 3βHSD during PGF-induced luteal regression in pseudopregnant rats |
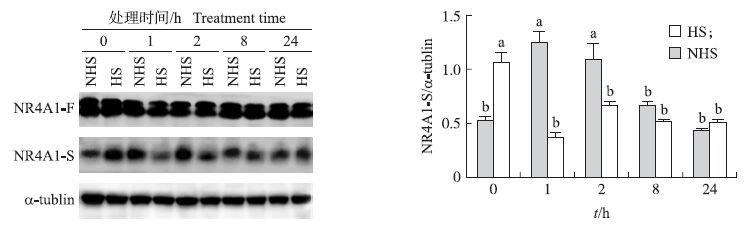
NR4A1与啮齿动物孕酮的分解代谢密切相关,但先前研究主要集中在mRNA水平,本试验利用2种NR4A1抗体进行检测,结果发现针对其全长片段量[相对分子质量(6.6~8.8) ×104]的NR4A1(NR4A1-F)和针对其氨基酸序列第50~200的片段(相对分子质量约3.5×104) 的变异体NR4A1(NR4A1-S)。如图 4所示:热应激对假孕大鼠PGF诱导的黄体退化过程中NR4A1-F蛋白的表达无影响(P>0.05) ,但PGF或热应激单一处理均显著提高了NR4A1-S蛋白的表达,HS组NR4A1-S 水平在PGF处理后1 h和2 h明显低于NHS组(P<0.05) 。
|
图 4 热应激对假孕大鼠PGF诱导的黄体退化过程中NR4A1-F和NR4A1-S蛋白表达的影响 Figure 4 The effect of heat stress on the expression of NR4A1-F and NR4A1-S during PGF-induced luteal regression in pseudopregnant rats |
利用免疫组织化学方法系统地对PKA磷酸化底物、StAR、P450scc、3βHSD和NR4A1-F蛋白在假孕大鼠黄体中的定位特征进行了研究。如图 5所示:在假孕大鼠的黄体中,PKA磷酸化底物主要在类固醇生成细胞的细胞核中表达;StAR、P450scc、3βHSD和NR4A1-F均在类固醇生成细胞的细胞质中表达。
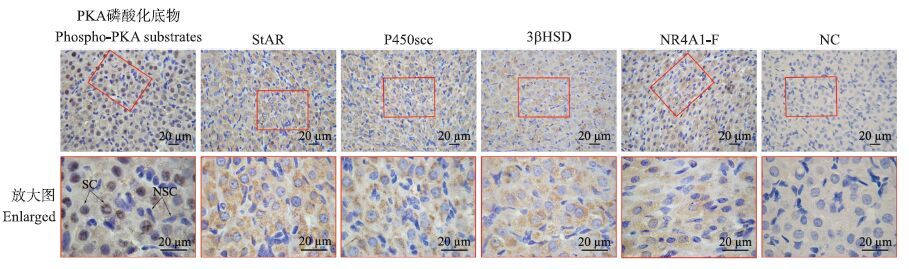
|
图 5 PKA磷酸化底物、StAR、P450scc、3βHSD和NR4A1-F在假孕大鼠黄体中的定位 Figure 5 Localization of phospho-PKA substrates,StAR,P450scc,3βHSD and NR4A1-F in the corpus luteum of pseudopregnant rats NC:阴性对照 Negative control;SC:类固醇生成细胞 Steroidogenic cells;NSC:非类固醇生成细胞 Non-steroidogenic cells |
热应激主要通过两大机制引起生殖障碍[1]。一方面,热应激通过动力学改变体温,继而影响生殖功能,如重新分配机体的血流以增加散热消耗,减少采食量以降低代谢产热,改变能量平衡和养分利用率,从而影响发情周期、妊娠维持和胚胎发育。另一方面,热应激直接影响生殖轴或间接影响与性腺功能相关的其他细胞功能。
动物热应激前、后的直肠温度差值是评定其遭受热应激最直观的指标[7]。本研究中,热应激前、后大鼠的直肠温度差异显著,表明建立的大鼠热应激模型可行。在包括啮齿类动物在内的物种中,子宫分泌的PGF2α作为溶黄体素,在妊娠末期和分娩前启动黄体溶解。本试验结果表明PGF处理8 h内显著降低了血清孕酮水平,与我们之前的研究结果一致[6]。但其在24 h又恢复到正常浓度,与Kurusu等[10]以PGF2α(每只30 μg)处理假孕6 d的大鼠效果相似,即短暂的PGF处理不足以引起孕酮水平的持续下降。同时热应激抑制了PGF诱导的孕酮水平的下降,提示热应激可能抑制黄体退化过程中的孕酮水平下降,这与Kurowicka等[11]报道的高温提高间情期大鼠孕酮水平一致。推测这应该是由于热应激影响了孕酮的合成或分解代谢途径。
众多研究表明,孕酮合成主要受到上游cAMP/PKA及主要调节蛋白StAR、P450scc和3βHSD等相关因素的调控[4]。本试验观察到PGF或热应激单一处理对以上4个促类固醇生成相关蛋白的表达均无影响,提示PGF及热应激不影响黄体退化过程中孕酮生成途径。这与Stocco等[12]如下观点一致:大鼠黄体功能下降,不是由于PGF2α抑制孕酮的合成,而是由于促进了20α-HSD的酶活性,加速孕酮代谢,从而将其转变为无生物活性的代谢产物20α-OHP。
外源PGF2α处理假孕第8天大鼠[5]或发情中期母牛的黄体细胞[5],均促进 20 α-HSD基因快速大量表达。进一步研究发现,PGF2α调控20α-HSD启动子的上游区域,该区域包含1个与Nur77特异结合的位点和1个Nur77反应元件。Sudeshna等[5]研究表明PGF2α处理后3 h,Nur 77 mRNA表达显著增加,但可能与PGF2α处理诱导的黄体细胞凋亡有关。Nur77还参与调节其他类固醇基因表达,如Nur 77(NR4A1 -F)过表达促进人卵巢的 3βHSD、StAR、CYP11A1和CYP17 基因的表达[13]。但在本试验中,PGF2α或热应激单一处理均未影响NR4A1-F的表达,也未影响PKA磷酸化底物、StAR、P450scc和3βHSD蛋白的表达,但快速诱导NR4A1-S的表达,可能是单独热应激影响卵巢内与Nur77有关的其他通路,但需要进一步的试验加以证实。而且,热应激降低了PGF诱导的NR4A1-S表达水平,这与热应激抑制了PGF诱导的孕酮水平下降一致,提示NR4A1-S表达可能与孕酮的分解代谢有关。Nur77(NR4A1-F)包括3个结构域:N端的转录激活区(TAD/AF-1、1-267AA)、中间的DNA结合域(DBD、268-354AA)和C端配体结合域(LBD、367-598AA)。Li等[14]研究认为:TAD和DBD,而非LBD诱导了细胞迁移、通透性和肌动蛋白应力纤维的形成,并进一步证明了TAD的41~60氨基酸片段是调节这些功能必不可少的。本试验中NR4A1-S为针对50~200氨基酸片段设计的抗体所检测。因此我们推测,大鼠NR4A1-S可能是NR4A1-F的部分片段或者其剪接体,并可能参与黄体中孕酮分解代谢,但目前国内外未见相关报道。
已有研究表明了促进孕酮合成的PKA磷酸化底物肽、StAR、P450scc和3βHSD蛋白在类固醇生成细胞中的定位[12]。本试验的免疫组织化学结果显示,NR4A1-F主要在类固醇生成细胞的细胞质中表达,这与以前的研究结果一致[15]。研究显示NR4A1通过对靶细胞基因转录的调节,参与细胞增殖、凋亡的调控,其功能与其细胞亚定位有关,NR4A1定位于细胞核发挥促存活作用,而定位于细胞质则发挥抗凋亡作用[16]。研究表明,NR4A1在新鲜黄体细胞中表达量显著高于陈旧黄体细胞,表明NR4A1可能在黄体细胞凋亡过程中起调控作用[17-18]。因此,本试验中检测到的NR4A1-F可能参与维持黄体细胞的功能,然而所用的NR4A1-S抗体并没有检测到NR4A1-S的定位,可能是该抗体不适合用于免疫组织化学研究所致。
本试验结果表明,热应激降低了黄体细胞对PGF的敏感性,干扰了NR4A1-S蛋白的表达,从而抑制孕酮分解代谢。这也为解释夏季猪的分娩率降低[19]、分娩时间延长[20]和牛的发情周期延长[21]提供了证据。总之,热应激可能通过NR4A1-S调节孕酮分解代解途径,短暂干扰假孕大鼠PGF诱导的黄体孕酮的下降。对卵巢黄体NR4A1的深入研究将可能为抗热应激提供一条新的途径。
| [1] | Hansen P J. Effects of heat stress on mammalian reproduction[J]. Philosophical Transactions of the Royal Society London Series B:Biological Sciences, 2009,364(1534): 3341–3350. DOI: 10.1098/rstb.2009.0131 |
| [2] | de S Torres-Júnior J R, de FA Pires M, de Sá W F, et al. Effect of maternal heat-stress on follicular growth and oocyte competence in Bos indicus cattle[J]. Theriogenology, 2008,69(2): 155–166. DOI: 10.1016/j.theriogenology.2007.06.023 |
| [3] | Hansen P J. Exploitation of genetic and physiological determinants of embryonic resistance to elevated temperature to improve embryonic survival in dairy cattle during heat stress[J]. Theriogenology, 2007,68(Suppl 1): S242–S249. |
| [4] | Mizutani T, Ishikane S, Kawabe S, et al. Transcriptional regulation of genes related to progesterone production[J]. Endocrine Journal, 2015,62(9): 757–763. DOI: 10.1507/endocrj.EJ15-0260 |
| [5] | Sudeshna T, Anand K, Medhamurthy R. Analysis of 20alpha-hydroxysteroid dehydrogenase expression in the corpus luteum of the buffalo cow:effect of prostaglandin F2-alpha treatment on circulating 20alpha-hydroxyprogesterone levels[J]. Reproductive Biology and Endocrinology, 2013,11(1): 111–118. DOI: 10.1186/1477-7827-11-111 |
| [6] | Guo N, Meng C, Bai W, et al. Prostaglandin F2alpha induces expression of activating transcription factor 3(ATF3)and activates MAPK signaling in the rat corpus luteum[J]. Acta Histochem, 2015,117(2): 211–218. DOI: 10.1016/j.acthis.2014.12.008 |
| [7] | Macias-Cruz U, Gastelum M A, Alvarez F D, et al. Effects of summer heat stress on physiological variables,ovulation and progesterone secretion in Pelibuey ewes under natural outdoor conditions in an arid region[J]. Animal Science Journal, 2016,87(3): 354–360. DOI: 10.1111/asj.2016.87.issue-3 |
| [8] | Meng C, Guo N, Wei Q, et al. Expression of repulsive guidance molecule b(RGMb)in the uterus and ovary during the estrous cycle in rats[J]. Acta Histochem, 2014,116(8): 1231–1236. DOI: 10.1016/j.acthis.2014.07.006 |
| [9] | Wang Y, Meng C, Wei Q, et al. Expression and regulation of scavenger receptor class B type 1 in the rat ovary and uterus during the estrous cycle[J]. Acta Histochem, 2015,117(3): 297–304. DOI: 10.1016/j.acthis.2015.03.007 |
| [10] | Kurusu S, Sonoda N, Nakahara M, et al. Evidence suggesting multiple promoting roles of luteal group IVA phospholipase A(2)in prostaglandin F(2alpha)-induced regression in pseudopregnant rats[J]. Prostaglandins and Other Lipid Mediators, 2010,93(1/2): 37–43. |
| [11] | Kurowicka B, Gajewska A, Franczak A. Effect of early thermal experience on pituitary-gonadal axis in female rats[J]. Reproductive Biology, 2006,6(1): 63–77. |
| [12] | Stocco C, Telleria C, Gibori G. The molecular control of corpus luteum formation,function,and regression[J]. Endocrine Reviews, 2007,28(1): 117–149. DOI: 10.1210/er.2006-0022 |
| [13] | Li M, Xue K, Ling J, et al. The orphan nuclear receptor NR4A1 regulates transcription of keys teroidogenic enzymes in ovarian theca cells[J]. Molecular and Cellular Endocrinology, 2010,319(1/2): 39–46. |
| [14] | Li Y, Bourbon P M, Grant M A, et al. Requirement of novel amino acid fragments of orphan nuclear receptor TR3/Nur77 for its functions in angiogenesis[J]. Oncotarget, 2015,6(27): 24261–24276. DOI: 10.18632/oncotarget |
| [15] | Xue K, Liu J Y, Murphy B D, et al. Orphan nuclear receptor NR4A1 is a negative regulator of DHT-induced rat preantral follicular growth[J]. Molecular Endocrinology, 2012,26(12): 2004–2015. DOI: 10.1210/me.2012-1200 |
| [16] | Zhang X. Targeting Nur77 translocation[J]. Oncologic,Endocrine and Metabolic, 2007,11(1): 69–79. |
| [17] | 翟永宁, 刁飞扬, 刘嘉茵. 核受体NR4A1蛋白在大鼠卵泡发育中的定位及其表达规律[J]. 医学研究生学报, 2007, 20(1): 32–35. Zhai Y N, Diao F Y, Liu J Y. The localization and expression pattern of nuclear receptor NR4A1 protein in rat ovary[J]. Journal of Medical Postgraduates, 2007,20(1): 32–35. (in Chinese) |
| [18] | 马红梅, 刘嘉茵. 核受体激素NR4A1在人卵巢周期中的表达[J]. 江苏医药, 2007, 33(5): 439–440. Ma H M, Liu J Y. Expression of nuclear hormone receptor NR4A1 in the human ovarian cycle[J]. Jiangsu Medical Journal, 2007,33(5): 439–440. (in Chinese) |
| [19] | 贾娟娟, 滚双宝, 林长光, 等. 胎次、配种及分娩月份对母猪繁殖性能的影响[J]. 甘肃农业大学学报, 2015, 50(1): 1–4. Jia J J, Gun S B, Lin C G, et al. The influence of different parities,mating months and birth months on reproductive performance of sows[J]. Journal of Gansu Agricultural University, 2015,50(1): 1–4. (in Chinese) |
| [20] | 陈丽, 张彬, 李丽立. 热应激对母猪繁殖性能的影响及防治措施[J]. 饲料博览, 2015(9): 13–17. Chen L, Zhang B, Li L L. The effects of heat stress on reproductive performance of sow and control meeasures[J]. Feed Review, 2015(9): 13–17. (in Chinese) |
| [21] | Sakatani M, Balboula A Z, Yamanaka K, et al. Effect of summer heat environment on body temperature,estrous cycles and blood antioxidant levels in Japanese black cow[J]. Animal Science Journal, 2012,83(5): 394–402. DOI: 10.1111/asj.2012.83.issue-5 |




