文章信息
- 王伟, 岳政府, 刘孝文, 张瑞福
- WANG Wei, YUE Zhengfu, LIU Xiaowen, ZHANG Ruifu
- 低温适应型植物根际促生细菌的筛选及促生效应研究
- Screening of low temperature adapted plant growth-promoting rhizobacteria and investigation of their promoting effects
- 南京农业大学学报, 2017, 40(1): 93-100
- Journal of Nanjing Agricultural University (Social Science), 2017, 40(1): 93-100.
- http://dx.doi.org/10.7685/jnau.201604022
-
文章历史
- 收稿日期: 2016-04-07
微生物肥料因其具有改良土壤结构,增加土壤肥力,促进植物对营养元素的吸收,刺激和调节植物生长,提高产量,改善品质,降低农残,保护环境等作用,因此在现代农业中得到越来越广泛的应用[1-2]。功能良好的菌种是研制微生物肥料的基础,筛选具有新功能或多功能、生长迅速、易存活的优良菌株至关重要[3-4]。
植物根际促生细菌(PGPR)通过多种机制促进植物生长和增加作物产量,如固氮、溶磷、解钾、产铁载体、产植物激素、产抗生素等,或者通过抑制病原菌的生长等方式间接促进植物生长[5-6]。关于植物根际促生菌的筛选,目前应用最广泛的方法是利用稀释涂布的分菌方法从土壤中分离出快速生长的菌株,测定其促生特性以及是否具有某些新功能,并将其纯化保存。新功能菌种的开发是微生物肥料行业发展的前提与保证。
温度是影响作物生长的关键因素。低温对作物产量具有不良影响,施用含PGPR的肥料能有效减轻这种不良影响[7]。高纬度寒冷地区的农业生产和反季节温室大棚蔬菜的生产都需要在相对低温的条件下能发挥作用的微生物肥料。因此,低温适应型根际促生菌的筛选和生物肥料的研制具有重要意义。
本研究主要立足于筛选低温适应型根际促生菌,创制在低温条件下对作物具有明显促生作用的微生物肥料。以期应用于我国北方地区冬季大棚蔬菜生产,起到在低温或寒冷条件下能增加作物产量,改善作物品质,保护环境的作用。
1 材料与方法 1.1 材料 1.1.1 根际土壤样品来源及前期处理采集我国不同省份的8个作物根际土壤样品(山西省和贵州省的土样为番茄根际土,内蒙古、新疆和四川省的土样为玉米根际土,海南省和江苏省的土样为黄瓜根际土,云南省的土样为魔芋根际土),采回的土壤盛于盆钵中,调节含水量至田间最大持水量的 60%。
1.1.2 初筛培养基NA培养基:牛肉膏3.5 g,蛋白胨10 g,NaCl 5 g,蒸馏水1 000 mL,琼脂15~20 g,pH7.2~7.4。
LB培养基:胰蛋白胨10 g ·L-1、酵母提取物5 g ·L-1、NaCl 10 g ·L-1,pH值7.0。
1.1.3 盆栽供试基质有机栽培基质,理化性质为有机质 130~200 g · kg-1,总养分40~60 g · kg-1,pH5.5~7.5,电导率(EC)1~2 ms · cm-1,总孔隙度 50%~70%,容重 290~360 kg · m-3。
1.1.4 供试有机肥腐熟堆肥:以鸡粪和秸秆为主要原料堆腐而成,有机质461.4 g · kg-1,总氮13.9 g · kg-1,P2O5 20.3 g · kg-1,K2O 9.6 g · kg-1,含水量26.53%,pH7.9。
1.1.5 供试土壤供试土壤为黄棕壤,理化性质为:有机质5.46 g · kg-1,全氮1.27 g · kg-1,速效磷6.8 mg · kg-1,速效钾88.4 mg · kg-1,pH8.18。
1.1.6 供试作物青菜为矮脚青‘华凤1号’,玉米品种为‘京甜紫花糯’,蕃茄品种为‘中蔬4号’。
1.2 方法 1.2.1 低温适应型菌株初筛8个土样分别取5 g置于盛有无菌玻璃珠和100 mL无菌水的锥形瓶中,15 ℃、170 r · min-1振荡30 min,得到土壤悬浮液,梯度稀释,在NA培养基上15 ℃倒置培养24~48 h。挑取生长迅速、形态不同的单个典型菌落,即获得相应分离物,经LB平板划线纯化3次,分别编号并加入灭菌甘油至浓度为15%,于-70 ℃保存待用。
将纯化的菌株进行促生特性测定,然后将产生一种或多种促生物质的菌株接入LB试管中,15 ℃、170 r · min-1振荡14 h,将D600=1.0的菌液按0.5%接种到100 mL LB三角瓶中,(15±1)℃、170 r · min-1振荡48 h,测D600,D600值大于0.6(能明显看出浑浊)的菌株即为低温适应型根际促生菌。
1.2.2 菌株促生特性研究NH3产生能力的测定参照 Dye[8]和康贻军等[9]的方法。嗜铁素产生能力的测定参照 Schwyn 等[10]和林天兴等[11]的方法。吲哚乙酸(IAA)产生能力的测定参照Glickmann 等[12]的方法。溶磷能力的测定参照文献[13-15]的方法。
1.2.3 促生效果盆栽试验2015年3—4月于南京农业大学资源与环境科学学院温室进行,选择8株低温适应型菌株(D4、F1、R1、R5、C1、C2、B5和P1)用于盆栽促生试验。玉米和番茄种子经表面消毒、催芽后播种于育苗盘,待幼苗长出 2~3 片真叶后,挑选大小、长势一致的幼苗移入装有灭菌栽培基质和蛭石(质量比为2:1)混合的塑料盆中,每盆 400 g,1株幼苗。供试菌株接种于 LB 液体培养基,15 ℃、170 r · min-1振荡培养至对数期,将菌悬液用无菌水洗涤 3 次后重悬于无菌水中,每盆加 5 mL 菌悬液,每 10 d 接菌1 次,接种量终浓度为 106 CFU · g-1,以加入等量无菌水为对照,每处理 6~8 次重复,随机区组排列,放置于温室且在自然光照下培养。
植物种植 30 d 后采样,将作物整株从盆中取出,清水洗净,吸水纸吸干,装入封口袋,置于冰盒中保鲜。测量各试验组和对照植株的各种形态学参数。
1.2.4 菌株鉴定待测各菌株在 LB 液体培养基中培养至对数期,提取细菌的基因组 DNA。以总 DNA 为模板,采用通用引物 27F/1492R[16](正向引物:5′-AGAGTTTGATCCTGGCTCAG-3′;反向引物:5′-GGTTACCTTGTTACGACTT-3′)进行16S rRNA 基因扩增。产物测序后,测序结果在 RDP数据库中进行比对,构建发育树以确定菌株的分类。
1.2.5 生物肥料创制将盆栽试验中促生效果好的菌株在糖蜜液体发酵培养基中发酵,发酵芽孢形成数量达到国家标准后,用10 kg腐熟堆肥吸附1 L发酵液后制作成微生物肥料,再以1%(质量分数)的施用量进行肥效试验。
1.2.6 肥效试验肥效试验于2015年11—12月在南京农业大学牌楼试验基地温室进行,选取盆栽试验中促生效果好的D4、R1两株菌制成生物有机肥进行青菜盆栽试验,室温维持在(15±1)℃,共设置8种处理:CK:不施肥;CF:100%化肥;OF:100%普通有机肥;D4:100% D4生物有机肥;R1:100% R1生物有机肥;CF+OF:50%化肥+50%普通有机肥;CF+D4:50%化肥+50% D4生物有机肥;CF+R1:50%化肥+50% R1生物有机肥。每处理 6次重复,随机区组排列,放置于自然光照下培养。以上处理中CK不施肥,其养分为供试土壤背景值,其余处理养分均保持一致。
青菜种植 60 d 后采样,将作物整株从盆中取出,清水洗净,吸水纸吸干,装入封口袋,置于冰盒中保鲜,带回实验室分析。测量各试验组和对照的各种形态学参数并采集根际土壤进行土壤酶活性测定。
1.2.7 土壤酶活性测定土壤脲酶测定:苯酚钠比色法测定[17]。土壤蔗糖酶测定:3,5-二硝基水杨酸比色法[17]。土壤碱性磷酸酶测定:土壤碱性磷酸酶(S-AKP/ALP)活性测定试剂盒(苏州科铭生物技术有限公司)。土壤过氧化氢酶测定:土壤过氧化氢酶(Solid-Catalase,S-CAT)试剂盒(苏州科铭生物技术有限公司)。
1.2.8 数据处理数据处理采用 Microsoft Office Excel 2010,统计分析采用 SPSS BASE ver.19.5 软件。
2 结果与分析 2.1 低温适应型菌株的初筛采用NA和LB初筛培养基分离纯化后,初筛所得36株菌株均具有溶磷、产 NH3、产 IAA 及产嗜铁素等一种或多种促生性能,其中具有产氨能力的 14 株,占所筛菌株的 38.9%;产 IAA的 20 株,占所筛菌株的 55.6%;产铁载体的 12 株,占所筛菌株的 33.3%;具有溶解有机磷能力的 15 株,占所筛菌株的 41.7%。经过低温(15 ℃)条件下生长验证,有8株菌在低温下生长较快。
2.2 菌株促生特性分别测定了8株菌的多项促生指标(表 1),所有菌株均具有产氨能力;产IAA的有6株,占所筛菌株的75%;8株菌均不产铁载体,也不具有溶解磷的能力。其中,D4在15 ℃时IAA产量最大,达到162 mg · L-1。
| 菌株编号 Strain No. | 产氨 NH3 production | 产铁载体 Siderophore production | IAA 产量/(mg·L-1) IAA production | 溶磷量/(mg·L-1) Soluble phosphate |
| D4 | +++ | — | 162±0.74 | — |
| F1 | +++ | — | 146±0.29 | — |
| R1 | +++ | — | 152±0.81 | — |
| R5 | +++ | — | 94±1.02 | — |
| C1 | ++ | — | 12±1.31 | — |
| C2 | + | — | — | — |
| B5 | ++ | — | 21±1.18 | — |
| P1 | +++ | — | — | — |
| 注: 从“+++”到“+”表示产氨能力由强到弱(根据颜色变化);数值表示平均值±标准误;“—”表示没有观测到该项指标。 | ||||
| Note: From“+++”to“+”represent different amount of ammonia production from strong to weak(according to color differences);Values are means±standard error;“—”represents not observed. The same as follows. | ||||
玉米和番茄种植30 d后,测量各试验组和对照组植株的形态学参数(表 2)。接种菌株D4、F1、R1和R5后玉米株高与对照有显著差异,分别增加41.2%、60.9%、50.6%和65%;接种菌株D4和R1后番茄株高与对照有显著差异,分别增加44.7%和55.5%。
| 作物 Crop | 菌株 Strains | 株高/cm Shoot height | 地上部鲜质量/g Shoot fresh weight | 地上部干质量/g Shoot dry weight | 根干质量/g Root dry weight |
| 玉米 | 水Water | 27.30±2.61c | 5.86±0.45b | 0.40±0.04b | 0.23±0.06b |
| Maize | D4 | 38.60±5.82ab | 7.57±0.33ab | 0.54±0.02ab | 0.40±0.06ab |
| F1 | 43.97±4.65ab | 7.34±2.82ab | 0.52±0.20ab | 0.29±0.05ab | |
| R1 | 41.17±0.95ab | 12.04±0.98a | 0.87±0.13a | 0.55±0.10a | |
| R5 | 45.10±4.81a | 8.89±2.96ab | 0.62±0.25ab | 0.36±0.23ab | |
| C1 | 35.57±4.89abc | 9.16±1.89ab | 0.64±0.17ab | 0.36±0.13ab | |
| C2 | 36.40±2.50abc | 6.65±2.37b | 0.52±0.14ab | 0.41±0.04ab | |
| B5 | 41.40±5.50ab | 5.84±2.16b | 0.45±0.21b | 0.15±0.13b | |
| P1 | 33.90±5.11abc | 5.04±0.96b | 0.37±0.08b | 0.22±0.08b | |
| 番茄 | 水Water | 32.07±2.73c | 6.12±2.73b | 0.45±0.17bc | 0.07±0.01b |
| Tomato | F1 | 44.90±3.94abc | 13.74±0.71ab | 1.01±0.07abc | 0.20±0.08ab |
| D4 | 46.40±3.72ab | 11.51±1.45ab | 1.11±0.19ab | 0.17±0.06ab | |
| R1 | 49.87±2.81a | 15.08±3.12a | 1.47±0.45a | 0.25±0.14a | |
| R5 | 37.10±1.19abc | 6.88±1.14b | 0.52±0.09bc | 0.15±0.04ab | |
| B5 | 34.80±7.69bc | 8.58±4.72ab | 0.60±0.32bc | 0.12±0.05ab | |
| P1 | 37.20±2.03abc | 9.33±1.85ab | 0.79±0.18bc | 0.12±0.02ab | |
| C1 | 41.10±8.28abc | 11.21±4.33ab | 0.84±0.11bc | 0.16±0.02ab | |
| 注:不同字母表示不同处理间数值在0.05水平上差异显著。 | |||||
| Note:Different letters represent significant differences in different treatment at 0.05 level. The same as follows. | |||||
根据盆栽促生试验结果,选择对玉米和番茄均有较好促生作用的菌株D4和R1在糖蜜培养基中进行液体发酵。根据菌株D4和R1在各自糖蜜液体发酵培养基中的生长曲线,选择稳定期的发酵液,即37 ℃、170 r · min-1振荡培养72 h的发酵液,芽孢形成数量在4.6×1010 CFU · mL-1和6×1010 CFU · mL-1左右。用腐熟堆肥吸附发酵液后,制作成的菌株D4和R1生物肥料芽孢数量分别为4.6×109和6×109 CFU · g-1。
2.5 肥效试验 2.5.1 生物有机肥对青菜株高的影响生物有机肥在混施处理中对青菜株高影响显著(表 3)。在施用单一肥的处理中,与CK及OF处理相比,D4与R1处理均没有显著差异;在混施处理中,与CF+OF处理相比,CF+R1处理有显著差异,增加了15.6%;CF+D4处理有显著性差异,增加了25.6%。
| 处理Treatment | 株高/cm Shoot height | 根长/cm Root length | 鲜质量/g Fresh weight |
| CK | 10.43±0.80d | 6.33±0.76d | 2.37±0.40e |
| CF | 15.10±0.53c | 8.33±0.29c | 18.60±1.99b |
| OF | 10.17±0.40d | 8.57±0.27c | 5.77±0.81d |
| CF+OF | 14.27±1.12c | 8.90±0.82c | 14.37±0.93c |
| R1 | 11.27±0.40d | 10.43±0.60b | 4.80±0.10d |
| CF+R1 | 16.90±0.69b | 13.40±1.82a | 29.37±0.29a |
| D4 | 12.30±2.40d | 10.73±2.00b | 3.23±0.55d |
| CF+D4 | 19.17±0.29a | 12.83±0.85a | 31.93±1.86a |
| 注: CK:不施肥;CF:100%化肥;OF:100%普通有机肥;D4:100% D4生物有机肥;R1:100% R1生物有机肥;CF+OF:50%化肥+50%普通有机肥;CF+D4:50%化肥+50% D4生物有机肥;CF+R1:50%化肥+50% R1生物有机肥。 | |||
| Note: CK:No fertilization;CF:100% chemical fertilizer;OF:100% organic fertilizer;D4:100% D4 bioorganic fertilizer;R1:100% R1 bioorganic fertilizer;CF+OF:50% chemical fertilizer and 50% organic fertilizer;CF+D4:50% chemical fertilizer and 50% D4 bioorganic fertilizer;CF+R1:50% chemical fertilizer and 50% R1 bioorganic fertilizer. The same as follows. | |||
生物有机肥对青菜根长影响显著(表 3)。在施用单一肥的处理中,与CK处理相比,D4与R1处理的根长分别增加了41%和39.3%;与CF处理相比,D4与R1处理的根长分别增加了20.1%和23%;与OF处理相比,D4与R1处理的根长分别增加了20.1%和17.8%;在混施处理中,与CF+OF处理相比,CF+D4和CF+R1处理的根长分别增加了30.6%和33.6%。
2.5.3 生物有机肥对青菜鲜质量的影响生物有机肥对青菜鲜质量影响显著(表 3)。在施用单一肥的处理中,与CK处理相比,D4与R1处理青菜鲜质量分别增加了26.6%和50.6%;与OF处理相比,D4与R1处理没有显著差异;在混施处理中,与CF+OF处理相比,CF+D4和CF+R1处理青菜鲜质量分别增加了55%和51.1%。
2.6 生物有机肥对青菜地土壤酶活性的影响 2.6.1 对土壤脲酶活性的影响从图 1-A看出,D4生物有机肥单施和混施处理的脲酶活性与对照相比均没有显著性差异。在施用单一肥的处理中,与CK、CF和OF处理相比,R1处理的脲酶活性均显著增加,分别增加了59%、50%和44%;在混施处理中,与CF+OF处理相比,CF+R1处理的脲酶活性显著增加了39.4%(图 2-A)。
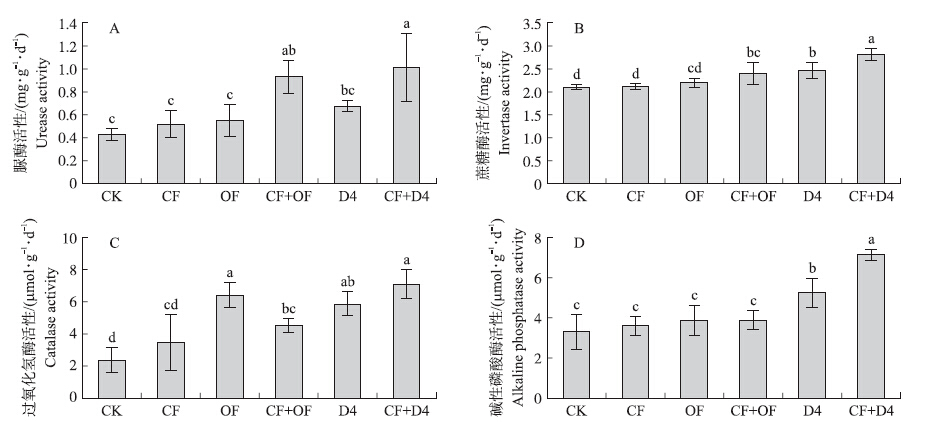
|
图 1 D4生物有机肥不同施肥处理对土壤脲酶(A)、蔗糖酶(B)、过氧化氢酶(C)和碱性磷酸酶(D)活性的影响 Figure 1 Effects of D4 bioorganic fertilizer on soil urease(A),invertase(B),catalase(C) and alkaline phosphatase(D)activities in different fertilization treatments |
从图 1-B可知:在施用单一肥的处理中,与CK、CF和OF处理相比,D4处理蔗糖酶活性均有显著差异,分别增加了19%、14.3%和9.5%;在混施处理中,与CF+OF处理相比,CF+D4处理蔗糖酶活性增加了14.3%(P<0.05)。在施用单一肥的处理中,与CK、CF和OF处理相比,R1处理蔗糖酶活性分别增加了12.5%、14.3%和9.5%;在混施处理中,与CF+OF处理相比,CF+R1处理蔗糖酶活性增加了45%(图 2-B)。
2.6.3 对土壤过氧化氢酶活性的影响从图 1-C可知:在施用单一肥的处理中,与CK和CF处理相比,D4处理过氧化氢酶活性分别增加了61%和45.8%;与OF处理相比,D4处理没有显著差异。在混施处理中,与CF+OF处理相比,CF+D4处理过氧化氢酶活性增加了35.7%。图 2-C显示,在施用单一肥的处理中,与CK和CF处理相比,R1处理过氧化氢酶活性分别增加了63.3%和26.7%;与OF处理相比,R1处理没有显著差异。在混施处理中,与CF+OF处理相比,CF+R1处理过氧化氢酶活性显著增加了43.8%(图 2-C)。
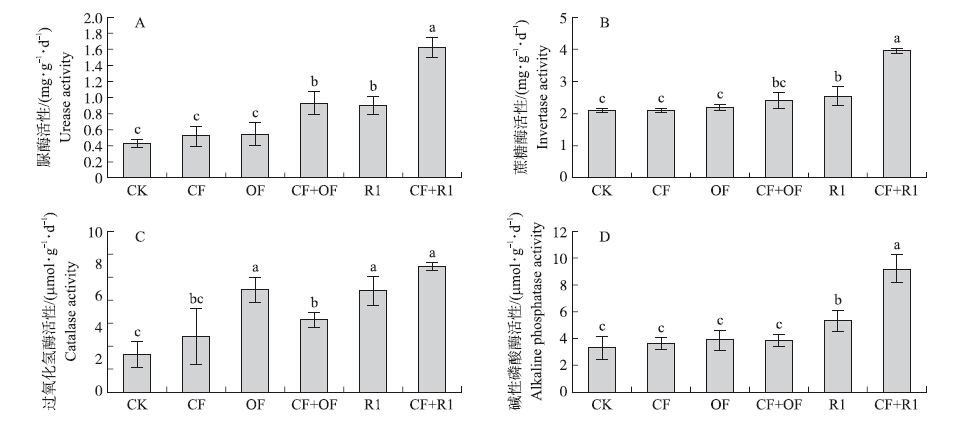
|
图 2 R1生物有机肥不同施肥处理对土壤脲酶(A)、蔗糖酶(B)、过氧化氢酶(C)和碱性磷酸酶(D)活性的影响 Figure 2 Effects of R1 bioorganic fertilizer on soil urease(A),invertase(B),catalase(C) and alkaline phosphatase(D)activities in different fertilization |
从图 1-D可知:在施用单一肥的处理中,与CK、CF和OF处理相比,D4处理碱性磷酸酶活性分别增加了35.7%、32.1%和28.6%;在混施处理中,与CF+OF处理相比,CF+D4处理碱性磷酸酶活性增加了44.4%。在施用单一肥的处理中,与CK、CF和OF处理相比,R1处理碱性磷酸酶活性分别增加了36%、32%和28%;在混施处理中,与CF+OF处理相比,CF+R1处理碱性磷酸酶活性增加了58.3%(图 2-D)。
2.7 菌株鉴定结果将所筛选的8株菌株16S rRNA 基因序列提交 NCBI 比对,根据与待测菌株同源性较高的菌株名称,初步鉴定菌株种属。结果(图 3)显示:8株菌株均属于芽孢杆菌属(Bacillus sp.)。其中,肥效试验用菌株D4属于巨大芽孢杆菌;R1菌株属于短小芽孢杆菌。

|
图 3 基于菌株R1和D4的 16S rRNA 基因序列构建的系统发育树 Figure 3 Phylogenetic trees of R1 and D4 by using 16S rRNA sequences |
近年来,随着微生物肥料行业的蓬勃发展,对开发新功能菌种的需求日益迫切,越来越多的科研工作者致力于植物根际促生菌的筛选。根际促生菌能改变根际环境中整个微生物群落的结构,使其与植物形成有益互作关系,以此促进植物生长[18-19]。荣良燕等[20]通过测定植物根际促生菌的促生特性,包括固氮作用、溶磷量、生长素分泌量、对病原菌的拮抗能力及菌株生长速度,筛选出了6株具有较好促生特性的优良菌株,利用筛选促生菌研制的生物肥料替代30%的化肥,试验结果表明玉米在株高、地上部生物量、穗长、穗粗、单位面积穗数、穗粒数和经济产量等方面均有提高。在植物根际促生菌促生效应的研究中,促生菌株的实际应用效果已有广泛报道,如段秀梅等[21]的测定结果显示玉米株高和干质量分别增加了 36.4%和 27.8%,Senthilkumar等[22]的研究结果表明水稻根长和茎长分别增加了61%和 53%,Murashige等[23]的研究结果表明烤烟鲜质量增加了 35%。试验结果说明植物根际促生菌对作物的促生作用在实际应用中已取得显著效果。本试验中,肥效试验结果显示D4和R1生物有机肥处理的青菜株高、根长和鲜质量均显著增加,促生效果明显,尤其是根长增加的比较显著,这一方面的意义不可忽略,植物根系的快速生长有助于在幼苗期大量吸收营养物质,为后期的生长提供保障。同时,生物有机肥和化肥混合施用处理促生效果好于有机肥或化肥单独施用,这与前人研究结果[24] 一致。
PGPR产植物激素是促进植物生长的一种重要机制。吲哚乙酸(IAA)是一种重要的植物激素,在较低浓度下就可以促进植物主根生长,高浓度抑制主根生长,但能促进侧根和须根的生长。大部分PGPR均能够产生 IAA。Shao等[25]所筛菌株的产 IAA 量为15.31~72.38 mg · L-1,而且大部分的初筛菌株具有产 IAA 能力,表明产植物激素 IAA 是植物根际促生菌具有促生作用的主要因素之一。本试验所选菌株D4和R1均没有产铁载体和溶磷的能力,但产IAA量高于前人报道,尤其在低温时IAA产量较高,可能有利于其在低温条件下的作物促生。
研究指出,施有机肥能显著提高土壤微生物量和碳、氮、磷含量[26]。有机肥分解需要微生物的作用,同时有机肥产生的营养元素不仅促进了作物的生长,也促进了微生物的生长,而且由于根的生长和根系分泌物的增加,因而也促进了土壤微生物的繁殖,提高了土壤酶活性。本研究中,除了D4生物有机肥单独施用对土壤脲酶活性影响不显著以外,D4和R1生物有机肥无论在单施还是与化肥的混施处理中对土壤蔗糖酶、过氧化氢酶和碱性磷酸酶活性均显著提高,这对生物有机肥对青菜的促生效果提供了一定的理论依据。
综上所述,本研究所筛选得到的低温适应型菌株和研制的生物肥料,对作物生长有明显的促生作用,具有在寒冷地区农业生产中应用的潜力。
| [1] | 葛诚. 微生物肥料生产应用基础[M]. 北京: 中国农业科技出版社, 2000 : 1 -28. Ge C. Production Application of Microbial Fertilizer[M]. Beijing: China Agricultural Science and Technology Press, 2000 : 1 -28. (in Chinese) |
| [2] | 张瑞福, 颜春荣, 张楠, 等. 微生物肥料研究及其在耕地质量提升中的应用前景[J]. 中国农业科技导报, 2013, 15(5): 8–16. Zhang R F, Yan C R, Zhang N, et al. Studies on microbial fertilizer and its application prospects in improving arable land quality[J]. Journal of Agricultural Science and Technology, 2013,15(5): 8–16. (in Chinese) |
| [3] | 刘静洋, 崔松松, 韩国民, 等. 棉花根际细菌的生理活性和促生效果[J]. 中国土壤与肥料, 2013(6): 88–92. Liu J Y, Cui S S, Han G M, et al. Physiological activity and promoting effects of rhizobacteria on cotton[J]. Soil and Fertilizer Sciences in China, 2013(6): 88–92. (in Chinese) |
| [4] | 崔晓双, 王伟, 张如, 等. 基于根际营养竞争的植物根际促生菌的筛选及促生效应研究[J]. 南京农业大学学报, 2015, 38(6): 958–966. Cui X S, Wang W, Zhang R, et al. Screening of plant growth-promoting rhizobacteria based on rhizosphere nutrition competiveness and investigation of their promoting effects[J]. Journal of Nanjing Agricultural University, 2015,38(6): 958–966. DOI: 10.7685/j.issn.1000-2030.2015.06.013 (in Chinese) |
| [5] | Lee S W, Lee S H, Balaraju K, et al. Growth promotion and induced disease suppression of four vegetable crops by a selected plant growth-promoting rhizobacteria (PGPR) strain Bacillus subtilis 21-1 under two different soil conditions[J]. Acta Physiologiae Plantarum, 2014,36: 1353–1362. DOI: 10.1007/s11738-014-1514-z |
| [6] | Bhattacharyya P N, Jha D K. Plant growth promoting rhizobacteria (PGPR):emergence in agriculture[J]. World Journal of Microbiology and Biotechnology, 2012,28: 1327–1350. DOI: 10.1007/s11274-011-0979-9 |
| [7] | Metin T, Medine G, Fikrettin S. Effects of plant growth promoting rhizobacteria on yield, growth and some physiological characteristics of wheat and barley plant[J]. Communications in Soil Science and Plant Analysis, 2012,43: 1658–1673. DOI: 10.1080/00103624.2012.681739 |
| [8] | Dye D W. The inadequacy of the usual determinative tests for identification of Xanthomonas spp[J]. New Zealand Journal of Science, 1962,5: 393–416. |
| [9] | 康贻军, 程洁, 梅丽娟, 等. 植物根际促生菌的筛选及鉴定[J]. 微生物学报, 2010, 50(7): 853–861. Kang Y J, Cheng J, Mei L J, et al. Screening and identification of plant growth-promoting rhizobacteria[J]. Acta Microbiologica Sinica, 2010,50(7): 853–861. (in Chinese) |
| [10] | Schwyn B, Neilands J B. Universal chemical assay for the detection and determination of siderophores[J]. Analytical Biochemistry, 1987,160: 47–56. DOI: 10.1016/0003-2697(87)90612-9 |
| [11] | 林天兴, 唐梅, 黄明远, 等. 高产铁载体棉田土壤细菌SS05的筛选与鉴定[J]. 微生物学通报, 2012, 39(5): 668–676. Lin T X, Tang M, Huang M Y, et al. Screening and identification of a high yield siderophores producing bacteria SS05 isolated from cotton soil[J]. Microbiology, 2012,39(5): 668–676. (in Chinese) |
| [12] | Glickmann E, Dessaux Y. A critical examination of the specificity of the salkowski reagent for indolic compounds produced by phytopathogenic bacteria[J]. Applied and Environmental Microbiology, 1995,61(2): 793–796. |
| [13] | Janne K, Marko L, Paivi N, et al. Isolation, characterization, molecular gene cloning, and sequencing of a novel phytase from Bacillus subtilis[J]. Applied and Enviromental Microbiology, 1998,64(6): 2079–2085. |
| [14] | Ribeiro C M, Cardoso E J B N. Isolation, selection, and characterization of root-associated growth promoting bacteria in Brazil pine (Araucaria angustifolia)[J]. Microbiological Research, 2012,167(2): 69–78. DOI: 10.1016/j.micres.2011.03.003 |
| [15] | Pongdet P, Bancha B, Piyada T, et al. Effect of plant growth promoting rhizobacteria (PGPR) inoculation on microbial community structure in rhizosphere of forage corn cultivated in Thai land[J]. European Journal of Soil Biology, 2011,47: 44–54. DOI: 10.1016/j.ejsobi.2010.11.004 |
| [16] | 李引, 虞丽, 李辉信, 等. 一株花生根际促生菌的筛选鉴定及其特性研究[J]. 生态与农村环境学报, 2012, 28(4): 416–421. Li Y, Yu L, Li H X, et al. Isolation, identification and characteristics of a peanut growth promoting strain of rhizobacteria[J]. Journal of Ecology and Rural Environment, 2012,28(4): 416–421. (in Chinese) |
| [17] | 关松荫. 土壤酶及其研究法[M]. 北京: 农业出版社, 1986 . Guan S Y. Soil Enzyme and Its Study Method[M]. Beijing: Agriculture Press, 1986 . (in Chinese) |
| [18] | Anuj R, Baljeet S, Monica J, et al. Identification of multi-trait PGPR isolates and evaluating their potential as inoculants for wheat[J]. Annals of Microbiology, 2011,61: 893–900. DOI: 10.1007/s13213-011-0211-z |
| [19] | 谯天敏, 郑磊, 张静, 等. 绛红褐链霉菌的根际定殖能力动态监测[J]. 南京林业大学学报(自然科学版), 2015, 39(5): 21–26. Qiao T M, Zheng L, Zhang J, et al. Dynamic detection for colonization of Streptomyces purpeofuscus in Juglans sigllata rhizosphere[J]. Journal of Nanjing Forestry University (Natural Science Edition), 2015,39(5): 21–26. (in Chinese) |
| [20] | 荣良燕, 姚拓, 黄高宝, 等. 植物根际优良促生菌(PGPR)筛选及其接种剂部分替代化肥对玉米生长影响研究[J]. 干旱地区农业研究, 2013, 31(2): 59–65. Rong L Y, Yao T, Huang G B, et al. Screening of plant growth promoting rhizobacteria strains and effects of inoculant on growth of maize by replacing part of chemical fertilizers[J]. Agricultural Research in the Arid Areas, 2013,31(2): 59–65. (in Chinese) |
| [21] | 段秀梅, 高晓蓉, 吕军, 等. 两株土壤分离菌的解磷能力及对玉米的促生作用[J]. 中国土壤与肥料, 2010(2): 79–85. Duan X M, Gao X R, Lü J, et al. Two phosphate-solubilizing bacteria from calcareous soil solubilizing phosphate capacity and promoting effect on corn seedling growth[J]. Soil and Fertilizer Sciences in China, 2010(2): 79–85. (in Chinese) |
| [22] | Senthilkumar M, Madhaiyan M, Sundaram S P, et al. Intercellular colonization and growth promoting effects of Methylobacterium sp.with plant-growth regulators on rice (Oryza sativa L.cv CO-43[J]. Microbiological Research, 2009,164(1): 92–104. DOI: 10.1016/j.micres.2006.10.007 |
| [23] | Murashige T, Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue cultures[J]. Physiologia Plantarum, 1962,15: 473–497. DOI: 10.1111/ppl.1962.15.issue-3 |
| [24] | 刘天毅, 李春英, 熊德中, 等. 烤烟有机肥与化肥配合施用效应的探讨[J]. 中国烟草科学, 2000(4): 23–26. Liu T Y, Li C Y, Xiong D Z, et al. The effects of organic fertilizer combined with chemical fertilizer on the flue-cured tobacco[J]. Chinese Tobacco Science, 2000(4): 23–26. (in Chinese) |
| [25] | Shao J H, Xu Z H, Zhang N, et al. Contribution of indole-3-acetic acid in the plant growth promotion by the rhizosphere strain Bacillus amyloliquefaciens SQR9[J]. Biology and Fertility Soils, 2015,51: 321–330. DOI: 10.1007/s00374-014-0978-8 |
| [26] | 刘国顺, 李正, 敬海霞, 等. 连年翻压绿肥对植烟土壤微生物量及酶活性的影响[J]. 植物营养与肥料学报, 2010, 16(6): 1472–1478. Liu G S, Li Z, Jing H X, et al. Effects of consecutive turnover of green manures on soil microbial biomass and enzyme activity[J]. Plant Nutrition and Fertilizer Science, 2010,16(6): 1472–1478. (in Chinese) |




