文章信息
- 穆静娟, 焦加国, 葛新成, 刘满强, 李根, 胡锋, 武俊, 李辉信
- MU Jingjuan, JIAO Jiaguo, GE Xincheng, LIU Manqiang, LI Gen, HU Feng, WU Jun, LI Huixin
- 植物病原真菌广谱拮抗菌M29的筛选、鉴定及其抑菌机制
- Isolation and identification of a plant pathogenic fungi and broad-spectrum antagonistic bacterium Bacillus subtilis M29 and its antibiotic mechanism
- 南京农业大学学报, 2017, 40(1): 84-92
- Journal of Nanjing Agricultural University (Social Science), 2017, 40(1): 84-92.
- http://dx.doi.org/10.7685/jnau.201604007
-
文章历史
- 收稿日期: 2016-04-04
2. 江苏省有机固体废弃物资源化协同创新中心, 江苏 南京 210095
2. Jiangsu Collaborative Innovation Center for Solid Organic Waste Utilization, Nanjing 210095, China
长期以来化学杀虫剂和杀菌剂的不适当使用造成了严重的环境问题。化学杀虫剂和杀菌剂在杀灭自然及农业生态系统中有害生物的同时也杀害了有益生物,残留的有毒物质进入食物链并且在生物体内累积。这不仅给环境带来了很大的压力,也给人们的身体健康带来了威胁,给可持续农业的发展战略提出了挑战,这就促使人们寻求更安全、有效的病害管理措施。
利用环境中的拮抗菌进行生物防治是目前普遍受到重视的环境友好型方法,研究者已从不同介质中分离筛选了许多优良生防菌种[1-4]。蚯蚓粪是蚯蚓对有机废弃物进行生物降解的产物,能够控制一些蔬菜类植物土传病害的发生[5]。实践证明,蚯蚓粪中富含细菌、放线菌和真菌,这些微生物不仅使复杂物质矿化为植物易于吸收的有效物质,而且还合成一系列有生物活性的抗菌物质,能够有效拮抗土传病原菌。贾凤安等[6]成功地从蚯蚓粪里分离得到拮抗能力强、抑菌谱广的拮抗微生物。孙燕霞等[7]从蚯蚓粪与黄粉虫沙里筛选出对尖孢镰刀菌具有拮抗作用的白地霉,并且进行紫外线诱变处理,得到白地霉的变种。刘雪连等[8]从蚯蚓粪里分离得到54株具备产酸性能的菌株,其中6个菌株对大肠杆菌具备拮抗作用。Pathma等[9]从蚯蚓粪中筛选出193株细菌,均表现出较好的拮抗活性和生物防治潜能。汪学军等[10]从蚯蚓粪里筛选得到16株对指示病原菌具备抗菌活性的放线菌,该研究为进一步分离抗菌物质用于生物防治提供理论基础。
虽然国内外对于植物土传病害的生物防治研究已经取得了一些进展,然而土传病害的生物防治仍存在诸多问题。因此,筛选出高效且广谱的生防菌株是目前进行生物防治的重要任务。本文试图从微生物数量多、活性强的蚯蚓粪中分离筛选,得到能够广谱拮抗土传病菌的生防菌并明确其生防机制,为日益严重的植物土传病害的绿色防治提供技术支撑。
1 材料与方法 1.1 供试材料 1.1.1 蚯蚓粪(vermicompost)和供试病原菌蚯蚓粪取自南京市江浦汤泉农场。黄瓜枯萎病菌(Fusarium oxysporum f.sp.cucumerinum)、棉花枯萎病菌(F.oxysporum f.sp.vasinfectum)、大丽轮枝病菌(Verticillium dahliae)、甜瓜枯萎病菌(F.oxysporum f.sp.melonis)、木霉病菌(Trichoderma spp.)、草莓根腐病菌(Pestalotiopsispho tiniae)、水稻纹枯病菌(Rhizoctornia solani)、烟曲霉病菌(Aspergillus fumigatus)等均由南京农业大学资源与环境科学学院植物营养与肥料学系提供。桃溃疡病菌(Phomopsis amygdali)、灰霉病菌(Botrytis cinerea)由南京农业大学植物保护学院杀菌剂生物学实验室提供。
1.1.2 供试培养基LB培养基:蛋白胨 10.0 g,酵母粉 5.0 g,氯化钠 10.0 g,蒸馏水1.0 L,pH7.0~7.2。PDA培养基:葡萄糖20.0 g,琼脂20.0 g,马铃薯粉6.0 g,蒸馏水1.0 L,pH5.4~5.8。YPD 培养基:葡萄糖20.0 g,蛋白胨20.0 g,酵母粉10.0 g,琼脂30.0 g,蒸馏水1.0 L,pH7.0~7.2。Landy培养基:葡萄糖20.0 g,L-谷氨酸5.0 g,KH2PO4 1.5 g,MgSO4 · 7H2O 0.5 g,KCl 0.5 g,酵母粉1.0 g,MnSO4 5.0 mg,CuSO4 · 5H2O 0.16 mg,FeSO4 · 7H2O 0.15 mg,L-苯丙氨酸 2.0 mg,蒸馏水 1.0 L,pH7.0~7.2。
1.2 拮抗菌的筛选与鉴定 1.2.1 拮抗菌的分离称取10 g蚯蚓粪,置于盛有90 mL无菌水的250 mL三角瓶中,在摇床中,30 ℃、180 r · min-1振荡30 min,静置10 min,得到悬浮液。系列稀释后,取1×10-4、1×10-5、1×10-6、1×10-7 g · mL-1稀释液100 μL 涂于LB培养基,每个梯度重复3次,于30 ℃恒温箱中培养24 h后,挑取不同类型单个菌落,4 ℃保存在LB斜面待用。
1.2.2 初筛分别将已在PDA平板上培养好的木霉病菌、灰霉病菌、烟曲霉病菌、大丽轮枝病菌、棉花枯萎病菌、甜瓜枯萎病菌、桃溃疡病菌和草莓根腐病菌用5 mm灭菌打孔器打孔,用镊子将直径为5 mm的病原菌块转接于PDA平板中央。同样方法将在YPD平板上培养好的黄瓜枯萎病菌、水稻纹枯病菌转接于YPD培养基中央,然后将分离得到的单菌落均匀地分4点接种在真菌菌饼四周(距菌饼外圈约1 cm,以下同),每个处理重复3次,以不接拮抗菌为空白对照(CK),置于30 ℃培养箱培养,灰霉病菌置于25 ℃培养箱,培养3~5 d,根据抑菌圈直径大小选出效果好的拮抗菌。
1.2.3 复筛将初筛得到的效果好的细菌通过梯度稀释进一步分离纯化,将纯化的菌株按照初筛的方法进行重复试验。挑选出抑菌圈直径比较大的菌株进行下一步试验,并计算抑菌率。抑菌率=(空白对照菌落直径平均值-处理抑菌菌落直径平均值)/空白对照菌落直径平均值×100%。
1.2.4 拮抗细菌菌株鉴定将活化后的菌株划线接种于LB平板上,30 ℃ 培养 24 h,观察菌落形态,并进行革兰氏染色,显微镜下观察其菌体形态。另外,通过双重固定法[11]前处理M29后,在型号为Hitachi S-3400N的电镜下进一步观察M29的形态特征。参照文献[12-13]对菌株进行生理生化鉴定。用SDS高盐法[14]提取菌株基因组DNA,采用27F/1492R(GAGTTTGATCCTGGCTCAG/CGGTTACCTTGTTACGACTT)通用引物对菌株16S rDNA基因进行PCR扩增。反应体系:DNA 模板(稀释10倍)1 μL,引物27F 和 1492R各1 μL,Premix Ex Taq酶25 μL,ddH2O 22 μL。PCR 反应条件:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃1 min,共 30 次循环。PCR产物经7.5 g · L-1 琼脂糖凝胶电泳检测后,送往南京思普金生物科技有限公司测序。将菌株的16S rDNA测序结果登录RDP数据库,找出序列同源性最高的11个模式菌株,采用MEGA 3.1 软件[15]Neighbor-joining 法构建系统发育树,自举法(bootstrap)对系统发育树进行检验,重复1 000次。
1.3 菌株M29的拮抗活性测定 1.3.1 抗菌谱及抑菌率的测定菌株的种子液培养:将保存的M29菌种在LB平板上划线,30 ℃培养24 h,用接种环取单菌落接种于含3 mL LB液体培养基的试管中,30 ℃、180 r · min-1培养24 h。按1%接种量将种子液接入装有200 mL LB液体培养基的500 mL三角瓶中,30 ℃、180 r · min-1培养24 h 后12 000 r · min-1离心,去掉上清液,浓缩菌液。依照1.2.2节中接种真菌的方法完成各种真菌的接种,然后吸取5 μL上述浓缩菌液均匀接种在真菌菌饼四周等距处,每个处理重复3次,以不接拮抗菌为空白对照(CK),置于30 ℃培养箱培养,灰霉病菌置于25 ℃培养箱,培养3~5 d,调查抑菌效果,计算抑菌率。
1.3.2 菌株M29产脂肽类抗菌物质的制备与拮抗活性测定无菌滤液的制备:以5%的接种量将种子液接种到100 mL Landy培养基,30 ℃、180 r · min-1培养后,发酵液于4 ℃、12 000 r · min-1离心20 min,用灭菌的0.22 μm滤膜过滤除菌,滤液在LB平板上培养,无菌落形成则视为无菌滤液。
抗菌物质粗提物的制备:抗菌物质的提取采用酸沉淀法。在上述无菌滤液中加入6 mol · L-1 HCl调节pH值至2.0,4 ℃过夜。于8 000 r · min-1离心10 min,收集沉淀,用pH2.0的水洗数次,沉淀干燥后加入甲醇抽提2次,合并抽提液,旋转蒸发,得到淡黄色粉末,溶于pH6.8的磷酸缓冲液(PBS)中,然后用灭菌的0.22 μm滤膜过滤后即得无菌粗提物[15]。
拮抗活性的测定:依照1.2.2节中接种真菌的方法完成各种真菌的接种,然后将4个无菌滤纸片均匀放在病原菌菌饼四周等距处,在每个滤纸片上滴10 μL脂肽类粗提取物,以等量PBS为空白对照,每个处理重复3次,放置在30 ℃培养箱培养,灰霉病菌置于25 ℃培养箱培养。3~5 d后调查结果,计算抑菌率。
1.3.3 菌株M29产VOCs对病原菌的抑菌率及抑菌谱菌株按1% 接种量将种子液接入装有200 mL LB液体培养基的500 mL三角瓶中,30 ℃、180 r · min-1培养24 h 后12 000 r · min-1离心,去掉上清液,吸取50 μL浓缩菌液涂布于LB平板上,置于无菌操作台内2 h晾干菌液。
依照1.2.2节中接种真菌的方法完成各种真菌的接种,然后将上述涂过拮抗菌的LB平板与接有病原真菌的PDA/YPD平板倒扣起来,接有拮抗菌的一面朝上,用封口膜密封;同时,设置对照组,只接病原真菌,不接拮抗菌。灰霉病菌放置在25 ℃培养箱,其他病原菌置于30 ℃培养箱,培养3~5 d调查结果,计算抑菌率。
1.4 数据统计与分析采用 Excel 2010 和SPSS 22.0软件进行数据统计分析。
2 结果与分析 2.1 拮抗菌的筛选本试验从蚯蚓粪中共分离筛选出65株细菌,通过初筛和复筛得到拮抗水稻纹枯病菌的细菌12株,拮抗黄瓜枯萎病菌的细菌21株,拮抗桃溃疡病菌的细菌3株,拮抗灰霉病菌的细菌3株。挑取拮抗效果最好的9株拮抗菌进行16S rDNA测序,将测序结果在NCBI上BLAST比对,均为芽孢杆菌属。其中,菌株M29能够抑制灰霉等10种病原菌且效果显著,因此进行后续研究。
2.2 菌株M29的鉴定菌株M29在LB平板上培养,培养初期可观察到菌落饱满透明、积累大量黏液、牢固地附着在培养基上;培养后期呈裂叶状,边缘毛发状,培养3 d后菌落呈褶皱垒起的山丘状,可产生近中生的椭圆状芽孢,孢囊稍膨大,细胞形态和排列呈杆状,单生,无荚膜,可运动(图 1)。M29的生理生化特性为革兰氏阳性,严格好氧,化能异养,接触酶阳性,M.R试验阴性,VP试验阳性,淀粉水解阳性,明胶水解阴性,柠檬酸盐利用阳性,硝酸盐还原阳性,最适培养条件为25~37 ℃,pH4~10,NaCl浓度1%~10%,最适碳氮源分别为蔗糖和硫酸铵。
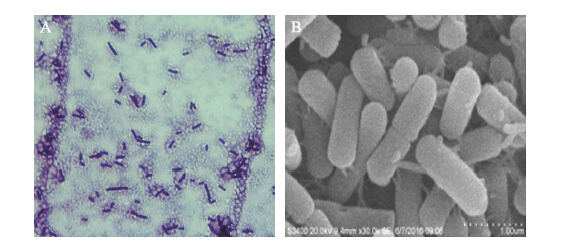
|
图 1 菌株M29在油镜(100×10)(A)及电镜(B)下的的形态特征 Figure 1 Morphological characteristics of strain M29 under the oil mirror(100×10)(A)and the electron microscopy(B) |
为进一步确定菌株的分类学地位,测定其16S rDNA基因序列,扩增目的基因序列长度为1 465 bp。菌株M29(KU870670)与数据库中菌株Bacillus subtilis(HM217126.1)和菌株Bacillus subtilis(KJ499783.1)相似度均为100%,利用软件MEGA 3.1对菌株M29构建系统进化树。图 2表明:菌株M29与Bacillus subtilis(HM217126.1)和Bacillus subtilis(KJ499783.1)在系统发育树上聚为一支,结合菌株形态特征及生理生化试验,确定菌株M29为枯草芽孢杆菌(Bacillus subtilis)。

|
图 2 依据16S rDNA序列构建的菌株M29同属相关种的系统发育树 Figure 2 Phylogenetic tree of strain M29 and related Bacillu ssp. based on 16S rDNA sequences with MEGA 3.1 software |
如图 3所示:菌株M29对灰霉病菌、黄瓜枯萎病菌、草莓根腐病菌、棉花枯萎病菌、桃溃疡病菌、大丽轮枝病菌、木霉病菌、烟曲霉病菌、水稻纹枯病菌等植物病原菌均有不同程度的抑制作用。从图 4可见:菌株M29对不同病原菌的抑菌率范围为49%~95%,对水稻纹枯病菌的抑菌率可达95%,对大丽轮枝病菌和灰霉病菌的抑菌率分别为91%和89%,对烟曲霉病菌的抑菌率最低,为49%。

|
图 3 菌株M29对不同真菌的抗菌谱 Figure 3 The antagonistic spectrum of strain M29 against different pathogenic fungi |
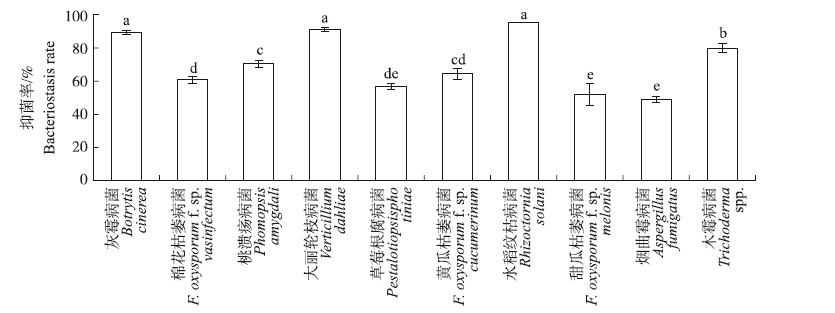
|
图 4 菌株M29对不同真菌的抑菌率 Figure 4 The bacteriostasis rate of strain M29 against different pathogenic fungis 不同小写字母表示处理间差异显著(P<0.05)。 Different small letters mean significant difference at 0.05 level among treatments. The same as follows. |
如图 5所示:菌株M29产脂肽类物质对不同真菌的生长均有抑制作用,对不同真菌的抑菌率为37%~97%,对桃溃疡病菌的抑制率高达97%,对烟曲霉病菌的抑制率最低,为37%。
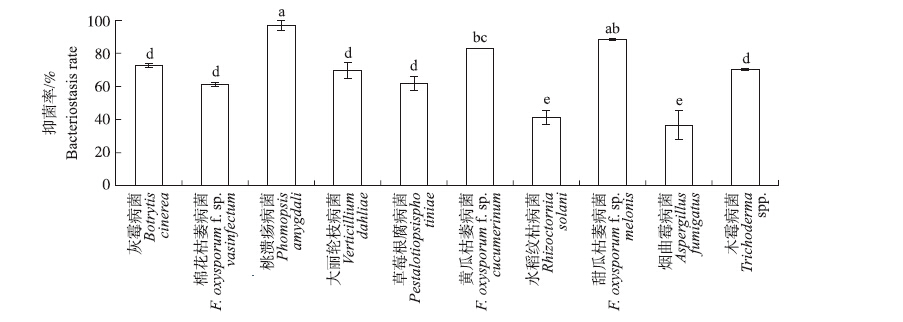
|
图 5 菌株M29产脂肽类粗提物对不同真菌的抑菌率 Figure 5 The bacteriostasis rate of lipopeptides produced by strain M29 |
由上述可知菌株M29不仅菌体本身具有极好的抑菌效果,而且其产生的脂肽类粗提取物,对不同真菌也有较好的抑菌效果。平板倒扣试验表明:菌株M29产生的VOCs不仅可抑制病原菌菌丝的生长,还能明显抑制真菌孢子和色素的产生(图 6)。菌株M29产生的VOCs对不同真菌的抑菌率为16%~65%,VOCs对大丽轮枝病菌的抑制率高达65%,对烟曲霉病菌的抑制率为16%(图 7)。

|
图 6 菌株M29产生的挥发性物质(VOCs)对不同真菌的抑菌谱 Figure 6 The antagonistic spectrum of volatile substances(VOCs)produced by strain M29 against different pathogenic fungi |
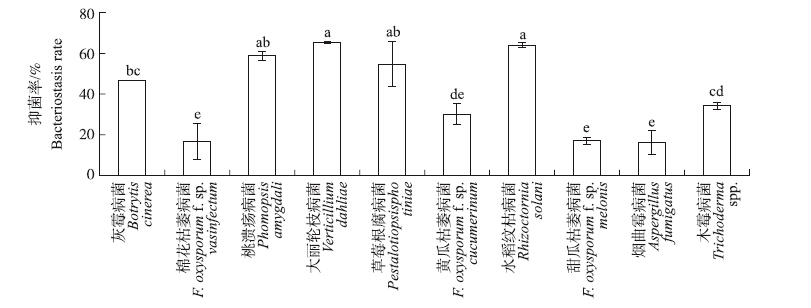
|
图 7 菌株M29产的VOCs对不同真菌的抑菌率 Figure 7 The bacteriostasis rate of VOCs produced by strain M29 against different pathogenic fungis |
利用微生物之间的拮抗作用防治植物病害进行生物防治国内外已有较多的研究[16]。鉴于植物土传病害对农产品产量与质量的危害,筛选具有广谱抗性的拮抗菌正逐渐成为国内外专家研究的热点[17]。本试验中通过平板对峙试验发现,枯草芽孢杆菌M29对10种植物病原菌均有不同程度的拮抗作用,这可能与拮抗菌分泌的物质对不同病原真菌的作用程度有关,还可能与供试病原真菌本身的特性相关,由于供试病原真菌属于不同的种属,决定了它们在生长习性、结构特点等方面有所差异,导致了生防菌在和病原菌互作过程中所表现出的拮抗能力不同。
菌株M29对10种病原菌的抑菌率为49%~95%。目前,国内拮抗菌的研究很多但报道的大多数拮抗菌不但抑菌率低,而且抑制菌单一。对尖孢镰刀菌属棉花枯萎病菌及水稻纹枯病菌的抑菌率分别仅为46.4%[18]和37.0%[19],对大丽轮枝病原菌的拮抗率为56%[20],对灰霉病原菌的抑制率为24.2%[21],均低于菌株M29对棉花枯萎病菌、水稻纹枯病菌、大丽轮枝病菌和灰霉病原菌的抑制率(60.99%、95%、91%和89.4%)。同时,我们发现大多数已报道的拮抗菌往往只强调抑菌效果的重要性,而对于拮抗不同类型病原菌的广谱性研究甚少[21-22]。贾凤安等[6]从蚯蚓粪中筛选出来的枯草芽胞杆菌FCJ2只对甜瓜枯萎病菌、甜瓜白粉病菌、甜瓜霜霉病菌等病原真菌有拮抗作用,且抑菌率只有64.7%、62.3%和49.2%[6]。本试验中,菌株M29不仅在抑菌率方面具有较好的效果而且可以抑制10种植物病原菌,具有较高的广谱性,分别为3种尖孢镰刀菌、3种霉菌、水稻纹枯病菌、草莓根腐病菌、桃溃疡病菌、大丽轮枝病菌等,抑菌种类呈现多样化。因此,可以解决大田内多种病原菌同时存在的问题。
除了营养、生态位竞争和诱导植物产生系统抗病性,利用脂肽类化合物和挥发性物质(VOCs)对抗植物病原菌是芽孢杆菌发挥拮抗作用的重要机制[23]。Mora 等[24]利用srfAA等6种抗菌肽合成基因分析了184株芽孢杆菌合成的脂肽类化合物的潜力。与非挥发性抗菌物质相比,挥发性抗菌物质更易于在土壤或空气中渗透和扩散,能更有效地杀灭病原菌。Leelasuphakul 等[25]认为,芽孢杆菌对仓储水果的抑菌效果主要得益于其挥发性抗菌物质的产生。
菌株M29不仅产脂肽类物质抑制病原菌生长,而且还能通过产VOCs抑制病原菌的生长。目前对于枯草芽孢杆菌拮抗土传植物病原菌的拮抗机制报道很多,但是对于枯草芽孢杆菌同时产脂肽类物质和VOCs抑制病原菌的研究不多,本研究中菌株M29相比于已经报道过的多数拮抗菌,不仅具有广谱拮抗的优势,而且其产生的脂肽类物质和VOCs均具有较好的拮抗效果,因此,该菌株的应用前景较为广阔,且为今后的深入研究提供了较典型的试验材料。
M29拮抗病原菌的机制有可能是一种也可能是几种作用的结合,其抑制机制是进一步研究的重点。下一步将采取基因组分析和蛋白组学技术对该菌株进行遗传背景和代谢产物的探索,为研制农业绿色生物杀菌剂、缓解化学农药残留问题提供理论基础和依据。
| [1] | Ryu C M, Farag M A, Hu C H, et al. Bacterial volatiles induce systemic resistance in Arabidopsis[J]. Plant Physiology, 2004,134(3): 1017–1026. DOI: 10.1104/pp.103.026583 |
| [2] | 张亮, 王改兰, 段建南, 等. 广谱生防菌对番茄枯萎病的防病效果及其机理[J]. 中国生物防治学报, 2015, 31(6): 897–906. Zhang L, Wang G L, Duan J N, et al. Suppression of tomato Fusarium wilt disease by bacteria strains and their mechanism[J]. Chinese Journal of Biological Control, 2015,31(6): 897–906. (in Chinese) |
| [3] | 程凯, 江欢欢, 沈标, 等. 棉花黄萎病拮抗菌的筛选及其生物防治效果[J]. 植物营养与肥料学报, 2011, 17(1): 166–174. Cheng K, Jiang H H, Shen B, et al. Isolation and biological control effects of cotton Verticilium wilt antagonist[J]. Plant Nutrition and Fertilizer Science, 2011,17(1): 166–174. (in Chinese) |
| [4] | 孙妍, 于地美, 黄华毅, 等. 黄栌枯萎病菌拮抗细菌的分离与鉴定[J]. 南京林业大学学报(自然科学版), 2015, 39(6): 17–23. Sun Y, Yu D M, Huang H Y, et al. Isolation and identification of an antagonistic becterium against tobacco tree wilt fungus Verticillium dahliae[J]. Journal of Nanjing Forestry University (Natural Science Edition), 2015,39(6): 17–23. (in Chinese) |
| [5] | 高海, 王彦靖, 刘迎春, 等. 蚯蚓粪资源化利用研究现状与展望[J]. 现代农业科技, 2015(6): 255–256. Gao H, Wang Y J, Liu Y C, et al. Research status and prospects on the utilization of vermincompost resource[J]. Modern Agricultural Science and Technology, 2015(6): 255–256. (in Chinese) |
| [6] | 贾凤安, 陈亮, 陈立, 等. 大棚甜瓜三种主要真菌病害拮抗细菌的筛选与鉴定[J]. 植物保护学报, 2010, 37(6): 505–510. Jia F A, Chen L, Chen L, et al. Isolation and characterization of antagonistic bacteria against three major fungal pathogens of greenhouse melon[J]. Acta Phytophylacica Sinica, 2010,37(6): 505–510. (in Chinese) |
| [7] | 孙燕霞, 张瑞清, 张伟, 等. 一株黄瓜枯萎病拮抗菌的筛选和鉴定[J]. 生物技术, 2009, 19(6): 22–25. Sun Y X, Zhang R Q, Zhang W, et al. Screening and identification of a fungal antagonist for restrain cucumber Fusarium wilt[J]. Biotechnology, 2009,19(6): 22–25. (in Chinese) |
| [8] | 刘雪连, 张宁, 崔东良, 等. 蚯蚓粪中乳酸菌的分离及其在大肠杆菌O157:H7中的抗菌活性[J]. 基因组学与应用生物学, 2011, 30(1): 1–6. Liu X L, Zhang N, Cui D L, et al. Lactic acid bacteria isolated from vermicompost and its antimicrobial activity in E. coli O157:H7[J]. Genomics and Applied Biolog, 2011,30(1): 1–6. (in Chinese) |
| [9] | Pathma J, Sakthivel N. Molecular and functional characterization of bacteria isolated from straw and goat manure based vermicompost[J]. Applied Soil Ecology, 2013,70: 33–47. DOI: 10.1016/j.apsoil.2013.03.011 |
| [10] | 汪学军, 闫双林, 闵长莉, 等. 蚯蚓粪中放线菌分离及其抗菌活性研究[J]. 中国中药杂志, 2015, 40(4): 614–618. Wang X J, Yan S L, Min C L, et al. Isolation and antimicrobial activities of actinomycetes from vermicompost[J]. China Journal of Chinese Materia Medica, 2015,40(4): 614–618. (in Chinese) |
| [11] | 李修善. 阿式肠杆菌和萎缩芽孢杆菌扫描电镜样品制备观察和分析[J]. 曲阜师范大学学报(自然科学版), 2016(1): 102–104. Li X S. Preparation for observation and analysis of Enterobacter asburiae and Bacillus atrophaeus SEM specimen[J]. Journal of Qufu Normal University (Natural Science Edition), 2016(1): 102–104. (in Chinese) |
| [12] | 朱旭芬. 现代微生物学实验技术[M]. 杭州: 浙江大学出版社, 2011 . Zhu X F. Modern Experimental Technique of Microbiology[M]. Hangzhou: Zhejiang University Press, 2011 . (in Chinese) |
| [13] | 布坎南. 伯杰氏细菌鉴定手册[M]. 北京: 科学出版社, 1984 . Bu K N. Bergey's Manual of Determinative Bacteriology[M]. Beijing: Science Press, 1984 . (in Chinese) |
| [14] | 庞建, 刘占英, 郝敏, 等. 革兰氏阳性细菌基因组DNA提取方法的比较及优化[J]. 微生物学通报, 2015(12): 2482–2486. Pang J, Liu Z Y, Hao M, et al. Comparison and optimization of methods for genomic DNA extraction from gram positive bacteria[J]. Microbiology, 2015(12): 2482–2486. (in Chinese) |
| [15] | 谢永丽, 高学文. 可可西里低温适生拮抗芽孢杆菌的筛选鉴定及脂肽化合物分析[J]. 应用生态学报, 2013, 24(1): 149–155. Xie Y L, Gao X W. Screening and identification of low temperature-adapted antagonistic Bacillus isolated from Kekexili region of West China and the analysis of the isolates lipopeptide compounds[J]. Chinese Journal of Applied Ecology, 2013,24(1): 149–155. (in Chinese) |
| [16] | Yang L, Quan X, Xue B, et al. Isolation and identification of Bacillus subtilis strain YB-05 and its antifungal substances showing antagonism against Gaeumannomyces graminis var.tritici[J]. Biological Control, 2014,85: 52–58. |
| [17] | Rajbir S, Debarati P, Jain R K. Biofilms:implications in bioremediation[J]. Trends in Microbiology, 2006,14(9): 389–397. DOI: 10.1016/j.tim.2006.07.001 |
| [18] | 吴辉, 潘梦武, 高易宏, 等. 辣椒疫病生防菌的筛选、鉴定及其抑菌机理初探[J]. 湖北农业科学, 2015, 54(7): 1596–1599. Wu H, Pan M W, Gao Y H, et al. Isolation, identification and biocontrol mechanism of antagonistic bacteria against Phytophthora capsici[J]. Hubei Agricultural Sciences, 2015,54(7): 1596–1599. (in Chinese) |
| [19] | 李铁军, 丁邦琴, 蔡凤, 等. 生防菌菌株LDB1对植物病原真菌的抑菌谱[J]. 湖北农业科学, 2015, 54(2): 341–345. Li T J, Ding B Q, Cai F, et al. Antifungal spectrum of biocontrol bacterium strain LDB1 against plant pathogen fungi[J]. Hubei Agricultural Sciences, 2015,54(2): 341–345. (in Chinese) |
| [20] | 邱德文. 我国植物病害生物防治的现状及发展策略[J]. 植物保护, 2010, 36(4): 15–18. Qiu D W. Current status and development strategy for biological control of plant diseases in China[J]. Acta Phytophylacica Sinica, 2010,36(4): 15–18. (in Chinese) |
| [21] | 李兴龙, 李彦忠. 土传病害生物防治研究进展[J]. 草业学报, 2015, 24(3): 204–212. Li X L, Li Y Z. Research advances in biological control of soil-bornedisease[J]. Acta Prataculturae Sinica, 2015,24(3): 204–212. (in Chinese) |
| [22] | 李全胜, 谢宗铭, 张国丽, 等. 棉花黄萎病拮抗芽孢杆菌S12的筛选鉴定及拮抗机制的分析[J]. 南京农业大学学报, 2015, 38(3): 402–408. Li Q S, Xie Z M, Zhang G L, et al. Screening and identification of antagonistic spore bacterium S12 against cotton Verticillium wilt and preliminary study on its antagonistic mechanisms[J]. Journal of Nanjing Agricultural University, 2015,38(3): 402–408. DOI: 10.7685/j.issn.1000-2030.2015.03.008 (in Chinese) |
| [23] | Pérez-García A, Romero D, Vicente A D. Plant protection and growth stimulation by microorganisms:biotechnological applications of Bacillus in agriculture[J]. Current Opinion in Biotechnology, 2011,22(2): 187–93. DOI: 10.1016/j.copbio.2010.12.003 |
| [24] | Mora I, Cabrefiga J, Montesinos E. Antimicrobial peptide genes in Bacillus strains from plant environments[J]. International Microbiology, 2011,14(4): 213–224. |
| [25] | Leelasuphakul W, Hemmanee P, Chuenchitt S. Growth inhibitory properties of Bacillus subtilis strains and their metabolites against the green mold pathogen (Penicillium digitatum Sacc.) of citrus fruit[J]. Postharvest Biology and Technology, 2008,48(1): 113–121. DOI: 10.1016/j.postharvbio.2007.09.024 |




