文章信息
- 闫允青, 姜桦韬, 谷超, 吴俊
- YAN Yunqing, JIANG Huatao, GU Chao, WU Jun
- ‘雪花梨’扩繁和叶片再生体系的建立
- Research on the establishment of rapid propagation and leaf regeneration system of pear 'Xuehuali'
- 南京农业大学学报, 2017, 40(1): 68-75
- Journal of Nanjing Agricultural University (Social Science), 2017, 40(1): 68-75.
- http://dx.doi.org/10.7685/jnau.201604006
-
文章历史
- 收稿日期: 2016-04-02
‘雪花梨’属白梨(Pyrus bretschneideri Rehd.)系统[1],至今已有2 000多年的栽培历史,是河北省传统的大宗出口水果,在国内外久负盛誉。一般单果质量300 g,果肉洁白,细脆而嫩,汁多味甜,还含有果酸、矿物质及多种维生素等营养成分[2],具有很高的食用价值和药用价值。近年来,由于在生产中出现的管理粗放,农药、化肥使用不合理等问题,导致梨树品种品质严重退化,果实外观比较差,果皮粗糙、果实石细胞含量较高,口感差,严重影响了其鲜果品质和市场价值。随着国内外果品贸易竞争的日益激烈,生产经营者也意识到果实品质的优劣直接关系到产业能否在市场竞争中获得长足发展。因此,对‘雪花梨’等传统品种的品质改良迫在眉睫。
梨是以无性繁殖为主的多年生木本植物,世代周期长,遗传上杂合程度高、童期长,育种费时、费力,且投入高[3]。近年来,基于组织培养的遗传转化技术在植物上被广泛应用,为推进梨等多年生果树的种质创新和新品种选育提供了极为有效的解决途径[4]。但相对于其他物种来说,梨的遗传转化研究进展缓慢,遗传转化效率很低。主要原因在于再生困难,再生率低,不同基因型之间差异性大,尤其是经过侵染、共培养、暗培养等一系列操作后,再生不定芽的概率更低。叶片再生作为遗传转化的前提和基础,获得高再生率,显得极为重要。从已有研究来看,关于梨离体培养的研究大多数是西洋梨品种,也有关于砂梨的报道,如‘翠冠’[5-6]、‘雪青’、‘幸水’[7]、‘丰水’[8]等,但是关于白梨品种的再生研究报道很少,且其再生率普遍很低,关于‘雪花梨’叶片再生的报道更少见。因此,本试验以‘雪花梨’为材料,研究不同激素配比对其扩繁体系的影响,并探索和优化影响其叶片再生的因素,以期建立‘雪花梨’组培苗的高效扩繁体系,获得较高的不定芽再生率,为‘雪花梨’快繁和遗传转化研究提供理论依据和技术支撑。
1 材料与方法 1.1 试验材料‘雪花梨’材料采自南京农业大学江浦园艺场。春季树体萌动时,剪取‘雪花梨’树上芽眼饱满的枝条带回实验室备用。MS培养基(固体,适于植物的组织培养,不加琼脂和蔗糖)、蔗糖、琼脂均购自南京寿德实验器材有限公司。
1.2 ‘雪花梨’无菌组培苗的获取将枝条置于20 g · L-1蔗糖溶液中,25 ℃室内催芽。待腋芽萌发后,流水冲洗40 min。在超净工作台内,先用70%乙醇处理嫩芽30 s,然后用无菌水洗涤3次,再用2.5%次氯酸钠处理4 min,最后用无菌水洗涤4次,滤纸吸去多余水分,置于培养基MS+0.2 mg · L-1 IBA+2.0 mg · L-1 6-BA+30 g · L-1蔗糖+7 g · L-1琼脂上初代培养,用同一培养基每隔30 d继代1次。
1.3 ‘雪花梨’组培苗的扩繁体系建立组培苗长势稳定后,选取生长一致的芽,将其接种到基础培养基为MS和细胞分裂素6-BA以及生长素IBA浓度组合不同的培养基上继代培养。6-BA质量浓度梯度设置为1.0、1.5和2.0 mg · L-1,IBA质量浓度梯度为0.2、0.3和0.4 mg · L-1,并观察组培苗生长情况;45 d时,统计其芽增殖率、植株高度。采用正交试验设计,共9个处理,每个处理接种10瓶,每瓶接种3个外植体,共接种30个外植体,重复3次。培养基中蔗糖质量浓度30 g · L-1,琼脂6.5 g · L-1,灭菌前将培养基pH值用HCl溶液或NaOH溶液调到5.8~6.0,121 ℃灭菌20 min。
1.4 ‘雪花梨’再生体系建立选取继代4次以上的平展健壮叶片(保留叶柄),垂直于叶片主脉横切3刀,接种于添加30 g · L-1蔗糖和9 g · L-1琼脂的诱导培养基上。暗培养一定时间后置于光下培养,培养温度(25±2)℃,光周期(昼/夜)14 h/10 h,光照度2 000 lx,每10 d换1次培养基。正交试验设计,每个处理接3个培养皿,每个培养皿8个叶片,重复3次。60 d后统计其叶片再生率、愈伤发生率、平均每叶再生梢数和褐化率。其计算方式如下:
再生率=再生梢叶片数/接种叶片数×100%;
愈伤发生率=产生愈伤的叶片数/接种叶片数×100%;
平均每叶再生梢数=再生梢总数/再生梢叶片数;
褐化率=褐化叶片数/接种叶片数×100%。
1.4.1 基础培养基种类、叶片放置方式和激素种类对叶片再生的影响各因素的试验处理如表 1。
1.4.2 激素浓度配比和暗培养时间对叶片再生的影响基础培养基为NN69培养基。TDZ浓度梯度设置为1.0、1.5和2.0 mg · L-1,IBA浓度梯度为0.2、0.3和0.5 mg · L-1,暗培养时间设置为0、14和21 d,远轴面朝下接种于培养基上。
| 影响因素 Influence factor | 培养基 Culture medium | 叶片放置方式 Ways of leaf inoculation | 细胞分裂素 Cytokinin | 生长素 Auxin | 暗培养时间/d Dark culture period |
| 培养基种类和叶片放置方式 Basic media and placement | MS | 远轴面朝下 Abaxial side down | TDZ | IBA | 21 |
| MS | 近轴面朝下 Adaxial side down | ||||
| NN69 | 远轴面朝下 Abaxial side down | ||||
| NN69 | 近轴面朝下 Adaxial side down | ||||
| 激素种类 Hormone types | NN69 | 远轴面朝下 Abaxial side down | 6-BA | 21 | |
| NN69 | TDZ | IAA | |||
| NN69 | TDZ | NAA |
待不定芽长至1 cm左右,将其切下并置于1/2 MS+0.2 mg · L-1IBA+1.0 mg · L-1 6-BA和MS+0.2 mg · L-1IBA+1.0 mg · L-16-BA中初代培养,筛选出最适初代培养基。30 d左右置于MS+0.2 mg · L-1IBA+2.0 mg · L-16-BA中继代培养,每隔45 d继代1次。
1.5 数据分析运用Excel 2013进行数据处理,运用SPSS 20.0进行方差分析。
2 结果与分析 2.1 不同激素配比对‘雪花梨’组培苗扩繁体系的影响由表 2可以看出:随着细胞分裂素的增加,芽增殖率提高;随着生长素增加,植株高度先增加后减少。细胞分裂素含量过高,虽然芽增殖率增加,但其植株高度降低。当6-BA含量为1.0 mg · L-1,IBA含量为0.3 mg · L-1时,芽增殖率最大为4.1,植株高度为2.66 cm,明显优于其他处理,因此适宜‘雪花梨’扩繁的培养基为MS+1.0 mg · L-16-BA+0.3 mg · L-1IBA。
| ρ(6-BA)/(mg·L-1) | ρ(IBA)/(mg·L-1) | 芽增殖率Rate of bud proliferation | 植株高度/cm Plant height |
| 1.0 | 0.2 | 1.90±0.88d | 1.55±0.20c |
| 0.3 | 4.10±0.88a | 2.66±0.51a | |
| 0.4 | 2.70±1.06bcd | 2.16±0.40b | |
| 1.5 | 0.2 | 2.30±1.25cd | 1.81±0.24c |
| 0.3 | 3.70±1.49ab | 1.66±0.19c | |
| 0.4 | 2.90±1.20bcd | 1.71±0.10c | |
| 2.0 | 0.2 | 3.00±0.94abcd | 1.85±0.43bc |
| 0.3 | 2.80±0.63bcd | 1.75±0.46c | |
| 0.4 | 3.40±1.51abc | 1.78±0.17c | |
| 注:同列不同小写字母表示差异显著(P<0.05)。 | |||
| Note:Different small letters within a column indicate significant difference at 0.05 level.The same as follows. | |||
如图 1所示:接种后4~5 d,叶片切口处因失水而逐渐卷曲,这时即有叶片开始出现褐化或白化现象;7~10 d左右,切口处(主要是叶脉处)开始出现白色或绿色团状物,即愈伤。随着培养时间的延长,愈伤逐渐增大,置于光下培养30 d左右,愈伤处有绿色芽眼产生,偶尔有芽产生。芽形成时先出现一个线状小叶片,后逐渐分化,形成完整的芽。

|
图 1 雪花梨’再生过程 Figure 1 The regeneration process of‘Xuehuali’ A.接种0 d Inoculated 0 day;B.接种10 d Inoculated 10 days;C.接种30 d Inoculated 30 days;D.接种60 d Inoculated 60 days;E.叶片再生不定梢Adventitious shoot regeneration from the leaves |
由表 3可以看出:MS培养基能形成愈伤,但愈伤分化芽的能力很弱,且培养后期叶片褐化严重;NN69培养基很容易形成愈伤,再生率达到50.00%,平均每叶片再生梢数为1.83个,且不容易褐化。因此适宜‘雪花梨’叶片再生的基础培养基为NN69培养基。而不同叶片接种方式对其再生率也有很大影响,近轴面朝下接种时,在NN69培养基上,其愈伤发生率都能达到100%,且叶片不容易褐化,但出芽率较远轴面朝下明显降低;在MS培养基上,其愈伤发生率明显低于远轴面,叶片不发生褐化,但也不能分化出不定芽。
| 培养基 Culture medium | 叶片接种方式 Ways of leaf inoculation | 平均每叶再生梢数 Average regeneration-bud number per leaf | 叶片再生率/% Rate of leaf regeneration | 愈伤发生率/% Callus incidence | 褐化率/% Rate of bowning |
| MS | 远轴面朝下 Abaxial side down | 1.00b | 4.17c | 83.00b | 29.17a |
| 近轴面朝下 Adaxial side down | 0c | 0d | 33.00c | 0c | |
| NN69 | 远轴面朝下 Abaxial side down | 1.83a | 50.00a | 100.00a | 5.00b |
| 近轴面朝下 Adaxial side down | 1.50a | 16.67b | 100.00a | 0c |
如表 4所示:在NN69培养基上,TDZ和6-BA都可使‘雪花梨’叶片再生出不定芽,但TDZ效果明显比6-BA好,其愈伤发生率达到100%,叶片再生率达到33.33%,均大于6-BA的25.00%和8.30%,因此适合‘雪花梨’再生的细胞分裂素种类为TDZ;对于生长素,IBA的效果明显,再生率为33.33%,明显优于NAA和IAA。因此适合‘雪花梨’叶片再生的激素种类为TDZ和IBA。
| 激素组合 Hormone combination | 平均每叶再生梢数 Average regeneration-bud number per leaf | 叶片再生率/% Rate of leaf regeneration | 愈伤发生率/% Callus incidence | 褐化率/% Rate of browning |
| 5.0 mg·L-1 6-BA+0.3 mg·L-1IBA | 1.00b | 8.30b | 25.00b | 16.67b |
| 2.0 mg·L-1 TDZ+0.3 mg·L-1 IBA | 1.88a | 33.33a | 100.00a | 16.67b |
| 2.0 mg·L-1 TDZ+0.3 mg·L-1 NAA | 0c | 0c | 100.00a | 0c |
| 2.0 mg·L-1 TDZ+0.3 mg·L-1 IAA | 0c | 0c | 100.00a | 25.00a |
保持相同的21 d暗培养时间,研究培养基激素配比对‘雪花梨’叶片再生率和褐化率的影响。由图 2-A可以看出:培养基中激素的含量配比对‘雪花梨’叶片再生影响很大,TDZ含量一定时,随着IBA含量的增加再生率先降低后增加,高的生长素含量不利于再生芽产生;高的细胞分裂素和低的生长素利于不定芽产生,但若细胞分裂素含量过高反而会抑制不定芽的产生;当细胞分裂素含量低时,适当提高生长素含量能提高芽再生率,TDZ和IBA含量分别为1.5和0.2 mg · L-1时再生率明显高于其他处理,达到70.83%。由图 2-B可以看出:TDZ含量一定时,随着IBA含量的增加褐化率先增加后降低。褐化率的变化趋势与再生率的趋势几乎相反,说明叶片褐化是制约‘雪花梨’叶片再生的重要因素,而低的褐化率可通过使用低浓度生长素和低浓度细胞分裂素或高浓度的细胞分裂素和高浓度的生长素获得。
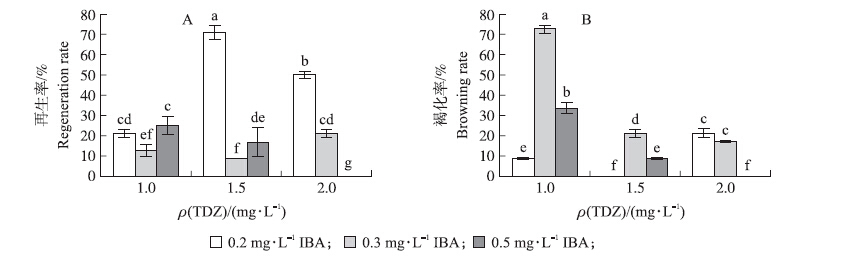
|
图 2 不同激素配比对叶片再生率(A)和褐化率(B)的影响 Figure 2 Effects of hormone ratio on leaf regeneration rate(A)and browning rate(B) |
IBA含量为0.2 mg · L-1不变,研究暗培养时间对‘雪花梨’叶片再生率和褐化率的影响。由图 3可知:暗培养时间是影响‘雪花梨’叶片再生的重要因素,不经过暗培养‘雪花梨’也能再生出不定芽但再生率很低,随着暗培养时间的增加‘雪花梨’叶片再生率逐渐增加;随着细胞分裂素含量的增加,暗培养时间的延长对‘雪花梨’再生的增长作用明显,TDZ含量为1.5 mg · L-1,暗培养时间为21 d时,其再生率明显高于其他处理。随着暗培养时间的增加,褐化率呈上升趋势,不经过暗培养,叶片褐化率很低。综上所述,要获得高的再生率,应该在使用适宜浓度的细胞分裂素和生长素的基础上,尽量缩短暗培养时间。

|
图 3 暗培养时间对叶片再生率(A)和褐化率(B)的影响 Figure 3 Effects of dark incubation time on leaf regeneration rate(A)and browning rate(B) |
综上,适合‘雪花梨’再生的培养基为NN69+1.5 mg · L-1TDZ+0.2 mg · L-1IBA,暗培养21 d,远轴面朝下放于培养基上,再生率达到70.83%,平均每叶再生芽数为2.06个,愈伤发生率达到100%,褐化率为0。
2.2.5 再生芽初代和继代培养由图 4可见:1/2MS+0.2 mg · L-1IBA+1.0 mg · L-16-BA培养基中的再生芽生长缓慢,最后萎蔫、褐化并死亡;MS+0.2 mg · L-1IBA+1.0 mg · L-16-BA培养基中的再生苗,植株生长健壮,且相对于继代多次的组培苗,再生苗生长速度快,叶片大。

|
图 4 不同基础培养基再生苗生长状况 Figure 4 The growth of regeneration seedling using different basic medium |
芽增殖率和生长状况与细胞分裂素和生长素种类及含量有关[9]。在段莹莹等[1]的研究中,使用6-BA、NAA和GA3组合使‘雪花梨’增殖率达到3.9,本试验仅采用6-BA和IBA就使增殖率达到4.1,使用的培养基和激素种类常见,培养基配制过程方便简单,再生率高,再生速度快、且再生苗容易成活。
梨叶片再生率的影响因素很多,基因型决定梨叶片的再生潜力[10]。在已有的研究报道中,西洋梨品种的再生效果最好[11],其他梨品种再生报道相对较少[6-7,12-13]。本试验发现‘雪花梨’是白梨中一个比较适宜再生的品种,再生率可达70.83%。
植物组织培养中,基础培养基种类包括MS、1/2MS、NN69、WPM4等,大量研究结果证明NN69比较适宜梨品种叶片再生[2-3,14-16],本试验结果与之一致。NN69和MS培养基的区别主要是铵态氮和硝态氮的离子浓度不同和它们之间的含量比例不同[3]。NN69培养基中无机盐浓度低,硝酸根离子含量高,Tang等[17]的试验证明NH4+/NO3-为1:7时,叶片再生率最高。另外,NN69的无机盐含量低,同时添加了生物素和叶酸,可能也是诱导不定芽的因素[18]。因此,在以后的试验中可以从这个方面入手探究梨叶片再生所需要的基础元素种类,从而细化培养基组分,为梨再生所必需元素提供理论基础。
本试验发现保存叶柄和切割后叶片的完整性很有必要,形成不定芽的部位主要是叶柄顶端和切口主脉,叶柄愈伤面积大且分化出芽的时间比主脉早很多。叶片没有伤口不能产生愈伤,切成条状的叶片虽然可以产生愈伤,但分化不定芽的效果不好;而垂直于主脉切2~3刀,保持叶片的完整,能很好地分化出芽。靠近叶柄的上部和中部更容易产生芽,下部几乎不产生芽。这与前人的研究结果一致[13,19-20]。叶片不同部位分化能力不同可能是由于内源激素或内源激素和外源激素交互作用不同[17],或者不同部位叶片再生对激素浓度要求不同,也可能与叶片不同部位发育条件不一样有关,叶片的成熟顺序由叶尖逐渐向叶端延伸,叶片尖端最先成熟,因此分化能力最差。叶片分化芽时主要在远轴面,可能是由于叶面远轴面气孔分布少,吸收营养物质困难所致。
大多数试验中暗培养是再生不定芽的必要因素,一般时间为14~21 d,叶片分化所需的暗培养时间可能也与梨的基因型有关,如‘六月酥梨’不经过暗培养其再生率仅为37.8%,经过30 d暗培养再生率提高到83.3%[21];‘山梨’叶片不经过暗培养再生率为9.7%,而经过20 d暗培养其再生率为36.1%[22];‘黄金梨’叶片暗培养0 d时,分化率为0,暗培养15 d时,再生率上升到45%[23]。本试验结果表明,暗培养不是‘雪花梨’再生的必要因素,不经过暗培养‘雪花梨’也能很好地分化出芽,TDZ和IBA含量分别为1.0 mg · L-1和0.5 mg · L-1时,分化率可达到25%,但是经过14 或21 d暗培养会明显提高芽增殖率。叶片的褐化与暗培养时间有一定的关系,暗培养时间越长,褐化率越高,这就可能导致再生率的下降,因此‘雪花梨’再生时可以适量减少暗培养时间。
培养基中激素种类、浓度、配比不同,芽生长、分化能力也不同,可能是因为它们刺激了不同基因控制的酶类,从而影响内源激素的分布水平,进而在生长和分化上形成差异。研究表明TDZ更有利于梨的叶片再生[23-26]。Bilyeu等[27]认为,TDZ和6-BA虽同为细胞分裂素类,但其作用机制不同。TDZ本身无细胞分裂素活性,但它可以抑制分裂素氧化酶对细胞分裂素的破坏作用而激发内源细胞分裂素活性,6-BA本身具有细胞分裂素活性。因此TDZ对叶片再生的影响与叶片本身内源激素含量有关,若叶片内源细胞分裂素含量少,TDZ作用不明显,使用6-BA效果较好。本试验研究结果也表明,TDZ较6-BA在‘雪花梨’的叶片再生效果中优势显著,这与孙清荣等[15]、吴雅琴等[28]研究结果一致。生长素种类很多,常用的有NAA、IAA、IBA等,在以往有关梨叶片再生的报告中NAA使用最普遍[3,11,27-30],很少有人使用IBA。但本试验发现,NAA用于‘雪花梨’叶片再生时,能很好地生成愈伤,但不定芽再生率明显低于IBA,与Lomberk[31]和苏艳丽等[32]认为IBA较NAA更适宜梨叶片再生的研究结果一致。本试验结果表明,适宜‘雪花梨’再生的TDZ含量为1.5 mg · L-1、IBA含量为0.2 mg · L-1,再生效果最好,再生率可达到70.83%。试验中还发现,高的生长素有利于愈伤的形成,但会抑制芽的分化,高的细胞分裂素可以取得高的芽再生率,但易产生玻璃化的芽。
| [1] | 段莹莹, 田彩芳, 宋宇琴, 等. 雪花梨的离体培养与快速繁殖[J]. 山西农业大学学报(自然科学版), 2014, 34(5): 464–467. Duan Y Y, Tian C F, Song Y Q, et al. In vitro culture and rapid propagation of pear Xuehuali[J]. Journal of Shanxi Agricultural University (Natural Science Edition), 2014,34(5): 464–467. (in Chinese) |
| [2] | 谭雪辉, 刘洪章. 梨组织培养与遗传转化研究进展[J]. 北方园艺, 2007(1): 147–149. Tan X H, Liu H Z. The research process on pear tissue culture and genetic transformation[J]. Northern Horticulture, 2007(1): 147–149. (in Chinese) |
| [3] | Yousefiara M, Jafarkhani K M, Bagheri A, et al. Study of factors affecting direct shoot regeneration of pear (Pyrus communis L.)[J]. Journal of Plant Molecular Breeding, 2014,2(1): 21–28. |
| [4] | 王新平, 茹慧玲, 孙慧英, 等. 果树转基因研究进展[J]. 山西农业科学, 2016, 44(1): 123–125. Wang X P, Ru H L, Sun H Y, et al. Research progress of transgenic fruit trees[J]. Journal of Shanxi Agricultural Sciences, 2016,44(1): 123–125. (in Chinese) |
| [5] | 周泳.农杆菌介导的铁贮藏蛋白基因转化‘翠冠梨’的研究[D]. 南京:南京农业大学,2005. Zhou Y.Study on agrobacterium-mediated transformation of Pyrus pyrifolia ‘Cuiguan’ with Ferritin gene[D]. Nanjing:Nanjing Agricultural University,2005(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10307-2005087940.htm |
| [6] | 尹婷.砂梨离体再生体系的建立及转chit42基因的研究[D]. 长沙:湖南农业大学,2008. Yi T. Study on the establishment of in vitro regeneration system from pear(P.pyrifolia Nakai)and chit42 gene transformation[D]. Changsha:Hunan Agricultural University,2008(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10537-2009091011.htm |
| [7] | 曹霞, 柴明良. 砂梨叶片再生不定梢的研究[J]. 果树学报, 2005, 22(5): 557–560. Cao X, Chai M L. Adventitious shoot regeneration from leaves of pear cultivars belonging to Pyrus pyrifolia[J]. Journal of Fruit Science, 2005,22(5): 557–560. (in Chinese) |
| [8] | 周莉莉, 蔡斌华, 乔玉山, 等. 不同处理对'丰水'梨离体叶片不定芽再生的影响[J]. 南京农业大学学报, 2007, 30(2): 34–38. Zhou L L, Cai B H, Qiao Y S, et al. Effects of different treatment on adventitious bud regeneration from in vitro leaves of Pyrus pyrifolia 'Hosui'[J]. Journal of Nanjing Agricultural University, 2007,30(2): 34–38. DOI: 10.7685/j.issn.1000-2030.2007.02.007 (in Chinese) |
| [9] | 韩延超, 陈德龙, 李六林. 曲面分析在'雪花梨'叶片不定芽诱导培养基筛选上的应用[J]. 北方果树, 2011(1): 3–6. Han Y C, Chen D L, Li L L. Application of curved surface analysis in culture medium screening of adventitous buds induction from leaves in vitro of 'Xuehua pear'[J]. Northern Fruits, 2011(1): 3–6. (in Chinese) |
| [10] | 付镇芳, 孟颢光, 张朝红, 等. 砀山酥梨叶片再生体系的建立[J]. 北方园艺, 2011(14): 98–101. Fu Z F, Meng H G, Zhang C H, et al. Primary establishment of plant regeneration system of pear scion cultivar 'Dangshansu'[J]. Northern Horticulture, 2011(14): 98–101. (in Chinese) |
| [11] | Leblay C, Chevreau E, Raboin L M. Adventitious shoot regeneration from in vitro leaves of several pear cultivars (Pyrus communis L.)[J]. Plant Cell, Tissue and Organ Culture, 1991,25: 99–105. |
| [12] | 秦璐, 陈泉, 梁志强, 等. 库尔勒香梨叶片不定芽再生诱导的研究[J]. 北方园艺, 2015(9): 76–79. Qin L, Chen Q, Liang Z Q, et al. Study on regeneration of adventitious bud from leaves of Pyrus sinkiangensis Yü[J]. Northern Horticulture, 2015(9): 76–79. (in Chinese) |
| [13] | 孙俊. 南果梨叶片离体培养的高效再生体系[J]. 江苏农业科学, 2014, 42(3): 44–46. Sun J. Research on the establishment leaf regeneration system of pear 'Nanguoli'[J]. Jiangsu Agricultural Sciences, 2014,42(3): 44–46. (in Chinese) |
| [14] | 孙清荣. 金花梨叶片不定梢诱导研究[J]. 落叶果树, 2000, 32(3): 8–10. Sun Q R. Regeneration of adventitious shoots from leaves of Pyrus pyrifolia Nak.cv.Jinhua[J]. Deciduous Fruits, 2000,32(3): 8–10. (in Chinese) |
| [15] | 孙清荣, 刘庆忠, 赵瑞华. 西洋梨叶片直接再生体细胞胚[J]. 园艺学报, 2003, 30(1): 85–86. Sun Q R, Liu Q Z, Zhao R H. Somatic embryo genesis from in vitro leaves of pear[J]. Acta Horticulturae Sinica, 2003,30(1): 85–86. (in Chinese) |
| [16] | 徐凌飞. 梨叶片和叶柄再生体系建立的研究[D]. 杨凌:西北农林科技大学,2001. Xu L F. Studies on setting up the regenerate system of leaf and petiole of pear[D]. Yangling:Northwest A&F University,2001(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10712-2001010846.htm |
| [17] | Tang H, Luo Y, Liu C. Plant regeneration from in vitro leaves of four commercial Pyrus species[J]. Plant, Soil and Environ, 2008,54(4): 140–148. |
| [18] | 赵竑博, 徐凌飞, 马锋旺, 等. 砀山酥梨叶片培养和植株再生[J]. 西北农业学报, 2007, 16(2): 153–157. Zhao H B, Xu L F, Ma F W, et al. Leaf culture and plantlet regeneration of pear scion cultivar 'Dangshansu'[J]. Acta Agriculturae Boreali-occidentalis Sinica, 2007,16(2): 153–157. (in Chinese) |
| [19] | Yepes L M, Aldwinckle H S. Factors that affect leaf regeneration efficiency in apple and effect of antibiotics in morphogenesis[J]. Plant Cell, Tissue and Organ Culture, 1994,37: 257–269. |
| [20] | Feng J, Yu X M, Shang X L, et al. Factors influencing efficiency of shoot regeneration in Ziziphus jujuba Mill.'Huizao'[J]. Plant Cell, Tissue and Organ Culture, 2010,101: 111–117. DOI: 10.1007/s11240-009-9663-2 |
| [21] | 吴中营, 徐凌飞, 董晓勤, 等. 六月酥梨叶片培养和植株再生[J]. 西北农业学报, 2011, 20(2): 159–164. Wu Z Y, Xu L F, Dong X Q, et al. Leaf culture and plant regeneration of pear Liuyuesu[J]. Acta Agriculturae Boreali-occidentalis Sinica, 2011,20(2): 159–164. (in Chinese) |
| [22] | 谭雪辉.山梨叶片再生体系的建立和遗传转化[D]. 长春:吉林农业大学,2005. Tan X H. Establishment of leaf regeneration system of Pyrus ussuriensis Maxim and transformation[D]. Changchun:Jilin Agricultural University,2005(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10193-2006010567.htm |
| [23] | 陶爱群, 尹婷, 谢深喜. 黄金梨叶片再生体系建立研究[J]. 湖南农业科学, 2012(5): 108–111. Tao A Q, Yi T, Xie S X. Establishment of leaf regeneration system for Huangjin pear (Pyrus pyrifolia Nakai)[J]. Hunan Agricultural Science, 2012(5): 108–111. (in Chinese) |
| [24] | Chevreau E. Adventitious shoot regeneration from leaf tissue of three pear (Pyrus sp.) cultivars in vitro[J]. Plant Cell Reports, 1989,7: 688–691. |
| [25] | 孙洪雁, 陶吉寒, 辛力, 等. TDZ和BA对金花梨和鸭梨叶片不定芽再生的影响[J]. 山东农业科学, 2016, 48(1): 26–28. Sun H Y, Tao J H, Xin L, et al. Effects of TDZ and BA on adventitious bud regeneration from leaf explants of pear cultivars Jinhua and Yali[J]. Shandong Agricultural Science, 2016,48(1): 26–28. (in Chinese) |
| [26] | Nacheva L R,Gercheva P S,Dzhuvinov V T. Efficient shoot regeneration system of pear rootstock OHF 333(Pyrus communis L.)leaves[C]//Hanke M V,Dunemann F,Flachowsky H. Proceedings of the First International Symposium on Biotechnology of Fruit Species. Dresden:Int Soc Horticultural Science,2009,839:195-201. |
| [27] | Bilyeu K D, Cole J L, Laskey J G, et al. Molecular and biochemical characterization of a cytokinin oxidase from maize[J]. Plant Physiol, 2001,125: 378–386. DOI: 10.1104/pp.125.1.378 |
| [28] | 吴雅琴, 赵艳华, 李春敏. 昌红苹果离体叶片不定芽的诱导及植株再生[J]. 云南农业大学学报, 2006, 21(1): 32–35. Wu Y Q, Zhao Y H, Li C M. Efficient adventitious bud induction and plant regeneration from leaves in vitro of apple (cv.Changhong)[J]. Journal of Yunnan Agricultural University, 2006,21(1): 32–35. (in Chinese) |
| [29] | Nakajima I, Ito A, Moriya S, et al. Adventitious shoot regeneration in cotyledons from Japanese pear and related species[J]. In Vitro Cell Dev Biol-Plant, 2012,48: 396–402. DOI: 10.1007/s11627-012-9451-2 |
| [30] | Kim S H, Shin S, Cho K H, et al. Shoot regeneration via culture of leaf explants in pear (Pyrus pyrifolia cv.Niitaka)[J]. J Plant Biotechnol, 2013,40: 203–209. DOI: 10.5010/JPB.2013.40.4.203 |
| [31] | Lomberk D. Adventitious shoot regeneration of pear (Pyrus spp.) genotypes[J]. Plant Cell, Tissue and Organ Culture, 2012,108: 229–236. DOI: 10.1007/s11240-011-0034-4 |
| [32] | 苏艳丽, 田鹏, 魏闻东. 红星梨叶片不定梢诱导及增殖培养[J]. 经济林研究, 2015, 33(1): 103–106. Su Y L, Tian P, Wei W D. Induction and proliferation culture of adventitious shoots from Pyrus communis leaves[J]. Nonwood Forest Research, 2015,33(1): 103–106. (in Chinese) |




