文章信息
- 邓叶, 阳淑金, 杜新平, 董彬, 任丽萍, 房伟民, 陈发棣, 蒋甲福
- DENG Ye, YANG Shujin, DU Xinping, DONG Bin, REN Liping, FANG Weimin, CHEN Fadi, JIANG Jiafu
- 菊花高效瞬时转化体系建立及稳定遗传植株再生
- Establishment of efficient transient transformation system and the regeneration of stable transformants in chrysanthemum
- 南京农业大学学报, 2017, 40(1): 48-53
- Journal of Nanjing Agricultural University (Social Science), 2017, 40(1): 48-53.
- http://dx.doi.org/10.7685/jnau.201603046
-
文章历史
- 收稿日期: 2016-03-25
菊花(Chrysanthemum morifolium Ramat.)作为国际四大鲜切花之一,具有很高的经济价值和观赏价值。而现有的菊花品种无法完全满足大众日益增长的需求[1],因此急需加快菊花育种和遗传研究工作的进度。根癌农杆菌介导的转基因技术是获得遗传修饰有机体的常用方法之一,同时也是研究基因功能的重要手段。早在1991年,研究发现通过农杆菌侵染的方法,能够获得菊花转基因阳性株系[2]。自此,农杆菌介导的遗传转化成为菊花转基因工作中应用最广泛的方法[1]。然而,转化效率低、阳性植株表达水平低甚至嵌合表达等问题限制着菊花转基因工作的进行[1,3-4]。近年来农杆菌介导的瞬时表达已经发展成为一种快速、有效、简单的基因功能分析方法[5-7],在许多植物组织中得到应用[8-11],而在菊花中尚未见报道。对烟草的研究发现,瞬时转化的叶片可以再生出稳定的转基因株系[12]。本试验以菊花‘优香’叶片为材料,以GUS作为外源基因,通过根癌农杆菌注射渗透的方法,建立瞬时表达及其再生的体系,旨在为菊花的高效转化和基因功能分析提供新途径。
1 材料与方法 1.1 试验材料和试剂供试材料为切花菊品种‘优香’‘神马’和菊花脑,取自南京农业大学中国菊花种质资源保存中心。在22 ℃,光照16 h · d-1条件下,将其生根苗培养30~50 d至有10~14片完全展开叶时备用。大肠杆菌(Escherichia coli)菌株DH5α、根癌农杆菌(Agrobacterium tumefaciens)菌株EHA105和pJL3:P19[13]、质粒pCAMBIA1301 vector (www.cambia.org.au)及pORE R1 vector(适用于单子叶植物和双子叶植物的双元载体)[14]由本实验室保存。
SacⅡ和NheⅠ内切酶购自Fermentas公司;高保真酶PrimeSTARTM HS DNA Polymerase、总RNA提取试剂TaKaRa RNAiso Reagent、反转录酶M-MLV、RNase Inhibitor、Oligo(dT)18 Primer、10 mmol · L-1 dNTP mixture、2.5 mmol · L-1 dNTP mixture、rTaq酶和pMD19-T均购自TaKaRa公司;X-Gluc、DNA凝胶回收试剂盒Axygen Agarose Gel DNA Purification Kit Ver.2.0和AxyPrep质粒DNA提取试剂盒购自Axygen公司;T4 DNA Ligase购自Thermo Scientific公司。测序公司为Invitrogen公司,所用引物由上海捷瑞生物工程有限公司合成。
1.2 植物表达载体pORER1- 2×35 S ∷ GUS的构建设计2×35S启动子引物(正向引物:5′-tccccgcggagaggcggtttgcgtattgg-3′,反向引物:5′-ctagctagcagagatagatttgtagagagagact-3′),以pCAMBIA1301质粒DNA为模板,进行PCR扩增并回收产物,将回收产物与pORE R1载体同时进行SacⅡ和NheⅠ双酶切,连接、转化至大肠杆菌感受态细胞(DH5α)后,测序验证,得到植物表达载体pORE R1- 2×35 S ∷ GUS。将构建成功的质粒转入农杆菌菌株EHA105。
1.3 农杆菌侵染液的制备将1.2节中获得的阳性农杆菌活化后培养至D600约为1.5,离心。参照文献[11-12]的方法,用适量侵染缓冲液(10 mmol · L-1 2-吗啉乙磺酸,0.1 mmol · L-1乙酰丁香酮,50 mmol · L-1 MgCl2水溶液,pH5.6)重悬至D600值等于0.8±0.2,继续培养不少于3 h后,以备注射。P19蛋白能有效抑制植物对外源导入载体表达的沉默效应,提高表达量[15],因此将pJL3:P19与pORE R1- 2×35 S ∷ GUS共转化,步骤参照Lindbo[13]的方法。
1.4 菊花叶片的瞬时转化注射前先于叶片近轴端主叶脉中部两侧无叶脉处点刻伤,伤口不可穿透叶片。以去除针头的注射器(2 mL)吸取1.3节中制备的侵染液,按压渗入叶肉细胞。用保鲜膜封闭植株以保湿,于25 ℃暗培养2 d后,转移到光下培养。
1.5 菊花GUS瞬时表达情况的检测 1.5.1 化学染色法光培养2 d后,参照Jefferson等[16]的方法,剪下叶片,置于X-Gluc染色反应液中(50 mmol · L-1 NaH2PO4,pH7.0;0.5 mmol · L-1 K4 ;1 mL · L-1 Triton X-100;200 mL · L-1甲醇;500 mg · L-1 X-Gluc),真空抽气10 min,37 ℃避光过夜染色后,用乙醇脱色(浓度按70%~95%梯度增加)至透明状后,观察GUS染色状况。
1.5.2 RT-PCR验证提取叶片总RNA,反转录为cDNA,以cDNA为模板,设计GUS基因引物(正向引物:5′-acggggaaactcagcaagc-3′,反向引物:5′-tgagcgtcgcagaacattacat-3′),选择菊花EF- 1α 基因为内参基因[17](正向引物:5′-ttttggtatctggtcctggag-3′,反向引物:5′-ccattcaagcgacagactca-3′),进行RT-PCR反应。
1.6 瞬时转化再生植株的获得 1.6.1 外植体消毒光培养1.5 d后,洗净被注射叶片,用75%乙醇表面消毒30 s,0.1%升汞消毒13 min,双蒸水清洗3~5遍。
1.6.2 组织培养将消毒的叶片切成叶盘,参照何俊平[18]的方法进行组织培养,抗生素(卡那霉素)筛选浓度参照傅荣昭等[19]的方法,待生根后对抗性植株进行鉴定。
1.6.3 阳性植株的鉴定方法同1.5.1和1.5.2节。
2 结果与分析 2.1 表达载体的构建从PCAMBIA1301 vector中克隆得到2×35S启动子的全长序列,全长为781 bp,插入pORE R1载体的SacⅡ和NheⅠ酶切位点之间,获得重组质粒pORE R1- 2×35 S ∷ GUS,结构如图 1所示。
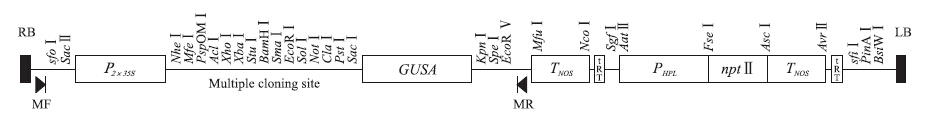
|
图 1 pORE R1- 2×35 S ∷ GUS表达载体结构 Figure 1 Structure of the expression vector pORE R1- 2×35 S ∷ GUS |
在瞬时表达试验中,共转化60个‘优香’叶片,其中46个为阳性转化子,转化效率为76.7%(表 1),另外‘神马’和菊花脑(C.nankingense)的转化效率分别为64.2%和60.0%,均显著高于农杆菌介导的稳定遗传在菊花中的转化效率(一般为3.0%~5.2%)[1,20-21]。
| 种类 Species | 转化叶片数 No.of transformed leaves | 阳性叶片数 No.of positive leaves | 死亡叶片数 No.of dead leaves | 转化效率/% Transformation rate |
| 优香Yuuka | 60 | 46 | 0 | 76.7 |
| 神马Jinba | 53 | 34 | 2 | 64.2 |
| 菊花脑C.nankingense | 45 | 27 | 9 | 60.0 |

|
图 2 GUS瞬时表达结果的鉴定 Figure 2 GUS assay of transient transformants A. 适合进行瞬时表达试验的植株状态;B.化学染色法鉴定GUS瞬时表达情况;C. RT-PCR鉴定GUS瞬时转录结果 1~5:第1~5片完全展开叶;a~d:pORE R1转化第2~5片完全展开叶,阴性对照;e:pORE R1- 2×35 S ∷ GUS载体,阳性对照;f~i:pORE R1- 2×35 S ∷ GUS阳性转化第2~5片完全展开叶 A. The stage of plant development appropriate for transient transformation;B. Histochemical assay of GUS transient expression level;C. RT-PCR assay of GUS transient transcription 1-5:The 1st-5th fully expanded leaves;a-d:The 2nd-5th fully expanded leaves transformed by pORE R1,negative control;e:pORE R1- 2×35 S ∷ GUS plasmid,positive control;f-i:The 2nd-5th fully expanded leaves transformed by pORE R1- 2×35 S ∷ GUS |
由图 2可见:叶片的GUS染色结果可通过肉眼直接观察,效果很好,表明GUS表达水平达到预期,可用于基因功能分析。但是,瞬时表达效率受叶位的影响较大。根据3次重复试验的结果可以看出,第1片完全展开叶无法观察到蓝色着色,不能用于瞬时表达试验;而第4和第5片完全展开叶的蓝色着色明显可见,染色效果较佳,是更适用于进行瞬时表达试验的材料。
为了进一步验证GUS染色的结果,光培养2 d后,选取‘优香’的第2~5片完全展开叶,提取总RNA,反转录为cDNA进行PCR扩增,结果(图 2-C)与化学染色法结果相符。
2.3 瞬时转化再生植株的获得根据瞬时表达试验的结果,选取‘优香’的第4和第5片完全展开叶为外植体,进行表面消毒和组织培养。总共培养54个叶盘,其中8个产生不定芽,通过抗性筛选得到35株生根苗(图 3)。经RT-PCR和化学染色法鉴定,其中21株为转基因阳性植株(图 4),转化效率高达38.9%。

|
图 3 转基因植株的再生 Figure 3 Regeneration from in vitro culture A.愈伤筛选Calli on selective medium;B.分化生长Plantlet differentiation;C.抗性芽Resistant shoots;D.生根苗Rooted plantlet |
另外,从图 4可以看出,5株阳性苗的GUS表达水平不同,组织染色后的着色情况也不同,2、3和4号染色后着色较深、着色面积较大,GUS表达水平也相对较高。
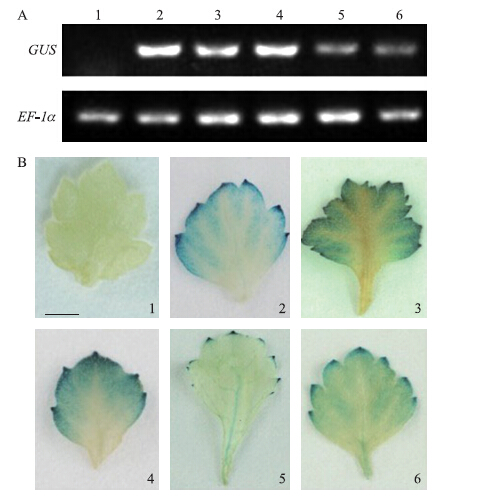
|
图 4 稳定转化植株的验证 Figure 4 Validation of stably transformed plants A.RT-PCR检测阳性株系的GUS转录水平;B.GUS化学染色法鉴定转基因阳性株系(叶片均为再生苗的第2片完全展开叶,Bar=0.5 cm) 1:野生型‘优香’;2~6:转pORE R1- 2×35 S ∷ GUS再生植株 A.RT-PCR assay of GUS transcription in stably transformed regenerants;B.GUS histochemical assay of stably transformed regenerants(all leaves shown in this image were the 2nd fully expanded leaves. Bar=0.5 cm) 1:Wild type of‘Yuuka’;2-6:Regenerants harboring pORE R1- 2×35 S ∷ GUS |
由于后代表达不稳定以及转基因沉默等原因,目前菊花遗传转化效率普遍较低[20-21];并且由于菊花属于多倍体,遗传背景复杂,其转基因阳性植株的表达水平也较低[1-21]。因此建立高效的瞬时表达体系,是研究和分析菊花基因功能的新突破点。多种植物中已建立的瞬时表达体系表明,启动子的选择、植物基因型、受体部位生长状态和侵染液成分等因素对瞬时表达的效果有显著影响[7,22-27]。CaMV 2×35S启动子比35S具有更强的驱动力,在菊花‘神马’中,前者驱动GUS基因的转录和翻译,能获得较高水平的GUS表达,化学染色后肉眼可见[28]。另外,P19是一种沉默抑制蛋白,能够抑制外源导入基因的转录后沉默,从而提高目的蛋白的表达水平[15];乙酰丁香酮则通过诱导农杆菌Vi区基因的活化和表达,促进T-DNA的插入,从而提高转化率[29]。本试验通过选用CaMV 2×35S启动子、共转化pJL3:P19和添加乙酰丁香酮等办法优化瞬时转化体系,获得了较高的瞬时表达水平和转化效率。
本研究中,GUS在‘优香’中的瞬时表达效率随叶位发生变化,从形态学上端至形态学下端数第4和第5片完全展开叶的转化效果较好,表明叶片的生理状况影响GUS基因的瞬时表达情况。这与玫瑰和月季中报道的花瓣位置影响瞬时转化效率的结论类似[24-25]。并且同叶位叶片的不同部位的染色状况也存在差异,叶缘和叶脉的染色效果不明显,猜测是由于各部位细胞的生理状态或者侵染液渗透程度的不同造成的。另外,以‘优香’‘神马’和菊花脑为材料进行瞬时表达试验,发现转化后各材料的转化效率和叶片状况存在差异,‘神马’和菊花脑的转化效率较低并且出现叶片死亡的现象,‘优香’表现最佳。由此可见,基因型差异能够影响菊花瞬时表达的效果。菊花品种繁多,遗传背景丰富,选用不同品种开展转基因试验需要建立不同的再生体系,因此利用传统的转基因技术研究基因功能不仅周期长,而且过程繁琐、工作量大。本研究构建的瞬时表达体系在不同的材料中均获得较理想的结果,说明该体系适用于菊花的不同品种和近缘属植物,不局限于特定品种。
利用传统的农杆菌侵染转化法将重组质粒pORE R2 2×35 S ∷ GUS转入菊花,得到转基因再生植株,转化效率仅为9.52%[28]。而通过瞬时转化及再生,获得稳定遗传的转基因植株,转化效率高达38.9%。本试验提供的方法具有显著的优越性。我们推测有两个原因,一是大田苗较组培苗健壮,具有更强的再生能力,通过组织培养的方法能够获得更多的再生苗;二是农杆菌注射法能够保证侵染液将叶片渗透完全,与传统的叶盘侵染法相比,渗透效果更好,从而提高了转化效率。在操作上,该方法虽然需要进行表面消毒,但所需叶盘数较少,无需进行预培养,组织培养前的步骤(注射和共培养)不需要无菌操作,并且注射的方法简单省时,因此值得推广应用。
综上,该瞬时转化体系的构建填补了农杆菌介导的瞬时表达在菊花中应用的空白,易于操作和实现,表达效率较高,适用性强,为更有效地研究菊花基因功能和蛋白功能提供了新手段。
| [1] | Teixeira da Silva J A, Shinoyama H, Aida R, et al. Chrysanthemum biotechnology:quo vadis?[J]. Critical Reviews in Plant Sciences, 2013,32(1): 21–52. DOI: 10.1080/07352689.2012.696461 |
| [2] | Ledger S E, Deroles S C, Given N K. Regeneration and Agrobacterium-mediated transformation of chrysanthemum[J]. Plant Cell Reports, 1991,10: 195–199. |
| [3] | Shinoyama H, Aida R, Ichikawa H, et al. Genetic engineering of chrysanthemum (Chrysanthemum morifolium):current progress and perspectives[J]. Plant Biotechnology, 2012,29(4): 323–337. DOI: 10.5511/plantbiotechnology.12.0521a |
| [4] | Aida R, Narumi T, Ohtsubo N, et al. Improved translation efficiency in chrysanthemum and torenia with a translational enhancer derived from the tobacco alcohol dehydrogenase gene[J]. Plant Biotechnology, 2008,25(1): 69–75. DOI: 10.5511/plantbiotechnology.25.69 |
| [5] | Wu H Y, Liu K H, Wang Y C, et al. AGROBEST:an efficient Agrobacterium-mediated transient expression method for versatile gene function analyses in Agrobacterium seedlings[J]. Plant Methods, 2014,10(1): 19. DOI: 10.1186/1746-4811-10-19 |
| [6] | King J L. The development of an efficient method of Agrobacterium-mediated transient expression in soybean(Glycine max)[D]. Columbus:The Ohio State University,2013. |
| [7] | Wroblewski T, Tomczak A, Michelmore R. Optimization of Agrobacterium-mediated transient assays of gene expression in lettuce, tomato and Arabidopsis[J]. Plant Biotechnology Journal, 2005,3(2): 259–273. DOI: 10.1111/pbi.2005.3.issue-2 |
| [8] | |
| [9] | Xu K D, Huang X H, Wu M M, et al. A rapid, highly efficient and economical method of Agrobacterium-mediated in planta transient transformation in living onion epidermis[J]. PLoS ONE, 2014,9(1). |
| [10] | 王火旭, 王关林, 王晓岩, 等. 大白菜AB-81高频再生系统的建立及gus A基因瞬时表达的研究[J]. 园艺学报, 2001, 28(1): 74–76. Wang H X, Wang G L, Wang X Y, et al. Establishment of efficient shoot regeneration system of Chinese cabbage (Brassica campestris ssp.pekinensis) inbred line AB-81 and studies of transient expression of gus A gene[J]. Acta Horticulturae Sinica, 2001,28(1): 74–76. (in Chinese) |
| [11] | 李静, 陈敏, 刘现伟, 等. 莴苣高效瞬时表达体系的建立[J]. 园艺学报, 2006, 33(2): 405–407. Li J, Chen M, Liu X W, et al. A highly efficient system establishment of transient expression in lettuce[J]. Acta Horticulturae Sinica, 2006,33(2): 405–407. (in Chinese) |
| [12] | Sparkes I A, Runions J, Kearns A, et al. Rapid, transient expression of fluorescent fusion proteins in tobacco plants and generation of stably transformed plants[J]. Nature Protocols, 2006,1(4): 2019–2025. DOI: 10.1038/nprot.2006.286 |
| [13] | Lindbo J A. High-efficiency protein expression in plants from agroinfection-compatible Tobacco mosaic virus expression vectors[J]. BMC Biotechnology, 2007,7: 52. DOI: 10.1186/1472-6750-7-52 |
| [14] | Coutu C, Brandle J, Brown D, et al. pORE:a modular binary vector series suited for both monocot and dicot plant transformation[J]. Transgenic Research, 2007,16(6): 771–781. DOI: 10.1007/s11248-007-9066-2 |
| [15] | Voinnet O, Rivas S, Mestre P, et al. Retracted:an enhanced transient expression system in plants based on suppression of gene silencing by the P19 protein of tomato bushy stunt virus[J]. The Plant Journal, 2003,33(5): 949–956. DOI: 10.1046/j.1365-313X.2003.01676.x |
| [16] | Jefferson R A, Kavanagh T A, Bevan M W. GUS fusions:β-glucuronidase as a sensitive and versatile gene fusion marker in high plants[J]. The EMBO Journal, 1987,5(13): 387–405. |
| [17] | Gu C S, Chen S M, Liu Z L, et al. Reference gene selection for quantitative real-time PCR in chrysanthemum subjected to biotic and abiotic stress[J]. Molecular Biotechnology, 2011,49(2): 192–197. DOI: 10.1007/s12033-011-9394-6 |
| [18] | 何俊平. 切花菊蚜虫抗性鉴定与机理探讨及LLA转基因研究[D]. 南京:南京农业大学,2010. He J P. Studies on aphid resistance identification,resistance related mechanisms and LLA gene transformation of cut chrysanthemum[D]. Nanjing:Nangjing Agricultural University,2010(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10307-1012270924.htm |
| [19] | 傅荣昭, 刘敏. 通过根瘤农杆菌介导法获得菊花转基因植株[J]. 植物生理学报, 1998, 24(1): 72–76. Fu R Z, Liu M. Production of transgenic plants of chrysanthemum via Agrobacterium tumefacien mediated method[J]. Acta Phytophysiologica Sinica, 1998,24(1): 72–76. (in Chinese) |
| [20] | Shinoyama H, Komano M, Nomura Y, et al. Introduction of delta-endotoxin gene of Bacillus thuringiensis to chrysanthemum[Dendranthema×grandiflorum (Ramat.) Kitamura]for insect resistance[J]. Breeding Science, 2002,52: 43–50. DOI: 10.1270/jsbbs.52.43 |
| [21] | 蒋细旺, 包满珠. 菊花转基因研究进展[J]. 华中农业大学学报, 2003, 22(6): 618–623. Jiang X W, Bao M Z. Advances of the research on transgenic chrysanthemum[J]. Journal of Huazhong Agricultural University, 2003,22(6): 618–623. (in Chinese) |
| [22] | Santos-Rosa M, Poutaraud A, Merdinoglu D, et al. Development of a transient expression system in grapevine via agro-infiltration[J]. Plant Cell Reports, 2008,27(6): 1053–1063. DOI: 10.1007/s00299-008-0531-z |
| [23] | Bhaskar P B, Venkateshwaran M, Wu L, et al. Agrobacterium-mediated transient gene expression and silencing:a rapid tool for functional gene assay in potato[J]. PLoS ONE, 2009,4(6): e5812. DOI: 10.1371/journal.pone.0005812 |
| [24] | Yasmin A, Debener T. Transient gene expression in rose petals via Agrobacterium infiltration[J]. Plant Cell, Tissue and Organ Culture, 2010,102(2): 245–250. DOI: 10.1007/s11240-010-9728-2 |
| [25] | 王磊, 陈雯, 刘娅, 等. 月季花瓣中农杆菌介导的基因瞬时表达体系的优化及其在RNAi中的应用[J]. 农业生物技术学报, 2014, 22(2): 133–140. Wang L, Chen W, Liu Y, et al. Optimization of Agrobacterium-mediated transient gene expression system and its utilization in RNAi based gene silencing of rose (Rosa hybrida) petals[J]. Journal of Agricultural Biotechnology, 2014,22(2): 133–140. (in Chinese) |
| [26] | 黎茵, 张以顺. 农杆菌注射渗透法转化烟草实验研究[J]. 实验技术与管理, 2010, 27(11): 50–52. Li Y, Zhang Y S. Study on Agrobacterium tumefaciens-mediated transient transformation of tobacco by infiltration[J]. Experimental Technology and Management, 2010,27(11): 50–52. (in Chinese) |
| [27] | 庞宏东, 向林, 赵凯歌, 等. 蜡梅SAMT基因遗传转化及其功能分析[J]. 南京林业大学学报(自然科学版), 2015, 39(6): 29–34. Pang H D, Xiang L, Zhao K G, et al. Genetic transformation and functional analysis of the SAMT gene in Chimonanthus praecox[J]. Journal of Nanjing Forestry University (Natural Sciences Edition), 2015,39(6): 29–34. (in Chinese) |
| [28] | 阳淑金, 宋爱萍, 何深颖, 等. CaMV 35S启动子在菊花中驱动GUS外源基因的表达分析[J]. 南京农业大学学报, 2015, 38(4): 554–559. Yang S J, Song A P, He S Y, et al. Expression analysis of CaMV 35S promoting GUS exogenous genes in transgenic chrysanthemum[J]. Journal of Nanjing Agricultural University, 2015,38(4): 554–559. DOI: 10.7685/j.issn.1000-2030.2015.04.005 (in Chinese) |
| [29] | 董喜才, 杜建中, 王安乐, 等. 乙酰丁香酮在植物转基因研究中的作用[J]. 中国农学通报, 2011, 27(5): 292–299. Dong X C, Du J Z, Wang A L, et al. Role of acetosyringone in plants transformation researcher[J]. Chinese Agricultural Science Bulletin, 2011,27(5): 292–299. (in Chinese) |




