文章信息
- 郭玉双, 余婧, 蒲伟, 邹颉, 付强, 余世洲, 林世锋, 张孝廉, 赵杰宏, 夏范讲
- GUO Yushuang, YU Jing, PU Wei, ZOU Jie, FU Qiang, YU Shizhou, LIN Shifeng, ZHANG Xiaolian, ZHAO Jiehong, XIA Fanjiang
- 烟草谷氧还蛋白NbGRX1的亚细胞定位及抗旱功能研究
- Subcellular localization of NbGRX1 and its role in plant response to drought stress
- 南京农业大学学报, 2017, 40(1): 34-39
- Journal of Nanjing Agricultural University (Social Science), 2017, 40(1): 34-39.
- http://dx.doi.org/10.7685/jnau.201606004
-
文章历史
- 收稿日期: 2016-06-02
2. 贵州烟叶复烤有限公司 铜仁复烤厂, 贵州 铜仁 554300 ;
3. 中国烟草总公司贵州省公司, 贵州 贵阳 550004
2. Tongren Factory of Guizhou Tobacco Leaf Redrying Co., Ltd., Tongren 554300, China ;
3. National Tobacco Corporation of Guizhou Province, Guiyang 550004, China
活性氧(reactive oxygen species,ROS)在植物体内主要包括超氧根阴离子(O2· - )、氢氧根离子(OH-)、羟基自由基(-OH)、过氧化氢(H2O2)等[1]。ROS参与了植物细胞内众多的生物学过程,是植物体内分子、生化和生理反应的重要信号分子[2-4]。通常,植物体内ROS的浓度很低,其代谢处于动态平衡,不会造成伤害作用。然而,当植物处于逆境时,其氧的代谢容易出现紊乱而产生过多的ROS,引起生物膜、叶绿体与线粒体等细胞器的过氧化损伤以及DNA和蛋白质等生物大分子的降解和失活,从而导致细胞死亡[5]。
同时,植物为了防止过多的ROS对其自身造成的危害,形成了较为复杂的抗氧化系统来调节蛋白质的氧化还原状态,从而避免由于ROS的损害造成其功能的丧失,主要包括植物的硫氧还蛋白系统(thioredoxin system)和谷氧还蛋白系统(glutaredoxin system)。前者主要包括NADPH、硫氧还蛋白(thioredoxin,Trx)和硫氧还蛋白还原酶(thioredoxin reductase,TR),后者主要包括NADPH、谷胱甘肽(glutathione,GSH)、谷胱甘肽还原酶(glutathione reductase,GR)和谷氧还蛋白[6-7]。
在前期研究中,我们克隆了烟草的谷氧还蛋白基因NbGRX1 ,对其序列特征、表达特性进行了研究[8]。本研究在此基础上,进一步研究了NbGRX1的亚细胞定位,并通过病毒介导的基因沉默和超量表达技术研究了该基因在植物抗旱过程中的作用。本研究对于阐明烟草抗旱的分子机制具有重要意义,也为植物抗逆基因工程提供了基因资源。
1 材料与方法 1.1 试验材料本氏烟(Nicotiana benthamiana)由贵州省烟草科学研究院育种工程中心提供。
1.2 方法 1.2.1 NbGRX1蛋白的亚细胞定位根据NbGRX1 基因序列及pCHF3载体[9]序列所含的酶切位点设计5′端带有酶切位点的PCR引物(5′- GGATCC ATGGCCTCATTGAACATCTC-3′/5′- GTCGAC TTAGCTTTTGAACAAGGTGG-3′),下划线为5′端分别添加BamHⅠ和SalⅠ的酶切位点,引物设计时应保证靶基因与绿色荧光蛋白(GFP)融合后均不发生移码突变。将该质粒转化到农杆菌菌株EHA105中。用PCR技术筛选阳性克隆,将阳性的农杆菌活化至D600为0.2~0.8,浸润4叶期的本氏烟叶片,48 h后在共聚焦显微镜下观察GFP的表达情况,GFP的激发波长为488 nm。
1.2.2 双生病毒卫星2mDNA1介导的 NbGRX1 基因沉默参照Huang等[10]建立的双生病毒2mDNA1沉默体系[10]。构建NbGRX1 沉默载体2mDNA1-NbGRX1 ,通过电击法导入农杆菌EHA105,与含辅助病毒——中国番茄黄化曲叶病毒(tomato yellow leaf curl China virus,TYLCCNV)侵染性克隆pBinPLUS-1.7A的农杆菌等比例混合后注射接种烟草,接种TYLCCNV和空载体的植物为对照。将NbGRX1 基因沉默的植株及对照植株浇透水后停止浇水进行干旱处理,待NbGRX1 基因沉默的全部植株出现叶片萎蔫卷曲等症状时,按照Turner[11]的方法测定烟草的相对含水量。
1.2.3 基因表达分析参照郭玉双等[12]建立的基因表达检测方法进行RNA的提取、cDNA第1链的合成和实时定量PCR(quantitative real time PCR,qRT-PCR)扩增。使用ΔΔCT方法计算在NbGRX1 基因沉默植株和对照植株中目的基因的表达量,每个试验3次重复。以延伸因子EF-1 -α(elongation factor 1-alpha1 gene,EF-1 -α)作为qRT-PCR的内参。
1.2.4 NbGRX1 基因在拟南芥中的超量表达及抗旱功能分析将NbGRX1 基因从测序载体上切下,回收,与相同酶切的pBin438载体[13]连接,转化农杆菌菌株EHA105。采用花絮浸蘸法转化拟南芥,筛选单拷贝纯合的转基因株系用于后期分析。将转基因拟南芥和野生型拟南芥种子播于土中,在4叶期对拟南芥进行干旱胁迫处理。干旱处理是对所有拟南芥浇透水后停止浇水,待对照拟南芥全部植株出现萎蔫、黄花等干旱症状时再复水2 d。
1.2.5 数据统计分析方法数据整理与计算用Microsoft Excel 2007软件,用SPSS 19.0统计分析软件进行数据方差分析与差异显著性检验。
2 结果与分析 2.1 NbGRX1蛋白的亚细胞定位将NbGRX1 基因扩增片段用BamHⅠ和SalⅠ酶切,回收后与经过相同酶消化的pCHF3载体大片段连接,使得靶基因的编码区融合在GFP的C-端(图 1)。将连接产物转化大肠杆菌DH5α,酶切鉴定正确的转化子。

|
图 1 用于亚细胞定位的植物瞬时表达载体示意图 Figure 1 Schematic representation of constructs used for subcellular localization |
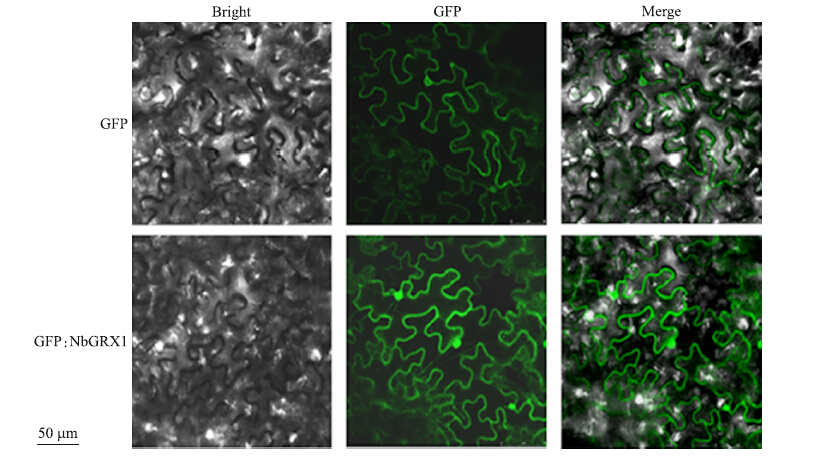
从图 2可见:空载体中的GFP蛋白多在细胞质和细胞核的周围,极少部分在细胞核内,而GFP:NbGRX1的融合蛋白则均匀分布在细胞质和细胞核中,因此可以推测NbGRX1蛋白能定位在植物的细胞核和细胞质中。
|
图 2 NbGRX1蛋白的亚细胞定位分析 Figure 2 Subcellular localization assays of NbGRX1 |
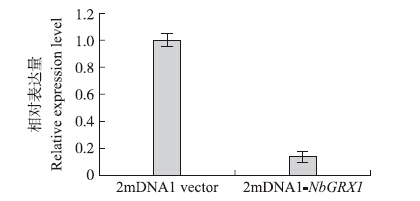
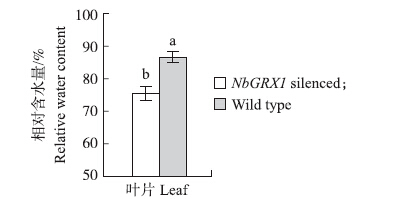
在接种15 d后,取接种植株与对照叶片,提取RNA并反转录成cDNA,利用RT-PCR检测NbGRX1 基因的表达水平。结果显示,接种沉默载体叶片中目的基因表达水平显著下调,约为对照的10%(图 3)。将NbGRX1 基因沉默的植株及对照植株进行干旱处理,NbGRX1 基因沉默的植株相对含水量明显低于对照植株(图 4),干旱6 d后NbGRX1 基因沉默的植株叶片表现出萎蔫症状,而对照植株仍然正常生长(图 5)。这些研究表明:NbGRX1 基因对植物的抗旱反应有重要的调控作用。
|
图 3 烟草NbGRX1 基因在接种沉默载体和对照载体植株中的表达水平 Figure 3 Relative expression level of NbGRX1 in NbGRX1 -silenced plant and wild type |
|
图 4 NbGRX1 基因沉默烟草与对照植株叶片的相对含水量 Figure 4 Relative water content of the NbGRX1 -silenced plants and wild type |

|
图 5 NbGRX1 基因沉默烟草与对照植株在干旱处理时的表型 Figure 5 Phenotype of NbGRX1 -silenced and wild type plants imposed by withholding water |
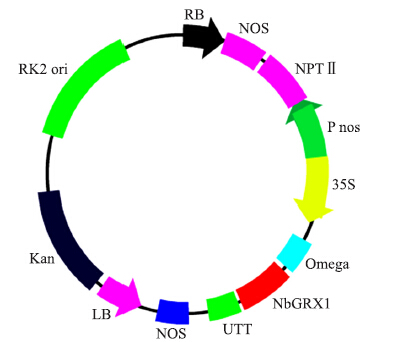
用BamHⅠ和SalⅠ酶切将NbGRX1 基因从T载体上切下,与相同酶切的pBin438载体连接,转化大肠杆菌DH5α,构建成植物表达载体pBin438-NbGRX1 (图 6),重组质粒含有NPTⅡ植物选择标记基因和cauliflower mosaic virus(CaMV)35S启动子调控的目的基因,适用于农杆菌介导的双子叶植物遗传转化。
|
图 6 NbGRX1 基因植物表达载体的构建 Figure 6 Construction of plant expression vectors |
用携带NbGRX1 基因的植物表达载体转化农杆菌EHA105,通过花序浸润法转化拟南芥并收获种子,将种子播于含100 mg · mL-1 Km的MS基本培养基上,具有Kan抗性的拟南芥能够正常生长,否则会白化死亡。经过拟南芥3代的筛选得到2个单拷贝插入的T3代转基因拟南芥株系N1和N2,对其进行Southern验证,结果显示,N1和N2为单拷贝外源基因插入(图 7)。
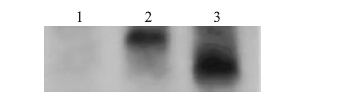
|
图 7 转基因拟南芥N1、N2株系NbGRX1基因的Southern杂交检测 Figure 7 Southern blot identification of transgenic Arabidopsis lines N1 and N2 transformed with NbGRX1 1:野生型Wild type;2:N1株系 N1 strain;3:N2株系N2 strain. The same as follows. |
为了检测NbGRX1 基因是否能提高转基因拟南芥在土壤生长条件下的抗性,我们测定了土壤条件下株系N1和N2与对照拟南芥对干旱的抗性。干旱处理10 d后,株系N1和N2与对照都有明显的生长延迟现象,其中对照植株大部分出现死亡,复水后也没有恢复生长,而株系N1和N2大部分植株仍然存活,且大部分植株表现为绿色,复水后植株继续生长(图 8)。相对含水量测定表明,干旱条件下NbGRX1 基因超量表达的植株明显高于对照植株(图 9),这说明NbGRX1 基因能够提高异源植物的抗性。

|
图 8 转基因拟南芥对干旱的抗性反应 Figure 8 Response of NbGRX1 overexpression line and wild type plants to drought stress |
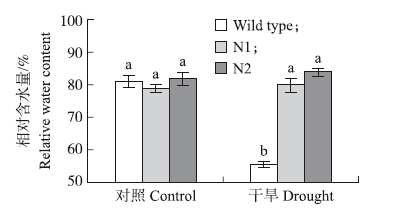
|
图 9 NbGRX1 基因超量表达植株与野生型植株叶片的相对含水量 Figure 9 Relative water content of the NbGRX1 overexpressed plants and wild type |
渗透胁迫是影响农业生产的严重问题,因此如何提高作物抗干旱、盐渍和低温的能力是亟待解决的问题。由于植物抗逆性状本身的复杂性及其与数量性状位点连锁关系的复杂性,采用传统的育种方法以获得优良品种已经十分困难。本研究在前期研究的基础上,通过病毒介导的基因沉默和转基因技术证明,NbGRX1 基因在植物抗旱过程中起重要作用。
众所周知,蛋白质的亚细胞定位对于实现其生物学功能至关重要,但是关于植物谷氧还蛋白亚细胞定位的信息却很少。通过生物信息学预测,植物谷氧还蛋白虽然可以定位在很多细胞器中,但是只有少数基因得到试验的验证。因此,加强谷氧还蛋白亚细胞定位的研究是了解其生物学功能的重要基础。在本试验中,我们证实NbGRX1能够定位在植物的细胞核和细胞质中,但是,究竟哪种定位与其功能直接相关目前还不是很清楚,下一步应该加强NbGRX1的定位与其功能的关系研究。
为研究NbGRX1 基因的功能,首先在本氏烟中利用VIGS技术,用双生病毒卫星2mDNA1在烟草中沉默了NbGRX1 基因,对沉默的烟草进行了干旱处理,与对照相比,NbGRX1 基因沉默的烟草表现出对干旱更高的敏感性。在对拟南芥的超量表达研究中,NbGRX1 过表达的拟南芥表现出对干旱更高的抗性。通过分析烟草和拟南芥中的NbGRX1 ,我们可以断定NbGRX1 基因是植物抗干旱重要的正调控因子。
植物谷氧还蛋白基因在植物的发育、DNA合成和胁迫信号转导等方面具有重要作用。拟南芥的CC类型的谷氧还蛋白ROXY1定位于植物的细胞核中,对调控植物的花瓣发育具有重要作用[14-15];进一步研究发现,ROXY1能够和另外1个CC类型的谷氧还蛋白ROXY2互作,共同调控植物花粉囊的发育[16]。拟南芥CC类型的谷氧还蛋白GRX480能和转录因子TGA2.2互作,并参与植物体内水杨酸(salicylic acid,SA)/茉莉酸(jasmonic acid,JA)的互作调控[17]。而拟南芥第4染色体的谷氧还蛋白基因簇AtGRXS3/4/5/7/8 受氮素调节并能够协调控制拟南芥中初生根的生长[18]。番茄的CGFS类型的谷氧还蛋白SlGRX1同时具有抗氧化、干旱以及盐碱的作用[19]。这些结果都证明了植物的谷氧还蛋白在植物的抗逆信号转导中具有重要的作用。
| [1] | Vranová E, Inzé D, van Breusegem F. Signal transduction during oxidative stress[J]. Journal of Experimental Botany, 2002,53: 1227–1236. DOI: 10.1093/jexbot/53.372.1227 |
| [2] | Buchanan B B, Balmer Y. Redox regulation:a broadening horizon[J]. Annual Review of Plant Biology, 2005,56: 187–220. DOI: 10.1146/annurev.arplant.56.032604.144246 |
| [3] | Scandalios J G. The rise of ROS[J]. Trends in Biochemical Science, 2002,27: 483–486. DOI: 10.1016/S0968-0004(02)02170-9 |
| [4] | Pitzschke A, Forzani C, Hirt H. Reactive oxygen species signaling in plants[J]. Antioxidants and Redox Signaling, 2006,8: 1757–1764. DOI: 10.1089/ars.2006.8.1757 |
| [5] | Rouhier N. Plant glutaredoxins:pivotal players in redox biology and iron-sulphur centre assembly centre assembly[J]. New Phytologist, 2010,186: 365–372. DOI: 10.1111/j.1469-8137.2009.03146.x |
| [6] | Dutilleul C, Garmier M, Noctor G, et al. Leaf mitochondria modulate whole cell redox homeostasis, set antioxidant capacity, and determine stress resistance through altered signaling and diurnal regulation[J]. Plant Cell, 2003,15: 1212–1226. DOI: 10.1105/tpc.009464 |
| [7] | Foyer C H, Noctor G. Redox homeostasis and antioxidant signaling:a metabolic interface between stress perception and physiological responses[J]. Plant Cell, 2005,17: 1866–1875. DOI: 10.1105/tpc.105.033589 |
| [8] | 郭玉双, 张建华, 张吉顺, 等. 烟草谷氧还蛋白基因NbGRX1的克隆与表达特性分析[J]. 东北农业大学学报, 2011, 42(10): 47–51. Guo Y S, Zhang J H, Zhang J S, et al. Cloning and expression pattern analysis a novel NbGRX1 gene from Nicotiana benthamiana[J]. Journal of Northeast Agricultural University, 2011,42(10): 47–51. (in Chinese) |
| [9] | Xiong R Y, Wu J X, Zhou Y J, et al. Characterization and subcellular localization of an RNA silencing suppressor encoded by rice stripe tenuivirus[J]. Virology, 2009,387: 29–40. DOI: 10.1016/j.virol.2009.01.045 |
| [10] | Huang C J, Xie Y, Zhou X P, et al. Efficient virus-induced gene silencing in plants using a modified geminivirus DNA1 component[J]. Plant Biotechnology Journal, 2009,7: 254–265. DOI: 10.1111/pbi.2009.7.issue-3 |
| [11] | Turner N C. Techniques and experimental approaches for the measurement of plant water status[J]. Plant and Soil, 1981,58: 339–366. DOI: 10.1007/BF02180062 |
| [12] | 郭玉双, 陈静, 刘筱嘉, 等. 烟草中一个LTR类反转录转座子基因的克隆与功能分析[J]. 南京农业大学学报, 2015, 38(6): 936–942. Guo Y S, Chen J, Liu X J, et al. Isolation and function analysis a LTR-retrotransposons from tobacco (Nicotiana tabacum)[J]. Journal of Nanjing Agricultrual University, 2015,38(6): 936–942. DOI: 10.7685/j.issn.1000-2030.2015.06.010 (in Chinese) |
| [13] | Cui X, Li G, Wang D, et al. A begomovirus DNA beta-encoded protein binds DNA, functions as a suppressor of RNA silencing, and targets the cell nucleus[J]. Journal of Virology, 2005,79: 10764–10775. DOI: 10.1128/JVI.79.16.10764-10775.2005 |
| [14] | Xing S P, Rosso M G, Zachgo S. ROXY1, a member of the plant glutaredoxin family, is required for petal development in Arabidopsis thaliana[J]. Development, 2005,132: 1555–1565. DOI: 10.1242/dev.01725 |
| [15] | Li S, Lauri A, Ziemann M, et al. Nuclear activity of ROXY1, a glutaredoxin interacting with TGA factors, is required for petal development in Arabidopsis thaliana[J]. Plant Cell, 2009,21: 429–441. DOI: 10.1105/tpc.108.064477 |
| [16] | Xing S, Zachgo S. ROXY1 and ROXY2, two Arabidopsis glutaredoxin genes, are required for anther development[J]. Plant Journal, 2008,53: 790–801. DOI: 10.1111/tpj.2008.53.issue-5 |
| [17] | Ndamukong I, Abdallat A A, Thurow C, et al. SA-inducible Arabidopsis glutaredoxin interacts with TGA factors and suppresses JA-responsive PDF1.2 transcription[J]. Plant Journal, 2007,50: 128–139. DOI: 10.1111/j.1365-313X.2007.03039.x |
| [18] | Walters L A, Escobar M A. The AtGRXS3/4/5/7/8 glutaredoxin gene cluster on Arabidopsis thaliana chromosome 4 is coordinately regulated by nitrate and appears to control primary root growth[J]. Plant Signaling and Behavior, 2016,11(4): e1171450. DOI: 10.1080/15592324.2016.1171450 |
| [19] | Guo Y S, Huang C J, Xie Y, et al. A tomato glutaredoxin gene SlGRX1 regulates plant responses to oxidative, drought and salt stresses[J]. Planta, 2010,232: 1499–1509. DOI: 10.1007/s00425-010-1271-1 |




