文章信息
- 张淼, 邹烨, 王道营, 杨玉玲, 张牧焓, 卞欢, 吴海虹, 诸永志, 耿志明, 徐为民
- ZHANG Miao, ZOU Ye, WANG Daoying, YANG Yuling, ZHANG Muhan, BIAN Huan, WU Haihong, ZHU Yongzhi, GENG Zhiming, XU Weimin
- 基于荧光光谱法的AMP与肌动球蛋白相互作用影响因素研究
- A study on the factors influencing the interaction of AMP with actomyosin by fluorophotometry
- 南京农业大学学报, 2016, 39(6): 1049-1054
- Journal of Nanjing Agricultural University, 2016, 39(6): 1049-1054.
- http://dx.doi.org/10.7685/jnau.201603022
-
文章历史
- 收稿日期: 2016-03-15
2. 江苏省农业科学院农产品加工研究所, 江苏 南京 210014 ;
3. 江苏省肉类生产与加工质量安全控制协同创新中心, 江苏 南京 210095
2. Institute of Agricultural Products Processing, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China ;
3. Jiangsu Collaborative Innovation Center of Meat Production and Processing, Quality and Safety Control, Nanjing 210095, China
肉品的嫩度和体内肌动球蛋白形态有密切的联系[1]。肌动球蛋白由肌球蛋白和肌动蛋白组成。鸭子在宰后体内的三磷酸腺苷(ATP)逐渐消耗殆尽, 肌肉僵直。随着ATP能量不断分解、消耗, 胴体内积累了大量的一磷酸腺苷(adenosine 5′-monophosphate, AMP)。AMP可以与肌动球蛋白发生作用, 促进肌动球蛋白解离为肌球蛋白和肌动蛋白, 从而使嫩度上升[2]。即AMP可促进肌动球蛋白解离, 改善鸭肉的嫩度[3]。AMP是一种内源性嘌呤核苷酸, 参与脱氧核糖核酸(DNA)和核糖核酸(RNA)的所有生命代谢[4]。近年来, 在食品加工中AMP通常用在肉类和家禽汤中作为增味剂(风味改性剂), 或作为食品添加剂以达到特定营养目的[5]。
蛋白质内源荧光可用于定量分析或结构研究[6]。肌动球蛋白分子中的色氨酸、酪氨酸残基等能吸收紫外光, 并能发射荧光, 所以可以使用荧光分光光度计观察AMP与肌动球蛋白反应的荧光强度, 并通过猝灭常数和结合常数来反映出AMP对肌动球蛋白分子解离的影响[7]。AMP可以作为猝灭剂, 降低AMP-肌动球蛋白分子体系的内源荧光, 发生静态猝灭, 并通过一个疏水键与肌动球蛋白结合[8]。
小分子与蛋白结合反应过程中, 在不同影响因素下, 其反应体系稳定性会受到影响, 如时间、pH值、缓冲溶液和离子类型等[9]。本研究通过荧光猝灭理论, 观察不同因素对AMP和肌动球蛋白结合反应荧光光谱的影响, 计算相关参数, 推断反应条件对AMP和肌动球蛋白结合稳定性的影响。
1 材料与方法 1.1 材料与试剂供试材料为肉用鸭(Anas platyrhynchos)5只, 购自南京市某农贸市场。
一磷酸腺苷(AMP)购自美国Sigma公司。其他试剂均为分析纯, 试验用水为二次去离子水。
1.2 仪器与设备UniCen MR台式冷冻离心机购自德国Herolab公司; FE20实验室pH计购自梅特勒-托利多仪器厂; FM-4P-TCSPC型荧光分光光度计购自美国Horiba Jobin Yvon公司; THZ-Q台式冷冻振荡器购自华美生化仪器厂; M124A电子分析天平购自意大利BEL公司; T25基本型匀浆机购自德国IKA公司。
1.3 方法 1.3.1 样品试剂处理配置Weber-Edsall缓冲溶液(含0.6 mol · L-1 KCl、0.04 mol · L-1 NaHCO3、0.01 mol · L-1 Na2CO3, pH7.2)。用此缓冲溶液配置肌动球蛋白溶液、AMP溶液、Clark-Lubs缓冲溶液(含0.2 mol · L-1 K2HPO4-NaOH, pH5.0~8.0)[10]、柠檬酸缓冲溶液(20 mmol · L-1 Citric acid-Na2HPO4, pH5.5)、磷酸缓冲溶液(20 mmol · L-1 Na2HPO4/NaH2PO4, pH7.0)、Tris-HCl缓冲溶液(20 mmol · L-1, pH7.2)及浓度为1.0 mmol · L-1的不同离子溶液(离子分别为Fe3+/Fe2+、Mg2+、Ca2+、K+和SO42-、Cl-、CO32-、NO2-)。
1.3.2 肌动球蛋白的提取参照文献[11]的方法并略有改动。取鸭肉胸大肌, 去除表面肌膜、结缔组织等, 切碎成肉糜待用。取2 g肉糜溶于20 mL Weber-Edsall (pH7.2)溶液中, 12 000 r · min-1冰浴匀浆2次, 每次30 s。匀浆后将溶液置于冷冻振荡器内, 4 ℃恒温振荡24 h。加2倍体积的蒸馏水, 振荡, 离心(4 ℃, 12 000 g, 20 min), 取沉淀加入20 mL Weber-Edsall溶液, 加2倍体积蒸馏水, 重复上述步骤。沉淀中加入15 mL Weber-Edsall溶液, 搅拌均匀后用2层纱布过滤, 调整溶液质量浓度为6 mg · mL-1, 作为样品1备用。
1.3.3 不同条件下AMP与肌动球蛋白作用荧光光谱测定取1 mL样品1于100 mL容量瓶中, 以Weber-Edsall缓冲溶液稀释定容至刻度, 摇匀。移取2 mL稀释后的样品1于比色皿中, 加入1 mL AMP溶液。根据不同测定目的, 再分别加入1 mL不同溶液(Clark-Lubs缓冲溶液、不同离子溶液、柠檬酸缓冲溶液等)混合均匀。设定激发波长为285 nm, 发射波长为300~500 nm, 狭缝均为20.0 nm, 扫描不同条件下的AMP与肌动球蛋白反应荧光光谱。
1.3.4 猝灭常数及结合常数的计算猝灭常数(Ksv):可用Stern-Volmer动态方程进行线性回归。
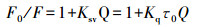
|
(1) |
式中:Q为猝灭剂(AMP)的浓度(mol · L-1); Kq(L · mol-1 · s-1)为猝灭速率常数(最大扩散速率常数为2.0×1010 L · mol-1 · s-1); Ksv为猝灭常数(L · mol-1); τ0为无猝灭剂存在时荧光分子的平均寿命(s), τ 0=10-8 s; F0和F分别为加入AMP前、后肌动球蛋白的荧光强度[12]。
结合常数(KLB):静态猝灭中, KLB(L · mol-1)可由Lineweaver-Burk双倒数函数得到。Lineweaver-Burk双倒数方程为:

|
(2) |
以猝灭剂(AMP)浓度的对数为横坐标, (F0/F-1)的对数为纵坐标, 作肌动球蛋白荧光猝灭的双倒数曲线[13]。双倒数曲线中, 结合常数(KLB)的大小可以反映体系的反应程度和稳定程度。
1.3.5 数据分析每次试验分别取3块不同鸭肉胸大肌, 按1.3.2节的方法提取肌动球蛋白, 进行相同处理(Clark-Lubs缓冲溶液、不同离子溶液、柠檬酸缓冲溶液等)后, 进行荧光光谱扫描试验并进行相关参数的计算, 用SPSS 17.0软件对测定数据进行标准差的分析计算。
2 结果与分析 2.1 pH值对AMP和肌动球蛋白结合反应的影响选择pH值为5.0、5.5、6.0、6.5、7.0、7.5、8.0的缓冲溶液, 测定AMP和肌动球蛋白的结合反应。图 1和图 2显示了AMP加入前后pH值对体系荧光光谱的影响。结果显示, 在同一环境下, 改变pH值基本不改变体系和蛋白质本身的荧光发射峰位。随着pH值的变化, 肌动球蛋白的荧光强度变化较大。且AMP加入前后, 在pH值为6.0~7.0环境中, 比值变化较小, 体系荧光强度较稳定。

|
图 1 pH值对肌动球蛋白(A)和AMP-肌动球蛋白(B)荧光光谱的影响 Figure 1 Effect of pH value on the actomyosin (A) and AMP-actomyosin (B) fluorescence spectrum c(AMP)=0.5 mmol · L-1(AMP:一磷酸腺苷Adenosine 5′-monophosphate) |
选择不同浓度的AMP (0、0.1、0.3、0.5和0.7 mmol · L-1), 在不同pH值条件下进行试验, 并按式(1)、(2)处理试验数据, 可以得到不同pH值下AMP和肌动球蛋白相互作用的KSV、KLB和相应直线的相关系数。
由表 1可以看出:pH值对AMP与肌动球蛋白相互作用的荧光猝灭程度及二者之间的结合力有较大影响。各条件虽然对KSV有一定的影响, 但是KSV都远大于最大速率常数(2.0×102 L · mol-1 · s-1), 所以并不改变AMP对肌动球蛋白静态猝灭的猝灭机制[14]。
| pH | Ksv/(L·mol-1) | Rsv | KLB/(L·mol-1) | RLB |
| 5.0 | 1 955.6±27.0 | 0.989 0 | 2 008.3±1.8 | 0.999 7 |
| 5.5 | 1 895.3±43.2 | 0.900 4 | 747.0±0.6 | 0.999 0 |
| 6.0 | 6 996.2±0.4 | 0.996 2 | 7 371.5±1.0 | 0.988 2 |
| 6.5 | 6 888.6±9.2 | 0.999 7 | 7 049.7±0.9 | 0.996 1 |
| 7.0 | 6 833.3±1.9 | 0.996 9 | 7 116.0±4.2 | 0.985 9 |
| 7.5 | 4 866.2±1.2 | 0.969 9 | 5 114.0±3.6 | 0.964 5 |
| 8.0 | 4 867.1±31.2 | 0.887 8 | 5 337.0±16.6 | 0.916 5 |
| 注:Ksv:猝灭常数Quenching constants; Rsv, RLB:标准差Standard deviation; KLB:结合常数Binding constants | ||||
当pH值为5.0~5.5时, AMP-肌动球蛋白的荧光强度明显较低且不稳定, 数值上表现在分子间的结合常数和猝灭常数较不稳定, 且值相对较小。当pH值为7.5~8.0时, 结合常数比中性环境下的小, 而比酸性环境下的略大。当pH值为6.0~7.0时, AMP对肌动球蛋白反应的相关参数均较稳定, 且数值最大。这与图 1和图 2的结论相吻合。

|
图 2 pH值对AMP-肌动球蛋白体系荧光强度的影响 Figure 2 Effect of pH value on the fluorescence intensity of AMP-actomyosin system c(AMP)=0.5 mmol · L-1 |
由图 3可见:在0~10 min内, 随着AMP与肌动球蛋白的作用时间延长, 体系荧光强度逐渐减小; 当反应超过10 min后, 体系荧光趋于平稳, 此后荧光强度在1 h内几乎不变。因此, 在该浓度下, AMP对肌动球蛋白解离的最佳时间为10 min。

|
图 3 反应时间对AMP-肌动球蛋白体系荧光强度的影响 Figure 3 Effect of reaction time on the fluorescence intensity of AMP-actomyosin system c(AMP)=0.5 mmol · L-1 |
采用Tris-HCl、柠檬酸和磷酸缓冲溶液分别对AMP-肌动球蛋白反应体系进行处理, 以Weber-Edsall缓冲溶液即肌动球蛋白的提取液为对照组。选择不同浓度(0、0.1、0.3、0.5、0.7 mmol · L-1) AMP进行试验。按式(2)处理试验数据, 可得到不同缓冲体系在不同pH值条件下, AMP与肌动球蛋白反应的结合常数(KLB)。由表 2可见:不同缓冲溶液, 在pH值为6.0~8.0环境下, 随pH值的变化, KLB的整体变化趋势与对照缓冲溶液趋势大致相同, 即缓冲溶液基本未改变KLB随pH变化的趋势。当pH值为5.0~5.5时, 由于体系不稳定, 因此, 不同缓冲溶液的体系结合常数也较不稳定。当pH值为6.0~8.0时, Tris-HCl缓冲溶液处理的体系KLB值较大, 且数值较稳定; 磷酸缓冲液的KLB值略大于对照组, 但变化趋势相对较大; 柠檬酸缓冲液条件下的KLB值略小于对照组。
| pH | KLB/(L·mol-1) | |||
| Weber-Edsall | Tris-HCl | 柠檬酸Citric acid | 磷酸Phosphoric acid | |
| 5.0 | 2 008.3±1.8 | 11 225.4±56.9 | 2 853.9±12.7 | 480.0±4.6 |
| 5.5 | 747.0±0.6 | 15 819.8±5.8 | 146.3±2.1 | 955.3±3.7 |
| 6.0 | 7 371.5±1.0 | 7 936.9±1.9 | 4 144.1±0.6 | 6 910.7±0.5 |
| 6.5 | 7 049.7±0.9 | 8 999.7±3.9 | 4 841.7±2.0 | 7 866.0±1.5 |
| 7.0 | 7 116.0±4.2 | 8 869.2±2.5 | 3 538.6±1.4 | 7 944.9±0.9 |
| 7.5 | 5 114.0±3.6 | 7 839.2±5.2 | 3 138.8±4.1 | 6 712.0±2.1 |
| 8.0 | 5 337.0±16.6 | 9 141.9±7.2 | 2 943.1±4.7 | 4 482.3±0.7 |
选取FeCl3/FeCl2、MgCl2、CaCl2、KCl和Na2SO4、NaCl、Na2CO3、NaNO2溶液, 选择不同浓度(0、0.1、0.3、0.5和0.7 mmol · L-1) AMP进行试验, 分别在各离子条件下, 研究AMP与肌动球蛋白的结合反应。按式(2)处理试验数据, 得出相关参数。由表 3可以看出:Fe3+/Fe2+和NO2-对体系影响明显, 在这两种环境下, 体系几乎无荧光。其他离子对体系也均有不同程度的影响, 其中Cl-增大了体系的结合力, 说明在一定条件下, Cl-可以促进AMP对肌动球蛋白的解离。
| 离子Ion | KLB/(L·mol-1) |
| SO42- | 2 983.1±3.1 |
| Cl- | 7 959.3±1.0 |
| CO32- | 5 774.6±3.5 |
| NO2- | - |
| CK | 7 116.0±4.2 |
| Ca2+ | 1 988.0±6.7 |
| Mg2+ | 3 311.1±1.5 |
| K+ | 4 616.0±2.1 |
| Fe3+/Fe2+ | - |
| 注: CK表示未加任何离子处理的对照组。CK represents treated controls without any added ion. “-”表示没有荧光。“-”represents no fluorescence. | |
本试验结果表明, pH值、反应时间、缓冲溶液及离子种类均对AMP-肌动球蛋白反应体系均有一定的影响, 促进或抑制AMP对肌动球蛋白的解离。
刘阳[15]发现在酸性环境中, 肌动球蛋白可能因酸诱导发生结构变化。在本试验中, 当pH值为5.0~5.5时, 肌动球蛋白处在酸性环境中, 氨基酸残基相互之间的距离增加, 共振能量转移降低, 使AMP-肌动球蛋白反应体系荧光强度降低。刘秀红[16]研究发现蛋白质处在等电点附近时, 蛋白质静电荷为零或很少, 分子间易发生聚集, 蛋白质较不稳定, 疏水基团外露, 使得溶解度大大降低。在此pH环境中, AMP-肌动球蛋白体系处在肌动球蛋白的等电点(pI为5.0~5.5)附近, 因此体系稳定性减弱, 肌动球蛋白和AMP的结合力下降。当pH值为7.5~8.0时, 随着pH值的增加, 肌动球蛋白所带的负电荷增加, 而和AMP相结合的作用力可能会由于静电斥力的存在而减弱, 所以结合常数减小, 体系稳定性减弱。当pH值为6.0~7.0时, 体系结合力最大, AMP更易于与肌动球蛋白结合, 且体系的稳定性最好。在此环境下, 用AMP处理肉制品, 会使肉制品的嫩度更佳。
本试验在柠檬酸和磷酸缓冲液环境下, AMP对肌动球蛋白的解离作用较差。而Tris-HCl缓冲溶液处理时, 结合力较大且较稳定, 说明在此环境下, 体系的构象可能保持相对稳定。因此, Tris-HCl缓冲溶液更有利于两者的互相结合, 促进AMP对肌动球蛋白的解离, 使肉品的嫩度得到较好的改善。
当离子与AMP-肌动球蛋白体系共存时, Fe3+/Fe2+和NO2-对肌动球蛋白和AMP的反应影响很大。推测可能是铁离子能和肌动球蛋白表面的羧基、氨基、咪基等侧链结合, 使体系产生大量絮状沉淀[17]。这2种离子的加入, 改变了蛋白质的结构, 使蛋白质沉淀变性, 从而使体系荧光消失[18]。Mg2+、Ca2+、K+对AMP-肌动球蛋白体系的结合力有减弱的作用, 根据王旭等[19]的研究分析, 可能是由于金属离子与肌动球蛋白作用时, 改变了肌动球蛋白与AMP结合的紧邻区域构型, 从而削弱了AMP与肌动球蛋白之间的结合。几种阴离子对体系的结合力也有不同程度的影响, 其中Cl-增大了AMP对肌动球蛋白反应的结合常数, 江波等[20]推断, 这可能是由于Cl-中和了肌动球蛋白表面的阳离子, 破坏了肌动球蛋白表面的保护水层, 从而增大了反应的表面积, 使得肌动球蛋白与AMP结合更充分, 分解能力增强。而当SO42-、CO32-和体系共存时, AMP对肌动球蛋白的结合常数减小, 因为离子和AMP竞争与肌动球蛋白的结合, 导致AMP与肌动球蛋白分子的作用面积减小, 表面的聚集作用减弱, 从而弱化了AMP与肌动球蛋白之间的反应, 同时在图谱中, 盐离子作为猝灭剂使得AMP-肌动球蛋白体系的荧光强度降低[21]。
本试验研究了不同因素对AMP和肌动球蛋白结合反应荧光光谱的影响, 推断不同条件对AMP和肌动球蛋白结合稳定性的影响, 进一步解析了AMP促进肌动球蛋白分解的相关机制, 为AMP改善肉品嫩度提供理论依据。
| [1] | 邓少颖, 王道营, 张牧焓, 等. Ca2+、ATP、ADP和AMP对鸭胸肉中肌动球蛋白解离的影响[J]. 食品科学, 2015, 36(3): 18–22. Deng S Y, Wang D Y, Zhang M H, et al. Actomyosin dissociation as influenced by Ca2+, ATP, ADP and AMP[J]. Food Science, 2015,36(3): 18–22. (in Chinese) |
| [2] | 王道营, 卞欢, 孙冲, 等. 肉品中肌动球蛋白解离原因及其与嫩度的关系[J]. 食品科技, 2015, 40(1): 145–148. Wang D Y, Bian H, Sun C, et al. The reason of actomyosin dissociation in meat and its relation with tenderness[J]. Food Science and Technology, 2015,40(1): 145–148. (in Chinese) |
| [3] | 董晗, 王道营, 张牧焓, 等. 不同加热温度对鸭肉肌动球蛋白解离的影响[J]. 食品工业科技, 2012(20): 120–124. Dong H, Wang D Y, Zhang M H, et al. Effect of different heating temperatures on liberation of actin from actomyosin in duck meat[J]. Science and Technology of Food Industry, 2012(20): 120–124. (in Chinese) |
| [4] | Pascal J M. DNA and RNA ligases:structural variations and shared mechanisms[J]. Current Opinion in Structural Biology, 2008,18(1): 96–105. DOI: 10.1016/j.sbi.2007.12.008 |
| [5] | Vinas P, Campillo N, Melgarejo G F, et al. Ion-pair high-performance liquid chromatography with diode array detection coupled to dual electrospray atmospheric pressure chemical ionization time-of-flight mass spectrometry for the determination of nucleotides in baby foods[J]. Journal of Chromatography A, 2010,1217: 5197–5203. DOI: 10.1016/j.chroma.2010.06.014 |
| [6] | 江崇球, 高明霞. 盐酸表阿霉素与牛血清白蛋白相互作用的研究及药物在血清与尿样中含量的测定[J]. 光谱学与光谱分析, 2003, 23(5): 937–940. Jiang C Q, Gao M X. Interaction of epirubicin with serum albumin and the determination of its content in serum and urine samples[J]. Spectroscopy and Spectral Analysis, 2003,23(5): 937–940. (in Chinese) |
| [7] | 王公轲, 席辉, 田芳, 等. 光谱和分子模拟法研究乙硫异烟胺与木瓜蛋白酶的分子作用机制[J]. 化学学报, 2011, 69(1): 95–100. Wang G K, Xi H, Tian F, et al. Mechanism of molecular interaction between ethionamide and papain:spectroscopic and molecular simulation investigations[J]. Acta Chimica Sinica, 2011,69(1): 95–100. (in Chinese) |
| [8] | 张淼, 王道营, 张牧焓, 等. 一磷酸腺苷与肌动球蛋白相互作用的荧光光谱研究[J]. 食品科学, 2016, 37(17): 1–6. Zhang M, Wang D Y, Zhang M H, et al. Fluorescence spectroscopy for the molecular interaction between adenosine 5'-monophosphate and actomyosin[J]. Food Science, 2016,37(17): 1–6. (in Chinese) |
| [9] | Wang N, Ye L, Zhao B Q, et al. Spectroscopic studies on the interaction of azelnidipine with bovine serum albumin[J]. International Journal of Pharmaceutics, 2008,351: 55–60. DOI: 10.1016/j.ijpharm.2007.09.016 |
| [10] | 杭州大学化学系分析化学教研室. 分析化学手册[M]. 北京: 化学工业出版社, 1997 . Analytical Chemistry Department of Hangzhou University. Analytical Chemistry[M]. Beijing: Chemical Industry Press, 1997 . (in Chinese) |
| [11] | Benjakul S, Visessanguan W, Aewsiri T, et al. Dissociation of natural actomyosin from kuruma prawn muscle induced bypyrophosphate[J]. Food Chemistry, 2007,102(1): 295–301. DOI: 10.1016/j.foodchem.2006.05.021 |
| [12] | Lakowicz J R. Principles of Fluorescence Spectroscopy[M]. New York: Plenum Press, 1983 : 278 -327. |
| [13] | 张爱梅, 王怀生, 罗玉会. 甲氨蝶呤与DNA相互作用的荧光光谱研究[J]. 分析测试学报, 2008, 27(1): 45–48. Zhang A M, Wang H S, Luo Y H. Study on the Interaction of methotrexate and DNA by fluorescence spectroscopy[J]. Journal of Instrumental Analysis, 2008,27(1): 45–48. (in Chinese) |
| [14] | Hu Y J, Liu Y, Zhang L X, et al. Studies of interaction between colchicine and bovine serum albumin by fluorescence quenching method[J]. Journal of Molecular Structure, 2005,750: 174–178. DOI: 10.1016/j.molstruc.2005.04.032 |
| [15] | 刘阳.心肌肌球蛋白的提纯及与柔红霉素作用的荧光研究[D].武汉:中南民族大学, 2007. Liu Y. Cardiac myosin purification and study on the interaction of daunorubicin by fluorescence spectroscopy[D]. Wuhan:Central University for Nationalities, 2007(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10524-2008012184.htm |
| [16] | 刘秀红.黄酮类药物小分子与血清蛋白间相互作用的光谱法研究[D].桂林:广西师范大学, 2007. Liu X H. Study on the interaction of flavonoids and serum protein by fluorescence spectroscopy[D]. Guilin:Guangxi Normal University, 2007(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10602-2007166619.htm |
| [17] | 郭明, 李慧东, 张璐颖, 等. Fe离子不同形态诱导血清蛋白质分子别构效应的比较分析研究[J]. 分子科学学报, 2013, 29(1): 31–36. Guo M, Li H D, Zhang L Y, et al. Comparison of the allosteric effects of serum protein molecules induced by different shaped Fe ion[J]. Journal of Molecular Science, 2013,29(1): 31–36. (in Chinese) |
| [18] | 王璋. 食品化学[M]. 北京: 中国轻工业出版社, 2009 . Wang Z. Food Chemistry[M]. Beijing: China Light Industry Press, 2009 . (in Chinese) |
| [19] | 王旭, 吴淑春, 王家学, 等. 水杨酸和牛血清白蛋白的相互作用研究及共存铜离子的影响[J]. 中国现代应用药学, 2013, 30(10): 1066–1070. Wang X, Wu S C, Wang J X, et al. Interaction of salicylic acid with bovine serum albumin and the effect of coexistent Cu2+ on the reaction[J]. Chinese Journal of Modern Applied Pharmacy, 2013,30(10): 1066–1070. (in Chinese) |
| [20] | 江波, 胡庆红. 十二烷基苯磺酸钠共振瑞利散射法测定蛋白质[J]. 分析试验室, 2002, 21(3): 27–30. Jiang B, Hu Q H. Determination of proteins by resonance rayleigh scattering with dodecyl benzene sodium sulfonate[J]. Chinese Journal of Analysis Laboratory, 2002,21(3): 27–30. (in Chinese) |
| [21] | 王少雄.人载脂蛋白H与磷脂膜的相互作用及其膜结合态构象的研究[D].北京:清华大学, 1999. Wang S X. Research on human apolipoprotein H interactions with phospholipid membranes and membrane-bound conformation[D]. Beijing:Tsinghua University, 1999(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10003-2002051634.htm |




