文章信息
- 潘寿, 骆乐, 刘小红, 王鸿萱, 徐国华
- PAN Shou, LUO Le, LIU Xiaohong, WANG Hongxuan, XU Guohua
- 氮素对水稻分蘖芽发育的影响及其作用机制
- Effects of nitrogen on rice tiller bud development and its mechanism
- 南京农业大学学报, 2016, 39(6): 973-978
- Journal of Nanjing Agricultural University, 2016, 39(6): 973-978.
- http://dx.doi.org/10.7685/jnau.201603049
-
文章历史
- 收稿日期: 2016-03-26
水稻是世界上最重要的粮食作物和经济作物之一, 全球以稻米为主食的人口占总人口的50%以上。中国人口众多, 作为占粮食总量44%的水稻能否正常生产是保证我国粮食安全的重要因素之一[1-2]。
对水稻产量的研究主要集中于单位面积的穗数、每穗实粒数和粒质量, 而单位面积的穗数与水稻植株的分蘖数量密切相关。揭示水稻分蘖生长的调控机制, 有助于对生产实践的指导, 从而提高粮食产量。分蘖是影响水稻穗数多少并进而影响单产的重要农艺性状之一, 是单子叶植物发育过程中形成的特殊分枝特性[3]。水稻分蘖可以分为两个主要过程, 即分蘖芽的形成和分蘖芽的伸长。水稻每个叶子基部内侧都会由侧生分生组织形成一个腋芽, 即分蘖芽。但在营养生长时期, 只有茎秆基部不伸长的节上的分蘖芽才会伸长, 最终形成一个独立的分蘖。
影响分蘖的因素有很多, 除自身遗传因素外, 营养条件、温度、光照、水分、种植密度等外界因素对水稻分蘖芽也有重要影响。营养元素中以氮素对分蘖的生长影响尤为明显。氮素是植物生长和发育所必需的大量元素之一。它不仅是氨基酸、核糖核酸、叶绿体、ATP和植物激素的重要组成部分, 还参与调控碳代谢、氨基酸代谢和蛋白质合成等生物学过程。在高等植物中, 氮素的缺乏严重影响植株的正常生长发育, 根部分枝增多, 产量降低[4-5]。氮素对水稻群体质量有显著影响, 对分蘖发生至关重要[6]。林贤青等[7]也证明了氮肥供应与水稻分蘖及成穗率密切相关。Brain等[8]认为, 氮素对植物生长发育的影响主要通过两个方面:营养水平和信号水平调节植物代谢发育。刘杨等[9]研究发现, 氮素调节水稻分蘖多少可能影响了细胞分裂素含量的变化, 增氮处理显著增加了分蘖节中细胞分裂素的含量。
氮素影响分蘖的现象已被广泛地认知, 然而, 氮素对水稻分蘖芽生长的调控研究还鲜有报道。本试验分别采用不同氮素浓度处理水稻, 测定水稻分蘖数, 观察分蘖芽是否形成, 检测分蘖芽活性情况, 旨在揭示氮素对水稻分蘖芽的发生和生长的影响机制, 从而为生产上氮素利用提供理论基础。
1 材料与方法 1.1 试验材料与设计试验于2015年在南京农业大学人工气候温室进行, 以水稻品种‘日本晴’(Nipponbare)、‘日本晴’背景的独角金内酯突变体dwarf 3(d3)和dwarf10(d10)为材料, 水稻无菌发芽, 出苗1周后移栽至中转箱中进行溶液培养(中转箱规格35 cm×24 cm×13 cm), 每个中转箱15棵苗, 每3 d换1次营养液。营养液采用国际水稻研究所(IRRI)建议的修正营养液(pH5.7)[10], 其中Fe 2+用Fe (EDTA-Na2)代替, 营养液中K+、Na+、Ca2+、Mg2+的浓度保持不变。培养条件为光照条件下温度30 ℃, 黑暗条件下24 ℃, 光照14 h, 黑暗10 h, 湿度为60%。移栽后, 进行不同氮素处理, 以硝酸铵为氮源, 浓度分别为0、0.2、2.5和5 mmol · L-1, 培养5周。
1.2 测定项目和方法 1.2.1 水稻分蘖数的测定对水稻根茎结合部进行观察, 统计分蘖的数目。分蘖数量以分蘖叶片是否伸出母叶叶鞘为准。移栽后连续培养4周, 对独角金内酯突变体材料及野生型进行分蘖数量的测定。
1.2.2 水稻分蘖芽原基的观察去除分蘖外侧的母叶叶鞘, 然后用显微镜进行观察拍照。野生型水稻每一片叶片内侧都有分蘖芽, 每去除一片叶片时进行拍照, 并找到相对应的分蘖芽进行拍照。
1.2.3 水稻分蘖芽长度的观察及测定去除分蘖外侧的母叶叶鞘, 然后用显微镜进行观察并拍照。第2分蘖芽、第3分蘖芽和第4分蘖芽分别用2nd分蘖芽、3rd分蘖芽和4th分蘖芽表示。拍完照后使用ImageJFree Software (https://imagej.nih.gov/ij/)测量分蘖芽的长度并进行数据分析。
1.2.4 水稻休眠与活跃分蘖芽基因表达量的测定在缺氮条件下, 3rd分蘖芽为休眠芽, 基本不伸长; 施加氮素条件下, 3rd分蘖芽为活跃分蘖芽, 由于伸长速度不一致, 分蘖芽伸长长度不一致, 取样时分为2组:小于0.5 cm和大于0.5 cm。将这3种分蘖芽部分组织分别取样进行RNA的提取、反转录和定量PCR, 以上均按照TaKaRa公司试剂盒说明书进行。使用ABI Step One Plus Real-Time PCR System进行检测。引物序列见表 1。
| 基因名称 Gene name |
基因号 Gene ID |
引物序列(5′→3′) Primer sequences |
| CYCD2;1 | Os07g0620800 | F:TTGCTACCCTGATGAGTTGC R:TTGCTACCCTGATGAGTTGC |
| His2A | Os05g0113900 | F:GAAGAAGACCGCGGAGAA R:TGAATGGAAGGACATGAAGC |
| UBQ | Os03g0234200 | F:CGCAAGAAGAAGTGTGGTCA R:CACGGTTCAACAACATCCAG |
采用Microsoft Excel 2007和SPSS 20.0软件进行数据分析处理和方差分析。
2 结果与分析 2.1 不同氮素浓度对水稻分蘖数量的影响由图 1可知:水稻品种‘日本晴’的分蘖数量随着氮素浓度的增加而增多。当氮素浓度增加至2.5 mmol · L-1时, 分蘖数量基本达到稳定。当氮素浓度增加到5 mmol · L-1时, 分蘖数增加不显著。0.2、2.5和5 mmol · L-1培养情况与不施加氮素相比, 分蘖数量在2周时分别增加了125%、175%和175%, 在3周时分别增加了130%、246%和277%, 在4周时分别增加了106%、273%和320%, 在5周时分别增加了120%、320%和340%。随着培养时间增加, 在缺氮的情况下, 分蘖数量也没有显著增加, 在0.2mmol · L-1氮素培养情况下3周后分蘖数量增长不明显。这些结果说明氮素浓度显著影响‘日本晴’的分蘖数量, 在缺氮的情况下, 未观察到分蘖明显伸长。
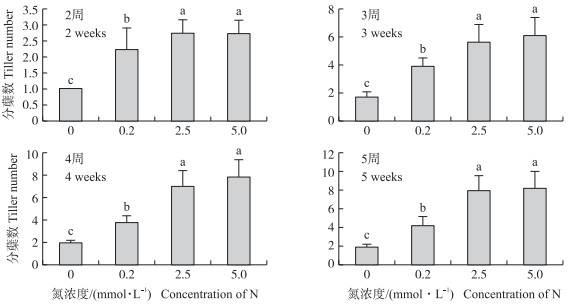
|
图 1 氮素浓度对水稻营养生长时期分蘖数量的影响 Figure 1 Effect of nitrogen concentration during vegetative stage on tiller number of rice 不同字母表示在0.05水平差异显著。The different letters mean significant difference at 0.05 level. n=8. |
图 2-A显示, 在水培5.5叶期时, 加氮情况下, 肉眼可观察到分蘖芽明显伸长; 不加氮情况下, 肉眼观察不到分蘖芽。不施加氮素的情况下, 4叶期时, 分蘖芽能够观察到(图 2-D), 且大小与加氮条件(图 2-B)下相似, 分蘖芽的分化形成并没有受到抑制。然而, 对比不加氮条件下发现:4叶期和5叶期水稻分蘖芽生长缓慢, 没有明显伸长(图 2-D和E)。施加氮素的情况下, 水稻分蘖芽的分化形成正常, 且5叶期水稻分蘖芽相比4叶期的有了明显伸长, 发育正常(图 2-B和C)。这些结果说明, 氮素浓度影响分蘖芽的伸长, 对分蘖芽的分化形成没有影响。
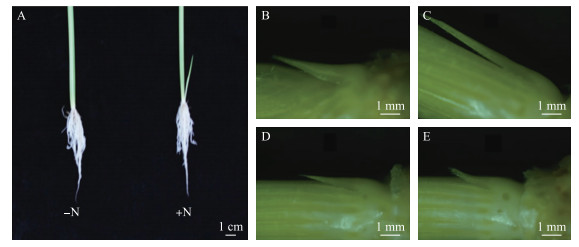
|
图 2 氮素对水稻分蘖形成的影响 Figure 2 Effect of nitrogen on buds formation of rice A.培养2周的水稻幼苗; B.加氮条件下4叶期分蘖芽; C.加氮条件下5叶期分蘖芽; D.缺氮条件下4叶期分蘖芽; E.缺氮条件下5叶期分蘖芽 A. Rice seedling grown for two weeks; B. Tiller bud at 4 leaves stage with nitrogen; C. Tiller bud at 5 leaves stage with nitrogen; D. Tiller bud at 4 leaves without nitrogen; E. Tiller bud at 5 leaves stage without nitrogen |
由图 3-A可知, 在水稻生长到4叶期的时候, 所有氮素浓度条件下水稻2nd和3rd分蘖芽生长情况基本一致, 都没有伸长的现象, 但是3rd分蘖芽长度比2nd分蘖芽明显增加, 预示3rd分蘖芽正在继续生长中。当水稻发育到5叶期时, 当浓度为2.5和5 mmol · L-1时, 3rd分蘖芽长度明显增加, 而2nd分蘖芽长度基本保持不变, 4th分蘖芽也没有明显伸长(图 3-B)。在5叶期时, 0和2.5 mmol · L-1氮素处理下, 2nd和4th分蘖芽长度没有显著差异, 3rd分蘖芽长度差异显著。这说明在该培养条件下, 加氮条件下3rd分蘖芽是活跃的分蘖芽, 而缺氮条件下3rd分蘖芽已经进入了休眠状态。结果说明:不同位置的分蘖芽处于不同的发育阶段, 并且对氮素的响应不同。
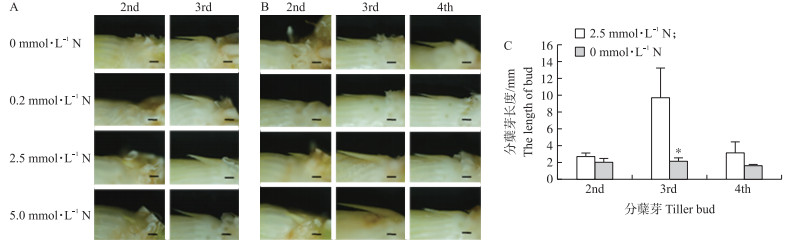
|
图 3 不同氮素浓度对不同部位分蘖芽伸长的影响
Figure 3 Effect of nitrogen concentration on tiller bud outgrowth
A.4叶期分蘖芽; B.5叶期分蘖芽; C.5叶期分蘖芽长度 A.Tiller bud at 4 leaves stage; B.Tiller bud at 5 leaves stage; C.Tiller buds length at 5 leaves stage 2nd、3rd和4th分别代表第2、第3和第4分蘖芽。2nd, 3rd and 4th resemble the tiller buds at 2nd, 3rd and 4th tiller bud, respectively. *P < 0.05, n=8. |
从图 4可知:停止生长的分蘖芽中, CYCD 2; 1和His2A表达量很低, 而活跃芽中, CYCD2; 1和His2A表达量都显著高于休眠芽中的表达量, 并且随着分蘖芽长度的增加而增加。结果表明:水稻分蘖芽在缺氮时停止生长, 细胞分裂停止。
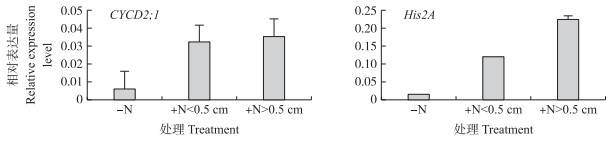
|
图 4 活跃芽和休眠芽基因表达分析 Figure 4 Expression analysis of active buds and dormant buds -N:缺氮条件下3rd分蘖芽3rd tiller bud without nitrogen; +N < 0.5 cm:施加氮素条件下, 长度小于0.5 cm的3rd分蘖芽3rd tiller bud length less than 5 cm with nitrogen; +N>0.5 cm:施加氮素条件下, 长度大于0.5 cm的3rd分蘖芽3rd tiller bud length more than 5 cm with nitrogen. n=3. |
独角金内酯参与调控水稻分蘖的生长, 并且特异影响水稻分蘖芽的伸长。为了明确独角金内酯是否参与氮素调控水稻分蘖芽伸长的过程, 对独角金内酯突变体d 3、d10和‘日本晴’分蘖芽数量进行测定。从图 5可知:独角金内酯突变体d 3、d10分蘖数显著高于‘日本晴’, ‘日本晴’和独角金内酯突变体d 3、d10分蘖的数量都会随着氮素浓度的增加而增多。这表明氮素对分蘖芽生长的调控不受独角金内酯途径影响, 即它们的调控途径相对独立。
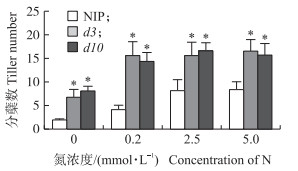
|
图 5 氮素浓度对NIP、d 3、d10分蘖数量的影响 Figure 5 Effect of nitrogen concentration on NIP, d 3, d10 tiller number NIP:日本晴Nipponbare; d 3:独角金内酯突变体dwarf 3 strigolactone mutant dwarf 3;d10:独角金内酯突变体dwarf 10 Strigolactone mutant dwarf 10. *P < 0.05, n=3. |
本试验中, 随着氮素浓度的增加, 水稻分蘖的数量也随之增加。有报道认为分蘖芽的发育受到多种环境因素的影响, 氮素营养是其中重要的因素[11]。氮素影响分蘖可能是间接的原因, 由于外界环境不同, 水稻吸收氮素的水平也不同, 导致水稻体内氮素含量也不同, 从而影响水稻分蘖发育; 某一叶片叶腋处的分蘖发生与否, 与某一叶位叶片、叶鞘氮素含量等密切相关[11]。本试验突出研究水稻分蘖芽的不同发育阶段。水稻分蘖芽的发育可分为两个阶段:分蘖的形成和伸长[3]。一般认为水稻分蘖数目是数量性状, 受到多基因控制, 并且很容易受到外界环境的影响。Li等[12]发现MOC 1基因控制侧生分生组织的形成, 缺失后表现出完全丧失分蘖芽形成的表型。Umehara等[13]发现控制分蘖芽伸长的关键是新型植物激素独角金内酯, 水稻d 3和d10突变体表现出矮化多分蘖的现象, 施加独角金内酯类似物GR24则分蘖减少, 因此独角金内酯对分蘖伸长起反向调节作用。进一步研究发现, 磷素影响分蘖的伸长, 并且通过诱导独角金内酯的合成来调控水稻分蘖的多少[14]。到目前为止, 氮素如何调控水稻的分蘖还不是很清楚。本研究中, 氮素影响水稻分蘖的伸长, 对水稻分蘖的形成没有影响, 这暗示了氮素影响分蘖与MOC1途径无关。Umehara等[15]认为磷素通过诱导独角金内酯合成从而影响水稻分蘖的多少, 而氮素是否影响独角金内酯还不明确。本研究对此也做了初步的分析, 发现不同氮素浓度处理下, d 3和d10分蘖数随着氮素浓度的增加而增多, 和野生型表现出一样的趋势, 这暗示着与磷素不同, 独角金内酯没有参与氮素调控水稻分蘖的伸长。
分蘖与叶片生长存在着同伸关系, 即主茎第i叶抽出时, i-3叶的分蘖也同时抽出[11]。丁艳锋[6]在研究氮素与分蘖的关系时, 提出某一叶位的分蘖芽与这一叶片叶鞘有密切关系。我们发现, 在供氮充足的条件下, 当第5片叶子完全伸出时, 3rd分蘖芽便显得很活跃; 而缺氮情况下, 则3rd分蘖芽完全休眠。我们没有观察到第6片叶子完全伸出, 而当水稻第5片叶子完全伸长时, 3rd分蘖芽处于极其活跃状态, 伸长趋势明显, 因此, 也能预期到第6片叶子完全伸出时, 3rd分蘖芽也会伸出。而不加氮素时, 分蘖芽完全休眠, 以至于不能生长, 也与丁艳锋[6]后期观察分蘖数较少的结果相符合。
本研究通过检测休眠芽与活跃芽中细胞分裂相关基因的表达, 发现休眠芽中细胞分裂相关基因表达明显受到抑制。CYCD 2; 1和His2A在休眠芽中表达较弱, 与Devitt等[16]和Shimizu等[17]和研究结果相符。因此, 细胞分裂可能参与了缺氮抑制分蘖伸长的过程。然而, 其中的调控途径还未见报道。氮素调控细胞分裂机制的研究对于生产实践有重要的价值, 该机制的揭示将有利于在生产中调控水稻分蘖芽的生长以及提高氮素的利用效率。
| [1] | 汤圣祥, 王中秋. 中国-国际水稻研究所科研合作结硕果[J]. 世界农业, 1998(2): 22–23. Tang S X, Wang Z Q. All scientific research cooperation between China and the International Rice Research Institute[J]. World Agriculture, 1998(2): 22–23. (in Chinese) |
| [2] | 胡培松, 翟虎渠, 万建民. 中国水稻生产新特点与稻米品质改良[J]. 中国农业科技导报, 2002, 4(4): 33–39. Hu P S, Zhai H Q, Wan J M. New characteristics of rice production and quality improvement in China[J]. Review of China Agricultural Science and Technology, 2002,4(4): 33–39. (in Chinese) |
| [3] | 李学勇, 钱前, 李家洋. 水稻分蘖的分子机理研究[J]. 中国科学院院刊, 2003, 18(4): 274–276. Li X Y, Qian Q, Li J Y. Progress in elucidating the molecular mechanism of rice tillering[J]. Bulletin of Chinese Academy of Sciences, 2003,18(4): 274–276. (in Chinese) |
| [4] | Stitt M, Krapp A. The interaction between elevated carbon dioxide and nitrogen nutrition:the physiological and molecular background[J]. Plant, Cell and Environment, 1999,22: 583–621. DOI: 10.1046/j.1365-3040.1999.00386.x |
| [5] | Good A G, Shrawat A K, Muench D G. Can less yield more? Is reducing nutrient input into the environment compatible with maintaining crop production?[J]. Trends in Plant Science, 2004,9(12): 597–605. DOI: 10.1016/j.tplants.2004.10.008 |
| [6] | 丁艳锋.氮素营养调控水稻群体质量指标的研究[D].南京:南京农业大学, 1997. Ding Y F. Regulations of rice population quality by nitrogen nutrition[D]. Nanjing:Nanjing Agricultural University, 1997(in Chinese with English abstract). http://www.oalib.com/references/17485268 |
| [7] | 林贤青, 朱德峰, 李春寿, 等. 水稻不同灌溉方式下的高产生理特性[J]. 中国水稻科学, 2005, 19(4): 328–332. Lin X Q, Zhu D F, Li C S, et al. Physiological characteristics of high yielding rice under different irrigation methods[J]. Chinese Journal of Rice Science, 2005,19(4): 328–332. (in Chinese) |
| [8] | Brian G F. Local and long-range signaling pathways regulating plant responses to nitrate[J]. Annual Review of Plant Biology, 2002,53(53): 203–204. |
| [9] | 刘杨, 王强盛, 丁艳锋, 等. 氮素和6-BA对水稻分蘖芽发育的影响及其生理机制[J]. 作物学报, 2009, 35(10): 1893–1899. Liu Y, Wang Q S, Ding Y F, et al. Effect of nitrogen and 6-BA on development of tilleringbud and its physiological mechanism[J]. Acta Agronomica Sinica, 2009,35(10): 1893–1899. DOI: 10.3724/SP.J.1006.2009.01893 (in Chinese) |
| [10] | 毛达如. 植物营养研究方法[M]. 北京: 北京农业大学出版社, 1994 : 16 . Mao D R. Methods of Plant Nutrition[M]. Beijing: Beijing Agricultural University Press, 1994 : 16 . (in Chinese) |
| [11] | 蒋彭炎, 马跃芳, 洪晓富, 等. 水稻分蘖芽的环境敏感期研究[J]. 作物学报, 1994, 20(3): 290–296. Jiang P Y, Ma Y F, Hong X F, et al. Studies on the sensitive stage to environment during differentiation and development of tiller buds in rice plant[J]. Acta Agronomica Sinica, 1994,20(3): 290–296. (in Chinese) |
| [12] | Li X Y, Qian Q, Fu Z, et al. Control of tillering in rice[J]. Nature, 2003,422(6932): 618–621. DOI: 10.1038/nature01518 |
| [13] | Umehara M, Hanada A, Yoshida S, et al. Inhibition of shoot branching by new terpenoid plant hormones[J]. Nature, 2008,455(7210): 195–200. DOI: 10.1038/nature07272 |
| [14] | Umehara M, Hanada A, Magome H, et al. Contribution of strigolactones to the inhibition of tiller bud outgrowth under phosphate deficiency in rice[J]. Plant and Cell Physiology, 2010,51(7): 1118–1126. DOI: 10.1093/pcp/pcq084 |
| [15] | Umehara M. Strigolactone, a key regulator of nutrient allocation in plants[J]. Plant Biotechnology, 2011,28(5): 429–437. DOI: 10.5511/plantbiotechnology.11.1109a |
| [16] | Devitt M L, Stafstrom J P. Cell cycle regulation during growth-dormancy cycles in pea axillary buds[J]. Plant Molecular Biology, 1995,29(2): 255–265. DOI: 10.1007/BF00043650 |
| [17] | Shimizu S, Mori H. Analysis of cycles of dormancy and growth in pea axillary buds based on mRNA accumulation patterns of cell cycle-related genes[J]. Plant and Cell Physiology, 1998,39(3): 255–262. DOI: 10.1093/oxfordjournals.pcp.a029365 |




