文章信息
- 胡亚亚, 邢路娟, 周光宏, 张万刚
- HU Yaya, XING Lujuan, ZHOU Guanghong, ZHANG Wangang
- 金华火腿粗肽液对PC12细胞氧化损伤的保护作用
- Antioxidant effects of crude peptides extracted from dry-cured Jinhua ham on PC12 cell injury
- 南京农业大学学报, 2016, 39(5): 852-857
- Journal of Nanjing Agricultural University, 2016, 39(5): 852-857.
- http://dx.doi.org/10.7685/jnau.201601032
-
文章历史
- 收稿日期: 2016-01-15
自由基是生物体在氧化代谢活动中产生的, 它包括羟自由基(·OH)、超氧阴离子自由基(O2·)、过氧化氢(H2O2)和NO等[1]。自由基化学性质活泼, 低浓度时在机体内可发挥重要作用, 如作为细胞信号[2], 但过量则会导致细胞组织受到氧化胁迫, 引起细胞和机体的损伤[3]。很多研究表明机体内过量的自由基和氧化应激与许多慢性病如冠心病、阿尔兹海默病和某些癌症的发病都存在一定的关系[4]。目前, 合成抗氧化剂已广泛应用于现代食品工业, 一些人工合成的抗氧化剂如丁基羟基茴香醚(BHA)和特丁基对苯二酚(TBHQ)虽然能抑制油脂氧化, 但这些物质具有一定的副作用, 会威胁人体健康[5]。因此越来越多的研究学者关注于寻求高效、安全的天然抗氧化剂[6]。
PC12细胞是大鼠肾上腺嗜铬瘤分化细胞株, 具有神经内分泌细胞的一般特征, 是体外神经细胞损伤保护作用研究使用的最为广泛的细胞系[7]。近年来有许多研究使用PC12细胞作为体外模型研究氧化应激与抗氧化剂关系的报道[8-9]。过氧化氢被认为是机体内高活性自由基的主要前体物质[9], 因此本研究选择过氧化氢来诱导PC12细胞产生氧化应激。
金华火腿与如皋火腿、宣威火腿并称为中国三大火腿, 它也是我国最著名的传统肉制品, 需要加工8~10个月, 在此过程中, 蛋白质发生强烈降解, 生成许多肽类物质[10]。Zhu等[11]用盐酸溶液从金华火腿中提取分离具有抗氧化活性的短肽, 其中序列为Gly-Lys-Phe-Asn-Val的五肽抗氧化活性最强。Xing等[12]从宣威火腿中提取分离出水溶性的抗氧化多肽, 其中序列为Asp-Leu-Glu-Glu的四肽被认为是最主要的抗氧化肽。本课题前期研究表明金华火腿粗肽液在体外有很强清除自由基能力、还原力、螯合Fe2+能力和总抗氧化能力[13], 而缺乏对抗氧化肽在细胞水平上的研究, 本文结合其在体外抗氧化体系中的活性, 通过建立PC12细胞氧化损伤体外模型, 探讨金华火腿粗肽液对PC12细胞氧化损伤的保护作用与机制。
1 材料与方法 1.1 材料与试剂金华火腿购自浙江省金字火腿食品有限公司; 还原型谷胱甘肽(GSH)、吩嗪甲酯硫酸盐(PMS)和还原型辅酶(NADH)均购自Sigma公司; 邻苯二甲醛、β-巯基乙醇、氢氧化钠、乙醇、磷酸二氢钠和磷酸氢二钠均购自国药集团化学试剂公司; 其他试剂均为分析纯。
1.2 仪器与设备HH-W恒温水浴箱购自恒丰仪器制造有限公司; T25匀浆机购自德国IKA公司; Spectral Max M2e酶标仪购自美国伯腾仪器有限公司; Avanti J-E高速离心机购自美国Beckman Coulter公司。
1.3 试验方法 1.3.1 样品处理火腿按照传统加工工艺加工, 包括腌制(1个月)、浸泡和洗刷(20~24 h)、整形、晒腿(7~15 d)、成熟(6~8个月)和后熟(2个月)等过程。随机选取后熟结束的6块火腿, 取股二头肌编号, 在分析测试前于-20 ℃冰柜保存。
1.3.2 粗肽的提取参照王娟等[14]的方法, 并稍作修改。具体操作为:取后熟结束的成品股二头肌25 g, 绞碎后加入100 mL磷酸缓冲液(pH7.0), 冰浴匀浆4次(22 000 r·min-1, 每次10 s)。匀浆液于4 ℃条件下静置2 h后离心(4 ℃, 12 000 g, 20 min)。离心完毕后, 取上清液加入3倍体积40%(体积分数)乙醇, 放置12 h后再次离心(4 ℃, 12 000 g, 20 min), 所得上清液用1 mol·L-1氢氧化钠调节至pH7.0。上清液经冷冻干燥后置于-20 ℃保存备用。
1.3.3 尺寸排阻色谱分离用去离子水平衡凝胶层析柱(5 cm×60 cm), 填料为葡聚糖凝胶树脂Sephadex G-25, 流速为4 mL·min-1。将粗肽液溶于去离子水配置成1 mg·mL-1的溶液, 上样量为4 mL, 用去离子水进行洗脱(洗脱流速为4 mL·min-1), 检测波长为280 nm。分别对每个分离组分进行收集, 冷冻干燥。
1.3.4 超氧阴离子自由基(O2·)清除率的测定清除O2·采用硝基四氮唑蓝还原法, 参照Liu等[15]的方法并稍作修改。用50 mmol·L-1的Tris-HCl(pH8.0)缓冲液将经过尺寸排阻色谱分离的各个组分粗肽液, 分别配制成质量浓度为0.5、1、2和4 mg·mL-1, 并以相应质量浓度的GSH为对照。取1.5 mL肽液, 依次加入0.5 mL 300 μmol·L-1 NBT(用pH8.0的Tris-HCl缓冲液配制), 0.5 mL 468 μmol·L-1 NADH(用pH8.0的Tris-HCl缓冲液配制)和0.5 mL 60 μmol·L-1 PMS(用pH8.0的Tris-HCl缓冲液配制), 立即混匀, 并于25 ℃水浴5 min后, 560 nm波长处测定吸光值。样品组的吸光值记为A样品, 以缓冲液代替样品的空白对照组记为A0。各浓度组的超氧阴离子自由基清除率=(1-A样品/A0)×100%。
1.3.5 细胞存活率测定细胞培养参考凌玉芳[16]的方法, 并稍作改动。PC12细胞在含10%胎牛血清的DMEM高糖培养基, 在37 ℃ 5% CO2饱和湿度的培养箱培养。细胞壁长成致密单层时(约为70%~80%), 分瓶扩大培养。
细胞存活率测定参照Su等[17]的方法, 并稍作改动。将处于对数生长期的细胞, 用0.25%的胰蛋白酶消化收集, 吹打成单细胞悬液后接种于96孔板, 放入培养箱中培养。终止培养前每孔加入MTT(终质量浓度为0.5 mg·mL-1), 放入培养箱中继续培养4 h后, 弃旧培养液, 每孔加入150 μL DMSO, 于摇床上振荡10 min完全溶解紫色结晶后, 酶标仪测定563 nm处吸光值。以对照组的细胞存活率为100%, 试验组细胞存活率=试验组D563值/对照组D563值×100%。
1.3.6 试验分组及处理试验分为4组, 每组4个重复。对照组:正常细胞组; 损伤组:细胞培养24 h后, 用400 μmol·L-1 H2O2处理, 继续培养至48 h; 200和400 μg·mL-1样品处理组:细胞培养24 h后, 分别用200与400 μg·mL-1多肽液和400 μmol·L-1 H2O2处理细胞, 继续培养至48 h。之后分别收集每组细胞和细胞培养上清液。
1.3.7 细胞MDA含量、LDH渗漏率及CAT、SOD和GSH-Px活性测定按照南京建成生物工程研究所生产的试剂盒说明书分别测定MDA含量、LDH渗漏率及CAT、SOD和GHS-Px活性。
1.4 数据处理采用SAS 8.1软件进行统计分析, 用单因素方差分析(one-way analysis of variance, ANOVA)方法进行方差分析, 采用Duncan′s multiple range test进行多重比较, 显著水平设为P < 0.05。试验重复3次。
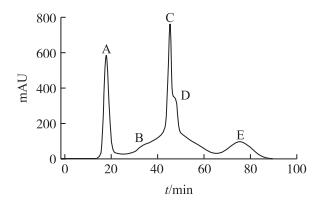
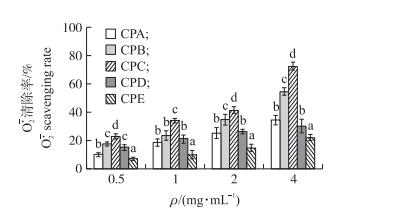
2 结果与分析 2.1 金华火腿粗肽液的分离纯化本试验采用葡聚糖凝胶层析法, 根据分子质量大小的不同对金华火腿粗肽液进行初步分离, 最终将金华火腿粗肽液分为5个组分(CPA、CPB、CPC、CPD和CPE)。如图 1所示:组分A的保留时间最短, 代表其分子质量最大, 而组分E的保留时间最长, 代表其分子质量最小。由图 2可以看出:5个组分清除超氧阴离子自由基的能力随着质量浓度的增大逐渐增加, 并存在明显的剂量效应关系。在质量浓度为4 mg·mL-1时, 组分CPC的清除能力达到了72.89%, 接着是组分CPB(55.98%)、组分CPA(34.33%)、组分CPD(30.13%)和组分CPE(21.03%)。综上所述, 本研究选取清除自由基能力最高的组分CPC进行下一步试验。
|
图 1 凝胶层析法分离金华火腿粗肽液 Figure 1 Size-exclusion chromatography of peptides from Jinhua ham A:CPA; B:CPB; C:CPC; D:CPD; E:CPE |
|
图 2 不同组分清除超氧阴离子自由基的能力 Figure 2 Measurement of superoxideanion radical scavenging activity of peptides from Jinhua ham 不同小写字母表示差异显著(P < 0.05)。Different lowercase letters indicate significant difference at 0.05 level. The same as follows. |
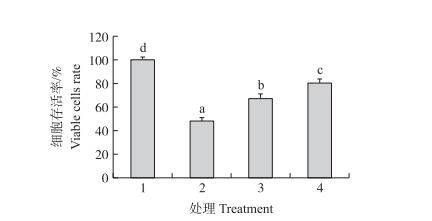
如图 3所示:过氧化氢处理后, 损伤组细胞存活率显著下降(P < 0.05), 降至48.19%。当细胞经过多肽预处理后, 与损伤组相比细胞存活率随着多肽浓度的增加而增加, 在质量浓度为200和400 μg·mL-1时, 细胞存活率分别达到67.44%和80.23%。
|
图 3 金华火腿粗肽组分CPC对H2O2氧化损伤PC12细胞存活率的影响 Figure 3 Effects of CPC on the cell viability of PC12 cells exposed to H2O2 1.对照组Control group; 2.损伤组Damage group; 3.200 μg·mL-1 CPC+400 μmol·L-1 H2O2; 4.400 μg·mL-1 CPC+400 μmol·L-1 H2O2. The same as follows. |
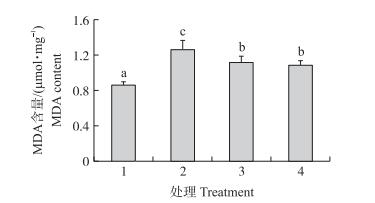
如图 4所示:损伤组MDA含量比对照组显著增加, 说明经过H2O2处理后细胞内脂质氧化程度增加; 而经过CPC预处理的样品保护组, MDA含量显著降低。其中400 μg·mL-1 CPC处理组的MDA含量为(1.08±0.05)μmol·mg-1。
|
图 4 CPC对H2O2氧化损伤细胞MDA含量的影响 Figure 4 Effect of CPC on the level of MDA in PC12 cells exposed to H2O2 |
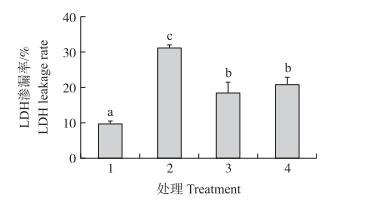
由图 5可知:经过过氧化氢处理后, LDH渗漏率升至(31.16±0.35)%, 说明细胞完整性受到破坏, 细胞内大量的LDH被释放至细胞外; 而经过200和400 μg·mL-1 CPC处理后, 分别降至(18.48±3.12)%和(20.73±2.24)%, 细胞LDH渗漏率显著下降。
|
图 5 CPC对H2O2氧化损伤细胞LDH渗漏率的影响 Figure 5 Effects of CPC on the leakage rate of LDH in PC12 cells exposed to H2O2 |
如表 1所示:与对照组相比, 经过过氧化氢处理后的CAT、SOD和GSH-Px活性均显著下降。在经过CPC预处理的保护组, 随着样品浓度的升高, 3种酶的活性均有不同程度提高, 呈现明显的剂量效应关系。尤其在CPC质量浓度为400 μg·mL-1时, 3种酶的活性比对应损伤组均有显著升高。
| 处理 Treatment |
CAT活性/(U·mg-1) CAT activity |
SOD活性/(U·mg-1) SOD activity |
GSH-Px活性/(U·mg-1) GSH-Px activity |
| 对照组Control group | 655.77±28.73d | 31.16±2.09d | 43.47±3.34d |
| 损伤组Damage group | 277.23±37.68a | 9.70±0.20a | 23.61±3.64a |
| 200 μg·mL-1 CPC+400 μmol·L-1 H2O2 | 322.79±22.40b | 16.19±3.71b | 27.82±1.57b |
| 400 μg·mL-1 CPC+400 μmol·L-1 H2O2 | 490.38±33.84c | 23.56±2.02c | 32.59±1.92c |
目前, 对于抗氧化多肽对细胞保护的作用有一些报道。Kong等[18]将乳清蛋白酶解物通过Sephadex G-10凝胶色谱柱和反向高效液相色谱纯化后得到了P4c, 将纯化的肽段应用于细胞氧化损伤保护作用研究中, 结果表明加入纯化的P4c肽段后, MRC-5细胞存活率明显提高。陈志飞[19]以蛋清源五肽为研究对象, 发现五肽WNWAD的氧化应激抑制活性最强, 显著提高HEK 293细胞存活率。本研究中, 过氧化氢处理后的对照组细胞存活率降至48.19%, 当细胞经过400 μg·mL-1多肽预处理后, 细胞存活率达到80.23%, 说明多肽液可以显著提高氧化损伤细胞的存活率。金华火腿在发酵过程中产生了大量的多肽[20], 这些多肽经体外抗氧化试验证明具有良好的抗氧化活性, 它们的抗氧化作用可能是淬灭过氧化氢在细胞内经代谢产生的氧自由基阻止了自由基对细胞的进一步损伤, 从而在一定程度上提高了细胞存活率。
机体内过量自由基会攻击并破坏细胞膜中的不饱和脂肪酸, 导致脂质过氧化, 进而引起细胞损伤。MDA是脂质过氧化反应的产物之一, 因而可以用来反映机体内脂质过氧化的程度, 间接反映细胞损伤的程度[21]。LDH是一种广泛存在于细胞质内的糖酵解酶, 一般情况下, LDH稳定存在于细胞质内。细胞受损的一个敏感指标是LDH水平的升高, 即当细胞培养上清液中LDH含量增加, 则说明细胞已经损伤、细胞膜通透性增加[22]。因此胞质中LDH渗漏至膜外的量可以反映细胞受损的程度。本研究结果显示, 过氧化氢处理后的细胞MDA含量和LDH渗漏率上升, 说明细胞受到了严重损伤, 这与付余等[23]对鲑鱼皮明胶水解物对细胞氧化损伤的保护作用的研究结果一致。而经不同质量浓度粗肽液CPC预处理的细胞, 其MDA含量、LDH渗漏率均有所降低, 但是200和400 μg·mL-1两组间差异不显著, 这可能是由于粗肽液中的杂质干扰, 随着浓度的升高, 对抗氧化活力的影响增大。综上所述, 粗肽液CPC在一定程度上抑制了细胞内的脂质过氧化作用, 维持细胞膜完整性, 从而减轻氧自由基介导的细胞膜结构与功能的损伤。
CAT、SOD和GSH-Px是细胞抗氧化防御系统中酶类物质的重要组成部分, 对机体内的氧化与抗氧化的动态平衡有重要作用。Hwang等[24]的研究表明, 过氧化氢对细胞内抗氧化酶系统有破坏作用。Jia等[25]对黑加仑提取物抗氧化研究中, 通过分析CAT、SOD、GSH-Px等指标的变化来评价抗氧化提取物对氧化损伤MRC-5细胞的保护作用。本研究表明:经过过氧化氢处理后的3种酶活性和对照组相比, 均显著下降, 说明抗氧化酶系统被破坏, 而在经过CPC预处理的保护组, 随着样品浓度的升高, 3种酶的活性均有不同程度提高, 呈现明显的剂量效应关系。表明CPC进入细胞后通过抗氧化生理功能, 清除了部分自由基, 维持了细胞抗氧化系统的正常运行, 进而阻止了过氧化氢对细胞的进一步损伤。
综上所述, 金华火腿粗肽液可能是通过提高细胞清除自由基的能力, 减少脂质过氧化产物MDA的生成, 防止细胞膜磷脂分子中的不饱和脂肪酸过氧化, 维持细胞膜完整性, 提高CAT、SOD和GSH-Px的活性, 从而对氧化应激中的PC12细胞起到保护作用, 但这种保护作用的具体分子生物学机制及其在体内的抗氧化机制还有待进一步的深入研究。
| [1] | 王璐莎, 陈玉连, 黄明, 等. 鸭肉蛋白酶解产物的抗氧化特性[J]. 食品科学, 2015, 36(17): 146–151. Wang L S, Chen Y L, Huang M, et al. Antioxidant activities of protein hydrolysates from duck meat[J]. Food Science, 2015,36(17): 146–151. (in Chinese) |
| [2] | Sarmadi B H, Ismail A. Antioxidative peptides from food proteins:a review[J]. Peptides, 2010,31(10): 1949–1956. DOI: 10.1016/j.peptides.2010.06.020 |
| [3] | 陈慧婵, 裴斐, 杨文建, 等. 金针菇、香菇和蛹虫草对小鼠体内抗氧化酶活性的影响[J]. 食品科学, 2014, 35(1): 219–223. Chen H C, Pei F, Yang W J, et al. Effects of Flammulina velutipes, Lentinula edodes and Cordyceps militaris on antioxidative enzyme activities in mice[J]. Food Science, 2014,35(1): 219–223. (in Chinese) |
| [4] | Halliwell B. Oxidants and the central nervous system:some fundamental questions. Is oxidant damage relevant to Parkinson's disease, Alzheimer's disease, traumatic injury or stroke?[J]. Acta Neurologica Scandinavica, 1989,80(126): 23–33. |
| [5] | Kmiecik D, Korczak J, Rudzińska M, et al. Stabilisation of phytosterols by natural and synthetic antioxidants in high temperature conditions[J]. Food Chemistry, 2015,173: 966–971. DOI: 10.1016/j.foodchem.2014.10.074 |
| [6] | 邢路娟, 胡亚亚, 周光宏, 等. 宣威火腿中粗肽的提取与抗氧化活性鉴定[J]. 南京农业大学学报, 2015, 38(4): 661–666. Xing L J, Hu Y Y, Zhou G H, et al. The extraction and antioxidant activities of crude peptides from Xuanwei ham[J]. Journal of Nanjing Agricultural University, 2015,38(4): 661–666. DOI: 10.7685/j.issn.1000-2030.2015.04.021 (in Chinese) |
| [7] | 李朝晖, 王芬, 刘水平, 等. 过氧化氢诱导PC12细胞损伤的模型的建立[J]. 法医学杂志, 2007, 23(3): 191–195. Li Z H, Wang F, Liu S P, et al. Establishment of PC12 cell injury model induced by H2O2[J]. Journal of Forensic Medicine, 2007,23(3): 191–195. (in Chinese) |
| [8] | 王世博, 邱景富, 白群华, 等. 黄芪甲苷对H2O2致PC12细胞氧化应激损伤的保护作用[J]. 中国药理学通报, 2011, 27(11): 1603–1609. Wang S B, Qiu J F, Bai Q H, et al. A study on protection of astragaioside Ⅳ about oxidative stress on PC12 cells induced by H2O2[J]. Chinese Pharmacological Bulletin, 2011,27(11): 1603–1609. (in Chinese) |
| [9] | 刘红亮, 胡磊, 王靖凯, 等. 槲皮素对H2O2损伤PC12细胞的保护效果与机制[J]. 中国药理学通报, 2014, 30(3): 373–377. Liu H L, Hu L, Wang J K, et al. Protective effects of quercetin on PC12 cells with H2O2-induced oxidative damage[J]. Chinese Pharmacological Bulletin, 2014,30(3): 373–377. (in Chinese) |
| [10] | Zhou G H, Zhao G M. History and heritage of Jinhua ham[J]. Animal Frontiers, 2012,2(4): 62–67. DOI: 10.2527/af.2012-0063 |
| [11] | Zhu C Z, Zhang W G, Zhou G H, et al. Isolation and identification of antioxidant peptides from Jinhua ham[J]. Journal of Agricultural and Food Chemistry, 2013,61(6): 1265–1271. DOI: 10.1021/jf3044764 |
| [12] | Xing L J, Hu Y Y, Hu H Y, et al. Purification and identification of antioxidative peptides from dry-cured Xuanwei ham[J]. Food Chemistry, 2016,194: 951–958. DOI: 10.1016/j.foodchem.2015.08.101 |
| [13] | 胡亚亚, 邢路娟, 周光宏, 等. 不同提取方法对金华火腿粗肽液抗氧化活性的影响[J]. 食品工业科技, 2015, 36(14): 115–118. Hu Y Y, Xing L J, Zhou G H, et al. Effect of extraction methods on the antioxidant activity of crude peptides from Jinhua ham[J]. Science and Technology of Food Industry, 2015,36(14): 115–118. (in Chinese) |
| [14] | 王娟, 赵改名, 张建威, 等. 金华火腿中小肽的分离纯化及结构研究[J]. 食品科学, 2012, 33(9): 16–20. Wang J, Zhao G M, Zhang J W, et al. Separation, purification and structural identification of small peptides from Jinhua ham[J]. Food Science, 2012,33(9): 16–20. (in Chinese) |
| [15] | Liu F, Ooi V E C, Chang S T. Free radical scavenging activities of mushroom polysaccharide extracts[J]. Life Sciences, 1997,60(10): 763–771. DOI: 10.1016/S0024-3205(97)00004-0 |
| [16] | 凌玉芳.乳清蛋白酶解物对过氧化氢诱导的氧化损伤的保护作用[D].无锡:江南大学, 2011. Ling Y F. Protective effect of whey protein hydrolysates on hydrogen peroxide-induced oxidative damage[D]. Wuxi:Jiangnan University, 2011(in Chinese with English abstract). http://cdmd.cnki.com.cn/article/cdmd-10295-1011082522.htm |
| [17] | Su M Y, Huang H Y, Li L, et al. Protective effects of 2', 4'-dihydroxy-6'-methoxy-3', 5'-dimethylchalcone to PC12 cells against cytotoxicity induced by hydrogen peroxide[J]. Journal of Agricultural and Food Chemistry, 2010,59(2): 521–527. |
| [18] | Kong B, Peng X, Xiong Y L, et al. Protection of lung fibroblast MRC-5 cells against hydrogen peroxide-induced oxidative damage by 0.1-2.8 kDa antioxidative peptides isolated from whey protein hydrolysate[J]. Food Chemistry, 2012,135(2): 540–547. DOI: 10.1016/j.foodchem.2012.04.122 |
| [19] | 陈志飞.蛋清抗氧化肽对HEK293细胞氧化应激损伤的抑制作用及机制研究[D].长春:吉林大学, 2015. Chen Z F. The anti-oxidative effects and mechanism of antioxidant peptides from egg white against oxidative stress injury in human embryonic kidney 293 cells[D]. Changchun:Jilin University, 2015(in Chinese with English abstract). http://cdmd.cnki.com.cn/article/cdmd-10183-1015599683.htm |
| [20] | Zhou G H, Zhao G M. Biochemical changes during processing of traditional Jinhua ham[J]. Meat Science, 2007,77(1): 114–120. DOI: 10.1016/j.meatsci.2007.03.028 |
| [21] | Janero D R. Malondialdehyde and thiobarbituric acid-reactivity as diagnostic indices of lipid peroxidation and peroxidative tissue injury[J]. Free Radical Biology and Medicine, 1990,9(6): 515–540. DOI: 10.1016/0891-5849(90)90131-2 |
| [22] | Chandra J, Samali A, Orrenius S. Triggering and modulation of apoptosis by oxidative stress[J]. Free Radical Biology and Medicine, 2000,29(3): 323–333. |
| [23] | 付余, 赵新淮. 鲑鱼皮明胶水解物的抗氧化活性及其对细胞氧化损伤的保护作用[J]. 食品工业科技, 2013, 34(5): 113–117. Fu Y, Zhao X H. Antioxidant activity of gelatin hydrolysates derived from salmon(Oncorhynchus keta)skin and their cytoprotective effect on oxidative injury of rat hepatocytes[J]. Science and Technology of Food Industry, 2013,34(5): 113–117. (in Chinese) |
| [24] | Hwang S L, Yen G C. Modulation of Akt, JNK, and p38 activation is involved in citrus flavonoid-mediated cytoprotection of PC12 cells challenged by hydrogen peroxide[J]. Journal of Agricultural and Food Chemistry, 2009,57(6): 2576–2582. DOI: 10.1021/jf8033607 |
| [25] | Jia N, Li T, Diao X, et al. Protective effects of black currant(Ribes nigrum L.)extract on hydrogen peroxide-induced damage in lung fibroblast MRC-5 cells in relation to the antioxidant activity[J]. Journal of Functional Foods, 2014,11: 142–151. DOI: 10.1016/j.jff.2014.09.011 |




