文章信息
- 许伟, 范梦雪, 孟婷婷, 胡文娟, 宫佳杰, 陈晓芳, 姜云晶, 朱电峰, 冯士彬, 李玉, 吴金节, 王希春
- XU Wei, FAN Mengxue, MENG Tingting, HU Wenjuan, GONG Jiajie, CHEN Xiaofang, JIANG Yujing, ZHU Dianfeng, FENG Shibin, LI Yu, WU Jinjie, WANG Xichun
- 脱氧雪腐镰刀菌烯醇对PC12细胞凋亡的影响
- Effect of deoxynivalenol on apoptosis of PC12 cells
- 南京农业大学学报, 2016, 39(5): 838-844
- Journal of Nanjing Agricultural University, 2016, 39(5): 838-844.
- http://dx.doi.org/10.7685/jnau.201510024
-
文章历史
- 收稿日期: 2015-10-18
脱氧雪腐镰刀菌烯醇(deoxynivalenol, DON)是一种常见的单端孢霉烯族类毒素, 广泛污染谷物类产品, 如小麦、大麦、玉米等, 在世界范围内均有报道[1-2]。动物食用了被DON污染的饲料, 多出现呕吐症状, 故其又被称为呕吐毒素(vomitoxin, VT)。DON中毒是指动物采食被该毒素污染的饲粮而出现厌食、呕吐、发热、反应迟钝等特征性中毒症状。DON的毒性效应有着种属差异性, 不同的动物对其敏感程度不同, 其中猪最敏感[3]。DON的理化性质非常稳定, 对热有很强的耐受性。因此, 被DON污染的谷物产品经过二次加工进入食物链, 仍可危害人和动物的健康。
DON对人和畜禽具有神经毒性、免疫毒性、生殖和发育毒性以及“三致”毒性等[3]。此外, DON还有很强的细胞毒性, 主要表现在细胞形态改变, 细胞膜破裂, DNA损伤, 抑制蛋白质的合成以及促进凋亡基因的表达等[4-6]。由于神经系统的复杂性, 人们对DON的神经毒性的认识目前仍处于探索阶段。另外, 关于DON对神经细胞毒性的体外研究鲜有报道。
PC12细胞是从大鼠肾上腺嗜铬细胞瘤克隆的细胞株, 具有神经内分泌细胞的一般特征, 且具有稳定传代的特点, 是一种优良的神经细胞模型。广泛应用于神经生理、病理和药理学等研究[7]。目前关于DON诱导神经细胞凋亡及相关基因和蛋白表达水平影响的研究少见报道。因此, 本试验选择PC12细胞作为研究对象, 了解DON对细胞凋亡相关基因Bcl-2 、Bax、Bid及凋亡蛋白Caspase3、Caspase9表达水平的影响, 旨在从细胞和分子水平探讨DON诱导PC12细胞凋亡的作用机制, 为丰富DON神经毒性的研究提供试验依据。
1 材料与方法 1.1 试验材料和仪器PC12细胞, 南京凯基生物科技发展有限公司; BB-15 CO2培养箱, 美国Thermo公司; XDS-1倒置显微镜, 重庆光电仪器有限公司; TEOL-2010高分辨率电子透射显微镜, 日本电子株式会社; 流式细胞仪, 美国BD公司; TC-XP基因扩增仪, 杭州博日科技有限公司; 荧光定量PCR仪, Life Technologies; DON, Sigma公司; 胎牛血清(FBS), 美国CLARK公司; DMEM培养基, 美国Hyclone公司; Annexin V-FITC/PI凋亡检测试剂盒, 沈阳万类生物科技有限公司; cleaved-Caspase 3抗体、cleaved-Caspase 9抗体, 美国CST公司; β-actin小鼠单克隆抗体, 北京锐抗生物科技有限公司; Trizol RNA提取试剂盒, 大连宝生物工程有限公司; SYBR qPCR Mix, 美国Biomiga公司; First Strand cDNA Synthesis Kit, 日本TOYOBO公司; ECL化学发光试剂盒, 美国Thermo公司。
1.2 细胞培养和分组将PC12细胞接种于5 cm×5 cm培养瓶中, 在37 ℃、5%浓度CO2培养箱中培养, 使用含10% FBS、100 U·mL-1青霉素以及100 mg·L-1链霉素的DMEM高糖培养基。
将1 mg DON溶于1 mL培养基中, 配成浓度为1 mg·mL-1的DON母液。用培养基继续将DON稀释成125、250、500、1 000和2 000 ng·mL-1。将处于对数生长期的PC12细胞(5×105 mL-1)接种于六孔板培养24 h, 以不同质量浓度的DON(0、125、250、500、1 000和2 000 ng·mL-1)处理24 h, 收集细胞用于形态学观察和细胞凋亡、Bcl-2 、Bax、Bid等mRNA水平及Caspase 3、Caspase 9蛋白等表达情况的检测。
1.3 形态学观察分别用0、125、250、500、1 000和2 000 ng·mL-1的DON处理细胞24 h后, 在倒置显微镜下观察DON对细胞形态的损伤情况, 并收集各浓度DON处理后的细胞, 2.5%戊二醛固定后进行电镜切片制样。
1.4 细胞凋亡检测细胞凋亡率采用Annexin V-FITC/PI试剂盒测定。将DON(每组3个重复)处理24 h后的细胞制成细胞悬液。用PBS洗涤2次, 收集细胞沉淀, 向细胞沉淀中加入500 μL binding buffer重悬细胞, 依次加入5 μL Annexin V-binding和5 μL PI(propidium iodide)。室温反应5~15 min后用流式细胞仪检测。
1.5 Bcl-2 、Bax、Bid mRNA表达水平测定收集不同浓度DON处理24 h后细胞, 用Trizol法提取RNA, 采用NanoVue浓度仪测定RNA浓度。采用First Strand cDNA Synthesis Kit在42 ℃ 30 min进行反转录反应, 80 ℃ 5 min进行反转录酶的失活反应。
目的基因Bcl-2 、Bax、Bid和内参GAPDH基因的引物序列参照GenBank相应基因序列, 由华大基因公司设计合成。引物序列及参数见表 1。
| 基因 Genes |
GenBank登录号 GenBank accession No. |
引物对序列(5′→3′) Primer pairs sequence(5′→3′) |
产物大小/bp Product size |
| GAPDH | NC_000072.6 | GGTGAAGGTCGGTGTGAACG/CTCGCTCCTGGAAGATGGTG | 232 |
| Bcl-2 | NC_000067.6 | TGGGATGCCTTTGTGGAACT/GCAGGTTTGTCGACCTCACT | 153 |
| Bax | NC_000073.6 | GGTTTCATCCAGGATCGAGA/TCCTCTGCAGCTCCATATTGC | 151 |
| Bid | NC_000072.6 | AGCTACACAGCTTGTGCCAT/CAGCTCGTCTTCGAGGTCTG | 186 |
按照StepOneTM Real-time PCR System和BIOMIGA SYBR qPCR Mix试剂盒说明配制PCR反应液。采用两步法PCR扩增标准程序:
第1步95 ℃ 1 min预变性; 第2步PCR反应:95 ℃ 15 s, 58 ℃ 20 s, 72 ℃ 20 s, 40个循环; 末段延伸72 ℃, 5 min。熔解曲线72 ℃→95 ℃, 每20 s升温1 ℃。
每个样品的基因Bcl-2 、Bax、Bid和内参基因GAPDH均在相同条件下进行扩增反应, 重复3次。
1.6 Western-blot法分析凋亡相关蛋白收集各组细胞, 用总蛋白提取试剂盒提取总蛋白, 用于cleaved-Caspase 3、cleaved-Caspase 9蛋白的分析。采用BCA蛋白浓度测定试剂盒检测蛋白浓度, 加入5×loading buffer后, 95 ℃处理5 min。总蛋白以50 μg的添加量进行SDS-PAGE(50 g·L-1浓缩胶, cleaved-Caspase 9使用120 g·L-1分离胶, cleaved-Caspase 3使用150 g·L-1分离胶)。使用半干转膜仪在120 V条件下转膜40 min, 将蛋白转印到PVDF膜上, 50 g·L-1 BSA封闭液室温封闭4 h。4 ℃条件下加cleaved-Caspase 3(1:750)、cleaved-Caspase 9(1:750)一抗过夜孵育。加二抗(1:10 000)室温孵育2 h。
1.7 数据分析数据均以x±SD表示, 利用SPSS 17.0统计软件进行单因素方差分析, Western-blot图片采用Quantity one软件进行灰度值分析。
2 结果与分析 2.1 DON对PC12细胞生长状态的影响不同浓度DON处理24 h后, 在倒置显微镜下观察PC12细胞生长情况(图 1)。对照组细胞(图 1-A)多为长梭形, 细胞间连接紧密。试验组细胞(图 1-B~F)随着DON浓度的增加, 细胞数量逐渐减少, 细胞凸起消失, 体积缩小, 失去原有的伸展状态, 逐渐变成圆形, 悬浮细胞逐渐增多。

|
图 1 DON对PC12细胞生长状态的影响(×400) Figure 1 Effect of DON on PC12 cell growth state(×400) A~F:DON处理质量浓度分别为0、125、250、500、1 000和2 000 ng·mL-1。 A-F:DON concentrations are 0, 125, 250, 500, 1 000 and 2 000 ng·mL-1, respectively. |
不同质量浓度DON处理24 h后, 在电镜下观察PC12细胞的形态学变化(图 2)。对照组细胞(图 2-A1)可见规则的细胞核、清晰的核仁和正常的细胞器, 染色质分布均匀, 线粒体结构正常及丰富的脊(图 2-A2)。试验组细胞(图 2-B1~图 2-F2)均出现了核膜皱缩, 染色质边集, 线粒体肿胀脊消失, 部分线粒体空泡变性等明显的细胞凋亡特征, 且DON的浓度越高, 这种现象越明显。2 000 ng·mL-1 DON处理组细胞核严重皱缩, 染色质凝集, 有的形成凋亡小体。
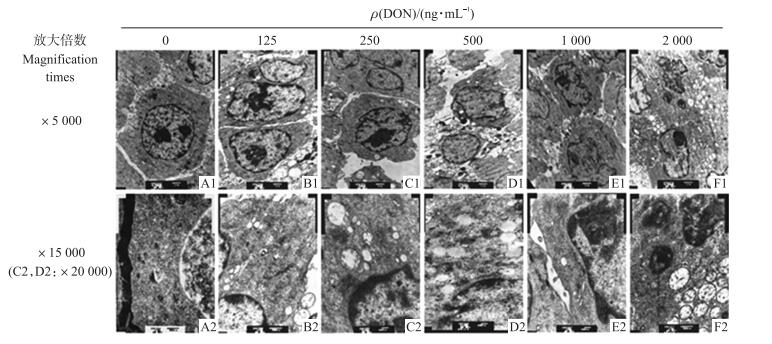
|
图 2 DON对PC12细胞超微结构的影响 Figure 2 Effect of DON on PC12 cell ultrastructure |
由图 3-A可见:随着DON浓度的增加, 细胞的凋亡率随之增加, DON浓度达到2 000 ng·mL-1时细胞凋亡率略下降, 但细胞死亡率增加。由图 3-B可见:与对照组相比, 各试验组细胞凋亡率均极显著升高(P < 0.01), DON浓度在125~1 000 ng·mL-1时, 凋亡率呈浓度依赖性升高, 而当DON为2 000 ng·mL-1时, 细胞凋亡率反而较1 000 ng·mL-1有所降低。
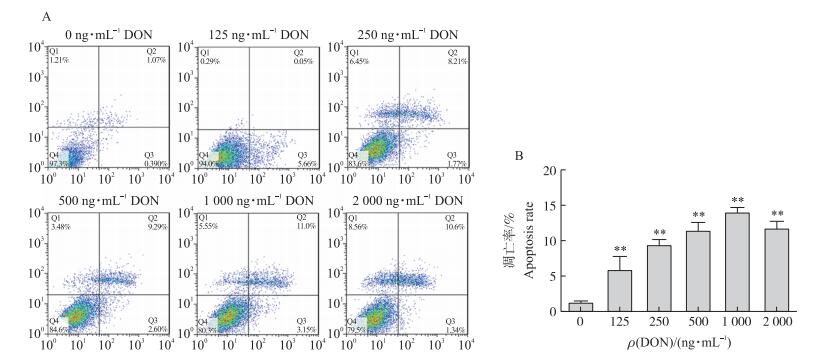
|
图 3 DON对PC12细胞凋亡的影响
Figure 3 Effect of DON on PC12 cell apoptosis
A.细胞凋亡图Cell apoptosis picture; B.细胞凋亡率Cell apoptosis rate *, * *:分别表示与对照组相比差异显著(P < 0.05)和差异极显著(P < 0.01)。 * and * * show significant difference(P < 0.05)and highly significant difference(P < 0.01)compared with control group, respectively.The same as follows. |
荧光定量PCR测定Bcl-2 、Bax、Bid mRNA的表达量, 结果见图 4。与对照组相比, Bax mRNA表达水平和Bax/Bcl-2均极显著增加(P < 0.01), 且随着DON浓度的增加而提高, 在1 000 ng·mL-1时达到峰值; Bcl-2 mRNA表达水平随着DON浓度的增加而降低, 在超过500 ng·mL-1时极显著下降, 在1 000 ng·mL-1时达到最低值; Bid mRNA表达水平在DON浓度超过250 ng·mL-1时极显著提高, 并随浓度的增加而提高, 在1 000 ng·mL-1时达到峰值。
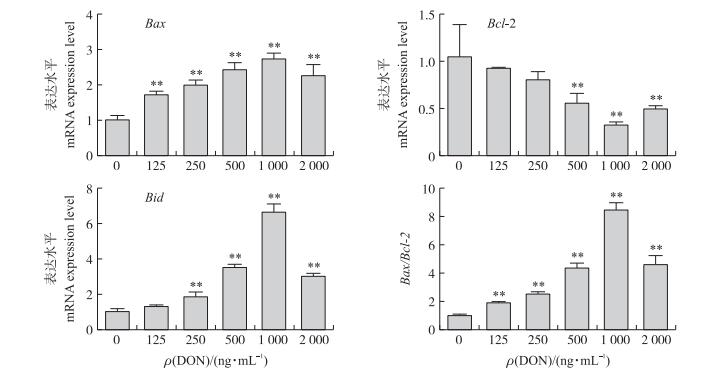
|
图 4 DON对凋亡相关基因表达的影响 Figure 4 Effects of DON on apoptosis-related genes expression |
如图 5所示:与对照组相比, DON各处理组cleaved-Caspase 9蛋白表达量均极显著增加(P < 0.01), 并随着DON浓度的增加而增加, 在1 000 ng·mL-1时达到最大值; cleaved-Caspase 3蛋白表达量在DON浓度超过500 ng·mL-1时极显著增加(P < 0.01), 同样也在1 000 ng·mL-1时达到峰值。
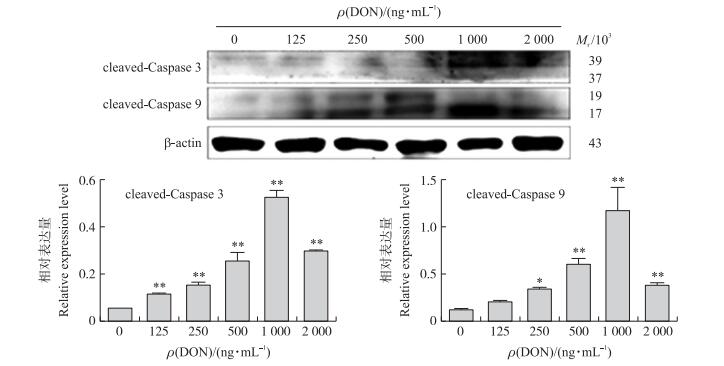
|
图 5 DON对凋亡相关蛋白表达水平的影响 Figure 5 Effect of DON on apoptosis-related proteins |
目前, DON的细胞毒性早已被证实, DON对细胞的毒性作用主要表现为引起细胞凋亡和细胞死亡。本试验选择PC12细胞建立体外神经细胞模型, 通过Annexin V-FITC/PI双染法检测细胞凋亡率, 荧光定量PCR检测凋亡相关基因的表达, Western-blot法分析凋亡相关蛋白的表达, 结果证明DON可诱导PC12细胞出现不同程度的凋亡, 为DON神经毒性的进一步研究奠定基础。
DON诱导细胞凋亡与毒素的浓度以及细胞的来源有关[8-9]。研究发现, 低浓度的DON主要引起细胞凋亡, 而高浓度的DON可引起细胞死亡[10-11]。本试验中, DON浓度在0~1 000 ng·mL-1时, 细胞凋亡率随DON浓度的增加而升高, 而在2 000 ng·mL-1时的细胞凋亡率低于1 000 ng·mL-1时的细胞凋亡率, 且死亡率明显升高。这种现象可能是因为高浓度DON诱导细胞死亡的速率大于细胞凋亡的速率。
Bcl-2家族的表达和调控是影响细胞凋亡的关键因素之一, 在细胞凋亡信号转导途径中发挥重要作用[12]。线粒体途径被Bcl-2家族成员控制, 它是凋亡的监管中心, 通过上调或下调Bcl-2家族的表达, 以及通过其将信号级联放大, 从而控制凋亡。Bcl-2家族目前至少有25个成员, 主要包括抗凋亡基因(Bcl-2)、促凋亡基因(Bax)以及平衡二者的基因[13-15]。
Bcl-2蛋白是抗凋亡蛋白, 具有稳定线粒体膜完整性的功能, 从而抑制线粒体释放细胞凋亡诱导因子(apoptosis inducing factor, AIF)和细胞色素C(cytochrome C, Cyt C)[16]。Bcl-2蛋白还与线粒体的PT通道有关, 能够抑制PT通道的开放, 从而阻止了Ca2+外流, 稳定线粒体膜电位[17]。Bax是Bcl-2家族的一员, 具有拮抗Bcl-2蛋白的作用, 是一种促凋亡蛋白, 又可与Bcl-2形成异二聚体抑制后者的抗凋亡效应[18]。Bax能够抑制线粒体释放AIF和Cyt C, 抑制凋亡蛋白酶的激活和维持钙稳态。因此Bax/Bcl-2在细胞凋亡中扮演着重要角色。Bid蛋白是Bcl-2家族的促凋亡蛋白, 可被Caspase 8酶切成具有活性的Bid蛋白, 进一步作用于线粒体, 导致线粒体中的Cyt C释放到胞浆中; Bid蛋白与Bax蛋白起协同作用, 引起Bax蛋白构象发生变化, 使其与线粒体紧密结合, 从而引起线粒体损伤[19-20]。因此, Bid蛋白使内外源凋亡通路联系起来[21]。
正常情况下, Bcl-2 mRNA表达水平增强, 能有效抵抗细胞损伤和阻止凋亡信号传导。本试验发现, Bcl-2 mRNA表达水平随着DON浓度的升高而下降, 而Bax的趋势与之相反, 因而Bax/Bcl-2值增加; Bid的相对表达量随着DON浓度的增加而增加, 表现为抗细胞凋亡作用减弱, 促细胞凋亡作用增强。不同浓度的DON作用后, 不同时间PC12细胞中Bax、Bid mRNA表达与细胞凋亡的趋势一致, 而抗凋亡基因Bcl-2与PC12细胞凋亡的趋势相反, 说明了DON导致的PC12细胞凋亡与Bcl-2 、Bax、Bid的表达密切相关。
Caspase家族是一种半胱氨酸蛋白酶家族, 在细胞凋亡分子机制中起重要作用。Procaspase 9是没有活性的, 只有与Cyt C、Apaf-1、ATP、ADP结合成凋亡复合体才具备活性[22]。活化后的Caspase 9切割下游以酶原形式存在的Caspase 3, 使Caspase 3活化。激活的Caspase 3(cleaved-Caspase 3)能剪切LaminA, 使核纤维层断裂, 核酸边集浓缩, 发生细胞凋亡[23]。本试验结果显示, cleaved-Caspase 9和cleaved-Caspase 3蛋白表达量与对照组相比都明显增加, 这促使了PC12细胞向着细胞凋亡的方向发展。
综上所述, DON可改变PC12细胞的生长状态, 显著调节凋亡相关基因与蛋白的表达水平, 通过线粒体信号转导途径诱导PC12细胞凋亡, 为进一步研究DON的神经毒性提供了理论依据。
| [1] | Mudili V, Siddaih C N, Nagesh M, et al. Mould incidence and mycotoxin contamination in freshly harvested maize kernels originated from India[J]. Journal of Science and Food Agriculture, 2014,94(13): 2674–2683. DOI: 10.1002/jsfa.2014.94.issue-13 |
| [2] | Brera C, Bertazzoni V, Debegnach F, et al. Exposure assessment for Italian population groups to deoxynivalenol deriving from pasta consumption[J]. Toxins, 2013,5(12): 2293–2309. DOI: 10.3390/toxins5122293 |
| [3] | Pestka J J. Deoxynivalenol:mechanisms of action, human exposure, and toxicological relevance[J]. Archives of Toxicology, 2010,84(9): 663–679. DOI: 10.1007/s00204-010-0579-8 |
| [4] | Bony S, Carcelen M, Olivier L, et al. Genotoxicity assessment of deoxynivalenol in the Caco-2 cell line model using the Comet assay[J]. Toxicollogy Letters, 2006,166(1): 67–76. DOI: 10.1016/j.toxlet.2006.04.010 |
| [5] | Baltriukiene D, Kalvelyte A, Bukelskiene V. Induction of apoptosis and activation of JNK and p38 MAPK pathways in deoxynivalenol-treated cell lines[J]. Alternatives to Laboratory Animals, 2007,35(1): 53–59. |
| [6] | Osamu M, Sachiko Y, Noriko Y, et al. Porcine hepatocyte apoptosis and reduction of albumin secretion induced by deoxynivalenol[J]. Toxicology, 2004,204(2/3): 241–249. |
| [7] | Qian M C, Liu J, Yao J S, et al. Caspase-8 mediates amyloid-β-induced apoptosis in differentiated PC12 cells[J]. Journal of Molecular, 2015,56(2): 491–499. |
| [8] | Krajarng A, Imoto M, Tashiro E, et al. Apoptosis induction associated with the ER stress response through up-regulation of JNK in HeLa cells by gambogic acid[J]. BMC Complementary and Alternative Medicine, 2015,15(1): 1–9. DOI: 10.1186/s12906-015-0520-z |
| [9] | Li D, Ye Y, Lin S, et al. Evaluation of deoxynivalenol-induced toxic effects on df-1 cells in vitro:cell-cycle arrest, oxidative stress, and apoptosis[J]. Environmental Toxicology and Pharmacology, 2014,37(1): 141–149. DOI: 10.1016/j.etap.2013.11.015 |
| [10] | He C H, Fan Y H, Wang Y, et al. The individual and combined effects of deoxynivalenol and aflatoxin B1 on primary hepatocytes of Cyprinus carpio[J]. International Journal of Molecular Science, 2010,11(10): 3760–3768. DOI: 10.3390/ijms11103760 |
| [11] | Ma Y, Zhang A, Shi Z, et al. A mitochondria-mediated apoptotic pathway induced by deoxynivalenol in human colon cancer cells[J]. Toxicology in Vitro, 2012,26(3): 414–420. DOI: 10.1016/j.tiv.2012.01.010 |
| [12] | 丁举静, 何成华, 刘俐君, 等. 脱氧雪腐镰刀菌烯醇对BHK-21细胞的线粒体膜电位及Bax和Bcl-2蛋白表达的影响[J]. 南京农业大学学报, 2011, 34(2): 101–106. Ding J J, He C H, Liu L J, et al. Effect of deoxynivalenol on the mitochondrial membrane potentials and Bax, Bcl-2 expression of BHK-21 cells[J]. Journal of Nanjing Agricultural University, 2011,34(2): 101–106. DOI: 10.7685/j.issn.1000-2030.2011.02.018 (in Chinese) |
| [13] | Huang D C, Strasser A. BH3-Only proteins-essential initiators of apoptotic cell death[J]. Cell, 2000,103(6): 839–842. DOI: 10.1016/S0092-8674(00)00187-2 |
| [14] | Adams J M, Cory S. The Bcl-2 apoptotic switch in cancer development and therapy[J]. Oncogene, 2007,26(9): 1324–1337. DOI: 10.1038/sj.onc.1210220 |
| [15] | Youle R J, Strasser A. The BCL-2 protein family:opposing activities that mediate cell death[J]. Nature Reviews Molecular Cell Biology, 2008,9(1): 47–59. DOI: 10.1038/nrm2308 |
| [16] | Bernardi P, Krauskopf A, Basso E, et al. The mitochondrial permeability transition from in vitro artifact to disease target[J]. FEBS Journal, 2006,273(11): 2077–2099. |
| [17] | Rizzuto R, Pinton P, Ferrari D, et al. Calcium and apoptosis:facts and hypotheses[J]. Oncogene, 2003,22(53): 8619–8627. DOI: 10.1038/sj.onc.1207105 |
| [18] | Qin G Q, Wu L P, Liu H Y, et al. Artesunate induces apoptosis via a ROS-independent and Bax-mediated intrinsic pathway in HepG2 cells[J]. Experimental Cell Research, 2015,336(2): 308–317. DOI: 10.1016/j.yexcr.2015.07.004 |
| [19] | Zhang L M, Zhao X C, Sun W B, et al. Sevoflurane post-conditioning protects primary rat cortical neurons against oxygen-glucose deprivation/resuscitation via down-regulation in mitochondrial apoptosis axis of Bid, Bim, Puma-Bax and Bak mediated by Erk1/2[J]. Journal of the Neurological Science, 2015,357(1/2): 80–87. |
| [20] | Wei M C, Lindsten T, Mootha V K, et al. tBID, a membrane-targeted death ligand, oligomerizes BAK to release cytochrome c[J]. Genes and Development, 2000,14(16): 2060–2071. |
| [21] | Cory S, Huang D C, Adams J M. The Bcl-2 family:roles in cell survival and oncogenesis[J]. Oncogene, 2003,22(53): 8590–8607. DOI: 10.1038/sj.onc.1207102 |
| [22] | Manns J, Daubrawa M, Driessen S, et al. Triggering of a novel intrinsic apoptosis pathway by the kinase inhibitor staurosporine:activation of caspase-9 in the absence of Apaf-1[J]. The FASEB Journal, 2011,25(9): 3250–3261. DOI: 10.1096/fj.10-177527 |
| [23] | Reed J C. Mechanisms of apoptosis avoidance in cancer[J]. Current Opinion in Oncology, 1999,11(1): 68–75. DOI: 10.1097/00001622-199901000-00014 |




