文章信息
- 陈长超, 王令怡, 孙嘉豪, 靳莎莎, 芮荣, 剧世强
- CHEN Changchao, Wang lingyi, SUN Jiahao, JIN Shasha, RUI Rong, JU Shiqiang
- 秋水仙碱对猪卵母细胞成熟及MⅠ期纺锤体的影响
- Effects of colchicine on the MⅠ spindle structure and in vitro maturation of porcine oocytes
- 南京农业大学学报, 2016, 39(5): 825-830
- Journal of Nanjing Agricultural University, 2016, 39(5): 825-830.
- http://dx.doi.org/10.7685/jnau.201510031
-
文章历史
- 收稿日期: 2015-10-21
哺乳动物卵母细胞成熟分裂方式特殊, 细胞只进行一次DNA的复制, 而随后发生两次连续的不均等分裂, 即第一次减数分裂和第二次减数分裂[1]。停滞在第一次减数分裂(meiosisⅠ)前期, 即生发泡(germinal vesicle, GV)期的卵母细胞, 在促性腺激素卵泡刺激素(follicle-stimulating hormone, FSH)或黄体生成素(luteinizing hormone, LH)的刺激下, 恢复减数分裂, 随后生发泡发生破裂(germinal vesicle breakdown, GVBD)。GVBD后的卵母细胞染色质发生浓缩, 附近的微管蛋白组装形成双极纺锤体, 同源染色体重组、配对, 并排列在赤道板上。卵母细胞发育至第一次减数分裂中期(metaphaseⅠ, MⅠ), 同源染色体在纺锤体的牵引下向两极迁移, 并排出第一极体(pbⅠ), 卵母细胞第一次减数分裂完成[2]; 受精发生后, 姐妹染色单体发生分离, 排出第二极体(pbⅡ), 第二次减数分裂完成[3]。染色体的正确分离对于配子的产生以及后代的健康发育至关重要, 而染色体的成功分离需要与纺锤体在时间和空间上的精确协调。在MⅠ期微管组装、双极纺锤体形成以及染色体凝集、排列与同源染色体分离等生物学过程中任何一个差错都可能导致非整倍染色体的发生[4-5], 进而引起一系列生殖缺陷[4-7]。
纺锤体是细胞分裂过程中形成的重要细胞器, 对于染色体正确排列和分离具有重要作用。小鼠卵母细胞成熟过程中纺锤体的结构形态异常将会直接导致染色体的排列和分离异常, 纺锤体的功能异常会导致卵母细胞发育停滞在MⅠ期, 不能排出pbⅠ[8-9]。在有丝分裂中, 纺锤体微管由中心体发出, 捕捉到姐妹染色体的动粒来促进染色体的排列; 而在卵母细胞减数分裂过程中, 无中心体结构, 纺缍体是由许多微管组织中心(MTOC)形成两极纺锤体。目前有关纺锤体微管蛋白在卵母细胞减数分裂过程中的功能及其与染色体的相互作用机制仍知之甚少, 且相关研究主要集中在小鼠等模式动物上, 而有关猪等大家畜卵母细胞减数分裂过程中纺锤体动态结构与功能研究并不多见[10-11]。
卵母细胞在减数分裂特定时期染色体分离机制是当前生殖和发育生物学的研究热点之一。研究猪卵母细胞减数分裂过程中纺锤体动态结构及其对染色体分离的影响对于揭示卵母细胞成熟机制、实施生殖调控具有重要意义。本研究首先采用免疫荧光结合激光共聚焦成像技术系统检测了微管和微丝在猪卵母细胞减数分裂过程中的动态表达及亚细胞定位; 在此基础之上, 通过秋水仙碱(colchicine)处理MⅠ期卵母细胞, 分析研究秋水仙碱对纺锤体微管组装、染色体分离及卵母细胞成熟的影响, 为进一步了解猪卵母细胞减数分裂机制提供试验依据。
1 材料与方法 1.1 抗体和试剂鼠抗α-tubulin-FITC单克隆抗体(F-2168)与Phalloidin-TRIRC(P-1951)购自Sigma公司, 秋水仙碱购自国药集团化学有限公司, 其他化学试剂如无特殊说明均购自Sigma公司。
1.2 猪卵母细胞采集与成熟培养于南京元润食品有限公司屠宰场采集猪卵巢后, 置于37 ℃无菌生理盐水中, 2 h内运至实验室。采集卵巢上直径为3~6 mm卵泡中的卵丘-卵母细胞复合体(cumulus oocyte complexes, COCs), 捡取胞质均匀、紧密包被3层及3层以上卵丘细胞的COCs, 按Lai等[12]报道的方法进行体外成熟培养。成熟培养结束后, 经1 g ·L-1透明质酸酶消化, 去除卵丘细胞, 出现pbⅠ则判为成熟卵母细胞, 即为MⅡ期卵母细胞。
根据试验设计分别于体外成熟培养0、20、26、36和44 h时收集生发泡期(GV)、GVBD、MⅠ、后末期(anaphase-telophaseⅠ, ATⅠ)和MⅡ期卵母细胞, 进行免疫荧光染色分析。
1.3 秋水仙碱处理卵母细胞秋水仙碱是微管蛋白抑制剂, 能使纺锤体微管发生解聚。使用前, 用超纯水将秋水仙碱进行稀释, 配置成5 mg · mL-1的储存液, -20 ℃条件下保存备用。培养之前分别将储存液用TCM-199溶液稀释至5、10和20 μg · mL-1。对照组则添加等量的超纯水。本试验将卵母细胞体外成熟培养至26 h, 即发育至MⅠ期后, 分别用不同质量浓度(5、10和20 μg · mL-1)的秋水仙碱处理1 h, 洗涤后再转移至不含秋水仙碱的成熟培养液中继续培养至试验设计需要时间, 分别在倒置显微镜和激光共聚焦显微镜下观察卵母细胞微管和pbⅠ排出情况, 分析不同浓度秋水仙碱对猪卵母细胞体外成熟的影响。
1.4 免疫荧光染色首先将卵母细胞在含4%多聚甲醛的PBS溶液中室温下固定30 min, 然后转移至通透液(含1% TritonX-100的PBS溶液)中室温下通透8 h, 再在封闭液中(含1% BSA的PBS溶液)室温下封闭1 h后, 然后转移至鼠抗α-tubulin-FITC单克隆抗体(1 : 200 PBS稀释)中室温下孵育2 h, 洗涤3次后再用Phalloidin-TRIRC(1 : 100 PBS稀释)染色40 min, 洗涤3次, 最后在10 μg · mL-1的Hoechst33342中染色10 min, 洗涤3次后, 转移至载玻片上, 完成封片。
1.5 激光共聚焦显微镜观察将完成封片的待检测样本在激光共聚焦显微镜(Zeiss LSM700 META, Oberkochen, Germany)下进行检查, 微管、微丝、染色体分别通过FITC、TRIRC及Hochest33342进行定位, 在激光共聚焦显微镜下观察, 分别呈现绿色、红色和蓝色。每组细胞不少于60个, 每个试验重复3次。
1.6 数据处理试验数据使用GraphPad Prism 5软件进行单因素方差分析(analysis of variance, ANOVA)。采用Tukey′s测验法进行多重样本(组)间差异的评估。结果均以平均数±标准误(x±SE)表示。
2 结果与分析 2.1 α-tubulin与F-actin在猪卵母细胞成熟分裂进程中的动态表达收集GV期至MⅡ期的卵母细胞, 采用免疫荧光技术检测微管蛋白α-tubulin和微丝蛋白F-actin在猪卵母细胞成熟分裂过程中的表达与亚细胞定位。如图 1所示:在GV期, α-tubulin均匀地分布于细胞质中, F-actin则主要分布在细胞质膜下的皮质区; GVBD之后, 染色质在细胞中浓缩, α-tubulin在其附近聚集, F-actin仍主要分布在细胞质膜下的皮质区; 至MⅠ期时, α-tubulin组装形成典型纺锤体, 染色体排列在赤道板上, 并共同迁移至卵母细胞皮质下区域, F-actin则在纺锤体和染色体紧邻皮质区大量富集形成典型的微丝帽; 至ATⅠ期时, 染色体在纺锤体的迁移下向两极移动, α-tubulin集中分布于两组染色体之间, 微丝帽向外突出明显; MⅡ期, α-tubulin重新快速组装成典型的纺锤体结构, 并且在细胞质膜下与pbⅠ周围均有明显的F-actin富集。上述结果表明, 在猪卵母细胞成熟分裂过程中α-tubulin与F-actin呈现动态分布与阶段性结构特点。
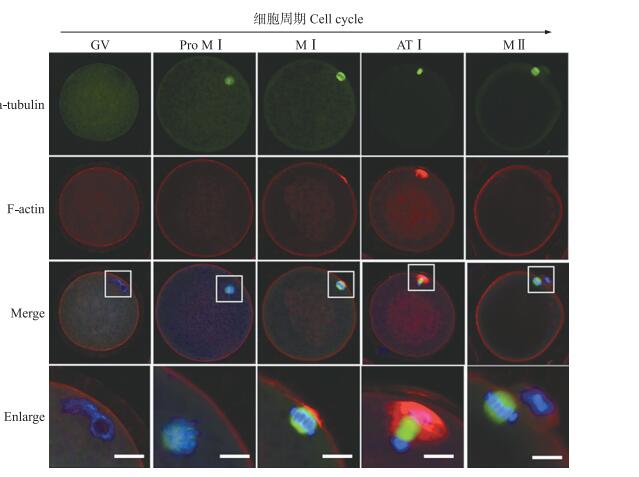
|
图 1 α-tubulin和F-actin在猪卵母细胞成熟过程中的亚细胞定位 Figure 1 Subcellular localization of α-tubulin and F-actin during pig oocyte meiotic maturation 绿色Green:α-tubulin; 红色Red:F-actin; 蓝色Blue:染色体Chromosome。Scale bar=5 μm |
为研究秋水仙碱对MⅠ期猪卵母细胞体外成熟的影响, 本试验将卵母细胞体外成熟培养至26 h, 即发育至MⅠ期后, 分别用不同质量浓度(5、10和20 μg · mL-1)的秋水仙碱处理1 h, 洗涤后再转移至不含秋水仙碱的成熟培养液中继续培养至44 h, 经透明质酸酶消化后, 在倒置显微镜下观察卵母细胞pbⅠ排出情况(图 2-A)。随着秋水仙碱浓度的增加, 卵母细胞pbⅠ排出率显著下降, 且呈现剂量依赖性关系。对照组pbⅠ排出率为(66.38±1.86)%(n=198), 而5、10和20 μg · mL-1秋水仙碱作用后pbⅠ排出率分别下降至(51.41±1.41)%(n=203, P < 0.01)、(49.02±0.13)%(n=208, P < 0.01)和(41.31±0.13)%(n=196, P < 0.01)(图 2-B)。

|
图 2 秋水仙碱(COL)对猪卵母细胞第一极(pbⅠ)体排出的影响
Figure 2 Effects of colchicine(COL)on the extrusion of pbⅠduring porcine meiosis
1)A.卵母细胞(pbⅠ)排出(比例尺:20 μm); B.不同浓度秋水仙碱对猪卵母细胞pbⅠ排出率的影响。
A.Observation of first polar body(pbⅠ)extrusion and cytoplasmic quality under inverted microscope between the control group and experimental group after 44 h culture(Scale bar=20 μm); B.Rate of pbⅠ extrusion after 44 h culture with different treatments. 2)* P < 0.05, * * P < 0.01, * * * P < 0.001. The same as follows. |
为进一步探讨秋水仙碱抑制MⅠ期猪卵母细胞成熟的机制, 将10 μg · mL-1秋水仙碱处理1 h的MⅠ期卵母细胞固定, 然后进行α-tubulin间接免疫荧光染色, 在激光共聚焦显微镜下观察秋水仙碱对MⅠ卵母细胞纺锤体结构的影响。如图 3所示:对照组大多数细胞染色体周围有MⅠ期纺锤体存在, 而处理组几乎所有细胞卵母细胞的MⅠ期纺锤体解聚消失, 染色体排列紊乱, 微管蛋白散在分布在胞质中, 只有少数细胞染色体周围有残留纺锤体微管。对照组中有纺锤体存在的卵母细胞比例为(59.64±5.01)%(n=207), 而在10 μg · mL-1秋水仙碱处理组中, 有纺锤体存在的卵母细胞比例则下降至(8.06±1.13)%(n=199), 极显著低于对照组(P < 0.01)。
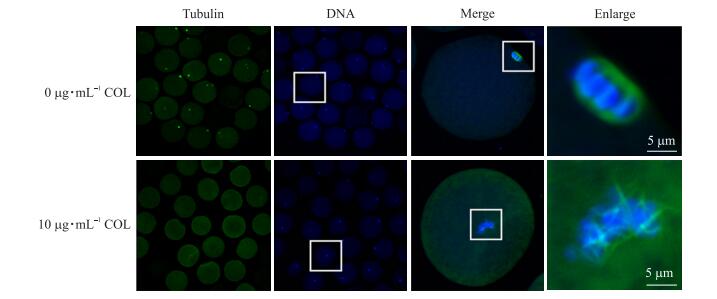
|
图 3 秋水仙碱对猪卵母细胞MⅠ期纺锤体结构的影响 Figure 3 Effects of colchicine on spindle structure of porcine MⅠ oocytes 绿色Green:α-tubulin; 蓝色Blue:染色体Chromosome |
以上研究发现, 用秋水仙碱处理1 h, 大多数MⅠ期猪卵母细胞的纺锤体发生解聚, 但仍有近半数的卵母细胞培养至44 h时仍可发育成熟并排出pbⅠ。据此我们推测, 秋水仙碱对MⅠ期猪卵母细胞纺锤体的解聚作用存在一定程度的可逆性, 当秋水仙碱撤除后, 解聚的纺锤体微管可能进行了重新组装, 并恢复其功能。因此, 本试验将猪卵母细胞成熟培养至26 h后, 用10 μg · mL-1的秋水仙碱处理1 h后, 再转移至不含秋水仙碱的成熟培养液中继续培养, 并分别在成熟培养至27、30和34 h收样固定, 然后进行α-tubulin免疫荧光染色, 在激光共聚焦显微镜下观察、分析卵母细胞纺锤体微管的重组恢复情况。结果表明:经秋水仙碱处理1 h后继续培养的大多数卵母细胞在染色体周围重新组装成纺锤结构, 当培养至30或34 h时, 纺锤体重组的卵母细胞比例分别为(56.94±2.59)%(n=176)和(74.23±2.56)%(n=116), 均显著高于27 h处理组(7.94±0.96)%(n=124)(P < 0.01)(图 4)。该试验结果证实, 秋水仙碱对MⅠ期猪卵母细胞纺锤体的解聚作用存在一定程度可逆性, 即当秋水仙碱撤除后, 大多数卵母细胞解聚的纺锤体微管可以重新组装成纺锤体。
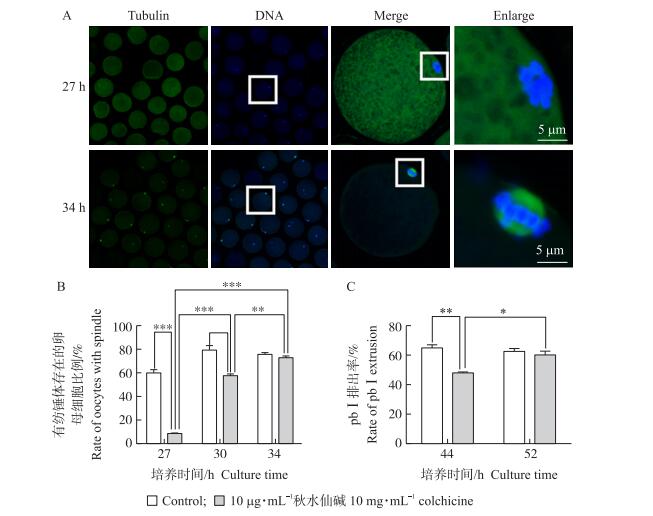
|
图 4 秋水仙碱处理后纺锤体组装和延长成熟培养时间后pbⅠ排出状况 Figure 4 Reassembling of spindle after colchicine treatment and rates of pbⅠextrusion after the extension of incubation time A、B.秋水仙碱作用后卵母细胞纺锤体重新组装情况(绿色:α-tubulin; 蓝色:染色体); C.延长成熟培养时间后pbⅠ排出率变化。 A, B.Reassembling of spindle after colchicine treatment(Green:α-tubulin; Blue:chromosome). C.Rate of pbⅠ extrusion after the extension of in vitro culture time. |
上述结果表明, 秋水仙碱撤除后, 大多数卵母细胞解聚的纺锤体微管可以重新组装成纺锤体, 但继续培养至44 h时, pbⅠ排出率仍显著低于对照组。于是, 我们将10 μg · mL-1秋水仙碱处理1 h之后的卵母细胞继续培养至52 h后, 在倒置显微镜下检测卵母细胞pbⅠ排出情况。结果如图 4-C所示, 成熟培养至44 h处理组卵母细胞pbⅠ排出率为(49.02±0.13)%(n=208), 而将成熟培养时间延长至52 h的处理组卵母细胞pbⅠ排出率增加至(59.57±6.58)%(n=261), 与44 h处理组相比有显著差异(P < 0.05)。因此撤除秋水仙碱作用的卵母细胞, 延长其成熟时间有助于卵母细胞pbⅠ排出率的恢复。
3 讨论本试验研究了微管和微丝等细胞骨架在猪卵母细胞减数分裂进程中的动态表达, 探讨了作用于微管的特异性药物秋水仙碱对卵母细胞成熟和MⅠ期纺锤体的影响。结果显示, α-tubulin及F-actin蛋白在卵母细胞减数分裂过程中呈现阶段性动态分布的特点, 秋水仙碱显著影响MⅠ期纺锤体的正常结构及卵母细胞pbⅠ排出, 但秋水仙碱撤除后, 微管蛋白可重新组成MⅠ期纺锤体结构, 延长培养时间后, pbⅠ排出率恢复, 说明秋水仙碱对MⅠ期卵母细胞纺缍体结构及功能的影响在一定程度上具有可逆性。
细胞骨架是真核细胞中的蛋白纤维网架体系, 与细胞分裂、细胞分化等生命活动密切相关, 微管和微丝是细胞骨架的主要成分。在细胞有丝分裂前期, 微管以中心体为核心向四周辐射, 到前中期, 开始装配纺锤体, 至中期时形成典型的纺锤体结构, 而到分裂后期, 极性微管牵拉染色体向细胞两极运动, 末期则主要分布于两组染色体之间[13]。在本试验中, 我们通过免疫荧光染色检测微管和微丝在猪卵母细胞减数分裂这种特殊分裂过程中的动态表达与分布, 发现在GVBD之后, α-tubulin开始在浓缩的染色体附近聚集, 至MⅠ期, 组装形成典型纺锤体, 并伴随染色体排列在赤道板上, 之后在纺锤体牵引染色体向两极移动。Kim等[14]对猪卵母细胞细胞骨架动态变化进行检测时发现:GV期, α-tubulin在猪卵母细胞中检测不到微管的存在; GVBD之后, 凝集的染色质周围出现小的星体微管; 在Pro MⅠ期, 星体微管与各自的染色质团联系在一起; MⅠ期时, 星体微管延长并包绕着染色质, 形成典型桶状对称性纺锤体结构; 至ATⅠ期时, 微管存在于减数分裂的纺锤体上, 同时在MⅡ期检测到微管存在于减数分裂典型的纺锤体上, 这与我们的试验结果相一致。这些阶段性的分布特点提示微管蛋白在猪卵母细胞MⅠ期双极纺锤体组装、染色体的排列与分离过程中扮演了重要的角色。
秋水仙碱是研究微管结构与功能的经典工具药物, 具有解聚微管的作用。当正在发生有丝分裂的细胞与秋水仙碱共孵育时, 秋水仙碱结构中的C环与微管蛋白特定的位点进行结合, 导致α微管蛋白与β微管蛋白二聚体结构发生改变, 进而使微管蛋白组装过程阻断, 不能形成微管并造成已组装的微管发生解聚, 导致与微管活动有关的功能丧失[13]。Yao等[15]将猪卵母细胞体外成熟培养至44 h, 即MⅡ期时, 然后再用秋水仙碱进行处理1 h, 结果发现MⅡ期典型纺锤体结构消失, 残留纺锤体微管蛋白聚集在染色体周围。在本试验中, 我们利用秋水仙碱处理MⅠ期卵母细胞, 结果发现卵母细胞pbⅠ排出率显著下降, 同时伴随MⅠ期纺锤体发生解聚, 染色体周围纺锤体微管全部消失或者部分残留, 染色体排列异常。这些结果说明秋水仙碱通过破坏猪卵母细胞MⅠ期纺锤体结构进而阻滞成熟分裂进程, 抑制了猪卵母细胞的成熟。进一步的试验结果表明, 秋水仙碱对于猪卵母细胞MⅠ期已经形成的纺锤体结构具有明显的降解作用, 且这种结构具有一定的可逆性, 即秋水仙碱撤除后, 解聚的纺锤体结构又可重新组装, 这一发现对于进一步研究动物卵母细胞成熟分裂过程中纺锤体的结构与功能及其相关蛋白激酶的调节作用具有重要意义。
| [1] | Brunet S, Verlhac M H. Positioning to get out of meiosis:the asymmetry of division[J]. Hum Reprod Update, 2011,17(1): 68–75. DOI: 10.1093/humupd/dmq044 |
| [2] | Coticchio G, Dal Canto M, Mignini R M, et al. Oocyte maturation:gamete-somatic cells interactions, meiotic resumption, cytoskeletal dynamics and cytoplasmic reorganization[J]. Hum Reprod Update, 2015,21(4): 427–454. DOI: 10.1093/humupd/dmv011 |
| [3] | Adhikari D, Liu K. The regulation of maturation promoting factor during prophase I arrest and meiotic entry in mammalian oocytes[J]. Mol Cell Endocrinol, 2014,382(1): 480–487. DOI: 10.1016/j.mce.2013.07.027 |
| [4] | Yuan Y F, Zhai R, Liu X M, et al. SUMO-1 plays crucial roles for spindle organization, chromosome congression, and chromosome segregation during mouse oocyte meiotic maturation[J]. Mol Reprod Dev, 2014,81(8): 712–724. |
| [5] | Balboula A Z, Stein P, Schultz R M, et al. RBBP4 regulates histone deacetylation and bipolar spindle assembly during oocyte maturation in the mouse[J]. Biol Reprod, 2015,92(4): 105. DOI: 10.1095/biolreprod.115.128298 |
| [6] | Duncan F E, Hornick J E, Lampson M A, et al. Chromosome cohesion decreases in human eggs with advanced maternal age[J]. Aging Cell, 2012,11(6): 1121–1124. DOI: 10.1111/acel.2012.11.issue-6 |
| [7] | Luciano A M, Franciosi F, Lodde V, et al. Oocytes isolated from dairy cows with reduced ovarian reserve have a high frequency of aneuploidy and alterations in the localization of progesterone receptor membrane component1 and aurora kinase B[J]. Biol Reprod, 2013,88(3): 58. DOI: 10.1095/biolreprod.112.106856 |
| [8] | Shuda K, Schindler K, Ma J, et al. Aurora kinase B modulates chromosome alignment in mouse oocytes[J]. Mol Reprod Dev, 2009,76(11): 1094–1105. DOI: 10.1002/mrd.v76:11 |
| [9] | Vogt E, Kipp A, Eichenlaub-Ritter U. Aurora kinase B, epigenetic state of centromeric heterochromatin and chiasma resolution in oocytes[J]. Reprod Biomed Online, 2009,19(3): 352–368. DOI: 10.1016/S1472-6483(10)60169-1 |
| [10] | George O, Johnston M A, Shuster C B. Aurora B kinase maintains chromatin organization during the MⅠ to MⅡ transition in surf clam oocytes[J]. Cell Cycle, 2006,5(22): 2648–2656. DOI: 10.4161/cc.5.22.3444 |
| [11] | Zhang L, Hou X, Ma R, et al. Sirt2 functions in spindle organization and chromosome alignment in mouse oocyte meiosis[J]. FASEB J, 2014,28(3): 1435–1445. DOI: 10.1096/fj.13-244111 |
| [12] | Lai L X, Prather R S. Production of cloned pigs by using somatic cells as donors[J]. Cloning and Stem Cells, 2003,5(4): 233–242. DOI: 10.1089/153623003772032754 |
| [13] | 翟中和, 王喜忠, 丁明孝. 细胞生物学[M]. 北京: 高等教育出版社, 2007 : 372 -376. Zhai Z H, Wang X Z, Ding M X. Cell Biology[M]. Beijing: Higher Education Press, 2007 : 372 -376. (in Chinese) |
| [14] | Kim N H, Funahashi H, Prather R S, et al. Microtubule and microfilament dynamics in porcine oocytes during meiotic maturation[J]. Mol Reprod Dev, 1996,43(2): 248–255. DOI: 10.1002/(ISSN)1098-2795 |
| [15] | Yao L J, Sun Q Y. Characterization of Aurora-A in porcine oocytes and early embryos implies its functionalroles in the regulation of meiotic maturation, fertilization and cleavage[J]. Zygote, 2005,13(1): 23–30. DOI: 10.1017/S0967199405003059 |




