文章信息
- 李烈川, 申明, 宁彩波, 管志强, 蒋毅, 吴望军, 刘红林
- LI Liechuan, SHEN Ming, NING Caibo, GUAN Zhiqiang, JIANG Yi, WU Wangjun, LIU Honglin
- 过氧化氢诱导猪卵巢颗粒细胞自噬及其对凋亡的影响
- Induction of granulosa cell autophagy and effects in apoptosis by hydrogen peroxide in porcine ovaries
- 南京农业大学学报, 2016, 39(5): 814-818
- Journal of Nanjing Agricultural University, 2016, 39(5): 814-818.
- http://dx.doi.org/10.7685/jnau.201601001
-
文章历史
- 收稿日期: 2016-01-01
在哺乳动物中, 卵泡闭锁是一种正常的生理过程, 研究卵泡闭锁有助于提高动物的繁殖力。现在人们普遍认为卵巢颗粒细胞凋亡能导致卵泡闭锁[1], 因此研究颗粒细胞凋亡具有重要意义。活性氧(reactive oxygen species, ROS)是动物繁殖过程中一种代谢副产物, 如果雌性动物卵泡中ROS的生成与清除平衡被打破, 容易对颗粒细胞产生氧化应激, 进而产生一系列诸如DNA降解、Caspase激活等凋亡特征。自噬是一种进化保守的生理学过程, 主要分为巨自噬、微自噬以及分子伴侣介导的自噬3种[2-3], 笔者主要研究巨自噬。巨自噬主要是将细胞内损伤的细胞器和大分子蛋白以自噬体的形式投送到溶酶体中降解, 消化产物可以被细胞重新利用[4]。正常水平的自噬主要是一种保护性自噬, 对细胞的功能和代谢具有重要意义, 若细胞存在过高水平的自噬, 细胞内容物被溶酶体大量降解, 会导致自噬性细胞死亡, 自噬性细胞死亡又被称为Ⅱ型细胞程序化死亡[5]。自噬和凋亡的关系非常复杂, 有文献报道自噬能抑制凋亡[6-7], 最典型的例子是肿瘤中高水平的自噬不利于细胞凋亡[8], 也有文献报道自噬能促进凋亡[9]。自噬与凋亡是由很多因素造成, 其中一个比较重要的原因是ROS的生成与清除失去平衡[10]。H2O2是一种常见的氧化应激诱导剂, 经过H2O2处理的细胞能在短时间内产生大量的ROS, 进而诱发细胞凋亡, 我们已经利用H2O2建立起了小鼠卵巢颗粒细胞氧化应激模型[11], 说明H2O2是一种合理的颗粒细胞氧化应激诱导剂。3-甲基腺嘌呤(3-methyladenine, 3-MA)主要抑制自噬体的形成[12], 被广泛用于自噬研究。本文利用3-MA来抑制氧化应激条件下猪卵巢颗粒细胞自噬及其抑制自噬后对颗粒细胞凋亡的影响, 为进一步研究颗粒细胞自噬与凋亡的分子机制以及对猪卵泡闭锁的影响奠定基础。
1 材料与方法 1.1 试验材料H2O2、LC3抗体、Tubulin抗体购自Sigama公司, SQSTM1/p62抗体购自Abcam公司, GFP-LC3质粒来源于浙江大学, Annexin V-FITC细胞凋亡检测试剂盒购自南京诺维赞生物科技有限公司, CCK8试剂盒购自日本同仁化学(Dojindo), 细胞培养所用的耗材均购自Invitrogen公司; 磷酸盐缓冲液(PBS)、DMEM/F12培养基及血清购自Life Technologies公司。
1.2 试验方法 1.2.1 猪卵泡颗粒细胞的获得、培养、传代与转染从南京栖霞屠宰场采集商品肉猪的卵巢, 放在装有37 ℃无菌生理盐水的保温桶中2 h内运到实验室。PBS清洗卵巢2次后用10 mL注射器从卵巢卵泡中吸取颗粒细胞, 将其放到15 mL离心管1 000 r·min-1离心5 min, 去除卵泡液。PBS清洗颗粒细胞2次, 每次1 000 r·min-1离心5 min, 去除PBS。用1 mL含有体积分数15%的胎牛血清和100 U·ml-1双抗的DMEM/F-12完全培养基重悬颗粒细胞, 充分吹打散开。提前在T25细胞培养瓶中加入3 mL的37 ℃预热过的完全培养基, 然后将1 mL重悬的颗粒细胞平均接种于每一个T25中, 37 ℃培养。24 h后观察颗粒细胞贴壁状况, 等细胞生长至90%汇合时传代。传代时先用PBS清洗2次, 再用1 mL胰酶消化, 再加入完全培养基终止消化, 最后接种于6、12、24和96孔板中继续后续试验。采用lip3000脂质体法做转染试验:转染在24孔板中进行, 所有孔均转染GFP-LC3质粒, 转染前吸掉培养基, 用1 mL PBS冲洗2次, 换300 μL Opti培养基, 放入37 ℃ CO2培养箱培养; 配A液(1 μg质粒和1 μL P3000试剂加入25 μL Opti培养基)、B液(0.75 μL脂质体加入25 μL Opti培养基); 配好后, B液加入A液, 室温孵育5 min后转染, 每孔50 μL, 6 h后换成正常的完全培养基。
1.2.2 猪卵巢颗粒细胞氧化应激模型的建立用不同浓度的H2O2(0、50、100和150 μmol·L-1)处理汇合度约90%的颗粒细胞12 h, 用于Annexin V-FITC凋亡测定和CCK8细胞活力测定。最终确定100 μmol·L-1 H2O2为本试验使用浓度。
1.2.3 猪卵巢颗粒细胞自噬模型的建立用100 μmol·L-1 H2O2处理颗粒细胞0、1、2、3和6 h, 分别收样用于Western-blot分析, 用100 μmol·L-1 H2O2处理分别转染了GFP-LC3质粒的颗粒细胞0、1、2和6 h, 收样用于激光共聚焦观察自噬体的形成状况[13]。
1.2.4 试验分组及处理试验分成4个组, 2个对照组(Control, Control+3-MA)、2个处理组(H2O2、H2O2+3-MA)用1 mmol·L-1 3-MA预处理4 h, 然后用100 μmol·L-1 H2O2处理颗粒细胞1 h或者12 h, 其中处理1 h的颗粒细胞用于Western-blot分析和激光共聚焦观察自噬体, 以确定3-MA的确能抑制H2O2诱导的自噬。处理12 h的细胞用于Annexin V-FITC凋亡测定和CCK8细胞活力测定。
1.2.5 CCK8测定细胞活力按照CCK8试剂盒说明书操作。每个样品重复6次, 取平均值。
1.2.6 Annexin V-FITC/PI细胞凋亡检测按照Annexin V-FITC凋亡测定试剂盒说明书进行, 每个样品重复3次。
1.2.7 Western-blot分析用含PMSF的RAPA裂解液收集细胞总蛋白, 用BCA法测定蛋白浓度。用120 g ·L-1 SDS-PAGE进行凝胶电泳分离。分离后恒压100 V转移至PVDF膜上1 h, 5% BSA封闭1 h, TBST洗3次, 每次5 min。加入一抗后4 ℃过夜。TBST洗3次, 每次5 min。常温加入二抗孵育1 h。TBST洗3次, 每次5 min, 最后显色拍照。试验中所有的洗膜与孵育均在混匀仪上进行。
1.3 数据分析数据采用x±SE表示, 用GraphPad Prism 5软件进行统计分析, 采用单因素方差分析和t测验。
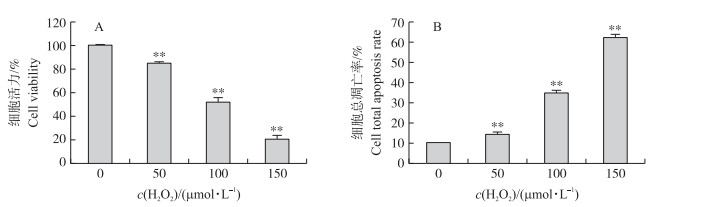
2 结果与分析 2.1 H2O2对猪卵巢颗粒细胞凋亡的影响如图 1-A所示:颗粒细胞在不同浓度H2O2(0(对照组)、50、100和150 μmol·L-1)作用12 h后, 细胞活力随H2O2浓度升高极显著降低(P < 0.01)。其中100 μmol·L-1 H2O2对细胞具有极显著毒性。图 1-B流式细胞术统计结果显示:H2O2浓度越高, 细胞总凋亡率也越高, 并且差异极显著(P < 0.01)。H2O2对细胞具有显著的凋亡诱导作用, 同时细胞活力的梯度变化, 说明氧化应激模型建立成功, 不管是低浓度还是高浓度的H2O2都对细胞具有一定的毒性, 参考前人的文献[11], 选取100 μmol·L-1 H2O2作为后续试验使用浓度。
|
图 1 不同浓度H2O2对细胞活力(A)和细胞总凋亡率(B)的影响(**P < 0.01) Figure 1 Effects of different concentrations of H2O2 on cell viability and total apoptosis rate |
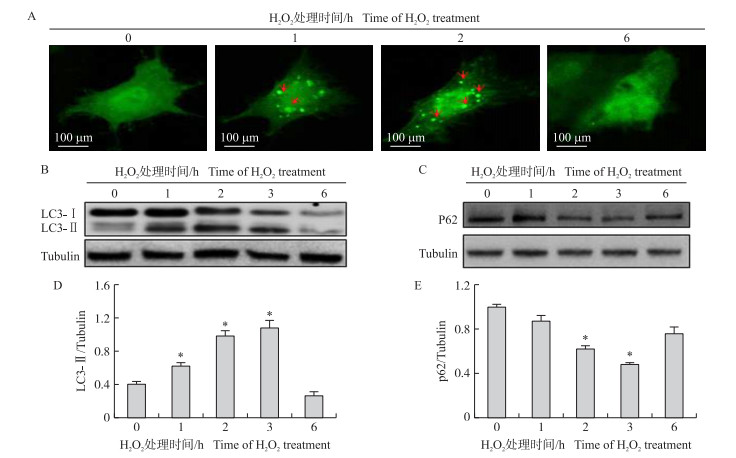
为研究氧化应激时间长短对猪颗粒细胞产生自噬的影响, 通过转染GFP-LC3质粒分别检测0、1、2和6 h自噬体的形成数量, 图 2-A可以观察到自噬体数量在1和2 h显著上升, 但是在6 h时很明显下降。为进一步确认此试验结果, 通过Western-blot检测自噬相关蛋白LC3和p62的变化情况(图 2-B和图 2-C), 发现LC3-Ⅱ的相对表达量在1、2和3 h都显著升高, 但是在6 h时显著下降, 同时p62的相对表达量先减少再增加。这一结果表明在氧化应激的早期自噬被诱导, 持续氧化应激自噬受到抑制。
|
图 2 100 μmol·L-1 H2O2诱导的颗粒细胞自噬 Figure 2 100 μmol·L-1 H2O2 induced autophagy in granulosa cells 红色箭头指向的绿点为自噬体的形成Red arrow pointing in the direction of the green dot represents the formation of autophagosome A.GFP-LC3斑点的形成和分布The formation and distribution of GFP-LC3 punctate; B.LC3蛋白表达的电泳图Western-blot for the protein levels of LC3;C.p62蛋白表达的电泳图Western-blot for the protein levels of p62;D.LC3-Ⅱ的相对表达量The relative expression of LC3-Ⅱ; E.p62的相对表达量The relative expression of p62 |
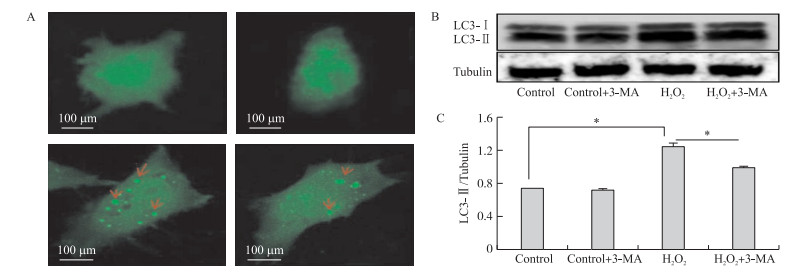
3-MA广泛用于自噬研究, 其能抑制Ⅲ型PI3K的活性从而抑制自噬, 为检验3-MA能否抑制H2O2诱导的猪卵巢颗粒细胞自噬, 先用3-MA预处理颗粒细胞4 h, 然后再用100 μmol·L-1 H2O2处理1 h, 如图 3-A所示:自噬体在对照组和3-MA组几乎没有自噬体(即红色箭头所示)的形成, 在H2O2组有大量的自噬体形成, 添加自噬抑制剂3-MA后自噬体数量大量减少, 说明3-MA能抑制自噬体的形成。结果显示(图 3-B、C), 在氧化应激组, 自噬标记物LC3-Ⅱ的相对表达量在添加3-MA后显著下调, 这说明自噬过程中LC3-Ⅰ转化为LC3-Ⅱ显著减少, 说明自噬受到抑制。以上说明3-MA能抑制H2O2诱导的猪卵巢颗粒细胞自噬, 3-MA可用于后续试验的研究。
|
图 3 A.GFP-LC3斑点的形成和分布The formation and distribution of GFP-LC3 punctate; B.LC3蛋白表达的电泳检测图Western-blot for the protein levels of LC3;C.LC3-Ⅱ的相对表达量The relative expression of LC3-Ⅱ Figure 3 3-MA对H2O2(100 μmol·L-1)诱导的猪卵巢颗粒细胞自噬的影响 Effects of 3-MA on granulosa cells autophagy induced by hydrogen peroxide(100 μmol·L-1)in porcine ovaries |
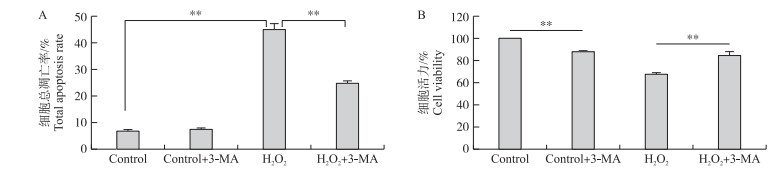
为评价氧化应激早期产生的自噬对颗粒细胞凋亡是否有影响, 我们用3-MA提前4 h预处理颗粒细胞, 然后再用100 μmol·L-1 H2O2处理12 h, 最后用流式细胞术检测细胞总凋亡率。统计结果如图 4所示, 抑制自噬后凋亡率较单独氧化应激组极显著下降(图 4-A)(P < 0.01)。同时我们利用CCK8检测了阻断自噬后的细胞活力, 扣除3-MA本身对细胞活力的影响, 3-MA处理组较氧化应激组细胞活力极显著上调(图 4-B)(P < 0.01)。以上结果表明:氧化应激诱导的猪卵巢颗粒细胞自噬是一种破坏性自噬, 自噬的激活有助于细胞凋亡, 而阻断自噬能减少凋亡的比例。
|
图 4 抑制自噬对细胞凋亡和细胞活力的影响(* *P < 0.01) Figure 4 The effect on cell apoptosis and cell viability after inhibition of autophagy |
在哺乳动物卵泡发育过程中伴随着大量卵泡闭锁, 只有很少一部分卵泡发育成熟并排卵, 大量研究表明颗粒细胞凋亡是引起卵泡闭锁的主要原因[1]。在卵泡发育和颗粒细胞凋亡过程中都存在着自噬[14], 因此自噬可能参与了颗粒细胞凋亡, 有研究表明大鼠颗粒细胞的自噬可能参与了卵泡发育[15], 自噬体的累积也会导致颗粒细胞的凋亡[14]。因此在猪卵巢颗粒细胞中研究自噬与凋亡的关系很有意义。雌性动物在繁殖过程中由于新陈代谢加强很容易产生氧化应激, 体外试验表明氧化应激能引起小鼠颗粒细胞凋亡[11], 因此我们利用氧化应激状态下的颗粒细胞研究自噬与凋亡的关系。本研究表明100 μmol·L-1 H2O2能诱导猪卵巢颗粒细胞凋亡, 如果应用较低浓度的H2O2, 颗粒细胞凋亡也有显著的差异, 细胞活力也有显著下降, 但是凋亡率和活力变化程度不大, 不利于后续的研究。但我们也没有选择高浓度的H2O2, 因为高浓度的H2O2在提高凋亡率的同时, 会出现大量细胞坏死的现象, 这是一种非正常的细胞死亡, 不是模拟体内颗粒细胞正常凋亡的模型, 同时考虑到本实验室在小鼠颗粒细胞建立氧化应激模型的成功经验, 选用了此浓度。为探究该浓度的H2O2能否引起颗粒细胞自噬的变化, 我们做了氧化应激时间梯度, 发现自噬只是存在氧化应激的早期阶段, 氧化应激时间越长, 自噬反而严重下调, 其中的机制非常复杂, 然而令我们感兴趣的是在氧化应激早期产生的自噬能否对后续的颗粒细胞凋亡产生影响。在氧化应激早期, 有的细胞抑制自噬有助于细胞存活[16], 然而有的细胞阻断自噬促进了细胞的凋亡[13], 因此我们先研究了经典自噬抑制剂3-MA能否阻断氧化应激诱导的猪颗粒细胞自噬, 发现3-MA确实能显著抑制自噬, 并且颗粒细胞凋亡率也明显下降, 细胞活力也有显著提高, 这些结果说明在猪卵巢颗粒细胞中, 自噬能促进颗粒细胞凋亡。虽然我们只用了流式细胞术检测了凋亡, 但从显微镜下的细胞群可以明显看到抑制自噬后的颗粒细胞明显比单独氧化应激的状态好。自噬和凋亡的关系异常复杂, 自噬和凋亡又存在很多交叉的信号通路, 因此, 本试验的结果为后续研究猪卵巢颗粒细胞自噬与凋亡的分子机制奠定了基础, 也为研究猪卵泡闭锁提供了新的思路。
| [1] | Matsuda-Minehata F, Inoue N, Goto Y, et al. The regulation of ovarian granulosa cell death by pro-and anti-apoptotic molecules[J]. Journal of Reproduction and Development, 2006,52(6): 695–705. DOI: 10.1262/jrd.18069 |
| [2] | Klionsky D J. The molecular machinery of autophagy:unanswered questions[J]. Journal of Cell Science, 2005,118(1): 7–18. DOI: 10.1242/jcs.01620 |
| [3] | Cuervo A M, Wong E. Chaperone-mediated autophagy:roles in disease and aging[J]. Cell Research, 2014,24(1): 92–104. DOI: 10.1038/cr.2013.153 |
| [4] | Wong A S, Cheung Z H, Ip N Y. Molecular machinery of macroautophagy and its deregulation in diseases[J]. Biochimica et Biophysica Acta(BBA):2011, 1812(11): 1490–1497. |
| [5] | Castino R, Bellio N, Follo C, et al. Inhibition of PI3k class Ⅲ-dependent autophagy prevents apoptosis and necrosis by oxidative stress in dopaminergic neuroblastoma cells[J]. Toxicological Sciences, 2010,117(1): 152–162. DOI: 10.1093/toxsci/kfq170 |
| [6] | Ding Y, Kim J K, Kim S I, et al. TGF-β1 protects against mesangial cell apoptosis via induction of autophagy[J]. Journal of Biological Chemistry, 2010,285(48): 37909–37919. DOI: 10.1074/jbc.M109.093724 |
| [7] | Dodson M, Liang Q, Johnson M S, et al. Inhibition of glycolysis attenuates 4-hydroxynonenal-dependent autophagy and exacerbates apoptosis in differentiated SH-SY5Y neuroblastoma cells[J]. Autophagy, 2013,9(12): 1996–2008. DOI: 10.4161/auto.26094 |
| [8] | Lock R, Debnath J. Extracellular matrix regulation of autophagy[J]. Current Opinion in Cell Biology, 2008,20(5): 583–588. DOI: 10.1016/j.ceb.2008.05.002 |
| [9] | Wu W, Zhang X, Hu X, et al. Lactate down-regulates matrix systhesis and promotes apoptosis and autophagy in rat nucleus pulposus cells[J]. Journal of Orthopaedic Research, 2014,32(2): 253–261. DOI: 10.1002/jor.v32.2 |
| [10] | Orrenius S. Reactive oxygen species in mitochondria-mediated cell death[J]. Drug Metabolism Reviews, 2007,39(2/3): 443–455. |
| [11] | Shen M, Lin F, Zhang J, et al. Involvement of the up-regulated FoxO1 expression in follicular granulosa cell apoptosis induced by oxidative stress[J]. Journal of Biological Chemistry, 2012,287(31): 25727–25740. DOI: 10.1074/jbc.M112.349902 |
| [12] | Wu Y, Tan H, Shui G, et al. Dual role of 3-methyladenine in modulation of autophagy via different temporal patterns of inhibition on classⅠand Ⅲ phosphoinositide 3-kinase[J]. Journal of Biological Chemistry, 2010,285(14): 10850–10861. DOI: 10.1074/jbc.M109.080796 |
| [13] | Song C, Song C, Tong F. Autophagy induction is a survival response against oxidative stress in bone marrow-derived mesenchymal stromal cells[J]. Cytotherapy, 2014,16(10): 1361–1370. DOI: 10.1016/j.jcyt.2014.04.006 |
| [14] | Choi J, Jo M, Lee E, et al. Induction of apoptotic cell death via accumulation of autophagosomes in rat granulosa cells[J]. Fertility and Sterility, 2011,95(4): 1482–1486. DOI: 10.1016/j.fertnstert.2010.06.006 |
| [15] | Choi J Y, Jo M W, Lee E Y, et al. The role of autophagy in follicular development and atresia in rat granulosa cells[J]. Fertility and Sterility, 2010,93(8): 2532–2537. DOI: 10.1016/j.fertnstert.2009.11.021 |
| [16] | Chen J, Ni B, Li B, et al. The responses of autophagy and apoptosis to oxidative stress in nucleus pulposus cells:implications for disc degeneration[J]. Cellular Physiology and Biochemistry, 2014,34(4): 1175–1189. DOI: 10.1159/000366330 |




