文章信息
- 蒋岁寒, 刘艳霞, 孟琳, 朱春波, 李想, 沈标, 石俊雄, 杨兴明
- JIANG Suihan, LIU Yanxia, MENG Lin, ZHU Chunbo, LI Xiang, SHEN Biao, SHI Junxiong, YANG Xingming
- 生物有机肥对烟草青枯病的田间防效及根际土壤微生物的影响
- Effects of biological organic fertilizer on field control efficiency of tobacco Ralstonia solanacearum wilt and soil microbial in rhizosphere soil
- 南京农业大学学报, 2016, 39(5): 784-790
- Journal of Nanjing Agricultural University, 2016, 39(5): 784-790.
- http://dx.doi.org/10.7685/jnau.201601053
-
文章历史
- 收稿日期: 2016-01-27
2. 贵州省烟草科学研究院, 贵州 贵阳 550000
2. Guizhou Tobacco Research Institute, Guiyang 550000, China
烟草青枯病是由茄科劳尔氏菌(Ralstonia solanacearum)引起的一种细菌性的土传病害[1], 在高温高湿的条件下, 容易大面积爆发, 造成烟区烟叶产量和质量下降, 甚至绝收[2]。以往对烟草青枯病的防控措施主要有抗病品种的选育[3]、化学药剂防控[4]及改善栽培管理[5]等方面, 然而, 这些防控措施也存在着抗病品种选育周期长, 需要大量人力物力, 化学药剂破坏环境, 轮作方式受土地限制等诸多问题[6]。近年来, 随着科技的进步和人们环保意识的加强, 生物防控方法引起了人们的重视。南京农业大学植物营养与肥料研究团队从土传病害严重的大田健康作物根际筛选拮抗菌并制成生物有机肥(BOF), 应用于香蕉枯萎病[7]、西瓜枯萎病[8]、茄子青枯病[9]、马铃薯青枯病[10]和烟草青枯病[11]等土传病害的防控, 均取得较好防效。BOF能抑制病原菌数量, 恢复病害土壤的微生物多样性, 促使土壤形成一个健康的微生物区系, 达到防控大田烟草青枯病病害的目的。本试验将BOF用于重庆市彭水县润溪烟草基地进行大田防控烟草青枯病试验, 检验BOF对烟草青枯病的防控效果, 并从生物有机肥对烟草根际土壤病原菌数量和根际土壤微生物多样性变化的影响去阐述防控的机制, 为烟草青枯病的生物防控提供理论依据。
1 材料与方法 1.1 供试材料试验烟草品种为PVH1452, 供试生物有机肥(BOF)由南京农业大学提供。BOF含有机质33.8%, 氨基酸4.3%, N 4.2%, P2O5 2.26%, K2O 1.08%。
1.2 田间试验处理于重庆市彭水县润溪乡白果坪村烟草连作田间进行试验。试验前青枯病发病率接近60%, 严重影响收成。试验地海拔1 040 m, 4-9月平均气温24 ℃, 平均累计降雨量1 104 mm。土壤类型为黄壤, 土壤pH值5.62, 有机质含量31.22 g·kg-1, 碱解氮含量125.59 mg·kg-1, 速效磷含量24.61 mg·kg-1, 速效钾含量167.87 mg·kg-1。在2个青枯病发病严重的田块进行试验, 每个田块约0.067 hm-2, 分别设2个处理, 即对照(CK)和施用BOF处理, 每个处理3个重复区组, 每区组183株烟株, 烟苗采用井窖式移栽。对照按常规施用当地烟草专用复合肥(m(N) : m(P2O5) : m(K2O)=8 : 10 : 22)750 kg·hm-2, 处理在对照基础上加施生物有机肥1 500 kg·hm-2作基肥。各处理代号分别为CK1(1号地对照处理)、BOF1(1号地施生物有机肥处理)、CK2(2号地对照处理)和BOF2(2号地施生物有机肥处理)。
1.3 田间试验病害调查及相关性状测定 1.3.1 病情测定为了评估生物有机肥在烟草整个生长期内对烟草青枯病的防治效果, 在烟草移栽后每隔10 d记载发病情况, 统计病情, 计算青枯病的发病率、病情指数和防控率。青枯病病情指数的分级调查按照《GB/T 23222—2008烟草病虫害分级及调查方法》进行。

|
烟叶采收烘烤按各处理分开单独进行。按照《GB 2635—1992烤烟》对各处理进行烟叶分级, 并按照《国家发展改革委国家烟草专卖局关于2014年烟叶收购价格政策的通知》(发改价格[2014]12号)中的《2014年烤烟价区表》和《2014年烤烟收购价格表》计算各处理的中上等烟比例和均价等生产质量指标。
1.3.3 荧光定量PCR检测土壤中青枯菌含量在烟草移栽后100 d内, 每隔20 d采样, 每个处理选取3株烟株, 采集根际土壤样品。土壤总DNA采用Soil DNA Isolation Kit(Omega)提取, 以样品DNA作为扩增模版, 用茄科劳尔氏菌16S rRNA基因的特异性引物(flicF:GAACGCCAACGGTGCGAACT; flicR:GGCGGCCTTCAGGGAGGTC)在荧光定量PCR仪上进行扩增反应。荧光定量PCR扩增反应体系(20 μL):SYBR Premix Ex TaqTM(2×)(TaKaRa)10.0 μL, ROX Reference Dye(50×)0.4 μL, flicF 0.4 μL, flicR 0.4 μL, DNA模版2.0 μL, ddH2O 6.8 μL。反应程序:95 ℃预变性30 s; 95 ℃变性5 s, 60 ℃退火30 s, 72 ℃延伸30 s, 40个循环[9]。熔解曲线步骤为95 ℃ 15 s, 60 ℃ 1 min, 95 ℃ 15 s, 反应结束后观察并确认扩增曲线和熔解曲线, 记录每个样品的CT值。将CT值代入标准曲线方程, 计算出样品模版的初始基因拷贝数并最终换算出每克干土的茄科劳尔氏菌的数量。
1.3.4 根际土壤微生物代谢多样性变化采用31种碳源的生态板(Biolog-ECO)分析根际土壤微生物的代谢多样性。首先称取10 g新鲜土壤样品, 加入90 mL无菌生理盐水中稀释, 在摇床里振摇30 min, 静止沉淀5 min, 然后进行100倍稀释, Biolog-ECO生态板每孔加入150 μL稀释后的土壤悬液。将Biolog-ECO生态板放到Biolog Omilog仪中30 ℃恒温培养72 h。每15 min自动测定波长为590和750 nm处的颜色与浊度[12]。
平均颜色变化率(AWCD)反映了土壤微生物的活性高低, 是对不同碳源利用的重要指标。AWCD值越大, 表明土壤微生物活性越高。计算土壤微生物代谢活性和微生物碳源利用率用Biolog-ECO生态板平均颜色变化率(AWCD)来表示[13]。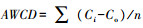
分析微生物群落功能多样性时, 常采用3种多样性指数, 其中Shannon多样性指数(H)反映土壤微生物群落的多样性, Simspon优势度指数(D)反映微生物群落的优势度, McIntosh均匀度指数(U)反映微生物群落的均匀度[14]。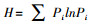
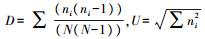
分析土壤微生物群落结构特征常将Biolog数据进行主成分分析, 可通过降维的方法, 用少数新的相互无关的变量来表示原数据中大部分的信息, 降维后的主元向量空间中可以用点的位置直观地反映出不同微生物群落的代谢特征[15]。
1.4 数据处理试验数据采用Microsoft Excel 2007, 显著性分析和主成份分析采用SPSS Statistics 20.0, 单因素方差分析差异显著性水平设为0.05。
2 结果与分析 2.1 茄科劳尔氏菌荧光定量PCR标准曲线图 1显示:荧光定量PCR中茄科劳尔氏菌的扩增效率达到98%, 标准曲线R2大于0.99。茄科劳尔氏菌的标准方程为CtR=-3.374COR+39.941。式中:CtR为茄科劳尔氏菌的CT值, COR为茄科劳尔氏菌基因拷贝数(103 g-1)。
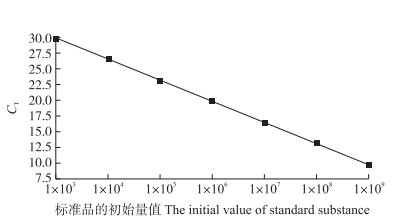
|
图 1 茄科劳尔氏菌荧光定量PCR标准曲线 Figure 1 The standard curve of Ralstonia solanacearum by real-time PCR |
从表 1可知:CK1和CK2处理的发病率分别为32.4%和34.4%, 但在施用生物有机肥后, 青枯病的发生情况显著减轻, 其中BOF1处理的发病率仅为13.4%, 防控效果为68.1%, BOF2处理的发病率为16.2%, 防控效果为70.5%。表明生物有机肥对烟草青枯病的防控有很好效果。
| 处理Treatments | 发病率/% Incidence rate | 病情指数/% Disease index | 防控效果/% Control efficiency |
| CK1 | 32.4±4.6a | 29.7±1.7a | |
| BOF1 | 13.4±1.1b | 10.3±0.9b | 68.1 |
| CK2 | 34.4±3.4a | 32.9±2.1a | |
| BOF2 | 16.2±3.1b | 9.7±0.8b | 70.5 |
| 注: 1) 同列数据后不同小写字母表示处理间在0.05水平差异显著。2) CK1、BOF1、CK2和BOF2分别表示1号地常规处理、1号地施生物有机肥处理、2号地常规处理和2号地施生物有机肥处理。 Note: 1) Different small letters in the same column mean significant difference at 0.05 level among treatments. 2) CK1, BOF1, CK2 and BOF2 represent routine treatment in No.1 field, bio-organic fertilizer treatment in No.1 field, routine treatment in No.2 field and bio-organic fertilizer treatment in No.2 field, respectively. The same as follows. |
|||
从表 2可以看出:BOF1和CK1处理相比, 产值和均价均有显著差异。而BOF2和CK2相比, 产量、产值、均价和中上等烟比例均有显著差异。生物有机肥在防控病情的同时也达到了增产、增值的效果。
| 处理 Treatments | 产量/(kg·hm-2) Yield |
产值/(元·hm-2) Yield value |
均价/(元·hm-2) Average price |
中上等烟比例/% Proportion of tobacco leaves with middle and first rank |
| CK1 | 1 747.5±121.3ab | 37 996.6±3 168.2b | 21.7±0.7b | 83.2±1.7bc |
| BOF1 | 1 903.5±87.8a | 47 446.0±2 562.5a | 24.9±0.6a | 88.3±3.0a |
| CK2 | 1 684.8±82.1ab | 35 940.8±2 301.6b | 21.3±0.5b | 81.7±1.8c |
| BOF2 | 1 866.2±40.7a | 30 256.1±1 420.4a | 24.3±0.8a | 85.7±2.1ab |
从图 2可以看出, 在烟苗移栽后0~60 d, 各处理的病原菌数量均逐渐增加, 但BOF处理均比CK的青枯菌数量增加缓慢, 表明生物有机肥对青枯菌具有抑制作用; 60~100 d, 各处理的病原菌数量增长较快, 主要由于烟株处于旺盛生长期且根系分泌物多, 适合病原菌的生长, 但由于BOF处理的青枯菌基数较低, 所以其峰值均小于CK。100 d以后, 烟株处于成熟期, 根际分泌物减少, 病原菌的数量下降。在整个生育期中, 生物有机肥处理的青枯菌数量始终低于对照, 这与发病率的结果是一致的。
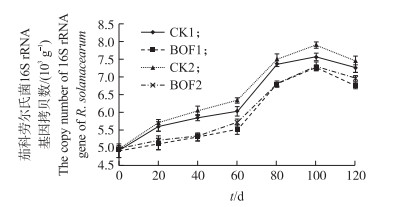
|
图 2 不同处理茄科劳尔氏菌16S rRNA基因拷贝数的变化 Figure 2 Dynamics of the copy numbers of 16S rRNA gene of R. solanacearum in tobacco rhizosphere soil in different treatments |
土壤微生物对碳源的利用情况, 可直接反映不同处理间土壤微生物总体活性的变化情况。从图 3可见:在烟草移栽后30、60和90 d时, BOF处理的AWCD值均显著高于CK, 说明生物有机肥能增进土壤微生物的活性。
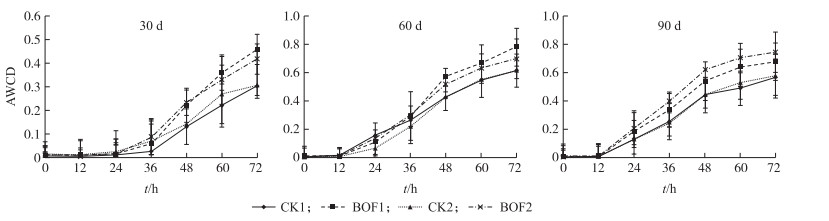
|
图 3 不同处理土壤微生物的平均颜色变化率(AWCD) Figure 3 The average well color development(AWCD)of soil microbes in different treatments |
从表 3可以看出, 在各个时期2个田块的BOF处理的Shannon指数、Simpson指数和McIntosh指数均显著高于CK处理, 说明BOF可以有效改善根际土壤微生物的群落结构, 增加多样性。
| 处理 Treatments |
Shannon指数Shannon index | Simspon指数Simspon index | McIntosh指数McIntosh index | ||||||||
| 60 d | 80 d | 100 d | 60 d | 80 d | 100 d | 60 d | 80 d | 100 d | |||
| CK1 | 3.62b | 3.03b | 3.56bc | 0.93c | 0.94c | 0.94b | 3.33b | 3.18b | 3.17b | ||
| BOF1 | 3.75a | 3.24a | 4.02a | 0.94b | 0.95b | 0.95a | 3.38a | 3.30a | 3.34a | ||
| CK2 | 3.71ab | 2.14d | 3.39c | 0.93c | 0.95b | 0.94b | 3.31b | 3.07c | 3.13b | ||
| BOF2 | 3.75a | 2.76c | 3.72ab | 0.95a | 0.96a | 0.96a | 3.38a | 3.19b | 3.31a | ||
从图 4可以看出:在PC1和PC2轴上, 不论是有机肥处理还是对照, 不同时期的分布均有差距, 说明在烟草生长过程中, 土壤微生物群落不断变化, 各个时期微生物的种群结构不同。2个CK各个时期在PC1和PC2轴上的分布都接近, 表示2个田块的CK在同一时期的微生物种群结构相似; 在同一时期, 2个BOF处理的分布也较接近, 表示他们的微生物种群结构也相似, 但在各个时期BOF处理与CK的分布都有一定的差距, 说明生物有机肥处理的土壤中微生物群落显著不同于对照, 生物有机肥对土壤微生物群落结构有显著的影响。
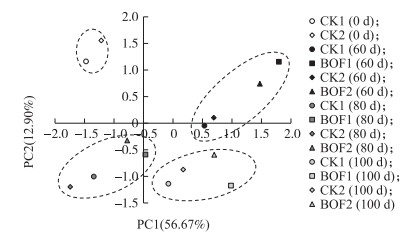
|
图 4 不同处理土壤微生物多样性的主成分分析 Figure 4 Principal analysis of soil microbe community diversity by different treatments |
研究表明, 将有机肥与拮抗微生物相结合制成生物有机肥, 有机肥为拮抗微生物提供了足够的营养物质, 使其容易在土壤中定殖, 从而有效抑制病原菌的生长, 防控作物土传病害, 提高作物产量[16-17]。目前, 生物有机肥对烟草病害防控研究逐步深入。王丽丽等[18]将解淀粉芽孢杆菌SQR-7制成的生物有机肥进行烟草青枯病盆栽防控试验, 防控率达到了66%以上。施用烟草专用生物肥可增强烟草植株抗性, 减少病害发生率, 提高烟叶产量[19]。与常规施肥相比, 施用生物有机肥能一定程度上降低烟株青枯病发病率, 提高产量产值[20]。但这些研究大多数是盆栽或小区试验, 生物有机肥的田间防效还需要大量的试验加以验证。本研究将生物有机肥用于高发病率的烟草大田, 评价生物有机肥田间防控青枯病的效果。本研究结果表明使用生物有机肥显著降低了烟草青枯病发病率和病情指数, 防控效果达到了68%以上, 同时提高了烟叶产量和产值。
烟草青枯病属于土传病害, 是否发病以及发病的严重程度除受环境因素如温度、湿度、土壤酸碱度影响外, 主要还取决于病原菌的数量[21]。刘艳霞[11]研究表明, 在有利气候条件下, 土壤中青枯病病原菌数量达到106 CFU·g-1时, 烟草开始发病。本研究中, 荧光定量PCR结果表明, 施生物有机肥前, 两个田块土壤中青枯菌数量差异不大, 均为104 CFU·g-1。随着烟株的生长发育, 根系分泌物的增多, 为病原菌的生长繁殖提供了营养, 病原菌数量逐渐增加[22-23]。但本研究中BOF处理的土壤中病原菌数量始终低于对照土壤, 病原菌的增殖速度也低于对照, 病原菌从104 CFU·g-1增至106 CFU·g-1比CK延后了20 d左右, 在移栽后60~80 d, 受高温高湿天气影响, 烟株进入发病高峰期。由于此时BOF处理的病原菌数量显著低于CK, 发病率和病情指数也低于CK。可能是因为本试验所用生物有机肥中的生防菌均从烟草大田健康植株根际土筛选所得, 也是烟草根际微生物群落的一分子, 因此回接到土壤后易于在根际定殖[24]。另外, 拮抗菌以有机肥为营养载体, 能够很好地在土壤中繁殖, 从而抑制土壤中青枯菌的生长和繁殖, 降低青枯病的发病率[25]。
生物有机肥在烟草植株根际不但可以影响土壤中的病原菌数量, 还可以调节微生物的群落多样性和功能多样性[26]。本试验中通过Biolog-ECO方法分析发现, BOF处理AWCD值均显著高于CK, 土壤微生物Shannon多样性指数、Simspon优势度指数和McIntosh均匀度指数均高于对照。这说明生物有机肥提高了土壤微生物整体代谢活性, 增加了土壤微生物的群落多样性和功能多样性, 进而提高土壤的生态功能, 对防控土传病害有非常积极的作用[27]。但是, 通过调节土壤微生态平衡抑制土传病害的方式, 需要较长的土壤培养时间, 因此要更好地防治青枯病, 可能需要连续几年施用生物有机肥, 最终使土壤能够通过自身的生态调节达到抑制病害发生的目的[28]。
综上所述, 施用由拮抗菌制成的生物有机肥能有效降低青枯病的发病率, 增加烟叶产量, 改善烟草植株生物性状, 降低土壤中病原菌数量, 有利于恢复根际土壤微生物多样性, 使连作土壤的生态系统朝着健康稳定的方向发展, 达到防控土传病害的效果。本试验证明在大田中施用生物有机肥对防控烟草青枯病具有良好的作用, 为将来的烟草青枯病生物防控奠定了基础。
| [1] | Álvarez B, Biosca E G, López M M. On the life of Ralstonia solanacearum, a destructive bacterial plant pathogen[M]//Méndez-Vilas A. Current Research, Technology and Education Topics in Applied Microbiology and Microbial Biotechnology. Badajoz:Formatex Research Center, 2010:267-279. http://formatex.info/microbiology2/isbn1-contents.pdf |
| [2] | 浙江农业大学. 农业植物病理学[M]. 上海: 上海科学技术出版社, 1980 . Zhejiang Kasetsart University. Agricultural Plant Pathology[M]. Shanghai: Shanghai Science and Technology Press, 1980 . (in Chinese) |
| [3] | 郑继法, 张建华, 许永玉, 等. 利用无毒产细菌素菌株防治烟草细菌性青枯病[J]. 中国烟草, 1994(3): 21–24. Zheng J F, Zhang J H, Xu Y Y, et al. Controlling tobacco bacterial wilt with avirulent bacteriocin-producing strain[J]. China Tobacco, 1994(3): 21–24. (in Chinese) |
| [4] | 卢洪兴, 曾军, 邱志丹, 等. 烟草青枯病发生与药剂防治研究[J]. 福建省农科院学报, 1996(3): 41–45. Lu H X, Zeng J, Qiu Z D, et al. Studies on the occurrence and chemical control of tobacco bacteria1 wilt[J]. Fujian Journal of Agricultural Sciences, 1996(3): 41–45. (in Chinese) |
| [5] | 霍沁建, 张深, 王若焱. 烟草青枯病研究进展[J]. 中国农学通报, 2007, 23(8): 364–368. Huo Q J, Zhang S, Wang R Y. Advance and control of tobacco bacterial wilt disease[J]. Chinese Agricultural Science Bulletin, 2007,23(8): 364–368. (in Chinese) |
| [6] | 宋松.烟草土传青枯病生防菌Bacillus amyloliquefaciens SQR11的分离、鉴定及其相关生防机制的研究[D].南京:南京农业大学, 2012. Song S. A preliminary study of antagonistic strain Bacillus amyloliquefaciens SQR11 against eggplant bacterial wilt and studies on its resistant mechanism[D]. Nanjing:Nanjing Agricultural University, 2012(in Chinese with English abstract). http://cdmd.cnki.com.cn/article/cdmd-10307-1013284626.htm |
| [7] | 何欣, 郝文雅, 杨兴明, 等. 生物有机肥对香蕉植株生长和香蕉枯萎病防治的研究[J]. 植物营养与肥料学报, 2010, 16(4): 978–985. He X, Hao W Y, Yang X M, et al. Effects of bio-organic fertilizer on growth and controlling fusarium-wilt disease of banana[J]. Plant Nutrition and Fertilizer Science, 2010,16(4): 978–985. (in Chinese) |
| [8] | 凌宁, 王秋君, 杨兴明, 等. 根际施用微生物有机肥防治连作西瓜枯萎病研究[J]. 植物营养与肥料学报, 2009, 15(5): 1136–1141. Ling N, Wang Q J, Yang X M, et al. Control of Fusarium wilt of watermelon by nursery application of bio-organic fertilizer[J]. Plant Nutrition and Fertilizer Science, 2009,15(5): 1136–1141. (in Chinese) |
| [9] | 丁传雨, 乔焕英, 沈其荣, 等. 生物有机肥对茄子青枯病的防治及其机理探讨[J]. 中国农业科学, 2012, 45(2): 239–245. Ding C Y, Qiao H Y, Shen Q R, et al. Control effect and action mechanism research of bio-organic fertilizer on eggplant bacterial wilt[J]. Scientia Agricultura Sinica, 2012,45(2): 239–245. (in Chinese) |
| [10] | 郑新艳, 韦巧婕, 沈标. 生物有机肥防治马铃薯青枯病的机制研究[J]. 南京农业大学学报, 2013, 36(2): 70–76. Zheng X Y, Wei Q J, Shen B. Study on the mechanism of bio-organic fertilizer controlling potato bacterial wilt[J]. Journal of Nanjing Agricultural University, 2013,36(2): 70–76. DOI: 10.7685/j.issn.1000-2030.2013.02.012 (in Chinese) |
| [11] | 刘艳霞.土传烟草青枯病的生物防控及其机理研究[D].南京:南京农业大学, 2012. Liu Y X. Study on biological control of tobacco bacterial wilt and its mechanisms of action[D]. Nanjing:Nanjing Agricultural University, 2012(in Chinese with English abstract). http://cdmd.cnki.com.cn/article/cdmd-10307-1013282626.htm |
| [12] | 凌琪, 包金梅, 李瑞, 等. Biolog-Eco解析黄山风景区空气微生物碳代谢多样性特征[J]. 应用基础与工程科学学报, 2012, 20(1): 56–63. Ling Q, Bao J M, Li R, et al. Analysis of carbon metabolism diversity characters of air microbes in Huangshan scenic spot using Biolog-Eco method[J]. Journal of Basic Science and Engineering, 2012,20(1): 56–63. (in Chinese) |
| [13] | 于镇华, 元野, 刘居东, 等. Biolog-Eco解析垦殖与自然恢复黑土微生物群落代谢功能季节变化[J]. 土壤与作物, 2013, 2(3): 105–111. Yu Z H, Yuan Y, Liu J D, et al. Seasonal variations of microbial community functional diversity in cultivated and natural restored mollisols using Biolog-Eco method[J]. Soil and Crop, 2013,2(3): 105–111. (in Chinese) |
| [14] | Staddon W J, Duchesne L C, Trevors J T. Microbial diversity and community structure of postdisturbance forest soils as determined by sole-carbon-source utilization patterns[J]. Microbial Ecology, 1997,34(2): 125–130. DOI: 10.1007/s002489900042 |
| [15] | 张志明, 许艳丽, 韩晓增, 等. 连续施肥对农田黑土微生物功能多样性的影响[J]. 生态学杂志, 2012, 31(3): 647–651. Zhang Z M, Xu Y L, Han X Z, et al. Effect of continuous fertilization on microbial functional diversity in black soil under cropland[J]. Chinese Journal of Ecology, 2012,31(3): 647–651. (in Chinese) |
| [16] | Hoitink H A J, Boehm M J. Biocontrol within the context of soil microbial communities:a substrate-dependent phenomenon[J]. Annual Review of Phytopathology, 1999,37: 427–446. DOI: 10.1146/annurev.phyto.37.1.427 |
| [17] | Trillas M I, Casanova E, Cotxarrera L, et al. Composts from agricultural waste and the Trichoderma asperellum, strain T-34 suppress Rhizoctonia solani, in cucumber seedlings[J]. Biological Control, 2006,39(1): 32–38. DOI: 10.1016/j.biocontrol.2006.05.007 |
| [18] | 王丽丽, 石俊雄, 袁赛飞, 等. 微生物有机肥结合土壤改良剂防治烟草青枯病[J]. 土壤学报, 2013, 50(1): 150–156. Wang L L, Shi J X, Yuan S F, et al. Control of tobacco bacterial wilt with biomanure plus soil amendments[J]. Acta Pedologica Sincia, 2013,50(1): 150–156. (in Chinese) |
| [19] | 陈态. 烟草多抗生物有机肥对病虫害防治效果及烟株生长的影响[J]. 现代农业科技, 2009(2): 131–132. Chen T. Effect of bio-organic on control of diseases and insect pests and its influence on tobacco growth[J]. Modern Agricultural Science and Technology, 2009(2): 131–132. (in Chinese) |
| [20] | 邓玉铉, 罗志威, 徐滔明, 等. 生物有机肥在烟草生产上的应用研究[J]. 湖南农业科学, 2015(8): 57–59. Deng Y X, Luo Z W, Xu T M, et al. Application research of bio-organic fertilizeron on tobacco production[J]. Hunan Agricultural Sciences, 2015(8): 57–59. (in Chinese) |
| [21] | 刘宪臣.温湿度对烟草青枯病发生的影响及调控技术研究[D].重庆:西南大学, 2014. Liu X C. A study on effects of changes and control of temperature and humidity on the occurring of tobacco bacterial wilt and thecontrol techniques[D]. Chongqing:Southwest University, 2014(in Chinese with English abstract). http://cdmd.cnki.com.cn/article/cdmd-10635-1014264621.htm |
| [22] | 刘军, 温学森, 郎爱东. 植物根系分泌物成分及其作用的研究进展[J]. 食品与药品, 2007, 9(3): 63–65. Liu J, Wen X S, Lang A D. Progress in components and effects of plant root exudates[J]. Food and Drug, 2007,9(3): 63–65. (in Chinese) |
| [23] | 李艳红, 徐智, 汤利, 等. 化肥减量配施生物有机肥对烤烟青枯病及其病原菌的影响[J]. 云南农业大学学报(自然科学版), 2015, 30(4): 612–617. Li Y H, Xu Z, Tang L, et al. Effects of combined appling chemical-fertilizers with bio-organic Fertilizers on bacterial wilt and its pathogen of flue-cured tobacco[J]. Journal of Yunnan Agricultural University(Natural Science Edition), 2015,30(4): 612–617. (in Chinese) |
| [24] | Koga K, Hara H, Tanaka H. Suppressive soils to bacterial wilt of tobacco in Japan and population dynamics of Pseudomonas solanacearum in these soils[J]. Jpn J Phytopathol, 1997,63: 304–308. DOI: 10.3186/jjphytopath.63.304 |
| [25] | El-Abyad M S, El-Sayed M A, El-Shanshoury A R, et al. Towards the biological control of fungal and bacterial diseases of tomato using antagonistic Streptomyces spp.[J]. Plant and Soil, 1993,149(2): 185–195. DOI: 10.1007/BF00016608 |
| [26] | 张云伟, 徐智, 汤利, 等. 生物有机肥对烤烟黑胫病及根际微生物代谢功能多样性的影响[J]. 中国烟草学报, 2014, 20(5): 59–65. Zhang Y W, Xu Z, Tang L, et al. Effects of bio-organic fertilizer on black shank of flue-cured tobacco and rhizospheric microbial metabolic functional diversity[J]. Acta Tabacaria Sinica, 2014,20(5): 59–65. (in Chinese) |
| [27] | 孙薇, 钱勋, 付青霞, 等. 生物有机肥对秦巴山区核桃园土壤微生物群落和酶活性的影响[J]. 植物营养与肥料学报, 2013, 19(5): 1224–1233. Sun W, Qian X, Fu Q X, et al. Effects of bio-organic fertilizer on soil microbial community and enzymes activities in walnut orchards of the Qinling-Bashan region[J]. Journla of Plant Nutrition and Fertilizer, 2013,19(5): 1224–1233. (in Chinese) |
| [28] | 李红丽, 郭夏丽, 李清飞, 等. 抑制烟草青枯病生物有机肥的研制及其生防效果研究[J]. 土壤学报, 2010, 47(4): 798–801. Li H L, Guo X L, Li Q F, et al. Tobacco wilt suppressing bio-manure and its bio-control effect[J]. Acta Pedologica Sincia, 2010,47(4): 798–801. (in Chinese) |




