文章信息
- 王冲, 周惜时, 夏妍, 陈晨, 郑录庆, 沈振国, 陈亚华
- WANG Chong, ZHOU Xishi, XIA Yan, CHEN Chen, ZHENG Luqing, SHEN Zhenguo, CHEN Yahua
- 铜胁迫下黄花月见草根系蛋白质组学分析
- Proteomics analysis of Oenothera glazioviana seedling roots under copper stress
- 南京农业大学学报, 2016, 39(5): 754-762
- Journal of Nanjing Agricultural University, 2016, 39(5): 754-762.
- http://dx.doi.org/10.7685/jnau.201603003
-
文章历史
- 收稿日期: 2016-03-02
2. 南京农业大学农村土地资源利用与整治国家地方联合工程研究中心, 江苏 南京 210095 ;
3. 江苏省有机固体废弃物资源化协同创新中心, 江苏 南京 210095
2. National Joint Local Engineering Research Center for Rural Land Resources Use and Consolidation, Nanjing Agricultural University, Nanjing 210095, China ;
3. Jiangsu Collaborative Innovation Center for Solid Organic Waste Resource Utilization, Nanjing 210095, China
土壤重金属污染已经成为世界性的环境问题, 土壤中过量的重金属不仅影响作物的产量和品质, 还可以危害人体的健康。提高植物重金属耐性能够降低由重金属污染带来的负面影响。铜是植物生长发育的必需元素, 它广泛参与植物体生长发育过程中的各种代谢, 能够对植物正常生长与代谢起关键性的作用[1-2]。但是, 植物正常生长所需的铜含量有一定的范围, 过量的铜会影响植物正常生长代谢, 使植物根系生长受到抑制, 生物量下降, 产生严重的毒害作用[3-4]。如果植物体内含有过量的铜, 不仅会对植物造成胁迫, 而且还通过植物根、茎、叶和果实等进入到食物链中, 从而危害人类健康[5]。随着分子生物学研究的深入, 高通量基因组学、转录组学和蛋白质组学等研究方法的涌现, 为植物抗逆响应机制研究提供了新途径。
黄花月见草(Oenothera glazioviana), 柳叶菜科, 月见草属, 1、2年生或多年生草本植物, 原产北美洲[6]。由于其根系中能够大量积累铜, 且自身具有很低的铜转运系数, 即从环境中吸收的铜绝大多数积累在根系, 往地上部转运的铜较少, 所以可以定义为一种铜排斥型植物。近年来开始人工栽培黄花月见草, 其可以作为铜矿区主体修复植物来对污染土壤进行改善[2, 7]。重金属对于植物体生理生化影响的研究已有很多, 而关于离子毒害机制的研究多集中在作物上, 对于土壤修复植物的金属离子响应机制仍处于探讨阶段[8-10]。而且, 对于黄花月见草耐铜性的报道都是围绕其生理表型、生化反应等方面, 而利用蛋白质组学技术开展黄花月见草根系生长发育和铜胁迫响应的研究尚未见报道。鉴于此, 我们研究了不同铜浓度处理下, 黄花月见草根系生长发育、铜含量和蛋白质组表达差异, 以探索其在重金属胁迫下的分子响应机制, 以期为修复植物金属响应的理论研究和土壤修复提供基本依据。
1 材料与方法 1.1 植物材料和试验设计供试植物为黄花月见草(Oenothera glazioviana), 采用水培的试验方法。水培选取饱满的植物种子, 消毒后播种在蛭石基质上发芽, 待幼苗两片子叶完全展开后, 选取长势和大小一致的幼苗, 用海绵将其固定在有孔的黑色有机玻璃板上, 然后放置在盛有1 L营养液的烧杯中培养。幼苗移栽到营养液中后, 初始培养时使用1/8 Hoagland营养液, 然后逐步换成1/4、1/2以至完全营养液, 用HCl或KOH溶液将营养液pH值调至5.45, 植物生长在可控的温室中, 培养条件如下:昼夜温度25 ℃/20 ℃, 相对湿度60%~80%, 光照时间12 h, 光照强度400 μmol·m-2·s-1。待幼苗生长至4叶1心期(不包括子叶)开始如下处理:0(对照Control)、25、50和100 μmol·L-1 CuSO4处理3 d后, 收集黄花月见草根系, 每个处理15株, 每5株混合作为1次重复, 取样后测定或冷冻保存于-80 ℃超低温冰箱待测。
1.2 根系和地上部指标测定选取不同浓度铜处理3 d后的幼苗, 采用WRHIZO全自动根系分析系统测定其根长、根尖数目、根系表面积和根系体积。采用LI-3000C便携式叶面积仪测定叶表面积。
1.3 铜含量测定铜处理3 d后, 每个处理植物根浸入25 mmol·L-1 EDTA-Na溶液中交换15 min, 以解吸根系表面吸附的金属离子, 再用去离子水将植物洗净吸干, 取根系放置120 ℃烘箱中30 min杀青, 之后烘干至恒质量, 准确称取(0.200 0±0.001 0)g, 加入V(HNO3) : V(HClO4)=87 : 13的混酸, 在电热消解仪(DigiBlock ED-54)上消煮。用电感耦合等离子体发射光谱仪(ICP-OES, Perkin Elmer Optima 2100DV)测定铜元素含量。
1.4 蛋白质样品制备蛋白质的提取采用TCA-丙酮法。称取黄花月见草根系1.0 g, 立即放入预冷的加有0.5 g PVP的研钵中, 加液氮研磨成均匀粉末, 加入预冷的100 g ·L-1三氯乙酸丙酮溶液(含0.07% β-巯基乙醇), 混匀, 置于-20 ℃过夜, 然后在4 ℃下15 000 r·min-1离心30 min, 弃去上清液, 沉淀用预冷的丙酮(含0.07% β-巯基乙醇)重悬, 重复上述步骤, 至上清液无色后, 沉淀经真空干燥制成蛋白质干粉。取适量蛋白质干粉加入裂解液, 20~25 ℃水浴超声30 min, 然后在25 ℃下18 000 r·min-1离心15 min, 弃沉淀, 上清液即蛋白质样品溶液, 置于-20 ℃冰箱保存备用。按Bradford法测定蛋白质含量[11]。
1.5 蛋白质样品酶解与脱盐取200 μg蛋白加入1 μL二硫苏糖醇(DTT), 60 ℃孵育1 h, 放置室温几分钟后, 加入10 μL碘化乙酰胺(IAM), 暗处室温放置45 min, 按照质量比为1 : 50加入测序级胰蛋白酶(Promega)溶液, 37 ℃反应过夜(16 h左右)。将酶解后的溶液转入截留蛋白相对分子量为10×103的超滤管中, 16 000 r·min-1离心25 min, 转移离心下来的液体至新离心管中, 加入终浓度为0.2%(体积分数)甲酸终止酶解反应。若有较多盐分, 则用微量层析柱(Ziptip)进行脱盐。取相同肽段量样品进行真空离子浓缩至干, 待上样。
1.6 质谱分析挥干后的肽段样品, 用0.2%甲酸水溶液复溶。每次进样量1.5 μg肽段量。质谱分析采用Thermo公司的液相色谱-二维线性离子阱质谱(LC-MS/MS, 型号LTQ-XL)进行[12]。高效液相色谱分析条件:1)色谱柱:BioBasic C18 Column(100 mm×0.18 mm, 粒径:5 μm); 2)进样量:10 μL; 3)流动相:A:0.1%甲酸水溶液; B:0.1%甲酸乙腈溶液; 梯度:5%~35%流动相B 20 min, 35%~95%流动相B 2 min; 流速:0.25 μL·min-1。质谱分析条件:喷雾电压3.5 kV; 毛细管温度275 ℃; 鞘气流速15 arb; 母离子扫描范围200~2 000 m·z-1; 隔离宽度2 Da。二级质谱条件:自动触发离子强度为1×104; 碰撞能量为35%。
1.7 数据分析非标记定量技术(label-free)定量不需要对样本进行特定标记处理, 只需要比较特定肽段/蛋白在不同样品间的色谱质谱响应信号便可得到样品间蛋白表达量的变化。质谱分析所获得的原始数据用Proteome Discoverer 1.4软件进行相对定量分析以及数据库检索。蛋白结果进行相对定量分析后, 参考Xie等[13]的方法, 稍作改动, 筛选差异表达蛋白参数如下:3组不同处理浓度至少有1组蛋白相对定量结果的处理组与对照组的含量比值(ratio)大于等于1.2(上调表达)或ratio小于等于0.83(下调表达), 且显著性水平(P < 0.05)。所用数据库为UniProt的绿色植物(Uniprot-Viridiplantae.fasta)蛋白库。再到UniProt(http://www. uniprot.org/)进行蛋白质GO(Gene Ontology)中BP(Biological Process)功能查询, 并结合文献进行蛋白质的功能分类。
1.8 层序聚类分析用Cluster 3.0软件进行蛋白定量结果层序聚类分析, 得出结果后用埃森软件树视图(Eisensoftware-TreeView)编辑。一个特定组中类似表达谱的蛋白以热图形式展示[14]。
2 结果与分析 2.1 不同浓度铜胁迫对黄花月见草生长特性的影响由表 1可见:与对照相比, 随着铜处理浓度的增加, 黄花月见草叶片表面积、根系长度、根尖数、根系表面积、根系体积均呈下降趋势, 下降趋势随处理浓度的增加而加大。25、50和100 μmol·L-1铜处理时, 叶表面积分别比对照降低了15.64%、21.96%和32.90%, 但是在100 μmol·L-1处理时才出现显著性差异; 根长与对照相比分别降低了2.58%、10.78%和22.61%, 也是在100 μmol·L-1处理时达到显著水平; 根尖数在25、50和100 μmol·L-1时都存在显著性差异; 根系表面积和根系体积在25 μmol·L-1处理时就显著降低, 而且降低趋势随着处理浓度增加而变大。此外, 由图 1可见:根系在铜处理下出现黄化现象, 而且随着铜处理浓度的增加, 根系黄化程度加深。
| 生理指标 Physiological index |
c(Cu)/(μmol·L-1) | |||
| 0(对照Control) | 25 | 50 | 100 | |
| 根长/cm Root length | 19.02±1.80a | 18.53±0.92a | 16.97±0.51b | 14.72±1.06c |
| 根尖数 Root tips | 382.67±81.00a | 244.75±50.76b | 151.67±27.54b | 117.00±43.35b |
| 根系体积/cm3 Root volume | 0.32±0.01a | 0.22±0.02b | 0.20±0.07bc | 0.18±0.04c |
| 根系表面积/cm2 Root surf area | 40.67±1.77a | 24.76±2.47b | 23.08±8.47b | 21.18±3.30b |
| 叶表面积/cm2 Leaf surf area | 11.25±1.19a | 9.49±0.28b | 8.78±0.57b | 7.55±0.57c |
| 注:同一行不同字母表示在0.05水平差异显著。Different letters in the same row indicate significant difference at 0.05 level. | ||||

|
图 1 不同浓度Cu处理下黄花月见草生长的表型 Figure 1 Phenotype of the O.glazioviana seedling under Cu treatments |
由图 2-A可见:不同浓度铜处理3 d后, 黄花月见草地上部位与根部铜含量都有所增加, 但是地上部位铜增加量较少, 在100 μmol·L-1铜处理时与对照相比仅增加了1倍。根系中铜含量增加显著, 25、50和100 μmol·L-1 Cu处理时, 与对照相比分别增加了4.9、17.4和61.7倍(2 685 mg·kg-1)。由图 2-B可以看出:随着Cu处理浓度的增加, 黄花月见草对于Cu的转运系数逐渐降低。结果表明:黄花月见草从外界吸收铜离子后主要积累在根部, 而往地上部位转运量很少。
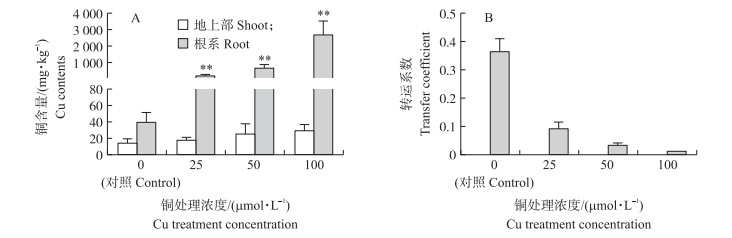
|
图 2 铜处理对黄花月见草铜含量(A)和转运系数(B)的影响 Figure 2 Effects of Cu treatment on Cu contents(A)and transfer coefficient(B)of O.glazioviana * * P < 0.01 |
采用Label-free方法对黄花月见草在4个铜浓度下蛋白进行分析(n=5)。经定量分析后共鉴定出46个蛋白, 根据Cluster软件按蛋白表达趋势总共分为5类(图 3)。第1类蛋白在50 μmol·L-1处理时表达较25 μmol·L-1处理时下调, 在100 μmol·L-1时表达又出现上调, 包含2个蛋白; 第2类蛋白在50 μmol·L-1处理时较25 μmol·L-1处理时下调, 但在100 μmol·L-1时与50 μmol·L-1时表达水平持平, 包含8个蛋白; 第3类蛋白绝大部分在3个浓度下表达差异变化不大, 但呈现下降趋势, 有2个特殊蛋白在50 μmol·L-1处理时较25 μmol·L-1时表达上调, 但是在100 μmol·L-1又出现下降趋势, 共包含17个蛋白; 第4类蛋白在50 μmol·L-1处理时比25 μmol·L-1时表达上调, 在100 μmol·L-1时持续上调, 包含9个蛋白; 第5类蛋白在50 μmol·L-1处理时比25 μmol·L-1时表达上调, 在100 μmol·L-1时与50 μmol·L-1时表达水平持平, 包含10个蛋白; 按照蛋白质BP可以大致分为5类(表 2), 分别是蛋白质合成与降解(30%)、碳水化合物与能量代谢(39%)、信号传导(22%)、抗氧化(7%)和发育(2%)相关蛋白。
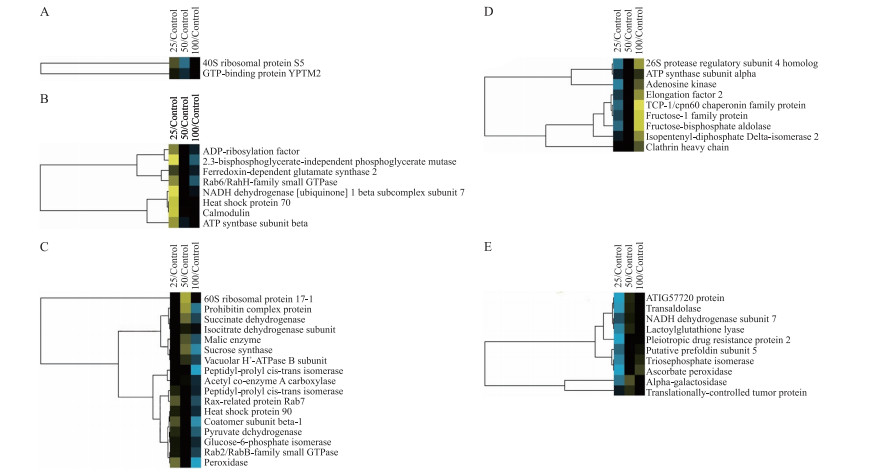
|
图 3 差异表达蛋白的聚类分析图 Figure 3 The cluster analysis of differential expression proteins |
| 登录号1 Accession No. | 蛋白名称 Protein names | 基因名2 Gene names | 物种 Organism | 特征肽段3 Unique peptides | 特征序列覆盖率/% Unique sequence coverage | 相对分子质量/103 Molecular weight |
比值4 Ratio |
||
| 25/ Control |
50/ Control |
100/ Control |
|||||||
| 蛋白合成与降解代谢Protein synthesis/degradation metabolism | |||||||||
| Q39641 | 热激蛋白70 Heat shock protein 70 |
Hsp70 | 小黄瓜 Cucumis sativus |
2 | 5.9 | 74.402 | 1.200 | 1.488 | 1.884 |
| P46466 | 26S蛋白酶调节亚基4 26S protease regulatory subunit 4 homolog |
TBP2 | 粳稻 Oryza sativa subsp.japonica |
3 | 14.7 | 41.837 | 0.898 | 1.136 | 1.425 |
| E3JPR7 | 核糖基化因子 ADP-ribosylation factor |
ADF | 花生 Arachis diogoi |
8 | 72.4 | 17.439 | 0.595 | 0.492 | 0.460 |
| B3TLN7 | 40S核糖体蛋白S5 40S ribosomal protein S5 |
RPS5 | 油棕榈 Elaeis guineensis var.tenera |
2 | 16.2 | 19.193 | 1.999 | 1.716 | 1.890 |
| B7FJH0 | 抑制素复合蛋白 Prohibitin complex protein |
MTR_3g008250 | 蒺藜苜蓿 Medicago truncatula |
3 | 13.7 | 30.333 | 0.674 | 0.844 | 0.533 |
| Q9T0P4 | 铁氧还谷氨酸合成酶2 Ferredoxin-dependent glutamate synthase 2 |
GLU2 | 拟南芥 Arabidopsis thaliana |
2 | 1.7 | 177.080 | 0.812 | 0.741 | 0.699 |
| C0Z2J4 | AT1G57720蛋白 AT1G57720 protein |
At1g57720 | 拟南芥 Arabidopsis thaliana |
2 | 9.5 | 43.953 | 1.084 | 1.766 | 1.668 |
| A6N0X3 | 60S核糖体蛋白17-1 60S ribosomal protein 17-1 |
籼稻 Oryza sativa subsp.indica |
4 | 18.9 | 28.575 | 2.547 | 3.295 | 2.509 | |
| G7IRR6 | 蛋白二硫键异构酶 Protein disulfide-isomerase |
PDI | 蒺藜苜蓿 Medicago truncatula |
2 | 4.6 | 63.018 | 0.771 | 0.769 | 0.508 |
| A8JHX9 | 延伸因子2 Elongation factor 2 |
EFG2 | 莱茵藻 Chlamydomonas reinhardtii |
2 | 2.1 | 94.056 | 0.943 | 1.054 | 1.306 |
| Q14TB1 | 热激蛋白90 Heat shock protein 90 |
hsp90 | 烟草 Nicotiana tabacum |
2 | 2.4 | 80.271 | 1.357 | 1.525 | 1.756 |
| S8CE21 | 肽脯氨酰顺反异构酶 Peptidyl-prolyl cis-trans isomerase |
PPI | 螺旋狸藻黄花 Genlisea aurea |
2 | 15.1 | 18.064 | 0.742 | 0.709 | 0.660 |
| G7KRA6 | TCP-1/cpn60伴侣家族蛋白 TCP-1/cpn60 chaperonin family protein | MTR_7g067470 | 蒺藜苜蓿 Medicago truncatula |
2 | 5.3 | 57.195 | 0.316 | 0.385 | 0.590 |
| W9R2M3 | 假定预折叠亚基5 Putative prefoldin subunit 5 |
L484_004772 | 桑树 Morus notabilis |
2 | 19.2 | 16.578 | 0.719 | 0.994 | 1.017 |
| 碳水化合物与能量代谢Carbohydrate and energy metabolism | |||||||||
| B5LAS7 | 乙酰辅酶A羧化酶 Acetyl co-enzyme A carboxylase |
甜椒 Capsicum annuum |
2 | 7.5 | 58.443 | 0.788 | 0.800 | 0.726 | |
| B5TM95 | NADH脱氢酶亚基7 NADH dehydrogenase subunit 7 |
NAD7 | 拟南芥 Arabidopsis thaliana |
5 | 20.6 | 36.460 | 1.038 | 1.252 | 1.210 |
| V4TYQ0 | 苹果酸酶 Malic enzyme |
CICLE_v10024268mg | 金钱橘 Citrus clementina |
2 | 4.2 | 69.464 | 2.793 | 1.892 | 1.675 |
| B9GTJ7 | 果糖-1家族蛋白 Fructose-1 family protein |
POPTR_0002s06960g | 杨树 Populus trichocarpa |
3 | 12.8 | 36.793 | 1.241 | 1.410 | 1.923 |
| W9SB91 | NADH脱氢酶[泛醌] 1β亚体亚基7 NADH dehydrogenase[ubiquinone] 1 beta subcomplex subunit 7 | L484_001336 | 桑树 Morus notabilis |
2 | 21.4 | 11.579 | 0.725 | 0.361 | 0.347 |
| M7ZEV2 | 琥珀酸脱氢酶 Succinate dehydrogenase |
TRIUR3_11055 | 乌拉尔图小麦 Triticum urartu |
6 | 18.4 | 65.222 | 2.758 | 2.884 | 2.666 |
| I0IK64 | 蔗糖合成酶 Sucrose synthase |
SuSy3 | 桉树 Eucalyptus globulus subsp.globulus |
2 | 2.5 | 91.687 | 3.150 | 3.665 | 2.381 |
| G9CG05 | 果糖二磷酸醛缩酶 Fructose-bisphosphate aldolase |
克拉花 Clarkia xantiana subsp.xantiana |
4 | 51.1 | 15.244 | 1.662 | 1.810 | 1.103 | |
| B9RFW4 | 丙酮酸脱氢酶 Pyruvate dehydrogenase |
RCOM_1437610 | 蓖麻 Ricinus communis |
2 | 13.9 | 38.775 | 1.783 | 1.742 | 1.621 |
| B7FLD9 | 2, 3-二磷酸甘油酸-独立磷酸甘油酸变位酶 2, 3-bisphosphoglycerate-independent phosphoglycerate mutase | MTR_7g074570 | 蒺藜苜蓿 Medicago truncatula |
3 | 5.2 | 61.058 | 1.060 | 0.721 | 0.603 |
| V4SXS4 | 异柠檬酸脱氢酶亚基 Isocitrate dehydrogenase subunit |
CICLE_v10011936mg | 金钱橘 Citrus clementina |
2 | 6.2 | 40.777 | 1.207 | 1.248 | 1.174 |
| B9T0A9 | 腺苷激酶 Adenosine kinase |
RCOM_0262240 | 蓖麻 Ricinus communis |
2 | 11.0 | 46.453 | 0.481 | 0.624 | 0.711 |
| M5X2A0 | 磷酸丙糖异构酶 Triosephosphate isomerase |
PRUPE_ppa010323mg | 桃树 Prunus persica |
3 | 16.5 | 27.279 | 2.606 | 3.426 | 3.610 |
| B6TS84 | 转醛醇酶 Transaldolase |
玉米 Zea mays |
2 | 5.4 | 47.888 | 0.563 | 0.815 | 0.777 | |
| Q7M2G6 | ATP合成酶α亚基 ATP synthase subunit alpha |
大花月见草 Oenothera villaricae |
3 | 7.7 | 53.323 | 1.634 | 1.676 | 1.723 | |
| P37399 | ATP合成酶β亚基 ATP synthase subunit beta |
ATPB | 胡萝卜 Daucus carota |
3 | 6.6 | 59.135 | 1.371 | 1.043 | 1.095 |
| P54243 | 6-磷酸葡萄糖异构酶 Glucose-6-phosphate isomerase |
PGIC | 合欢月见草 Oenothera sinuata var.hirsuta |
7 | 19.2 | 62.685 | 2.012 | 1.960 | 1.813 |
| Q2MK92 | α-半乳糖苷酶 Alpha-galactosidase |
小黄瓜 Cucumis sativus |
3 | 10.7 | 45.697 | 0.787 | 1.107 | 0.986 | |
| 信号传导Signal transduction | |||||||||
| A9SC62 | Rab2/RabB家族小G蛋白 Rab2/RabB-family small GTPase |
RabB12 | 小立碗藓 Physcomitrella patens subsp.patens |
4 | 34.1 | 17.829 | 0.816 | 0.794 | 0.700 |
| A9RJ78 | Rab6/RabH家族小G蛋白 Rab6/RabH-family small GTPase |
RabH11 | 小立碗藓 Physcomitrella patens subsp.patens |
5 | 29.0 | 22.997 | 0.857 | 0.700 | 0.592 |
| M8C7F4 | GTP结合蛋白YPTM2 GTP-binding protein YPTM2 |
F775_29863 | 节节麦 Aegilops tauschii |
2 | 18.2 | 21.515 | 0.446 | 0.397 | 0.432 |
| F4HQE6 | 包被体β亚基-1 Coatomer subunit beta′-1 |
At1g79990 | 拟南芥 Arabidopsis thaliana |
4 | 5.4 | 104.140 | 1.235 | 1.101 | 0.817 |
| A6Y950 | 液泡质子泵ATP酶B亚基 Vacuolar H+-ATPase B subunit |
VHA-B | 蒺藜苜蓿 Medicago truncatula |
15 | 52.9 | 54.110 | 0.565 | 0.604 | 0.497 |
| I1J8Z9 | 内涵蛋白重链 Clathrin heavy chain |
CHC1 | 大豆 Glycine max |
2 | 1.4 | 192.740 | 0.824 | 0.857 | 0.965 |
| B6UEL3 | Ras相关蛋白Rab7 Ras-related protein Rab7 |
玉米 Zea mays |
2 | 17.9 | 23.182 | 0.362 | 0.320 | 0.276 | |
| P04464 | 钙调蛋白 Calmodulin |
小麦 Triticum aestivum |
2 | 10.7 | 16.847 | 1.692 | 1.238 | 1.247 | |
| V7BP31 | 乳酸先谷胱甘肽裂解酶 Lactoylglutathione lyase |
PHAVU_006G149400g | 菜豆 Phaseolus vulgaris |
2 | 9.8 | 32.350 | 1.535 | 2.119 | 2.013 |
| W9QHU3 | 多效耐药蛋白2 Pleiotropic drug resistance protein 2 |
L484_013784 | 桑树 Morus notabilis |
3 | 3.0 | 167.190 | 0.672 | 0.957 | 0.957 |
| 氧化还原Oxidoreduction | |||||||||
| Q39471 | 异戊二磷酸果糖δ-异构酶2 Isopentenyl-diphosphate delta-isomerase 2 | IPI2 | 仙女扇 Clarkia breweri |
5 | 21.0 | 32.561 | 2.636 | 2.783 | 3.416 |
| I7HD42 | 抗坏血酸过氧化酶 Ascorbate peroxidase |
APX2 | 枣 Ziziphus jujuba |
2 | 12.7 | 28.073 | 1.045 | 1.603 | 1.755 |
| V7CIB9 | 过氧化物酶 Peroxidase |
PX | 菜豆 Phaseolus vulgaris |
2 | 7.0 | 34.028 | 1.245 | 1.067 | 0.558 |
| 发育Development | |||||||||
| B9RT61 | 翻译调控瘤蛋白 Translationally-controlled tumor protein |
TCTP | 蓖麻 Ricinus communis |
2 | 22.0 | 18.962 | 0.521 | 0.583 | 0.549 |
| 注: 1 Uniprot数据库的登录号Accession number according to the UniProt database; 2蛋白所应对的基因名The gene name of the corresponding protein; 3蛋白所含有的特征肽段The unique peptide of the corresponding protein; 4处理与对照组的蛋白含量的比值The ratio between proteins content of identified protein in treated vs control. | |||||||||
铜是植物正常生命活动所必需的微量元素, 可以使某些酶和蛋白都保持活性, 在生物的生理生化过程都有极其重要的作用。但是, 当在植物体内的铜含量超过一定阈值后, 植物就会出现各种应激反应。大量研究证明, 重金属逆境会影响植物代谢, 对光合作用、呼吸作用、糖代谢、蛋白合成以及生长发育等各个方面都会产生影响[15]。本研究中, 黄花月见草在100 μmol·L-1 Cu处理时其根部铜含量(2 685 mg·kg-1)远大于地上部铜含量(29.01 mg·kg-1), 与文献[7]报道一致。本试验设计4个Cu处理浓度, 在一定浓度(25 μmol·L-1)铜处理时黄花月见草各方面都与对照没有显著差异, 生长状况都比较正常。在高浓度(100 μmol·L-1)铜胁迫时, 黄花月见草生长受到严重抑制, 说明其自身虽然存在一定抵御铜胁迫的能力, 但超过自身修复能力范围后也无法保证各种生长发育正常进行。
3.2 差异表达蛋白分析 3.2.1 铜胁迫下黄花月见草根系蛋白质合成与降解相关蛋白表达本研究共鉴定到14个相关蛋白, 其中大部分为分子伴侣蛋白, 此类蛋白主要参与细胞内蛋白质的重新折叠、加工、稳定及蛋白质变性后的复性、胞内运输、降解以及修复受损的蛋白质等, 维持胞内环境稳态。本次试验鉴定到热激蛋白70和90, 蛋白质二硫键异构酶和肽基脯氨酰顺反异构酶。其上调表达说明对保护植物细胞免受进一步的损伤, 对短期减轻逆境引起的伤害有很大的作用。60S和40S核糖体蛋白具有调节蛋白选择转录翻译功能。有研究曾报道拟南芥经历盐胁迫后某些核糖体蛋白(L10、S3a、S12)发生下调[16], 而水稻在低温胁迫、杨树在干旱胁迫后某些糖体蛋白(酸性核糖体蛋白P3a、60S核糖体蛋白L16和核糖体蛋白S3)则发生了上调[17]。翻译装置不同部件的差异表达说明植物在响应胁迫时存在一个复杂的机制控制蛋白的合成。本试验中, 60S酸性核糖体蛋白上调可能会提高蛋白的翻译过程或帮助合适的核糖体发挥功能。
3.2.2 铜胁迫下黄花月见草根系碳水化合物与能量代谢相关蛋白表达本研究共鉴定到4个与TCA相关的蛋白, 分别是苹果酸酶、琥珀酸脱氢酶、丙酮酸脱氢酶和异柠檬酸脱氢酶亚基, 表明TCA在黄花月见草响应铜胁迫时起作用。此外, 鉴定到2个ATP合成酶, 分别是ATP合成酶α亚基和ATP合成酶β亚基。有研究表明ATP合成酶过表达能够增加拟南芥的耐旱性[18]。此外, 试验鉴定到3个与糖酵解有关的蛋白, 包括6-葡萄糖磷酸异构酶、果糖二磷酸缩醛酶和磷酸丙糖异构酶, 3种蛋白都是上调表达, 说明黄花月见草在铜胁迫下会通过糖酵解来产生更多的能量保证自身正常呼吸作用。另外, 蔗糖合成酶(sucrose synthase)在植物生长发育过程中有着举足轻重的作用。因为蔗糖是植物消耗的主要碳源, 植物遭受逆境胁迫时, 蔗糖积累现象是植物对逆境胁迫的一种保护性反馈, Jha等[19]研究发现, 受重金属砷毒害的水稻幼苗蔗糖合成酶合成活性显著提高, 为能量消耗提供足够碳源。
3.2.3 铜胁迫下黄花月见草根系信号传导相关蛋白表达本试验鉴定到3个Rab小G蛋白分别是Rab2/RabB、Rab6/RabH和Rab7。Rab亚家族通过调控复杂的囊泡运输和维管系统活动调控真核细胞各细胞器之间的物质交换和信息传递。Ara6/AtRabF1正向调控内体(endosome)固醇的内吞; 另一研究报道显示, Rha1/AtRabF2a、Ara7/AtRabF2b在液泡定位的蛋白运输上起着重要的调控作用[20]。试验中鉴定到液泡质子泵ATP酶β亚基, 该蛋白利用ATP水解所提供的能量进行质子的跨膜运输[21]。由质子泵活动所造成的跨液泡膜内外的H+电化学梯度对于其他离子或溶质在液泡中的积累也具有重要作用。现已证实, V-ATPase和H+-无机焦磷酸化酶在植物对于环境胁迫(例如盐胁迫)的应答中相当重要[22]。试验中鉴定到该蛋白下调表达, 对于调节液泡膜内外质子稳态有重要作用。钙调素蛋白可以调节Ca2+在细胞内的稳态。Ca2+对植物细胞的结构和生理功能都有着重要的作用, 它不仅能维持膜结合蛋白及细胞膜的稳定性, 参与胞内动态平衡和生长发育的调控, 而且在细胞内还可起第二信使作用。本试验中, 该蛋白上调表达, 说明铜胁迫下黄花月见草通过Ca2+在细胞内的稳态来调控生长发育等生物学过程。另外, 乳酰谷胱甘肽裂解酶可以催化甲基乙二醛转化为无毒的乳酸。在糖酵解、氨基酸分解代谢和逆境胁迫下会产生甲基乙二醛这种对细胞有毒性的代谢产物[23]。该蛋白上调表达说明铜胁迫下可能产生了有害物质甲基乙二醛, 通过该蛋白降解转化为无毒的乳酸, 从而缓解细胞毒性。
3.2.4 铜胁迫下黄花月见草根系抗氧化和发育相关蛋白表达植物通过自身体内抗氧化系统来消除或减少受到外界胁迫诱导的ROS伤害, 其中异戊烯二磷酸异构酶是合成异戊二烯的关键酶, 异戊二烯可以保护植物体免受ROS胁迫[24]。抗坏血酸过氧化物酶和过氧化物酶被认为是清除活性氧过程中最主要的抗氧化酶类。抗坏血酸过氧化物酶能通过AsA-谷胱甘肽-NADPH循环, 催化AsA氧化来清除H2O2和
铜是影响作物生长发育, 甚至产量的重要环境因子。当长时间处在不利环境的时候, 植物会通过短期的应激反应抵抗逆境胁迫从而进化为可遗传的能力。本研究结果表明:黄花月见草低转运系数可以将其定义为铜排斥型植物, 而且其可以耐受一定浓度的铜胁迫, 但是过量的铜也会抑制黄花月见草幼苗的正常生长并引起根系铜的富集。蛋白质组学法分析鉴定到46个表达有显著意义的蛋白, 以蛋白种类被分为蛋白合成和降解、碳水化合物与能量代谢、信号传导、抗氧化和发育相关, 经分析后每个蛋白在调节植物响应外界胁迫都有重要意义。这些试验结果为更好地理解高等植物铜响应分子机制提供了一种新的视野。
| [1] | Ouzounidou G, Čiamporová M, Moustakas M, et al. Responses of maize(Zea mays L.)plants to copper stress:Ⅰ. Growth, mineral content and ultrastructure of roots[J]. Environmental and Experimental Botany, 1995,35(2): 167–176. DOI: 10.1016/0098-8472(94)00049-B |
| [2] | Guo P, Wang T, Liu Y, et al. Phytostabilization potential of evening primrose(Oenothera glazioviana)for copper-contaminated sites[J]. Environmental Science and Pollution Research, 2014,21(1): 631–640. DOI: 10.1007/s11356-013-1899-z |
| [3] | Jiang W, Liu D, Liu X. Effects of copper on root growth, cell division, and nucleolus of Zea mays[J]. Biologia Plantarum, 2001,44(1): 105–109. DOI: 10.1023/A:1017982607493 |
| [4] | Sheldon A, Menzies N. The effect of copper toxicity on the growth and root morphology of Rhodes grass(Chloris gayana Knuth.)in resin buffered solution culture[J]. Plant and Soil, 2005,278(1/2): 341–349. |
| [5] | Chen B C, Ho P C, Juang K W. Alleviation effects of magnesium on copper toxicity and accumulation in grapevine roots evaluated with biotic ligand models[J]. Ecotoxicology, 2013,22(1): 174–183. DOI: 10.1007/s10646-012-1015-z |
| [6] | Singh S, Kaur R, Sharma S K. An updated review on the Oenothera genus[J]. J Chin Integr Med, 2012,10(7): 717–725. DOI: 10.3736/jcim20120701 |
| [7] | 贺瑶, 周惜时, 夏妍, 等. 铜排斥型植物黄花月见草(Oenothera glazioviana)对铜胁迫的响应以及在铜污染土壤上的合理利用[J]. 农业环境科学学报, 2015, 34(3): 449–460. He Y, Zhou X S, Xia Y, et al. Physiological responses of Oenothera glazioviana to copper stress and its rational utilization in copper contaminated soil[J]. Journal of Agro-Environment Science, 2015,34(3): 449–460. (in Chinese) |
| [8] | Lee K, Bae D W, Kim S H, et al. Comparative proteomic analysis of the short-term responses of rice roots and leaves to cadmium[J]. Journal of Plant Physiology, 2010,167(3): 161–168. DOI: 10.1016/j.jplph.2009.09.006 |
| [9] | Requejo R, Tena M. Proteome analysis of maize roots reveals that oxidative stress is a main contributing factor to plant arsenic toxicity[J]. Phytochemistry, 2005,66(13): 1519–1528. DOI: 10.1016/j.phytochem.2005.05.003 |
| [10] | Wang Y, Qian Y, Hu H, et al. Comparative proteomic analysis of Cd-responsive proteins in wheat roots[J]. Acta Physiologiae Plantarum, 2011,33(2): 349–357. DOI: 10.1007/s11738-010-0554-2 |
| [11] | Wang J, Fan M. Handbook of Protein Technology[M]. Beijing: Science Press, 2000 : 77 -100. |
| [12] | Wilson R, Diseberg A F, Gordon L, et al. Comprehensive profling of cartilage extracellular matrix formation and maturation using sequentral extration and label-free quantitative proteomics[J]. Molecular and Cellular Proteomics, 2010,9(6): 1296–1313. DOI: 10.1074/mcp.M000014-MCP201 |
| [13] | Xie H, Yang D H, Yao H, et al. iTRAQ-based quantitative proteomic analysis reveals proteomic changes in leaves of cultivated tobacco(Nicotiana tabacum)in response to drought stress[J]. Biochem Biophys Res Commun, 2016,469(3): 768–775. DOI: 10.1016/j.bbrc.2015.11.133 |
| [14] | Lu Y, Liu X, Shi S, et al. Bioinformatics analysis of proteomic profiles during the process of anti-Thy1 nephritis[J]. Molecular and Cellular Proteomics, 2012,11(4): M111. 008755. DOI: 10.1074/mcp.M111.008755 |
| [15] | 唐咏, 王萍萍, 张宁. 植物重金属毒害作用机理研究现状[J]. 沈阳农业大学学报, 2006, 37(4): 551–555. Tang Y, Wang P P, Zhang N. Researches in heavy metal toxicity mechanism in plant[J]. Journal of Shenyang Agricultural University, 2006,37(4): 551–555. (in Chinese) |
| [16] | Jiang Y, Yang B, Harris N S, et al. Comparative proteomic analysis of NaCl stress-responsive proteins in Arabidopsis roots[J]. J Exp Bot, 2007,58(13): 3591–3607. DOI: 10.1093/jxb/erm207 |
| [17] | Xiao X, Yang F, Zhang S, et al. Physiological and proteomic responses of two contrasting Populus cathayana populations to drought stress[J]. Physiologia Plantarum, 2009,136(2): 150–168. DOI: 10.1111/ppl.2009.136.issue-2 |
| [18] | Sweetlove L J, Beard K F, Nunes-Nesi A, et al. Not just a circle:flux modes in the plant TCA cycle[J]. Trends Plant Sci, 2010,15(8): 462–470. DOI: 10.1016/j.tplants.2010.05.006 |
| [19] | Jha A B, Dubey R S. Carbohydrate metabolism in growing rice seedlings under arsenic toxicity[J]. Journal of Plant Physiology, 2004,161(7): 867–872. DOI: 10.1016/j.jplph.2004.01.004 |
| [20] | Novick P, Zerial M. The diversity of Rab proteins in vesicle transport[J]. Current Opinion in Cell Biology, 1997,9(4): 496–504. DOI: 10.1016/S0955-0674(97)80025-7 |
| [21] | Sun-Wada G H, Wada Y, Futai M. Vacuolar H+pumping ATPases in luminal acidic organelles and extracellular compartments:common rotational mechanism and diverse physiological roles[J]. Journal of Bioenergetics and Biomembranes, 2003,35(4): 347–358. DOI: 10.1023/A:1025780932403 |
| [22] | Fukuda A, Tanaka Y. Effects of ABA, auxin, and gibberellin on the expression of genes for vacuolar H+-inorganic pyrophosphatase, H+-ATPase subunit A, and Na+/H+antiporter in barley[J]. Plant Physiology and Biochemistry, 2006,44(5): 351–358. |
| [23] | 刘菊华, 邓成菊, 金志强, 等. 香蕉乙二醛酶基因MaGLO14的克隆及在非生物胁迫下的功能鉴定[J]. 中山大学学报(自然科学版), 2011, 50(5): 87–92. Liu J H, Deng C J, Jin Z Q, et al. Isolation and functional identification of banana glyoxalase gene(MaGLO14)under various abiotic stresses[J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2011,50(5): 87–92. (in Chinese) |
| [24] | Velikova V, Tsonev T, Loreto F, et al. Changes in photosynthesis, mesophyll conductance to CO2, and isoprenoid emissions in Populus nigra plants exposed to excess nickel[J]. Environ Pollut, 2011,159(5): 1058–1066. DOI: 10.1016/j.envpol.2010.10.032 |
| [25] | Kim Y, Arihara J, Nakayama T, et al. Antioxidative responses and their relation to salt tolerance in Echinochloa oryzicola Vasing and Setaria virdis(L.)Beauv[J]. Plant Growth Regulation, 2004,44(1): 87–92. DOI: 10.1007/s10725-004-2746-5 |
| [26] | Bommer U A, Thiele B J. The translationally controlled tumour protein(TCTP)[J]. The International Journal of Biochemistry and Cell Biology, 2004,36(3): 379–385. DOI: 10.1016/S1357-2725(03)00213-9 |
| [27] | Brioudes F, Thierry A M, Chambrier P, et al. Translationally controlled tumor protein is a conserved mitotic growth integrator in animals and plants[J]. Proc Natl Acad Sci USA, 2010,107(37): 16384–16389. DOI: 10.1073/pnas.1007926107 |
| [28] | Amson R, Pece S, Marine J C, et al. TPT1/TCTP-regulated pathways in phenotypic reprogramming[J]. Trends in Cell Biology, 2013,23(1): 37–46. DOI: 10.1016/j.tcb.2012.10.002 |
| [29] | Berkowitz O, Jost R, Pollmann S, et al. Characterization of TCTP, the translationally controlled tumor protein, from Arabidopsis thaliana[J]. Plant Cell, 2008,20(12): 3430–3447. DOI: 10.1105/tpc.108.061010 |




