文章信息
- 刘涛, 任莉萍, 曹沛沛, 陈发棣, 房伟民, 陈素梅, 管志勇, 腾年军, 张飞, 赵爽, 王海滨, 宋爱萍, 蒋甲福
- LIU Tao, REN Liping, CAO Peipei, CHEN Fadi, FANG Weimin, CHEN Sumei, GUAN Zhiyong, TENG Nianjun, ZHANG Fei, ZHAO Shuang, WANG Haibin, SONG Aiping, JIANG Jiafu
- 菊花不同时期各组织器官石蜡切片制作条件的优化
- The paraffin section making conditions of chrysanthemum different tissues in different period
- 南京农业大学学报, 2016, 39(5): 739-746
- Journal of Nanjing Agricultural University, 2016, 39(5): 739-746.
- http://dx.doi.org/10.7685/jnau.201601030
-
文章历史
- 收稿日期: 2016-01-14
菊花(Chrysanthemum morifolium)是多年生草本植物, 头状花序单生或数个集生于茎枝顶端, 总苞片多层, 花冠多分为舌状花和管状花两种, 花色繁多, 花形各异, 观赏价值极高[1]。菊花多为短日照植物, 秋季开花者居多[2], 目前对其发育方面的研究颇多, 如张婷等[3]在菊花花刺方面的研究, 以及Deng等[4]关于菊花种间杂交生殖障碍的研究, 在以上研究中, 石蜡切片的制作均作为关键技术被使用。然而, 在以往的报道中, 石蜡切片的制作均采用Sun等[5]的方法, 该方法虽能得到效果较好的切片, 但操作过于繁琐, 染色方法的使用也相对单一, 且在这些涉及菊花石蜡切片的报道中, 也未出现专门针对菊花某一特定组织器官或不同组织器官石蜡切片制作方法优化的研究。在其他植物中, 关于不同时期不同组织器官进行石蜡切片制作条件优化的研究已有报道, 如杏花花芽[6], 水稻根尖[7], 桦树[8], 紫萼茎与叶[9], 天麻[10]等。基于此类报道的研究成果, 针对菊花不同时期不同组织器官的特性, 进行石蜡切片制作条件的优化, 筛选出针对特定组织的最适石蜡切片制作方法, 以期为应用石蜡切片技术进行的相关研究提供技术支持。
另外, 在植物组织石蜡切片的染色方面, 固绿作为一种常用染色剂集中应用于番红-固绿双重染色法中, 且对于该染色方法的优化研究颇多, 如徐青[11]关于染色技术的改进及李凤英等[12]总结的低毒高效石蜡切片制作法。但就固绿本身而言, 很少有其单独使用进行石蜡切片染色的应用, 其快速高效的染色优点并未得到充分利用。在本试验中, 针对固绿自身特点并结合前人经验[13], 筛选出应用于植物组织石蜡切片的简单快速染色法, 旨在提高固绿利用率的同时, 保证染色效果, 简化染色步骤, 节约染色成本及染色时间。
1 材料与方法 1.1 材料试验材料为切花菊品种‘优香’, 取自南京农业大学中国菊花种质资源保存中心。取样时间为2015年3月至7月, 样品包括:幼根(定植初期即扦插定植20 d根的成熟区)、老根(盛花期根的成熟区)、幼茎(定植初期茎上半段)、老茎(盛花期茎上半段)、叶片(花芽分化期叶片)、花芽(花芽分化期花芽, 包括生长点肥大期、总包鳞片分化期、小花原基分化期等几个主要时期[14])、舌状花(盛花期偏外轮花瓣)。
1.2 试验方法 1.2.1 常规石蜡切片制作1)固定:‘优香’各组织器官取样后加FAA固定液(70%乙醇、冰醋酸和甲醛体积比为18 : 1 : 1)固定24 h以上。2)切片:切片制作参照Sun等[5]的方法。经脱水、透明、渗蜡、包埋等处理, 使用切片机进行切片。3)脱蜡及染色:依次使用二甲苯、1/2二甲苯+1/2乙醇、无水乙醇、梯度乙醇溶液、蒸馏水等对切片进行脱蜡处理, 并使用不同染色剂对切片进行染色。4)脱水、透明、封片及观察:使用梯度乙醇、无水乙醇、1/2乙醇+1/2二甲苯、二甲苯等依次进行脱水透明处理; 随后于载玻片上滴加中性树胶, 盖盖玻片, 待其风干后置于显微镜下观察。
1.2.2 不同组织器官最佳渗蜡时间的确定取定植初期的幼根、幼茎, 花芽分化期的花芽、叶及盛花期的老根、老茎、舌状花等, 通过固定、脱水、透明等操作后, 设置不同渗蜡时间(3、4、5和6 d), 每天早晚加蜡, 对材料进行渗蜡处理。渗蜡处理后包埋, 切片, 观察切片效果。
1.2.3 不同组织器官最适切片厚度的确定取不同组织器官, 经固定、脱水、透明、渗蜡、包埋等操作后, 使用切片机设置不同切片厚度(表 1)对材料进行切片操作。所得石蜡切片经固绿快速染色法进行染色, 封片后置于显微镜下观察。
| 幼根Young root | 老根Old root | 幼茎Young stem | 老茎Old stem | 叶Leaf | 花芽Flower bud | 舌状花Ray flower |
| 10 | 16 | 10 | 10 | 16 | 8 | 10 |
| 16 | 20 | 12 | 12 | 20 | 10 | 16 |
| 20 | 25 | 14 | 14 | 25 | 14 | 20 |
| 25 | 30 | 16 | 16 | 30 | 20 | 25 |
取组织切片, 选用5种染色方法进行染色处理:苏木精染色法、甲苯胺蓝染色法、固绿快速染色法、番红-固绿双重染色法和番红单染法。
苏木精染色法:参照Sun等[5]的方法, 对切片进行逐步脱蜡, 40 g · L-1铁矾浸泡, 5 g · L-1苏木精染色, 20 g · L-1铁矾脱色。
甲苯胺蓝染色法:参照Sakai[15]的方法, 脱蜡后直接1 g · L-1甲苯胺蓝染色30 min。
固绿快速染色法:1)固绿染色液的配置:称取固绿1 g, 加入甲醇15 mL, 搅拌, 直至无肉眼可见固体颗粒为止(因甲醇易挥发, 操作应迅速), 随后加入150 mL 80%乙醇, 搅拌, 使其充分溶解, 室温静置, 备用。2)染色方法:材料的固定、渗蜡、包埋、切片等操作与其他染色方法相同[5], 取组织切片, 置于二甲苯中脱蜡处理30 min, 依次转移至1/2乙醇+1/2二甲苯、无水乙醇(2次)中浸泡各160 s, 然后将切片直接转移至固绿染色液中, 染色处理5 min左右; 待染色结束后, 使用无水乙醇洗去浮色, 重复此过程1~2次, 每次160 s, 洗去浮色即可用1/2二甲苯+1/2乙醇、二甲苯依次透明。
番红-固绿双重染色法:以实验室常用染色法为准, 10 g · L-1番红染色24 h以上, 固绿染色1~2 min。
番红单染法:与番红-固绿双重染色法相似, 仅取消固绿染色过程。
2 结果与分析 2.1 菊花不同时期不同组织石蜡切片最适渗蜡时间的确定取不同组织器官, 经渗蜡切片等操作后, 观察切片效果。由表 1可知:幼根渗蜡充分需5 d, 老根6 d, 幼茎6 d, 老茎7 d, 叶4 d, 花芽5 d, 舌状花4 d。
| 渗蜡时间/d Permeability wax time |
幼根 Young root |
老根 Old root |
幼茎 Young stem |
老茎 Old stem |
叶 Leaf |
花芽 Flower bud |
舌状花 Ray flower |
| 4 | + | - | - | - | ++ | + | ++ |
| 5 | ++ | + | + | - | ++ | ++ | ++ |
| 6 | ++ | ++ | ++ | + | ++ | ++ | ++ |
| 7 | ++ | ++ | ++ | ++ | ++ | ++ | ++ |
| 注: -:切片时易出现蜡带中组织不完整, 蜡带破碎, 甚至材料无法切开等现象, 属渗蜡极不充分表现; +:切片时大部分蜡带完整, 材料不易黏连, 所得切片中组织完整性较好, 但仍有少数蜡带破碎的情况出现, 属渗蜡较充分的表现; ++:切片时蜡带完整, 不会破碎, 材料易切开, 蜡带中组织十分完整, 属渗蜡充分的表现。 Note: -:The organization is not complete, the wax ring is broken, the material can′t be cut. It means that the penetration of wax is not sufficient. +:Most of wax ring is complete, the material is easier to be cut, and the organization is complete. This means that the penetration of wax is moderate. ++:The wax ring is complete, the material is easy to be cut, and the organization is complete. It means that the penetration of wax is sufficient. |
|||||||
取不同组织器官样品, 经切片、染色、封片后, 置于显微镜下观察发现:幼根的切片厚度在16 μm时, 组织完整性最好, 着色效果最优; 小于该厚度, 组织易破损, 着色较浅; 而大于该厚度时, 会出现细胞堆积, 切片模糊, 着色过深等情况。老根的切片厚度在20 μm时, 效果最佳。对于其他组织, 其最适切片厚度分别为:幼茎12 μm, 老茎12 μm, 叶25 μm, 花芽10 μm, 舌状花16 μm。在对应切片厚度下, 组织破损较少或无破损, 组织着色效果也最佳(图 1)。
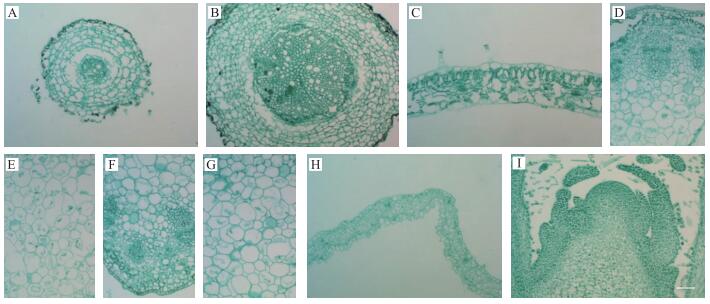
|
图 1 不同组织最适切片厚度经固绿快速染色法染色后效果图(×20, Bar=50 μm) Figure 1 The effect picture of different tissues′ most proper section thickness after staining by fast green A:幼根(切片厚度16 μm); B:老根(20 μm); C:叶(25 μm); D、E:幼茎(12 μm); F、G:老茎(12 μm); H:舌状花(16 μm); I:花芽(10 μm) A:Young root(section thickness 16 μm); B:Old root(20 μm); C:Leaf(25 μm); D, E:Young stem(12 μm); F, G:Old stem(12 μm); H:Ray flower(16 μm); I:Flower bud(10 μm) |
由图 2、3可见:经苏木精染色后, 幼根、老根细胞均呈灰色, 细胞形态及细胞核能清晰辨别; 经甲苯胺蓝染色后, 幼根、老根中木质化细胞呈绿色, 其他细胞呈蓝紫色; 经番红单染色后, 幼根、老根中仅木质化细胞着红色, 而其他细胞几乎不显色; 经固绿快速染色法染色后, 幼根、老根中所有细胞均呈绿色; 经番红-固绿双重染色后, 幼根、老根中木质化程度较重的细胞呈红色而木质化程度较轻的细胞及其他细胞均呈绿色。
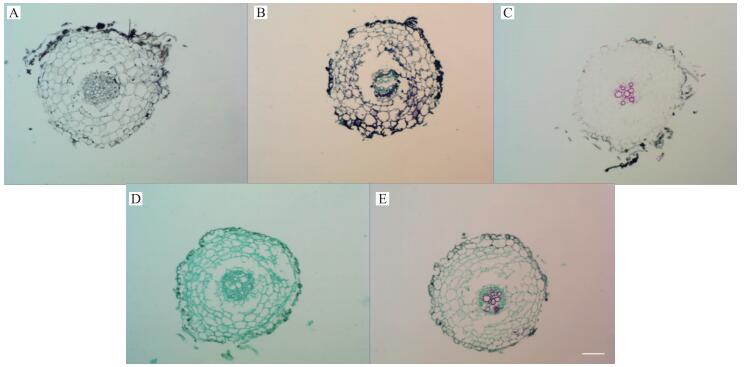
|
图 2 定植初期幼根经不同染色方法染色后的效果图(×20, Bar=50 μm) Figure 2 The effect picture of young root at early planting stage after staining by different staining method A:苏木精染色法Hematoxylin staining method; B:甲苯胺蓝染色法Toluidine blue staining method; C:番红单染法Sarranine staining method; D:固绿快速染色法Fast green quickly staining method; E:番红-固绿双重染色法Sarranine and fast green staining method |
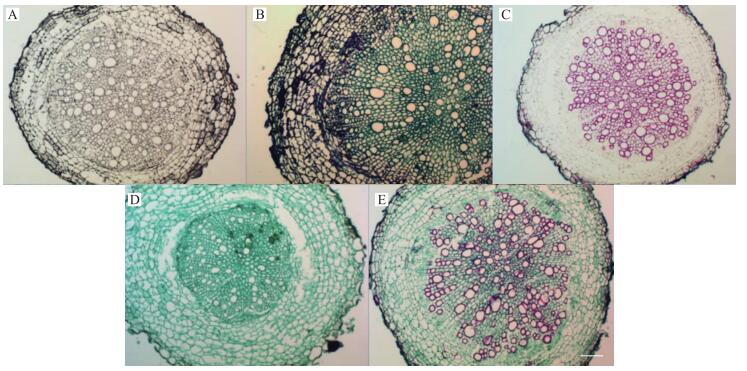
|
图 3 盛花期老根经不同染色方法染色后的效果图(×20, Bar=50 μm) Figure 3 The effect picture of old root at flowering stage after staining by different staining method A:苏木精染色法Hematoxylin staining method; B:甲苯胺蓝染色法Toluidine blue staining method; C:番红单染法Sarranine staining method; D:固绿快速染色法Fast green quickly staining method; E:番红-固绿双重染色法Sarranine and fast green staining method |
综合分析, 对于幼根、老根而言, 若以木质部和韧皮部区分作为观察重点, 应以番红-固绿双重染色法为首选, 其次是甲苯胺蓝染色法, 再次是番红单染; 若观察目的仅限于木质部, 则应首选番红单染法进行染色。
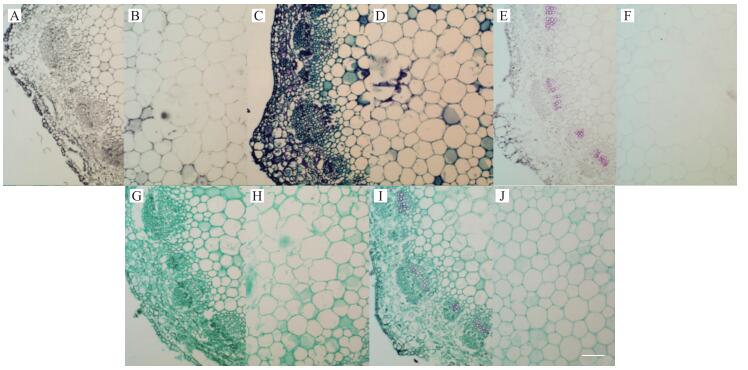
由图 4、5可见:经苏木精染色后, 幼茎、老茎中细胞呈灰色, 其中老茎着色相对更深; 经甲苯胺蓝染色后, 幼茎、老茎中木质化细胞呈绿色, 其他细胞呈蓝紫色, 但由于两种颜色对比度不大, 因此区分存在难度; 经番红单染后, 幼茎、老茎中仅木质部着红色; 经固绿快速染色法染色后, 幼茎、老茎中所有细胞都显绿色; 经番红-固绿双重染色后, 幼茎、老茎中木质部细胞呈红色而其他细胞呈绿色。
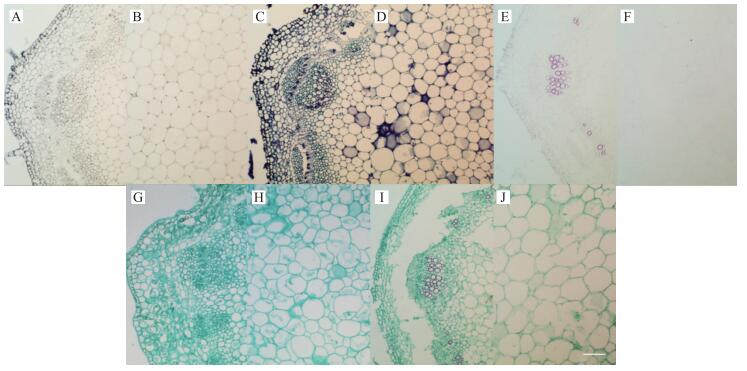
|
图 4 定植初期幼茎经不同染色方法染色后的效果图(×20, Bar=50 μm) Figure 4 The effect picture of young stem at early planting stage after staining by different staining method A、B:苏木精染色法Hematoxylin staining method; C、D:甲苯胺蓝染色法Toluidine blue staining method; E、F:番红单染法Sarranine staining method; G、H:固绿快速染色法Fast green quickly staining method; I、J:番红-固绿双重染色法Sarranine and fast green staining method |
|
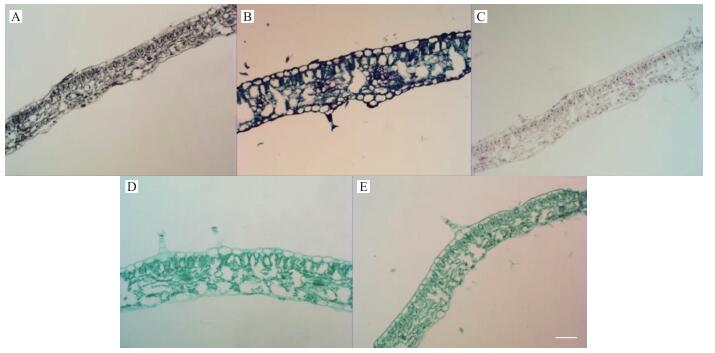
图 5 盛花期老茎经不同染色方法染色后的效果图(×20, Bar=50 μm) Figure 5 The effect picture of old stem at flowering stage after staining by different staining method A、B:苏木精染色法Hematoxylin staining method; C、D:甲苯胺蓝染色法Toluidine blue staining method; E、F:番红单染法Sarranine staining method; G、H:固绿快速染色法Fast green quickly staining method; I、J:番红-固绿双重染色法Sarranine and fast green staining method |
综合分析, 对于幼茎、老茎而言, 若观察重点即包含木质部又涉及其他组织, 则应首选番红-固绿双重染色法, 若仅观察木质部, 则首选番红单染法。
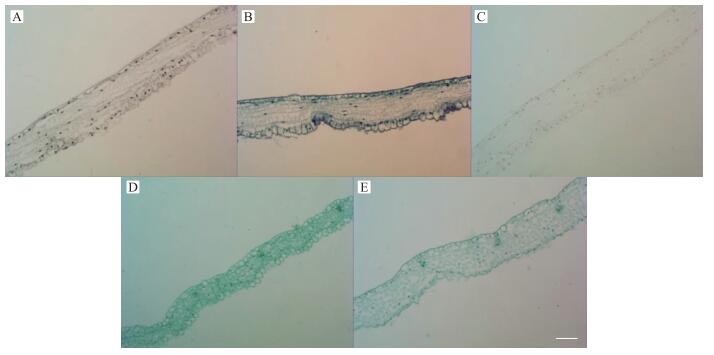
由图 6、7、8可见:对于不含木质化细胞的叶、舌状花、花芽而言, 经各染色方法染色后, 染色效果差异不大, 例如苏木精染色后所有细胞均呈灰色, 甲苯胺蓝染色后所有细胞均呈蓝紫色, 番红染色后所有细胞均呈红色(很浅), 固绿染色后所有细胞均呈绿色, 番红-固绿双重染色后所有细胞也呈绿色(与固绿单染效果相似)。
|
图 6 叶经不同染色方法染色后的效果图(×20, Bar=50 μm) Figure 6 The effect picture of leaf after staining by different staining method A:苏木精染色法Hematoxylin staining method; B:甲苯胺蓝染色法Toluidine blue staining method; C:番红单染法Sarranine staining method; D:固绿快速染色法Fast green quickly staining method; E:番红-固绿双重染色法Sarranine and fast green staining method |
|
图 7 舌状花经不同染色方法染色后的效果图(×20, Bar=50 μm) Figure 7 The effect picture of ray flower after staining by different staining method A:苏木精染色法Hematoxylin staining method; B:甲苯胺蓝染色法Toluidine blue staining method; C:番红单染法Sarranine staining method; D:固绿快速染色法Fast green quickly staining method; E:番红-固绿双重染色法Sarranine and fast green staining method |
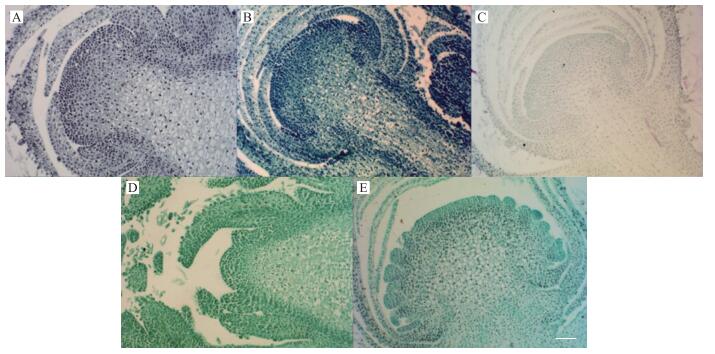
|
图 8 花芽经不同染色方法染色后的效果图(×20, Bar=50 μm) Figure 8 The effect picture of flower bud after staining by different staining method A:苏木精染色法Hematoxylin staining method; B:甲苯胺蓝染色法Toluidine blue staining method; C:番红单染法Sarranine staining method; D:固绿快速染色法Fast green quickly staining method; E:番红-固绿双重染色法Sarranine and fast green staining method |
综合分析, 针对不含木质化结构的组织, 在染色方法的选择上应遵循操作简单, 节省成本, 节约时间的原则, 因此首选固绿快速染色法。
3 结论与讨论通过对本试验结果的分析比较, 我们发现在石蜡切片制作过程中, 菊花不同时期不同组织器官的渗蜡时间及切片厚度存在差异。同一组织器官, 成熟的比幼嫩的需渗蜡更久, 切片更厚; 不同组织器官, 虽在切片厚度上无明显规律, 但在渗蜡时间上, 一般含木质化成分多或组织较硬者需渗蜡更久。另外, 在染色方法上, 需根据观察目的进行选择, 像幼根、老根、幼茎、老茎等, 在观察时一般以木质部为观察重点, 集中观察其木质化程度及木质部大小, 因此在选择染色方法时一般选用能区分木质部的番红-固绿双重染色法、甲苯胺蓝染色法; 若仅需观察木质部, 则应选择番红单染法, 防止因固绿复染造成木质化程度较低的部分被遮盖; 而叶片、舌状花、花芽等不含木质化成分或仅以组织结构、细胞形态、细胞大小等作为观察重点的组织, 应以操作简单, 节省时间及成本的固绿快速染色法为首选。另外, 若观察目的集中在细胞核方面, 则应选择苏木精进行染色。
除此之外, 试验过程中总结的固绿快速染色法, 有其突出优点。首先固绿快速染色法在操作方面极为简单, 使用甲醇进行初溶, 溶解效率极高, 染色液的配制完全不需过滤操作, 且染色步骤简单, 不需脱水、复水等操作, 整个染色过程可在1 h内完成。固绿快速染色法比苏木精染色法[5]可节省3~4 h, 比甲苯胺蓝染色法[15]可节省1~2 h, 比番红单染或番红-固绿双重染色[6]可节省时间至少8 h。另外, 由于染色液配制过程中固绿使用效率的提高和染色步骤的简化, 使固绿快速染色法在节省染色成本方面也有突出优点。
当然由于本试验仅针对菊花根、茎、叶、花等肉眼可见组织器官, 而对花药、子房、胚胎等未涉及, 因此对这些组织的石蜡切片制作方法还有待研究; 另外, 试验结果是否适用于其他植物也有待进一步探究。
| [1] | 李鸿渐, 邵健文. 中国菊花品种资源的调查收集与分类[J]. 南京农业大学学报, 1990(1): 30–36. Li H J, Shao J W. The investigation and collection of chrysanthemum variety resources in China[J]. Journal of Nanjing Agricultural University, 1990(1): 30–36. DOI: 10.7685/j.issn.1000-2030.1990.01.006 (in Chinese) |
| [2] | 张莉俊, 戴思兰. 菊花种质资源研究进展[J]. 植物学报, 2009, 44(5): 526–535. Zhang L J, Dai S L. The research progress of chrysanthemum germplasm resources[J]. Chinese Bulletin of Botany, 2009,44(5): 526–535. (in Chinese) |
| [3] | 张婷, 房伟民, 蒋甲福, 等. 菊花毛刺的形态及显微结构[J]. 南京农业大学学报, 2014, 37(1): 43–46. Zhang T, Fang W M, Jiang J F, et al. Morphology and microstructure of chrysanthemum burr[J]. Journal of Nanjing Agricultural University, 2014,37(1): 43–46. DOI: 10.7685/j.issn.1000-2030.2014.01.008 (in Chinese) |
| [4] | Deng Y M, Teng N J, Chen S M, et al. Reproductive barriers in the intergeneric hybridization between Chrysanthemum grandiflorum(Ramat.)Kitam.and Ajania przewalskii Poljak.(Asteraceae)[J]. Euphytica, 2010,174: 41–50. DOI: 10.1007/s10681-009-0113-3 |
| [5] | Sun C Q, Chen F D, Teng N J, et al. Factors affecting seed set in the crosses between Dendranthema grandiflorum(Ramat.)Kitamura and its wild species[J]. Euphytica, 2010,171(2): 181–192. DOI: 10.1007/s10681-009-0005-6 |
| [6] | 帅焕丽, 杨途熙, 魏安, 等. 杏花芽石蜡切片方法的改良[J]. 果树学报, 2011, 28(3): 536–539. Shuai H L, Yang T X, Wei A, et al. A modified technique of paraffin section for apricot flower buds[J]. Journal of Fruit Science, 2011,28(3): 536–539. (in Chinese) |
| [7] | 张新梅, 董晓英, 沈仁芳. 水稻幼嫩根尖常规石蜡切片制作技术改良[J]. 江苏农业科学, 2013, 41(12): 71–73. Zhang X M, Dong X Y, Shen R F. The improvement of rice young root routine paraffin section[J]. Jiangsu Agricultural Sciences, 2013,41(12): 71–73. (in Chinese) |
| [8] | 苏印泉, 彭锋, 黎斌. 桦树松萝的石蜡切片方法改良及形态学研究[J]. 西北植物学报, 2007, 27(5): 859–863. Su Y Q, Peng F, Li B. Improvement of paraffin section methods and morphological studies on usnea betulina[J]. Acta Bot Boreal-Occident Sin, 2007,27(5): 859–863. (in Chinese) |
| [9] | 王虹. 五种紫萼藓科植物茎及叶的解剖学观察[J]. 植物研究, 2002, 22(1): 19–22. Wang H. The study of anatomical structure of stems and leaves in five grimmiaceac moddes[J]. Bulletin of Botanical Research, 2002,22(1): 19–22. (in Chinese) |
| [10] | Zhu H Y, Bai L, Bao H Y. Microstructure of the rhizoma, flower and stem of Gastrodia elata[J]. Medicinal Plant, 2014,5(3): 1. |
| [11] | 徐青. 植物石蜡切片双重染色技术的改进[J]. 宁夏农学院学报, 1999, 20(2): 89–90. Xu Q. Plant paraffin double staining technique improvement[J]. Journal of Ningxia Agricultural College, 1999,20(2): 89–90. (in Chinese) |
| [12] | 李凤英, 马姜明, 梁士楚, 等. 低毒高效的植物石蜡切片方法[J]. 农学学报, 2014, 4(4): 83–85. Li F Y, Ma J M, Liang S C, et al. A low-toxicity and high-effectiveness preparation method for plant paraffin section[J]. Journal of Agriculture, 2014,4(4): 83–85. (in Chinese) |
| [13] | 华中农学院植物教研室植物显微技术组. 爱氏苏木精整体染色及番红-固绿双重染色滴染法在石蜡切片中的运用[J]. 植物学通报, 1984, 3(6): 56. Huazhong Agricultural College Plant Microscopy Techniques of Teaching and Research Section Set. The application of hematoxylin and sarranine-fast green dyed droplets staining in paraffin section[J]. Chinese Bulletin of Botany, 1984,3(6): 56. (in Chinese) |
| [14] | 李风童, 陈素梅, 陈发棣, 等. 托桂花型菊花花发育的组织结构观察[J]. 园艺学报, 2010, 37(12): 1961–1968. Li F T, Chen S M, Chen F D, et al. Histological structure observation on the floral development of anemone type chrysanthemum[J]. Horticultural Plant Journal, 2010,37(12): 1961–1968. (in Chinese) |
| [15] | Sakai W S. Simple method for differential staining of paraffin embedded plant material using toluidine blue O[J]. Biotechnic and Histochemistry, 1973,48(5): 247–249. |




