文章信息
- 王美英, 王芳, 韩金志, 陆兆新, 别小妹
- WANG Meiying, WANG Fang, HAN Jinzhi, LU Zhaoxin, BIE Xiaomei
- Paenibacillus polymyxa JSa-9发酵培养基优化及其在黄瓜枯萎病中的应用研究
- Optimization of fermentation medium and application in cucumber Fusarium wilt of Paenibacillus polymyxa JSa-9
- 南京农业大学学报, 2016, 39(4): 673-680
- Journal of Nanjing Agricultural University, 2016, 39(4): 673-680.
- http://dx.doi.org/10.7685/jnau.201512010
-
文章历史
- 收稿日期:2015-12-09
多黏类芽孢杆菌(Paenibacillus polymyxa)在农业部被列为免做安全鉴定的一级菌种[1],其产生的多黏菌素B(polymyxins B)、多黏菌素E(colistin)具有临床应用价值,某些菌种可作为有效的生防菌剂并促进植物生长[2, 3, 4],具有广阔的应用前景。相比于直接利用有抗菌活性的多黏类芽孢杆菌,将其与堆肥结合制成生防菌剂对于抑制一些土壤致病菌更加有效[5, 6, 7, 8, 9]。由于芽孢对不良物理、化学刺激具有极强的抗性,多黏类芽孢杆菌芽孢液将成为生防菌剂中的研究热点,而提高芽孢产量对其发展至关重要。P.polymyxa JSa-9菌株是本试验室筛选分离的一株抑菌谱较广的多黏类芽孢杆菌,不仅能抑制革兰氏阳性菌而且对革兰氏阴性菌及多种霉菌都有显著的抑菌效果。此菌株主要产生两类具有广谱抗菌活性的化合物,包括5种环状和2种直链型的脂肽LI-F以及1种多黏菌素B组分[10, 11]。国内外对多黏类芽孢杆菌发酵液或从其发酵液中分离纯化出来的抑菌物质的应用研究较多,但对芽孢液的相关研究较少。因此,我们以黄瓜枯萎病的致病菌尖孢镰刀菌黄瓜专化型作为指示菌,研究多黏类芽孢杆菌P.polymyxa JSa-9对该菌的抑制作用,并利用Taguchi试验设计等方法对P.polymyxa JSa-9进行产芽孢发酵培养基的优化,以芽孢作为微生物农药菌剂的有效成分,研究其对黄瓜枯萎病的生物防治作用,为其在实际生产中的应用提供依据。
1 材料与方法 1.1 试验材料 1.1.1 供试菌株及指示菌株供试菌株为Paenibacillus polymyxa JSa-9,由南京农业大学食品科技学院酶工程试验室分离保藏,并已保藏于中国普通微生物菌种保藏管理中心(CGMCC No.4314)。指示菌为尖孢镰刀菌黄瓜专化型(Fusarium oxysporum f.sp.cucumerinum 37438)和串珠镰孢菌(Fusarium moniliforme 30174),来自于中国农业微生物菌种保藏管理中心(ACCC);禾谷镰刀菌野生型2021(Fusarium graminearum 2021)由南京农业大学植物病理研究室提供。
1.1.2 培养基Landy培养基、LB培养基、PDA培养基和BPY培养基参照文献[12]。
1.2 平板对峙法测抑菌活性将病原真菌在平板上活化,用5 mm打孔器打取菌饼接种到PDA平板中心(长有菌丝体的一面朝下),28 ℃下培养2 d后,在平板上对峙四点(距平板中心3 cm处)放置无菌滤纸片,吸取20 μL发酵上清液(发酵液离心取上清液)于5 mm滤纸片上,置于28 ℃恒温箱内培养。以未接细菌发酵液的处理为对照,每处理重复3次,待空白对照病原菌长满平板时,十字交叉法测量菌落直径(试验组沿滤纸片与平板中心方向进行测量),计算抑菌率[13]。抑菌率=(对照组菌落生长直径-试验组菌落生长直径)/对照菌落生长直径×100%。
1.3 培养基优化 1.3.1 培养方法种子液制备:从斜面上刮取两环活化好的P.polymyxa JSa-9菌株接种到装有LB液体培养基的三角瓶中,置于恒温摇床中,30 ℃、180 r·min-1振荡培养24 h后使用。摇瓶容量为250 mL,装液量为50 mL。发酵液制备:将培养好的种子液按10%(体积分数)的接种量接种于发酵培养基中,置于恒温摇床中,30 ℃、180 r·min-1振荡培养72 h。摇瓶容量为250 mL,装液量为50 mL。
1.3.2 单因素试验前期经过筛选(Landy、BPY、NB、LB),以BPY培养基作为初始发酵培养基,芽孢产量(将发酵液于80 ℃水浴15 min后,平板菌落计数法检测芽孢产量)和芽孢形成率(芽孢产量与细菌总数的比值)作为评测指标,采用单因素试验方法筛选最适于P.polymyxa JSa-9产芽孢的碳源、氮源和无机盐。
碳源的优化:将BPY培养基中的碳源(葡萄糖)分别替换为玉米粉、麦芽浸粉、可溶性淀粉、蔗糖、小麦粉、乳糖,添加量为5 g·L-1。
氮源的优化:以麦芽浸粉作为碳源,将BPY培养基中的氮源(牛肉膏、酵母膏、蛋白胨)分别替换为NH4Cl、大豆蛋白胨、黄豆粉、鱼粉蛋白胨、牛肉膏、酵母膏、玉米浆,添加量为10 g·L-1。
无机盐的优化:以麦芽浸粉为碳源、玉米浆为氮源,将BPY培养基中的无机盐(NaCl)分别替换为CaCO3、MgCl2·6H2O、KH2PO4,添加量为5 g·L-1。
| 自变量 Independent variables | 代号 Codes | 编码水平 Levels | ||
| 1 | 2 | 3 | ||
| 麦芽浸粉/(g·L-1) Malt extract | X1 | 5 | 10 | 15 |
| 玉米浆/(g·L-1) Corn steep liquor | X2 | 10 | 15 | 20 |
| CaCO3/(g·L-1) | X3 | 3 | 5 | 7 |
| MgCl2·6H2O/(g·L-1) | X4 | 0.3 | 0.5 | 0.7 |
在以上单因素试验以及前期研究的基础上,将麦芽浸粉、玉米浆、CaCO3、MgCl2·6H2O 4个因素设置为信号因子,对培养基进行Taguchi方法优化,以芽孢产量和信噪比(S/N)为望大性响应值。采用JMP软件进行试验设计和数据分析。
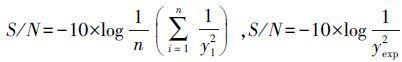 ,其中S/N为信噪比,yi为评价指标,yexp为预指标。本试验取望大值,即S/N越大越好。
,其中S/N为信噪比,yi为评价指标,yexp为预指标。本试验取望大值,即S/N越大越好。
试验设在东台市农南农药化工有限公司的试验用塑料大棚内,施农家肥,井水灌溉。管理按常规进行。
试验共设4个处理:黄瓜分别接种发酵上清液(药剂1)、芽孢液(药剂2)、多·酮(40%可湿性粉剂,多菌灵含量35%,三唑酮含量5%)500倍稀释液(药剂3)、无菌清水(对照CK),每处理10个塑料钵,每钵2株黄瓜幼苗,重复3次。
发酵上清液制备:将种子液接种于Landy培养基中,30 ℃、180 r·min-1摇床培养72 h,得到的发酵液调节为含菌量为1.0×108 CFU·mL-1的菌液,然后10 000 r·min-1离心得到发酵上清液。
芽孢液制备:将种子液接种于上述优化得到的芽孢培养基中,30 ℃、180 r·min-1摇床培养72 h,将发酵液于80 ℃水浴15 min,离心去上清液,将沉淀用生理盐水洗涤2次调节为1.0×108 CFU·mL-1的芽孢液。
挑取籽粒饱满的黄瓜种子消毒,28 ℃催芽,然后挑取出芽整齐一致的黄瓜种子播种在装有无菌土(300 g)的塑料钵中,在黄瓜2片真叶期灌根接种,接种时用1片硬纸板插入植株根部周围的土中数次,以达到伤根的目的,然后每株灌浓度为107 CFU·mL-1的尖镰孢孢子悬浮液5 mL,并分别灌入药剂1、药剂2、药剂3和CK各25 mL,室温保持25~28 ℃。
于接种10 d后调查全部秧苗,观察幼苗枯萎病发病情况并计算病情指数和相对防效,并于接种21 d后调查全部秧苗,记录幼苗株高及单株叶片数。其中黄瓜枯萎病发病程度参照闫敏[14]和宋以星等[15]的分级统计方法:1级发病程度为叶面无症状,代表数值为0;2级发病程度为1/4以下的叶面表现萎蔫症状,代表数值为1;3级发病程度为1/4~1/2叶面表现萎蔫症状,代表数值为2;4级发病程度为1/2以上叶面表现萎蔫症状,代表数值为3;5级发病程度为全株萎蔫死亡,代表数值为4。其中,病情指数=∑(各级病株数×各级代表值)/(调查总数×4)×100%,相对防效=(对照病情指数-处理病情指数)/对照病情指数×100%。
2 结果与分析 2.1 Paenibacillus polymyxa JSa-9发酵液对真菌的抑制作用由图 1可以看出:与对照组相比,处理组的平板内出现了明显的抑菌带,菌落生长受到较强的抑制作用,菌丝量减少,对尖孢镰刀菌黄瓜专化型、串珠镰刀菌和禾谷镰刀菌的抑菌带半径(滤纸片中心至真菌菌丝边缘,沿滤纸片与平板中心方向)分别为10.39、10.39和9.59 mm。

|
图 1 Paenbacillus polymyxa JSa-9发酵上清液对真菌的抑制效果 Fig. 1 Inhibitory effect of Paenbacillus polymyxa JSa-9 supernatant on fungus A.尖孢镰刀菌黄瓜专化型Fusarium oxysporum f.sp.cucumerinum;B.串珠镰刀菌Fusarium moniliforme;C.禾谷镰刀菌Fusarium graminearum |
尖孢镰刀菌黄瓜专化型、串珠镰刀菌、禾谷镰刀菌的对照组菌落直径分别为69.17、69.95和87.82 mm,试验组菌落直径显著低于对照组,分别为41.45、41.53和41.66 mm,P.polymyxa JSa-9对3株真菌的抑菌率分别为43.76%、43.20%、55.72%。由此可以得出,P.polymyxa JSa-9菌株对尖孢镰刀菌黄瓜专化型、串珠镰刀菌和禾谷镰刀菌具有较强的抑制效果。
2.2 培养基优化 2.2.1 单因素试验以BPY培养基作为初始发酵培养基,筛选最优碳源、氮源、无机盐,单因素试验结果如图 2、图 3和图 4所示。
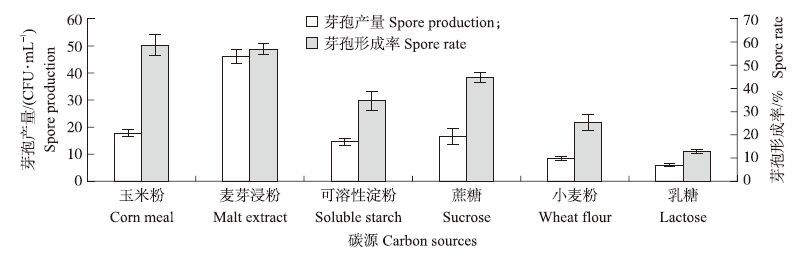
|
图 2 不同碳源对P.polymyxa JSa-9芽孢产量和芽孢形成率的影响 Fig. 2 Effect of different carbon sources on spore production and spore rate of P.polymyxa JSa-9 |

|
图 3 不同氮源对P.polymyxa JSa-9芽孢产量和芽孢形成率的影响 Fig. 3 Effect of different nitrogen sources on spore production and spore rate of P.polymyxa JSa-9 |
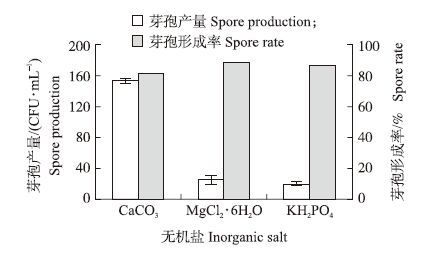
|
图 4 不同无机盐对P.polymyxa JSa-9芽孢产量和芽孢形成率的影响 Fig. 4 Effect of different inorganic salt on spore production and spore rate of P.polymyxa JSa-9 |
由图可知,以麦芽浸粉、玉米浆和CaCO3分别替换初始培养基中的碳源、氮源和无机盐时,P.polymyxa JSa-9的芽孢产量和芽孢形成率达到最大值,因此将其分别作为最适碳源、氮源和无机盐。
2.2.2 Taguchi试验Taguchi试验设计结果如表 2所示,利用JMP软件对该设计进行统计分析。响应值为芽孢产量时,各因素效应检验结果(表 3)显示,麦芽浸粉(P=0.033)在P=0.05的水平下影响显著,其他因子对芽孢产量影响不显著。响应值为信噪比时各因素效应检验(表 4)显示,麦芽浸粉(P=0.048)仍然在P=0.05的水平下影响显著。说明麦芽浸粉不管是对于芽孢的产生还是对于模型的信噪比都具有显著影响。
| 组别Groups | 因子 Factors | 芽孢产量/(107 CFU·mL-1)Yield of spore | 信噪比S/N | |||
| X1 | X2 | X3 | X4 | |||
| 1 | 1 | 1 | 1 | 1 | 221.25 | 46.79 |
| 2 | 1 | 2 | 2 | 2 | 507.50 | 54.10 |
| 3 | 1 | 3 | 3 | 3 | 157.50 | 43.91 |
| 4 | 2 | 1 | 2 | 3 | 257.50 | 48.20 |
| 5 | 2 | 2 | 3 | 1 | 341.25 | 50.66 |
| 6 | 2 | 3 | 1 | 2 | 296.25 | 49.42 |
| 7 | 3 | 1 | 3 | 2 | 607.50 | 55.67 |
| 8 | 3 | 2 | 1 | 3 | 615.00 | 55.77 |
| 9 | 3 | 3 | 2 | 1 | 375.00 | 51.45 |
| 变异来源Source of variation | 自由度Degree of freedom | 平方和Quadratic sum | F值F value | Pro>F |
| 麦芽浸粉 Malt extract | 2 | 111 038.344 | 7.049 | 0.033* |
| 玉米浆 Corn steep liquor | 2 | 56 953.132 | 2.426 | 0.163 |
| CaCO3 | 2 | 200.005 | 0.006 | 0.939 |
| MgCl2·6H2O | 2 | 40 612.557 | 1.573 | 0.250 |
| 变异来源Source of variation | 自由度Degree of freedom | 平方和Quadratic sum | F值F value | Pro>F |
| 麦芽浸粉 Malt extract | 2 | 59.419 | 5.748 | 0.048* |
| 玉米浆 Corn steep liquor | 2 | 36.447 | 2.676 | 0.146 |
| CaCO3 | 2 | 1.552 | 0.083 | 0.781 |
| MgCl2·6H2O | 2 | 25.902 | 1.712 | 0.232 |
利用JMP软件的预测刻画器对芽孢生产的预测如图 5,当各因素均处于最佳水平,即培养基组分为麦芽浸粉15 g·L-1、玉米浆15 g·L-1、CaCO3 5 g·L-1、MgCl2·6H2O 0.5 g·L-1时,预测得到的芽孢产量可达到7.44×109 CFU·mL-1,此时培养基的信噪比为60.13。
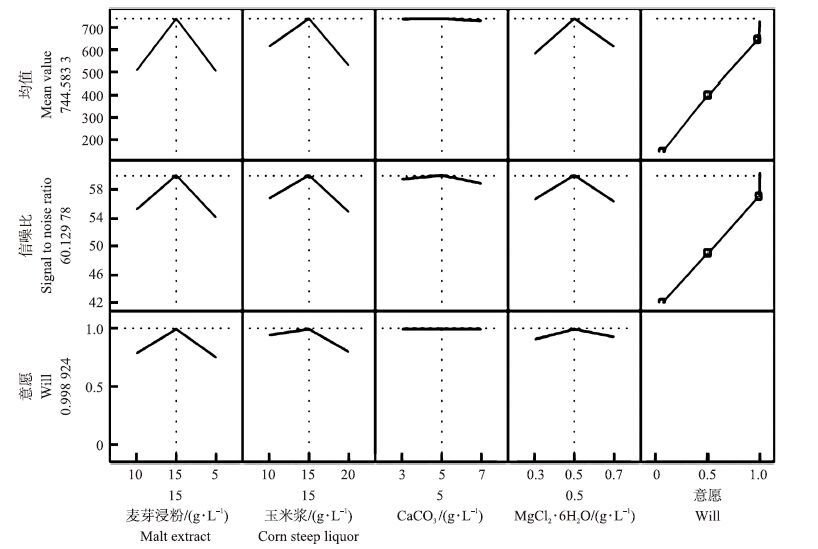
|
图 5 Taguchi试验芽孢产量最佳水平设置预测 Fig. 5 Prediction profile of the most efficient level setup in Taguchi experimental design |
接种黄瓜枯萎病致病菌后,各处理黄瓜幼苗出现了不同程度的症状,症状较严重的植株出现子叶萎蔫、茎基部缩变呈褐色,症状较轻的植株叶片边缘变黄,有少量斑点。由表 5可知:接种黄瓜枯萎病致病菌10 d后,在20~30 ℃的温室条件下,对照组黄瓜发病率达41.67%,而经发酵上清液(药剂1)、芽孢液(药剂2)和多·酮500倍稀释液(药剂3)处理的黄瓜幼苗发病率分别为18.33%、25.00%、15.00%。另外,芽孢液对黄瓜枯萎病的相对防效为69.02%,与多·酮500倍稀释液防效无显著差异(P<0.05),但显著高于发酵上清液的防效,这可能是由于芽孢在叶片上定殖,使其可以长时间发挥抑菌作用。
| 试验处理Experimental treatments | 发病率Morbidity | 病情指数Disease index | 相对防效Relative control efficacy |
| 药剂1 Agent1 | 18.33±0.88c | 19.30±1.95b | 62.16±3.50b |
| 药剂2 Agent 2 | 25.00±2.02b | 15.80±1.33b | 69.02±1.84a |
| 药剂3 Agent 3 | 15.00±1.11c | 14.50±2.02b | 71.57±2.84a |
| 对照CK | 41.67±3.25a | 51.00±4.29a | |
| 注:1)药剂1:发酵上清液;药剂2:芽孢液;药剂3:多·酮500倍稀释液;对照:无菌清水;2)不同小写字母表示差异显著(P<0.05)。 Note:1)Agent1:Fermentation supernatant;Agent 2:Spore suspension;Agent 3:Many ketones diluted up to 500 times;CK:Sterile water;2)Different small letters indicate significant difference at 0.05 level. The same as follows. | |||
综上,发酵液上清液和芽孢液均可以减少黄瓜枯萎病发病率,其中,芽孢液的抑制效果优于发酵上清液。
2.3.2 不同生防菌剂对黄瓜苗期株高的影响由图 6-A可以看出:接种生防菌剂21 d之后,与对照组相比,经药剂1和药剂3处理的黄瓜幼苗株高没有显著差异(P>0.05),而经药剂2处理的黄瓜幼苗,其株高显著提高(P<0.05)。其中,经药剂1、药剂3和CK处理过的黄瓜幼苗株高分别为6.56、6.51、6.1 cm,而经药剂2处理过的黄瓜幼苗株高平均为7.61 cm。由此可以得出,多黏类芽孢杆菌JSa-9芽孢液可以显著促进黄瓜植株生长。

|
图 6 不同处理对黄瓜株高(A)和黄瓜单株叶片数(B)的影响 Fig. 6 Effects of different treatments on plant height(A)and the number of leaves per plant(B)of cucumber |
由图 6-B可以看出:接种生防菌剂21 d之后,与对照组相比,经药剂1和药剂3处理的黄瓜幼苗单株叶片数没有显著差异(P>0.05),而经药剂2处理的黄瓜幼苗,其单株叶片数显著高于药剂3和CK组(P<0.05)。其中,经药剂1、药剂3和CK处理过的黄瓜幼苗单株叶片数分别为4.40、4.21、3.65,而经药剂2处理过的黄瓜幼苗单株叶片数平均为4.79。由此可以得出,多黏类芽孢杆菌JSa-9芽孢液可以显著促进黄瓜幼苗叶片的生长(P<0.05)。
3 讨论本文通过平板对峙法得出P.polymyxa JSa-9对尖孢镰刀菌黄瓜专化型、串珠镰刀菌、禾谷镰刀菌均具有较强的抑制作用。采用单因素试验方法确定了发酵培养基最优碳源、氮源和无机盐分别为麦芽浸粉、玉米浆、CaCO3。随后采用Taguchi试验设计确定了P.polymyxa JSa-9产芽孢各组分的最优配比:麦芽浸粉15 g·L-1、玉米浆15 g·L-1、CaCO3 5 g·L-1、MgCl2·6H2O 0.5 g·L-1。经优化后的培养基培养,芽孢产量预测可达到7.44×109 CFU·mL-1,此时培养基的信噪比为60.13。生防试验中,将芽孢液与发酵上清液、多·酮500倍稀释液、无菌清水对比发现,芽孢液对黄瓜枯萎病的相对防效及在促进黄瓜幼苗根部生长和生叶方面,均显著优于其他药剂。说明P.polymyxa JSa-9芽孢液对黄瓜枯萎病有良好的防治效果,且具有一定促生长作用。
在单因素试验中,发现CaCO3是促进芽孢生成的最佳无机盐,这是因为CaCO3可以缓冲培养基的pH 值。郭夏丽等[16]发现,培养基初始pH值为中性时,芽孢产量最大。Greene[17]也曾报道CaCO3能够通过调节pH强烈启动芽孢生成。在Taguchi试验设计方法中,对影响P.polymyxa JSa-9芽孢产量的4个关键因子进行了组分配比优化,其中对响应值影响最大的因素是麦芽浸粉含量,不论是以芽孢产量还是以信噪比为响应值,其影响均是显著的(P<0.05),这是因为麦芽浸粉作为发酵培养基的碳源,对芽孢的合成是必需的,是影响芽孢形成的决定性因素[18]。麦芽为禾本科植物大麦的成熟果实发芽之后经干燥而得,主要含有淀粉、还原糖、蔗糖、蛋白质以及粗脂肪等成分,可以作为生产芽孢的有效碳源。
目前,国内外对于生防微生物在黄瓜枯萎病上的应用已有广泛报道。如,李世贵[19]通过田间小区试验表明长柄木霉(Trichoderma longibrachiatum)固体菌剂对黄瓜枯萎病具有明显的防病增产效果,防病效果比当地传统施肥提高了45.12%;Park等[20]研究发现把恶臭假单胞杆菌和非致病性尖孢镰孢菌同时施在土壤中,对黄瓜枯萎病防效达到50%。本研究通过优化培养基可将P.polymyxa JSa-9芽孢液相对防效提高到69.02%。一些研究将微生物与有机肥发酵制成微生物有机肥,可显著降低黄瓜枯萎病发病率,本研究中P.polymyxa JSa-9芽孢液是否可通过这种方法进一步提高防效,需做进一步研究。
生物防治是利用对植物无害或有益的生物来控制有害生物的数量,将其控制在经济阈值以下,进而达到预防病虫害的目的[21]。随着人们对无污染、无公害绿色食品的需求日益提高,枯萎病菌的生物防治越来越引起人们的关注[22],利用微生物及其代谢产物,植物提取物等生物农药及对人体和生态环境无害的生防菌剂替代化学农药已成为世界范围内的研究发展方向。
目前,基于生物防治的优点及黄瓜这种可以生食的蔬菜的绿色要求,生物防治黄瓜枯萎病成为人们关注的焦点。因此,研究黄瓜枯萎病生物防治方法迫在眉睫,对发展黄瓜生产、增加瓜农收入、保障消费者健康、减少环境污染和维持农业可持续发展,都具有重大的理论和生产意义。
| [1] | 杨少波,刘训理. 多黏类芽孢杆菌及其产生的生物活性物质研究进展[J]. 微生物学通报,2008,35(10):1621-1625. Yang S B,Liu X L. Research advances in Paenibacillus polymyxa and their bioactive substances[J]. Microbiology,2008,35(10):1621-1625(in Chinese with English abstract). |
| [2] | Son S H,Khan Z,Kim S G,et al. Plant growth-promoting rhizobacteria,Paenibacillus polymyxa and Paenibacillus lentimorbus suppress disease complex caused by root-knot nematode and fusarium wilt fungus[J]. Journal of Applied Microbiology,2009,107(2):524-532. |
| [3] | Ryu C M,Kim J,Choi O,et al. Improvement of biological control capacity of Paenibacillus polymyxa E681 by seed pelleting on sesame[J]. Biological Control,2006,39(3):282-289. |
| [4] | Timmusk S,Grantcharova N,Wagner E G H. Paenibacillus polymyxa invades plant roots and forms biofilms[J]. Applied and Environmental Microbiology,2005,71(11):7292-7300. |
| [5] | Huang X Q,Chen L H,Ran W,et al. Trichoderma harzianum strain SQR-T37 and its bio-organic fertilizer could control Rhizoctonia solani damping-off disease in cucumber seedlings mainly by the mycoparasitism[J]. Applied Microbiol Biotechnol,2011,91(3):741-755. |
| [6] | Ling N,Xue C,Huang Q W,et al. Development of a mode of application of bioorganic fertilizer for improving the biocontrol efficacy to Fusarium wilt[J]. Biocontrol,2010,55(5):673-683. |
| [7] | Wei Z,Yang X M,Yin S X,et al. Efficacy of Bacillus-fortified organic fertiliser in controlling bacterial wilt of tomato in the field[J]. Applied Soil Ecology,2011,48(2):152-159. |
| [8] | Luo J,Ran W,Hu J,et al. Application of bio-organic fertilizer significantly affected fungal diversity of soils[J]. Soil Biology and Biochemistry,2010,74(6):2039-2048. |
| [9] | Zhang N,Wu K,He X,et al. A new bioorganic fertilizer can effectively control banana wilt by strong colonization of Bacillus subtilis N11[J]. Plant and Soil,2011,344(1):87-97. |
| [10] | Deng Y,Lu Z X,Lu F X,et al. Study on an antimicrobial protein produced by Paenibacillus polymyxa JSa-9 isolated from soil[J]. World Journal of Microbiology and Biotechnology,2011,27(8):1803-1807. |
| [11] | Deng Y,Lu Z X,Lu F X,et al. Identification of LI-F type antibiotics and di-n-butyl phthalate produced by Paenibacillus polymyxa[J]. Journal of Microbiological Methods,2011,85(3):175-182. |
| [12] | 邓阳. Paenibacillus polymyxa Jsa-9抗菌物质的结构鉴定及小麦生防应用研究[D]. 南京:南京农业大学,2012. Deng Y. Identification of antimicrobial substances produced by Paenibacillus polymyxa Jsa-9 and application in biocontrol of wheat[D]. Nanjing:Nanjing Agricultural University,2012(in Chinese with English abstract). |
| [13] | 张淑梅,沙长青,赵晓宇,等. 一株抗真菌内生多黏芽孢杆菌的分离鉴定及对水稻恶苗病菌的抑制作用[J]. 中国生物工程杂志,2010,30(2):84-88. Zhang S M,Sha C Q,Zhao X Y,et al. Identification of an endophytic Paenibacillus polymyxa strain producing antifungal protein and the inhibition to Fusarium moniliforme causing rice bakanae disease[J]. China Biotechnology,2010,30(2):84-88(in Chinese). |
| [14] | 闫敏. 黄瓜枯萎病的生物防治研究[D]. 雅安:四川农业大学,2003. Yan M. Study on the biological control of antogonistic bacteria against cucumber Fusarium wilt[D]. Ya'an:Sichuan Agicultural University,2003(in Chinese with English abstract). |
| [15] | 宋以星,杨蕊,杨运华,等. 芽孢杆菌B1对黄瓜枯萎病菌的拮抗作用[J]. 河南科技学院学报,2011,39(3):38-41. Song Y X,Yang R,Yang Y H,et al. B1 strain of bacillus antigonism to Fusarium oxysporum[J]. Journal of Henan Institute of Science and Technology,2011,39(3):38-41(in Chinese with English abstract). |
| [16] | 郭夏丽,狄源宁,王岩. 枯草芽孢杆菌产芽孢条件的优化[J]. 中国土壤与肥料,2012(3):99-103. Guo X L,Di Y N,Wang Y. Optimization of sporulation conditions of Bacillus subtilis[J]. Soil and Fertilizer Sciences in China,2012(3):99-103(in Chinese). |
| [17] | Greene H C. Colony organization of certain bacteria with reference to sporulation[J]. Journal of Bacteriology,1938,35(3):261-273. |
| [18] | 王天云,陈振风,王福源. 一种促使乳酸芽孢杆菌大量生成芽孢的方法[J]. 工业微生物,2001,31(3):13-18. Wang T Y,Chen Z F,Wang F Y. A method for facilitate sporulation of Bacillus WTFY1001[J]. Industrial Microbiology,2001,31(3):13-18(in Chinese). |
| [19] | 李世贵. 防治黄瓜枯萎、青椒疫病木霉菌的研究[D]. 北京:中国农业科学院,2005. Li S G. The research about Triehodemra spp. against the cucumber Fusarium wilt and the green pepper Phytophthora blight[D]. Beijing:Chinese Academy of Agricultural Sciences,2005(in Chinese with English abstract). |
| [20] | Park C S,Paulitz T C,Baker R. Biocontrol of Fusarium wilt of cucumber resulting from interactions between Pseudomonas putida and nonpathogenic isolates of Fusarium oxysporum[J]. Phytopathology,1988,78(2):190-194. |
| [21] | 鲁海菊,张云霞,刘云龙. 生物防治研究进展[J]. 红河学院学报,2004,2(2):90-92. Lu H J,Zhang Y X,Liu Y L. New advances of bio-control of plants pathogen[J]. Journal of Honghe University,2004,2(2):90-92(in Chinese). |
| [22] | 彭埃天,宋晓兵,凌金锋,等. 香蕉枯萎病菌4号生理小种分子检测与枯萎病生物防治研究进展[J]. 果树学报,2009,26(1):77-81. Peng A T,Song X B,Ling J F,et al. Advances in research on molecular detection and biological control of Fusarium oxysporum f. sp.cubense race 4[J]. Journal of Fruit Science,2009,26(1):77-81(in Chinese with English abstract). |




