文章信息
- 任伟龙, 张瑜, 钱晨韵, 孙勇, 杨婧, 侯石桐, 阮宝林, 王丽平. 2016.
- REN Weilong, ZHANG Yu, QIAN Chenyun, SUN Yong, YANG Jing, HOU Shitong, RUAN Baolin, WANG Liping. 2016.
- 不同剂量黄连素对肉鸡组织P-gp编码基因Abcb1 mRNA表达及口服恩诺沙星药动学的影响
- The effect of berberine on the pharmacokinetics of oral enrofloxain in broilers
- 南京农业大学学报, 39(3): 488-494
- Journal of Nanjing Agricultural University, 39(3): 488-494.
- http://dx.doi.org/10.7685/jnau.201507036
-
文章历史
- 收稿日期:2015-07-22
黄连素,又称小檗碱(berberine),是从黄连、黄柏、三棵针等数十种中药中提取的一种异喹啉类生物碱,在临床中一直被用作清热解毒和治疗肠道细菌性腹泻药物,也是兽医临床较常用的一种抗菌药物[1]。作为一类非处方药物,黄连素的临床安全性无需管理部门的严格评估,但是近年来多项研究已报道黄连素可影响一些药物如环孢菌素A、地高辛等的血药浓度,介导药物间相互作用。其机制虽未完全阐明,但部分体外试验初步证实黄连素可通过影响机体细胞色素P450(CYP450)和P-糖蛋白(P-glycoprotein,P-gp)的活性从而介导药物间相互作用的发生[2, 3]。随着黄连素的广泛应用,其所介导的药物间相互作用日渐成为关注的焦点。
P-gp 是由Abcb1基因编码的一种ATP依赖性转运蛋白,不仅在肿瘤细胞高度表达,而且在人和动物的正常组织中如肝细胞的胆管面和胆小管上皮细胞的管腔侧、小肠及大肠的柱状上皮细胞顶端等均有分布[4, 5],故会影响外源化合物的体内过程,尤其对药物的口服吸收利用度会产生影响。有研究显示黄连素会影响肿瘤细胞或正常组织内P-gp的表达或活性,如伍奕等[2]采用10、20、40和80 μmol · L-1的黄连素处理结肠癌细胞株HCT-8/VCR后,可显著降低HCT-8/VCR细胞内P-gp 的表达,并能增强细胞内罗丹明-123的荧光强度,且荧光强度与黄连素的浓度呈正相关。目前有关黄连素对P-gp影响的研究大多集中于啮齿动物和人,有关肉鸡的研究数据仍较缺乏。
恩诺沙星为动物专用的氟喹诺酮类药物,因具有抗菌谱广、杀菌活性强,与其他抗菌药物无交叉耐药性等特点而被广泛使用[6]。Guo等[7]的研究结果已证明恩诺沙星为肉鸡P-gp的底物,其在肉鸡体内的药动学过程可受P-gp表达变化的影响,但黄连素是否会通过影响P-gp而介导其与恩诺沙星的相互作用尚未见报道。因此,本试验拟考察不同剂量的黄连素处理肉鸡后对不同组织P-gp的 mRNA表达及对口服恩诺沙星药代动力学的影响,以探究黄连素与口服恩诺沙星的药物间相互作用,为临床用药提供参考。
1 材料与方法 1.1 试验动物30只健康1日龄AA肉鸡,购于南京温氏养鸡场,饲喂不含任何抗菌药物的全价饲料,饲养至1月龄,体质量0.6~0.7 kg,自由饮水。
1.2 药品、试剂与引物RNAisoTM Plus(总RNA提取试剂),购自TaKaRa公司;焦碳酸二乙酯(DEPC)、dNTP、RNA酶抑制剂、随机引物、琼脂糖、M-MLV,均购自生兴生物科技有限公司;PCR Master Mix、SYBR Green real-time PCR Master Mix,购自诺唯赞生物科技有限公司;恩诺沙星原料药(批号20140608,含量99.8%),购于上虞京新药业有限公司;恩诺沙星标准品(批号 H0080904,含量99.8%),购自中国药品生物制品检察所;盐酸黄连素(含量98%,CAS:633-65-8,进口分装,上海澄绍生物科技有限公司);乙腈,德国默克公司,色谱纯级(HPLC);肝素钠注射液(规格:2 mL,12 500 IU,批号:H31022051),上海第一生化药业有限公司;磷酸、三乙胺、二氯甲烷、正己烷均为分析纯级(AR)。
参照文献[8]设计看家基因β-actin引物,利用Primer Premier 5.0设计Abcb1的荧光引物,由上海捷瑞生物公司合成。β-actin上/下游引物:5′-GCTGTTGTATTTCCTGCTATGG-3′/5′-ACAAACAAGTGGGCTGCTG-3′,扩增产物长126 bp;Abcb1上/下游引物:5′-AAACACCACGGGAGCAT-3′/5′-AGTGTTAGTTGCCAGCCAT-3′,扩增产物长度91 bp。
1.3 荧光定量PCR法检测黄连素对肉鸡组织Abcb1mRNA表达的影响 1.3.1 样品采集及处理选取15只1月龄AA肉鸡随机分为3组,即空白对照组、黄连素低剂量组(40 mg · kg-1)和黄连素高剂量组(80 mg · kg-1),各处理组肉鸡灌服黄连素2次(分别于09:00和17:00各灌服1次)。于第2天09:00立即剖杀对照组和黄连素处理组鸡只,采集肝脏、肾脏、十二指肠、空肠和回肠组织,将采集的新鲜组织放入液氮速冻后,转入-80 ℃冰箱长期保存,以备提取组织RNA。
1.3.2 组织总RNA的提取及反转提取过程按照提取试剂盒说明书进行,具体参考Guo等[7]的步骤。若提取的RNA完整性及纯度较好,则按试剂盒说明将RNA反转为cDNA。反转过程包括2步:首先将RNA(0.5 μg · mL-1)4 μL,随机引物2 μL、DEPC H2O 2 μL、dNTP 2 μL混匀后置于PCR仪中70 ℃加热5 min,后迅速置于冰上;然后加入15 μL的混合物体系:RNA酶抑制剂0.2 μL、DEPC H2O 9.3 μL、M-MLV 0.5 μL、5×Buffer 5 μL。将此混合物置于PCR仪中 37 ℃,60 min;95 ℃,5 min,即将RNA反转为cDNA,置于-20 ℃冰箱保存。
1.3.3 实时荧光定量PCR采用SYBR Green实时定量PCR的方法,反应体系为:cDNA 2 μL,Abcb1及β-actin基因上、下游引物各0.4 μL,SYBR Green PCR Mix 10 μL,灭菌三蒸水7.2 μL。扩增条件为:95 ℃ 5 min;95 ℃60 s,60 ℃ 30 s,40个循环。每个组织样设置3个平行并取平均值,以β-actin基因为内参,采用2-ΔΔCT方法分析Abcb1基因相对表达量的差异。
1.3.4 数据处理荧光定量结果采用2-ΔΔCT方法[9]进行计算,结果以平均数±标准误(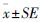 )表示,应用SPSS 16.0软件对均值进行单因素方差分析(one way ANOVA,LSD)。
)表示,应用SPSS 16.0软件对均值进行单因素方差分析(one way ANOVA,LSD)。
根据参考文献[6]报道的波长范围内检测观察,选择吸收高、分离良好、杂质干扰少的波长作为检测波长。
1.4.2 血浆中恩诺沙星检测的色谱条件Waters e2695型高效液相色谱仪2489紫外检测器(美国Waters公司);色谱柱:Kromasil C18 HPLC Columns(5 μm,25 cm×4.6 mm,南京微色谱公司);柱温35 ℃;检测波长278 nm;进样量10 μL;流速1.0 mL · min-1;流动相为0.1 mol · L-1 H3PO4溶液(三乙胺调pH值至3.5)-乙腈(体积比为84:16)。
1.4.3 主要工作液配制0.1 mol · L-1H3PO4溶液配制:准确移取6.822 mL 的H3PO4溶液置于1 L容量瓶中,纯净水定容,三乙胺调pH值至3.50,抽滤,超声除气泡后,待用;10 mg · mL-1恩诺沙星溶液的配制:准确称取恩诺沙星1.0 g,置于50 mL烧杯中,滴加少量NaOH溶液,使恩诺沙星充分溶解后,转移至100 mL 容量瓶中,定容至100 mL;恩诺沙星储备液的配制:准确称取恩诺沙星对照品10.0 mg,置于10 mL容量瓶中,加混匀的流动相充分溶解后定容,即为1 mg · mL-1溶液,4 ℃保存备用。
1.4.4 给药方案与样品的采集15只健康肉鸡随机分成3组,分别为对照组单剂量口服恩诺沙星10 mg · kg-1)(n=5);黄连素高、低剂量(40、80 mg · kg-1)处理组,采用不同剂量黄连素处理1 d后口服恩诺沙星(10 mg · kg-1,n=5)。所有鸡在试验期间自由饮水。分别于给药前和给药后0.083、0.167、0.25、0.333、0.50、0.75、1、2、3、4、6、8、12和24 h后进行翅下静脉无菌采血,每次约2.0 mL,置于肝素钠抗凝管中,4 ℃、4 000 g离心8 min分离上层血浆,所得血浆样品-20 ℃冰箱保存,待测。
1.4.5 血浆样品处理准确吸取200 μL血浆,加入2 mL二氯甲烷涡旋3 min,于4 ℃、12 000 g离心10 min,吸取下层有机相于2 mL EP管中,35 ℃水浴氮气仪吹干,加200 μL流动相复溶后,将样品涡旋混匀5 min,之后加入400 μL正己烷除脂,4 ℃、12 000 g离心10 min,吸取100 μL下层溶液,置于进样管内进样测定。
1.4.6 HPLC检测肉鸡血浆中恩诺沙星制备AA肉鸡的空白血浆、空白血浆加恩诺沙星(1 μg · mL-1)和灌服恩诺沙星后1 h 时的血浆样品,进样后考察恩诺沙星的专属性。
空白血浆内添加恩诺沙星,产生一系列工作浓度,每个浓度5个平行,以浓度和测得的峰面积为坐标轴制备标准曲线。
根据空白流动相得基线噪音值求其平均值,按信噪比(S/N)为10求出定量限(LOQ),按S/N为3求出检测限(LOD),其中定量限满足精密度和准确度的要求。
空白血浆内加入恩诺沙星,制备低、中、高(0.1、1和10 μg · mL-1)3个浓度的血浆样,每一浓度5个平行,进样分析后计算相对回收率(实测浓度值与理论浓度值之比)。制备低、中、高(0.05、1、10 μg · mL-1)3个浓度的空白血浆加恩诺沙星样品,每个浓度平行处理5份,连续检测3 d,计算日内、日间精密度。样品处理方法均参考1.4.5节。
1.5 药动学参数计算及统计分析采用中国药理学会3P97软件计算血药浓度-时间数据,选择最佳房室吸收模型,求出药动学参数。用SPSS 16.0软件统计分析药动学参数,数据以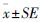 表示,并采用 graphpad prism 5.0 软件制作血药浓度-时间曲线(简称药-时曲线)。
表示,并采用 graphpad prism 5.0 软件制作血药浓度-时间曲线(简称药-时曲线)。
用微量分光光度计测量提取的RNA浓度及纯度,A260/A280值在1.8~2.0范围内。以10 g · L-1琼脂糖电泳对RNA进行鉴定,可看到28S和18S rRNA 2条清晰的条带,比例约为2:1,证明其未发生降解(图 1)。取RNA和cDNA各2 μL,以β-actin为看家基因进行PCR扩增,产物进行琼脂糖凝胶电泳。结果显示:以cDNA为模板的泳道可见清晰的扩增产物条带,证明cDNA合成成功;以RNA为模板的泳道无扩增产物条带,表示RNA中无基因组污染。
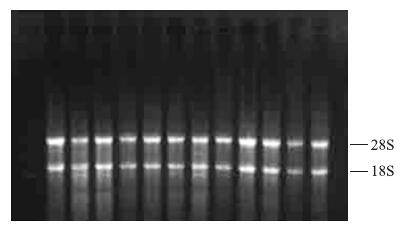 |
图 1 组织总RNA凝胶电泳图谱 Fig. 1 Electrophotogram of tissue total RNA |
取2 μL cDNA,建立20 μL反应体系,每个样 品重复3次,对Abcb 1进行扩增,得出Abcb1 mRNA在肉鸡肝脏、肾脏和肠道组织中的相对表达量(图 2)。 高、低剂量的黄连素处理1 d能显著或者极显著降低肾脏(P=0.021、P=0.003)、十二指肠(P=0.036、P=0.008)、空肠(P=0.086、P=0.028)和回肠(P=0.026、P=0.003)中Abcb1 mRNA的表达水平。
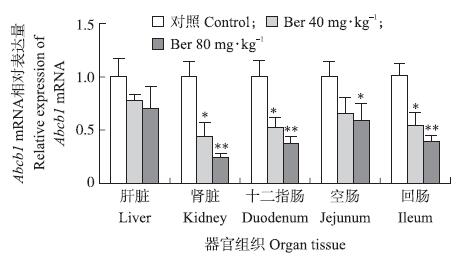 |
图 2 黄连素对肝脏、肾脏及肠道组织Abcb1 mRNA 表达的影响 Fig. 2 The effect of berberine(Ber)on Abcb1 mRNA expression in liver,kidney and intestines |
根据文献[6]报道,选取紫外吸收高且内源性干扰少的278 nm波长作为检测波长。按优化的色谱条件,得到空白血浆、空白血浆加药及给药后1 h的血浆样品色谱图(图 3)。如图所示,血浆中内源性物质不干扰恩诺沙星的分离,色谱峰平均保留时间均在 7.9 min左右。
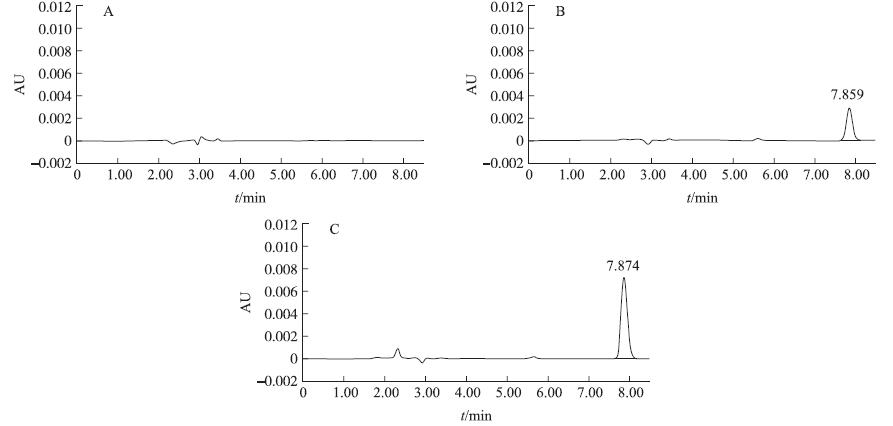 |
图 3 恩诺沙星的专属性考察 Fig. 3 Specificity of enrofloxacin in plasma of broilers A.空白血浆 Blank plasma;B.给药1 h血浆样品Plasma sample after 1 h of oral administration of enrofloxacin;C.空白血浆加药Blank plasma spiked with enrofloxacin |
以峰面积为纵坐标(Y)对药物浓度(X,μg · mL-1)进行线性回归,得出恩诺沙星的标准曲线方程为Y=61 085X+1 207(R2=0.999 9)。在该检测条件下,血浆中恩诺沙星均在0.025~10 μg · mL-1范围内,浓度与峰面积线性关系良好。
2.2.3 定量限和检测限按信噪比为10时测定恩诺沙星的最低定量限为0.05 μg · mL-1;以信噪比为3时测定恩诺沙星的最低检测限为 0.02 μg · mL-1。
2.2.4 回收率和精密度恩诺沙星低、中、高3个浓度(0.1、1和10 μg · mL-1)的血浆质控样品的测定结果显示本试验条件下,恩诺沙星的提取回收率均大于82%,连续检测3 d,日内、日间变异系数均小于11%,符合试验要求。
2.2.5 不同剂量黄连素处理对口服恩诺沙星药动学参数的影响对照组和黄连素处理组肉鸡按10 mg · kg-1单剂量口服恩诺沙星后,测定血药浓度,绘制药-时曲线(图 4)。用3P97软件分析血药浓度数据,并根据AIC等参数选择最佳房室吸收模型[10],结果显示恩诺沙星在体内的药动学符合一级吸收一室模型。主要的药动学参数见表 1。与对照组相比,经不同剂量的黄连素处理后再单剂量口服恩诺沙星,可使恩诺沙星在肉鸡体内的吸收速率常数(Ka)显著上升(P<0.05),消除半衰期(T1/2ke)显著延长(P<0.05),达峰时间(Tmax)显著缩短(P<0.05);虽然血浆中峰浓度(Cmax)未发生显著变化,但是药-时曲线下面积(AUC0~∞和AUC0~2 h)显著增加(P<0.05)。表明黄连素处理可使恩诺沙星在肉鸡体内的吸收加快,消除速率变慢,结果提示黄连素可以影响口服恩诺沙星在肉鸡体内的药动学过程。
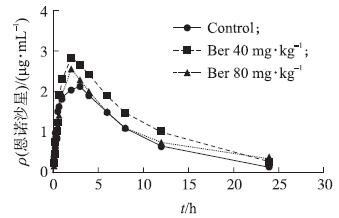 |
图 4 不同剂量黄连素处理后单剂量口服恩诺沙星的药-时曲线 Fig. 4 Concentration-time curve of enroflocaxin with and without differnet dose Ber |
 ,n=5)
Table 1 The main pharmacokinetic parameters of enrofloxacin in broilers treated by Ber
,n=5)
Table 1 The main pharmacokinetic parameters of enrofloxacin in broilers treated by Ber | 参数 Parameters | 对照组 Control group | Ber 40 mg·kg-1 | Ber 80 mg·kg-1 |
| Ka/h-1 | 0.96±0.25 | 1.66±0.17* | 1.79±0.18* |
| T1/2a/h | 0.80±0.31 | 0.59±0.08 | 0.86±0.25 |
| T1/2e/h | 4.19±0.26 | 5.87±0.48* | 7.57±1.46* |
| Tmax/h | 2.66±0.45 | 2.13±0.18* | 2.07±0.35* |
| Cmax/(μg·mL-1) | 1.83±0.25 | 2.52±0.14 | 2.28±0.12 |
| AUC0~∞/(μg·mL-1·h) | 21.78±1.59 | 28.04±0.54* | 26.80±0.68* |
| AUC0~2 h/(μg·mL-1·h) | 5.30±0.45 | 7.07±0.36* | 7.60±0.58* |
| 注:* 表示与对照组比较差异显著(P<0.05)。* means significant difference at 0.05 level compared with control group. | |||
P-糖蛋白由Abcb 1 基因编码,是近几年来研究较多的一种耐药蛋白。P-gp不仅在肿瘤细胞中高表达,在正常组织中也广泛分布。P-gp的转录表达受多种因素的影响,如化学药物、生理状态、激素、年龄、疾病状态等[11]。Zhang等[12]发现黄酮类化合物姜黄素使大鼠体内塞利洛尔的AUC提高了1.9倍,清除率(CL)降低了22%;Choi等[13]研究发现槲皮素能够使大鼠口服多柔比星的AUC和峰浓度以浓度依赖的方式显著增加。黄酮类药物对其他药物药动学的影响是否与P-gp有关还有待商榷。
黄连素是临床常用的抗菌中药。已有研究表明黄连素会影响啮齿类动物P-gp的表达和功能[3, 14],但其对家禽等农场动物的影响及调节机制研究甚少。另外,越来越多的氟喹诺酮类抗菌药物被证实为P-gp的底物,如Dautrey等[15]发现同时给予大鼠环丙沙星和P-gp抑制剂维拉帕米后,环丙沙星的AUC会显著升高,CL显著下降;Yamaguchi等[16]在研究大鼠体内格帕沙星和左氧氟沙星的生物利用度时,发现两药同时联用P-gp抑制剂环孢素A后,格帕沙星的生物利用度提高了40%,而左氧氟沙星和格帕沙星的清除率分别降低了1/3和1/2。Hennessy等[17]和Guo等[7]也已分别证实氟喹诺酮类药物恩诺沙星及其主要代谢产物环丙沙星是药物转运蛋白P-gp的底物。恩诺沙星和黄连素均为广谱抗菌药,且兽医临床上广泛用于细菌感染的治疗,但是二者联用是否会产生药物间的相互作用尚未见报道。因此,本试验选用不同剂量的黄连素(40和80 mg · kg-1)处理肉鸡,首先检测了肉鸡各组织P-gp mRNA的表达,其次也考察了其对肉鸡口服恩诺沙星的药动学影响。
已有研究报道,黄酮类化合物能够调节P-gp的表达和活性。韦灵玉等[18]研究发现大鼠连续灌服黄连素提取液后,肠黏膜上P-gp 的活性明显增强;而黄芩对 P-gp 的活性则具有一定抑制作用,并且二者合煎液的抑制作用更强。Guo等[19]发现10、30、100和300 mg · kg-1黄连素处理对小鼠的Mdr1a mRNA表达水平并没有影响。常宏宇等[20]研究发现黄酮类化合物姜黄素作用K562/A02细胞后能逆转细胞的耐药性,并恢复细胞对阿霉素的敏感性,这种机制主要与Abcb1 mRNA 的下调、细胞膜P-gp的表达减少有关。Suzuki等[21]发现黄连素能够降低血管平滑肌细胞Mdr1a和Mdr1b mRNA 的表达,但对其编码蛋白P-gp的表达及底物罗丹明-123的外排没有影响。而本研究发现,不同剂量黄连素处理AA肉鸡后,肾脏和小肠各段P-gp的 mRNA表达显著下降,这与很多研究者的结果是相似的。
我们推测黄连素的这种抑制作用对于提高药物口服生物利用度方面具有重要意义。经本试验研究发现,经黄连素处理后肉鸡体内恩诺沙星的吸收速率常数Ka显著上升(P<0.05),达峰时间Tmax显著降低(P<0.05),AUC及T1/2ke显著升高(P<0.05)。该结果提示恩诺沙星联用一定剂量的黄连素可增加其吸收速度,因此更有助于治疗临床中的细菌感染疾病。鉴于已有的大鼠研究结果[3, 14]以及本实验室的体外和在体的初步研究结果(尚未发表),推测黄连素可能通过抑制P-gp的表达,从而增加肉鸡体内恩诺沙星的含量,但这仍需进一步确证。
近年来研究发现多种类型的化学逆转剂,如维拉帕米(VPM)、环孢菌素A(CsA)等可抑制P-gp活性从而提高药物的口服生物利用度。但这些药物作用靶点单一,毒副作用较大,体内应用时可引起不同程度的不良反应,因此寻找新型有效的P-gp抑制剂具有重要药理学意义。黄连素属于天然化合物,具有抗病毒、抗肿瘤、多作用靶点以及毒性低等多种优点,有望成为新一代的P-gp抑制剂,下一步研究主要集中在其对P-gp表达和功能的影响及其作用机制,并进一步筛选其合适的作用剂量作为P-gp抑制剂以应用于临床。
| [1] | 李波,朱维良,陈凯先. 小檗碱及其衍生物的研究进展[J]. 药学学报,2008,43(8):773-787. Li B,Zhu W L,Chen K X. Advances in the study of berberine and its derivatives[J]. Acta Pharmaceutica Sinica,2008,43(8):773-787(in Chinese with English abstract). |
| [2] | 伍奕,曾勇,梁松岳. 黄连素逆转结肠癌细胞株HCT-8/VCR多药耐药及其与P-gp功能变化相关性的探索性研究[J]. 中国医药指南,2010,8(21):18-20. Wu Y,Zeng Y,Liang S Y. The exploratory research on the berberine reverse the HCT-8/VCR multidrug resistence and its relationship with P-gp functional variance[J]. Guide of China Medicine,2010,8(21):18-20(in Chinese with English abstract). |
| [3] | Qiu W,Jiang X H,Liu C X,et al. Effect of berberine on the pharmacokinetics of substrates of CYP3A and P-gp[J]. Phytotherapy Research,2009,23(11):1553-1558. |
| [4] | Murakami T,Takano M. Intestinal efflux transporters and drug absorption[J]. Expert Opinion on Drug Metabolism & Toxicology,2008,4(7):923-939. |
| [5] | Juliano R L,Ling V. A surface glycoprotein modulating drug permeability in Chinese hamster ovary cell mutants[J]. Biochimica et Biophysica Acta,1976,455(1):152-162. |
| [6] | 赵瑞娇,胡亚南,张凤凤,等. 恩诺沙星微囊在猪体内的药物动力学[J]. 西北农业学报,2011,20(12):11-15. Zhao R J,Hu Y N,Zhang F F,et al. Pharmacokinetics of enrofloxacin microcapsules in pigs[J]. Acta Agriculturae Boreali-Occidentalis Sinica,2011,20(12):11-15(in Chinese with English abstract). |
| [7] | Guo M,Sun Y,Zhang Y,et al. E.coli infection modulates the pharmacokinetics of oral enrofloxacin by targeting P-glycoprotein in small intestine and CYP4503A in liver and kidney of broilers[J]. PLoS ONE,2014,9(1):e87781. |
| [8] | Xing J Y,Kang L,Jiang Y L. Effect of dietary betaine supplementation on lipogenesis gene expression and CpG methylation of lipoprotein lipase gene in broilers[J]. Molecular Biology Reports,2011,38(3):1975-1981. |
| [9] | Smith N F,Figg W D,Sparreboom A. Recent advances in pharmacogenetic approaches to anticancer drug development[J]. Drug Development Research,2004,62(3):233-253. |
| [10] | Yamaoka K,Nakagawa T,Uno T. Application of Akaike's information criterion(AIC)in the evaluation of linear pharmacokinetic equations[J]. Journal of Pharmacokinetics and Biopharmaceutics,1978,6(2):165-175. |
| [11] | 史成军,符立梧. P-糖蛋白的表达和功能活性调控研究进展[J]. 药学学报,2007,42(49):911-916. Shi C J,Fu L W. Advances in the study of expression and regulation of P-glycoprotein[J]. Acta Phamaceutia Sinica,2007,42(49):911-916(in Chinese with English abstract). |
| [12] | Zhang W,Tan T M,Lim L Y. Impact of curcumin-induced changes in P-glycoprotein and CYP3A expression on the pharmacokinetics of peroral celiprolol and midazolam in rats[J]. Drug Metab Dispos,2007,35(1):110-115. |
| [13] | Choi J S,Piao Y J,Kang K W. Effects of quercetin on the bioavailability of doxorubicin in rats:role of CYP3A4 and P-gp inhibition by quercetin[J]. Arch Pharm Res,2011,34(4):607-613. |
| [14] | Shan Y Q,Ren G,Wang Y X,et al. Berberine analogue IMB-Y53 improves glucose-lowering efficacy by averting cellular efflux especially P-glycoprotein efflux[J]. Metabolism,2013,62(3):446-456. |
| [15] | Dautrey S,Felice K,Petiet A,et al. Active intestinal elimination of ciprofloxacin in rats:modulation by different substrates[J]. Br J Pharmacol,1999,127(7):1728-1734. |
| [16] | Yamaguchi H,Yano I,Saito H,et al. Pharmacokinetic role of P-glycoprotein in oral bioavailability and intestinal secretion of grepafloxacin in vivo[J]. J Pharmacol Exp Ther,2002,300(3):1063-1069. |
| [17] | Hennessy M,Spiers J P. A primer on the mechanics of P-glycoprotein the multidrug transporter[J]. Pharmacol Res,2007,55(1):1-15. |
| [18] | 韦灵玉,张玉杰,徐静静,等. 黄连黄芩配伍诱导对大鼠肠黏膜上P-gp活性的影响[J]. 中国实验方剂学杂志,2012,18(18):141-146. Wei L Y,Zhang Y J,Xu J J,et al. Induction of P-glycoprotein in rat jejunum by combined use of coptis-scute herb[J]. Chinese Journal of Experimental Traditional Medical Formulae,2012,18(8):141-146(in Chinese with English abstract). |
| [19] | Guo Y,Pope C,Cheng X,et al. Dose-response of berberine on hepatic cytochromes P450 mRNA expression and activities in mice[J]. J Ethnopharmacol,2011,138(1):111-118. |
| [20] | 常宏宇,潘凯丽,马福成,等. 姜黄素、红霉素逆转K562/A02细胞多药耐药机制的研究[J]. 中华血液学杂志,2006,27(4):254-258. Chang H Y,Pan K L,Ma F C,et al. The study on reversing mechanism of multidrug resistance of K562/A02 cell line by curcumin and erythromycin[J]. Chinese Journal of Hematology,2006,27(4):254-258(in Chinese with English abstract). |
| [21] | Suzuki H,Tanabe H,Mizukami H,et al. Selective regulation of multidrug resistance protein in vascular smooth muscle cells by the isoquinoline alkaloid coptisine[J]. Biol Pharm Bull,2010,33(4):677-682. |




