文章信息
- 乔娜, 干驰, 朱佳琪, 徐旭俊, 陈建泉, 成国祥. 2016.
- QIAO Na, GAN Chi, ZHU Jiaqi, XU Xujun, CHEN Jianquan, CHENG Guoxiang. 2016.
- 转hLF基因山羊血液生理生化指标检测分析
- Hematological and biochemical indices in blood of hLF transgenic goat
- 南京农业大学学报, 39(3): 483-487
- Journal of Nanjing Agricultural University, 39(3): 483-487.
- http://dx.doi.org/10.7685/jnau.201411017
-
文章历史
- 收稿日期:2014-11-11
2. 上海转基因研究中心, 上海 201210;
3. 上海转基因动物育种与制药工程技术研究中心, 上海 201210
2. Shanghai Transgenic Research Center, Shanghai 201210, China;
3. Shanghai Engineering Research Center of Transgenic Animal Breeding and Pharmacy, Shanghai 201210, China
人乳铁蛋白(human lactoferrin,hLF)具有抑菌、杀菌、抗病毒、调节免疫、促进铁吸收、抗肿瘤等功能。人乳铁蛋白已经越来越多地被作为食品添加剂用以增强人体免疫力,改善人体健康[1]。天然hLF来源于人乳汁中,且在初乳中含量可达6 mg · mL-1,常乳中约为1 mg · mL-1,其获得途径非常有限,无法进行工业化生产。近些年随着转基因技术的不断成熟,转基因动物的相关研究也不断深入,通过哺乳动物乳腺特异地表达外源蛋白,成为目前生产重组蛋白的理想方式之一[2, 3, 4]。牛、羊等家畜产奶量大,因而成为乳腺生物反应器理想的动物类型[5]。Yang等[6]制备了在乳腺中表达人乳铁蛋白和乳清白蛋白的转基因奶牛,为中国开发出“人乳化”牛奶提供了保障。近年来,转基因生物安全问题越来越受到重视,促进了转基因生物安全性的评价方法的不断完善。外源基因对转基因动物的生长、健康状况是否存在负面影响,需要更深一步的研究[7]。蔡文涛等[8]从精液品质、精浆生化指标、血常规、血清生化指标等方面系统评价并证实了外源基因对转抗凝血酶Ⅲ、β-干扰素、乙肝表面抗原基因转基因公羊的繁殖能力与健康状况未产生不良影响。Hua等[9]提出,猪生理生化指标和繁殖能力可作为转sFat-1 基因猪环境安全评价的有效方法之一。血液与机体的代谢、营养情况和疾病有着密切的联系,当动物受到外界因子的影响而产生生理变化时,会迅速地反映在血液指标中[10]。血液生理生化指标不仅对了解动物的生理状态有指导意义,也是生理学、病理学、毒理学和药物研究,以及探讨疾病发病机制的重要参考指标[11]。目前国内对转基因山羊血液生理生化指标研究的公开文献甚少。本研究以上海杰隆生物工程股份有限公司转hLF基因奶山羊为试验动物,对其在连续一年内不同时期的血液生理生化指标进行追踪检测分析,旨在为转基因羊的健康评价、疾病诊断及生理试验研究等方面提供参考和依据。
1 材料与方法 1.1 试验动物转基因羊:从原代转hLF基因山羊(上海转基因研究中心2002年利用显微注射方法制备获得,专利号:ZL00115794.9)与正常奶山羊自然配种所得hLF基因整合阳性的后代个体中,选择出生日期相近(6~7月龄),饲养条件相同,健康、无病的半同胞转hLF基因羊30只,公、母各半。对照组羊:选用与转hLF基因羊出生时间相近,健康、无病的非转基因山羊20只,公、母各半。
1.2 仪器与试剂BC-2800Vet兽用血液细胞分析仪、BS-120全自动生化分析仪及血球稀释液、溶血剂、生化检测试剂盒等均购自深圳Mindray公司;一次性负压采血管(2 mL血常规管、5 mL血清管)购自扬州华光器械厂。
1.3 方法 1.3.1 样本采集和处理自群体9月龄开始,每3个月采样并测定1次,连续测定4次。采样当日羊群空腹,用一次性负压采血管颈静脉采血。血常规管收集2 mL血液样品,缓慢颠倒至与抗凝剂(EDTA · K2)充分混合;血清管收集5 mL血液样品,避光,室温静置待测。
1.3.2 血液常规指标检测鲜样品测定前,缓慢颠倒混匀后,静置2 min后上样测定。采用BC-2800Vet 兽用血液分析仪检测血液白细胞(WBC)、红细胞(RBC)、血红蛋白(HGB)、红细胞压积(HCT)等。
1.3.3 血清生化指标检测将血清管置于Thermo冷冻离心机中,4 ℃、3 500 r · min-1离心10 min。取500 μL 上层血清进行测定。采用BS-120全自动生化分析仪测定血清直接胆红素(DBIL)、肌酐(CREA)、甘油三酯(TG)、丙氨酸氨基转移酶(ALT)、门冬氨酸氨基转移酶(AST)、总蛋白(TP)、白蛋白(ALB)、葡萄糖(GLU)、尿素等生化指标。
1.4 数据统计处理采用SPSS 11.5统计软件,对正常奶山羊与转hLF基因山羊间的各项指标进行统计分析。数据均以平均值±标准差(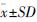 )的形式表示。
)的形式表示。
4个测定时期,转hLF基因山羊(试验组)与正常非转基因羊(对照组)的白细胞数、红细胞数、血红蛋白含量和红细胞压积均无显著性差异(表 1)。
| 指标Item | 9月龄 9 months old | 12月龄 12 months old | 15月龄15 months old | 18月龄 18 months old | ||||
| 试验组 Test group |
对照组 Control group |
试验组 Test group |
对照组 Control group |
试验组 Test group |
对照组 Control group |
试验组 Test group |
对照组 Control group |
|
| WBC/109L-1 | 17.61±5.34 | 18.79±5.73 | 16.95±3.47 | 18.24±4.09 | 16.98±4.96 | 16.99±3.85 | 14.33±3.76 | 15.88±4.87 |
| RBC/1012L-1 | 17.46±1.67 | 17.24±1.00 | 16.62±1.39 | 16.51±1.47 | 15.82±1.70 | 15.67±1.40 | 16.46±1.77 | 16.60±1.77 |
| HGB/(g·L-1) | 104.77±10.50 | 104.65±7.21 | 109.30±9.87 | 108.60±10.80 | 91.37±10.84 | 93.10±10.94 | 101.57±11.75 | 105.40±14.05 |
| HCT/% | 27.05±3.65 | 27.19±2.27 | 27.38±2.92 | 27.76±3.22 | 24.89±2.79 | 25.98±3.78 | 28.52±3.86 | 29.42±4.47 |
| 注: 1)试验组Test group,n=30;对照组Control group,n=20.表2同此。The same as in Table 2. 2)WBC:白细胞数Leukocyte;RBC:红细胞数Erythrocyte;HGB:血红蛋白Hemoglobin;HCT:红细胞压积Hematocrit value. |
||||||||
4个测定时期,转hLF基因羊(试验组)与非转基因羊(对照组)的9项生化指标比较结果显示:转hLF基因羊与同期非转基因羊在各个时期的肝、肾功能及血糖水平均无显著差异,18月龄雄性转hLF基因羊总蛋白水平显著高于正常非转基因羊(P<0.05)。各时期性别间的比较结果显示:直接胆红素、甘油三酯、转氨酶和尿素等指标在不同性别之间存在显著差异(P<0.05)。其中,雄性转基因羊直接胆红素在9月龄和12月龄显著低于雌性组(P<0.05),雄性组丙氨酸氨基转移酶、尿素、门冬氨酸氨基转移酶和甘油三酯等指标分别在9月龄、12月龄、15月龄和18月龄时显著低于雌性组(P<0.05)。其他各项生化指标在各时期的转hLF基因羊与非转基因羊之间、性别之间差异均不显著(P>0.05)(表 2)。
| 指标 Item |
9月龄9 months old | 12月龄12 months old | 15月龄15 months old | 18月龄18 months old | |||||
| 试验组 Test group |
对照组 Control group |
试验组 Test group |
对照组 Control group |
试验组 Test group |
对照组 Control group |
试验组 Test group |
对照组 Control group |
||
| 雄性 | DBIL/(μmol·L-1) | 2.56±0.66a | 2.63±0.82a | 1.81±0.81a | 1.63±0.89a | 2.81±1.01 | 2.56±0.67 | 2.73±0.29 | 2.65±0.58 |
| Male | CREA/(μmol·L-1) | 74.74±11.11 | 78.76±5.98 | 79.61±3.58 | 80.66±9.10 | 79.79±12.27 | 76.13±5.84 | 91.48±8.61 | 91.32±7.25 |
| TG/(mmol·L-1) | 0.33±0.14 | 0.32±0.11 | 0.23±0.04 | 0.25±0.04 | 0.31±0.10 | 0.39±0.22 | 0.18±0.05a | 0.24±0.12 | |
| ALT/(U·L-1) | 21.83±5.54a | 22.28±5.34 | 22.06±1.74 | 21.34±5.89 | 24.25±5.96 | 20.80±3.10 | 17.45±5.12 | 20.85±4.49 | |
| AST/(U·L-1) | 106.54±36.77 | 103.74±9.98 | 97.67±10.24 | 92.91±7.90 | 71.36±13.52a | 68.92±8.56a | 71.31±9.54 | 80.64±17.20 | |
| TP/(g·L-1) | 70.27±4.76 | 71.37±4.17 | 78.07±2.98 | 78.31±3.62 | 72.90±4.97 | 75.28±5.12 | 82.14±4.44* | 77.42±6.90 | |
| ALB/(g·L-1) | 31.29±1.61 | 32.09±0.52 | 35.91±1.21 | 35.84±0.76 | 31.84±3.26 | 33.47±1.51 | 34.95±6.70 | 32.61±4.70 | |
| GLU/(mmol·L-1) | 3.33±0.31 | 3.26±0.19 | 3.41±0.47 | 3.37±0.17 | 3.41±0.26 | 3.27±0.47 | 2.93±0.48 | 3.12±0.47 | |
| Urea/(mmol·L-1) | 7.51±2.10 | 8.02±0.81 | 5.30±0.93a | 5.03±0.93 | 5.55±0.97 | 5.41±0.64 | 7.72±0.84 | 7.32±1.52 | |
| 雌性 | DBIL/(μmol·L-1) | 3.03±0.37 | 2.88±0.55 | 2.42±0.29 | 2.28±0.19 | 2.57±0.33 | 2.65±0.21 | 2.63±0.20 | 2.40±0.57 |
| Female | CREA/(μmol·L-1) | 74.51±4.86 | 72.73±8.62 | 66.55±2.93 | 64.76±4.14 | 74.19±4.82 | 72.12±3.01 | 80.09±6.60 | 81.88±7.26 |
| TG/(mmol·L-1) | 0.30±0.09 | 0.32±0.13 | 0.40±0.11 | 0.42±0.12 | 0.32±0.13 | 0.33±0.14 | 0.25±0.10 | 0.27±0.09 | |
| ALT/(U·L-1) | 26.43±4.43 | 23.28±5.61 | 17.94±5.36 | 21.61±4.83 | 17.54±2.76 | 18.72±4.44 | 17.51±5.06 | 16.25±6.81 | |
| AST/(U·L-1) | 97.87±16.64 | 85.68±13.22 | 96.58±23.10 | 84.72±9.10 | 96.97±10.27 | 93.56±8.04 | 66.57±12.51 | 65.49±24.53 | |
| TP/(g·L-1) | 73.46±2.82 | 73.59±4.57 | 73.35±3.54 | 73.95±3.39 | 75.57±3.47 | 77.08±4.56 | 85.73±5.90 | 83.80±4.90 | |
| ALB/(g·L-1) | 32.11±1.10 | 31.74±1.35 | 34.51±0.97 | 35.19±1.05 | 34.76±1.09 | 35.48±1.60 | 36.45±1.30 | 37.41±1.12 | |
| GLU/(mmol·L-1) | 3.19±0.20 | 3.36±0.21 | 3.63±0.42 | 3.82±0.34 | 2.50±0.39 | 2.68±0.34 | 2.71±0.62 | 2.85±0.57 | |
| Urea/(mmol·L-1) | 7.74±0.95 | 7.23±1.35 | 7.21±0.64 | 7.14±0.52 | 4.95±0.37 | 4.79±0.54 | 8.54±1.24 | 8.54±0.68 | |
| 注: 1)DBIL:直接胆红素Direct bilirubin;CREA:肌酐Creatinine;TG:甘油三酯Triglyceride;ALT:丙氨酸氨基转移酶Alanine aminotransferase;AST:门冬氨酸氨基转移酶Aspartate aminotransferase;TP:总蛋白Total protein;ALB:白蛋白Albumin;GLU:葡萄糖Glucose;Urea:尿素。2)*:表示同时期相同性别试验组与对照组相比有显著差异Test group had significant difference compared with control group at the same period in the same gender(P < 0.05);a:同时期雄性组与雌性组相比有显著差异Male group had significant difference compared with female group at the same period(P < 0.05). | |||||||||
本单位采用显微注射获得原代健康转hLF基因公羊,并将其与正常普通奶山羊交配进行扩繁,获得能够在泌乳期乳汁中特异、稳定表达hLF蛋白的转基因羊群体,该群体常乳中hLF蛋白含量大于0.3 mg · mL-1。利用转hLF基因羊乳汁分别对大鼠进行短期灌胃和90 d喂养,证实其对大鼠代谢机能没有影响,乳汁中重组的hLF蛋白与天然hLF蛋白结构特征一致,转hLF基因羊乳与普通羊乳具有实质等同性,且hLF基因的转入未对转基因羊群的繁殖性能产生显著影响[12, 13, 14, 15]。
本试验中转基因羊外源hLF基因的启动子为山羊β-酪蛋白启动子,该启动子使hLF蛋白仅在转基因母羊泌乳期乳汁中特异表达[16]。本试验所测定的4个时期,试验组转基因羊尚未泌乳,因此从理论上分析试验组的转基因羊在生理上与正常奶山羊应无差异。本试验所测定的血液4项生理和9项生化指标结果显示:4个测定时期转hLF基因羊与非转基因羊在血液细胞计数、血糖及肝肾功能等方面均未有显著差异,各项指标均在正常范围内,与理论一致。18月龄时,雄性转hLF基因羊血清总蛋白水平显著高于正常非转基因羊。9~18月龄中,直接胆红素、甘油三酯、转氨酶和尿素等几项指标分别在不同时期存在性别之间的差异,各指标雄性组均低于雌性组,在动物生长发育过程中,机体对糖、脂肪、蛋白质的代谢可能存在性别间的差异,这种差异同样存在于同时期的非转基因羊之间,且其均在山羊正常生理范围之内波动,与是否转基因羊无关。其他各项生化指标在各时期的转基因羊和非转基因羊之间差异均不显著,这与蔡文涛等[8]对转基因羊的血液生理生化分析结果一致。
胆红素是血红蛋白分解产生的,胆红素随血液进入肝脏后经过各种化学变化,转变成葡萄糖醛酸胆红素而排出体外,达到肝脏的解毒作用,直接胆红素一般作为黄疸疾病的诊断。总蛋白是由肝脏合成的,它们有维持血浆正常胶体渗透压、运输脂肪酸和胆红素、维持血浆pH值恒定等作用[17]。转氨酶是肝脏高度特异性酶,在肝炎急性期,转氨酶的活性会显著增高。本试验中转hLF基因羊的胆红素、总蛋白和白蛋白水平均正常,且转氨酶含量在各个测定时期都较为稳定,证明其肝脏解毒功能正常。
血糖浓度的相对恒定是在神经、激素和肝脏等组织器官的调节下达到的。肝脏是维持血糖浓度恒定的重要器官。转hLF基因羊的胆固醇、血糖都在正常值范围,表明转hLF基因羊肝脏、胰脏功能正常。
肌酐是血液中除蛋白质以外的含氮物质,大部分由肾脏排除,血液肌酐含量反映肾脏的排氮功能。肌酐受非肾性干扰比尿素氮少,对肾功能的测定比尿素氮敏感。通常采用肌酐和尿素氮的联合检测来诊断肾功能异常疾病。转hLF基因羊这两项指标水平均在正常值范围,证明该群体肾功能正常。
本研究分析结果初步证实,hLF基因对山羊的基本代谢和血液学指标无显著影响,转基因羊的健康状况良好。在今后工作中,我们将对泌乳期转基因羊相关指标进行深入研究,不断完善血液生化指标的检测种类,扩大监测群体,逐步建立转hLF基因羊的正常参考范围,为转基因羊的安全性评价和疾病诊断提供数据依据。
| [1] | 陈莎莎,丁月云,金融,等. 乳铁蛋白的抑菌作用及其机制[J]. 中国乳品工业,2007,35(5):53-58. Chen S S,Ding Y Y,Jin R,et al. Antibacterial function of lactoferrin(LF)and its mechanism[J]. China Dairy Industry,2007,35(5):53-58(in Chinese with English abstract). |
| [2] | Scharfen E C,Mills D A,Maga E A. Use of human lysozyme transgenic goat milk in cheese making:effects on lactic acid bacteria performance[J]. Journal of Dairy Science,2007,90(9):4084-4091. |
| [3] | Maga E A,Cullor J S,Smith W,et al. Human lysozyme expressed in the mammary gland of transgenic dairy goats can inhibit the growth of bacteria that cause mastitis and the cold-spoilage of milk[J]. Foodborne Pathogens and Disease,2006,3(4):384-392. |
| [4] | 支旭勃,李青旺,冯波,等. 转基因羊乳中重组人乳铁蛋白的分离工艺研究[J]. 黑龙江畜牧兽医,2008(5):83-84. Zhi X B,Li Q W,Feng B,et al. Study on the separation process for recombinant human lactoferrin transgenic goat milk[J]. Heilongjiang Animal Science and Veterinary Medicine,2008(5):83-84(in Chinese). |
| [5] | 乔娜,徐旭俊,刘思国,等. 转hLYZ基因山羊繁殖、遗传及hLYZ基因的表达稳定性[J]. 江苏农业学报,2013,29(3):570-573. Qiao N,Xu X J,Liu S G,et al. Reproduction,inheritance and expression stability of human lysozyme gene in goat[J]. Jiangsu Journal of Agricultural Sciences,2013,29(3):570-573(in Chinese with English abstract). |
| [6] | Yang P H,Wang J W,Gong G C,et al. Cattle mammary bioreactor generated by a novel procedure of transgenic cloning for large-scale production of functional human lactoferrin[J]. PLoS ONE,2008,3(10):e3453. |
| [7] | 张然,王媛媛,鲍永华,等. 转基因动物应用的研究现状与生物安全评价[J]. 生物产业技术,2010(3):48-59. Zhang R,Wang Y Y,Bao Y H,et al. Applications of transgenic animal research status and evaluation of biosafety[J]. Biotechnology and Business,2010(3):48-59(in Chinese). |
| [8] | 蔡文涛,苏文龙,房义,等. 转基因山羊精液品质、血常规和血清及精浆生化指标的分析[J]. 中国畜牧杂志,2014,50(5):28-31. Cai W T,Su W L,Fang Y,et al. Analysis of semen quality,routine blood,biochemical indexes of serum and seminal plasma in transgenic goats[J]. Chinese Journal of Animal Science,2014,50(5):28-31(in Chinese). |
| [9] | Hua W J,Liu X M,Cheng N,et al. Determination of physiological biochemical parameters and reproductive performance in transgenic sFat-1 gene pigs[J]. Agricultural Science & Technology,2010,11(5):106-108. |
| [10] | 陈琨飞. 不同脂肪来源的日粮对仔猪生长发育性能、血液生化指标及免疫功能的影响[D]. 南京:南京农业大学,2012. Chen K F. Effect of different fat source in diet to piglet on its performance and blood biochemical indexes and immunity[D]. Nanjing:Nanjing Agricultural University,2012(in Chinese with English abstract). |
| [11] | 郑凤娇,傅泳航,刘光泽,等. HBV转基因小鼠血液生理生化指标检测分析[J]. 解放军医学杂志,2011,36(9):970-972. Zheng F J,Fu Y H,Liu G Z,et al. Hematological and biochemical indexes in blood of HBV transgenic mice[J]. Medical Journal of Chinese People's Liberation Army,2011,36(9):970-972(in Chinese with English abstract). |
| [12] | 乔娜,徐旭俊,刘思国,等. 转hLF基因羊繁殖、遗传与表达稳定性[J]. 中国农业科学,2012,45(13):2737-2742. Qiao N,Xu X J,Liu S G,et al. Breeding and expression stability of human lactoferrin transgenic goat[J]. Scientia Agricultura Sinica,2012,45(13):2737-2742(in Chinese with English abstract). |
| [13] | 李佐刚,汤瑶,孙旭,等. 转基因山羊羊乳中重组人乳铁蛋白性质的检定与研究[J]. 药物分析杂志,2008,28(2):223-226. Li Z G,Tang Y,Sun X,et al. Identification and characterization of recombinant human lactoferrin in the milk of transgenic goats[J]. Chinese Journal of Pharmaceutical Analysis,2008,28(2):223-226(in Chinese with English abstract). |
| [14] | 王二先,徐旭俊,苗晋锋,等. 转人乳铁蛋白基因山羊乳对大鼠生长及代谢机能的影响[J]. 南京农业大学学报,2011,34(2):119-123.DOI:10.7685/j.issn.1000-2030.2011.02.021. Wang E X,Xu X J,Miao J F,et al. Effect of transgenic human lactoferrin goats' milk on growth and metabolic performance in rats[J]. Journal of Nanjing Agricultural University,2011,34(2):119-123(in Chinese with English abstract). |
| [15] | 武建明,庾庆华,刘思国,等. 转人乳铁蛋白羊奶生物安全试验[J]. 山东农业科学,2013,45(2):23-27. Wu J M,Yu Q H,Liu S G,et al. Evaluation on biological safety of goat milk transferred human lactoferrin[J]. Shandong Agricultural Sciences,2013,45(2):23-27(in Chinese with English abstract). |
| [16] | Zhang J,Li L,Cai Y F,et al,Expression of active recombinant human lactoferrin in the milk of transgenic goats[J]. Protein Expression and Purification,2008,57:127-135. |
| [17] | 李树伟,许宗运,应璐,等. 卡拉库尔羊血液生化指标常值测定[J]. 塔里木大学学报,2005,17(1):8-10. Li S W,Xu Z Y,Ying L,et al. Studies on the blood biochanistry index of Karakul[J]. Journal of Tarim University,2005,17(1):8-10(in Chinese with English abstract). |




