文章信息
- 张宏鹏, 唐小川, 徐世永, 陈清, 刘红林. 2016.
- ZHANG Hongpeng, TANG Xiaochuan, XU Shiyong, CHEN Qing, LIU Honglin. 2016.
- 聚乙烯亚胺提升慢病毒滴度的研究
- Study on the improvement of the titer of the lentivirus by polyethylenimine
- 南京农业大学学报, 39(3): 455-459
- Journal of Nanjing Agricultural University, 39(3): 455-459.
- http://dx.doi.org/10.7685/jnau.201507029
-
文章历史
- 收稿日期:2015-07-15
慢病毒载体已经发展成为一种重要的基因运载工具。相比于其他病毒载体,慢病毒的优势就是它可以高效感染处于不分裂状态的细胞,并在被感染细胞中稳定整合且长期表达。这一特点使慢病毒载体技术广泛应用于未分化细胞(如各类干细胞)和终末分化细胞(如神经细胞和上皮细胞)的相关试验中[1]。经典的慢病毒生产方法就是将3个或者4个质粒(即常说的三质粒系统或者四质粒系统)按照一定比例混匀,共同瞬时转染到HEK 293T细胞中一段时间后,再分离纯化并浓缩在细胞培养基中获得的病毒颗粒,获得高滴度的慢病毒[2, 3, 4]。目前使用较为广泛的瞬时转染方法是磷酸钙(CaP)法和脂质体法[5]。但是在实际使用中,高滴度慢病毒的生产却是一件很不容易的事。CaP法中,由于需要对pH值进行极其严格的校准,因而可能导致生产的慢病毒各批次之间的滴度存在较大差异。脂质体法中,转染过程简单易行,但由于脂质体价格偏高,试验成本较高,因而约束了慢病毒载体的应用。
作为一种新的转染介质,聚乙烯亚胺(polyethylenimine,PEI)在应用于慢病毒生产领域具有较大优势。首先,PEI是一种廉价的化工产品,已经作为一种转染试剂在重组蛋白生产领域得到了广泛应用,已有PEI用于腺相关病毒和慢病毒生产的报道[6, 7];其次就是使用PEI配制的转染缓冲液对于pH值要求很低,操作起来十分简便;此外,其化学性质稳定,对细胞无毒副作用。本试验在充分结合了两种传统方法优点的基础上,对使用PEI作为转染介质的慢病毒生产方法进行了简化和优化,以探索建立一种新的生产方法,使慢病毒的生产变得更加廉价且易于操作。
1 材料与方法 1.1 试验材料本试验采用四质粒慢病毒包装系统,其中慢病毒包装载体质粒pLP1、pLP2、pLP/VSVG以及慢病毒空载体质粒pLenti 7.3-V5 DEST均购自长沙赢润生物科技有限公司。载体构建相关试剂均购自TaKaRa公司;无内毒素质粒提取试剂盒购自Omega公司;stbl3感受态细胞购自北京全式金公司,细胞培养所用耗材均购自Invitrogen公司;PEI购自Polyscience公司;慢病毒滴度检测试剂盒购自Clontech公司。
1.2 试验方法 1.2.1 慢病毒载体构建增强型绿色荧光蛋白基因(eGFP)来自动物遗传育种实验室保存质粒,将质粒用SpeⅠ和XhoⅠ双酶切,对酶切产物进行纯化,与经同样内切酶处理的慢病毒载体质粒pLenti 7.3-V5 DEST Vector连接,新构建的质粒命名为pLenti 7.3-eGFP。
1.2.2 无内毒素质粒的提取将病毒包装所需4个质粒分别在stbl3感受态细胞中进行转化试验,加入LB液体培养基过夜培养。再在获得的菌液中分别提取4种无内毒素质粒。具体操作步骤参见Omega公司试剂盒使用说明书。
1.2.3 PEI浓储液的准备将5份0.08 g PEI粉末分别溶于245 mL超纯水中,将pH值分别调至6.0、7.0、8.0、9.0和10.0,然后将溶液体积均补至250 mL。将PEI浓储液用0.22 μm滤膜过滤后,4 ℃保存。
1.2.4 使用脂质体作为转染试剂生产慢病毒本试验中,脂质体法生产的慢病毒来源于Life Technologies公司慢病毒包装试剂盒,具体步骤见试剂盒使用说明书。
1.2.5 使用PEI作为转染试剂细胞生产慢病毒将10.5 μg的质粒(包括1.75 μg pLP1、1.75 μg pLP2、1.75 μg pLP/VSVG、3.75 μg pLenti 7.3-eGFP),混合于150 μmol · L-1 NaCl溶液中,并用该NaCl溶液将质粒混合物体积补至100 μL,再取适量pH7.0的PEI浓储液,按N/P=20稀释于150 μmol · L-1 NaCl中,将体积补至100 μL。进行慢病毒包装时的293T细胞培养基具体成分为:90%高糖DMEM+10%FBS+2 mmol · L-1 GlutaMax+25 μmol · L-1氯喹+100 U · mL-1青霉素/链霉素双抗。将DNA-PEI混合物与培养基混匀。计数15 cm培养皿中的293T细胞,在细胞数目约为5×106时,吸除原有培养基,加入上述慢病毒包装培养基与质粒混合液,开始培养。转染16 h后更换新培养基。转染48 h后,收集细胞培养基,500 g离心5 min。吸取上清液并用0.45 μm滤膜过滤。
1.2.6 慢病毒的浓缩和效价滴度的测定具体操作步骤参见Kutner等[2]的报道。
1.2.7 慢病毒物理颗粒滴度的测定本试验中,慢病毒物理颗粒滴度使用Clontech慢病毒滴度检测试剂盒检测,具体方法见使用说明书。试验重复3次,结果取平均值后进行统计分析。
1.2.8 N/P值和转染DNA总量对慢病毒滴度影响的测定准备总质量分别为1、2.6、5.25、10.5、15.75和21 μg的4个质粒混合液,均使用150 μmol · L-1 NaCl溶液稀释至100 μL质粒预混液,再取适量的PEI浓储液按N/P分别为5、10、15、20、25和30稀释于150 μmol · L-1 NaCl溶液中,并将体积补至100 μL。生产病毒的其他步骤同1.2.5节所述,病毒浓缩和滴度测定的步骤同1.2.6和1.2.7节所述。试验设置3个重复,结果取平均值后进行统计分析。
1.2.9 细胞培养基中的FBS、氯喹、GlutaMax对慢病毒滴度影响的测定在1.2.5节使用的细胞培养基的基础上,在总共8个分组中分别去掉10%FBS、2 mmol · L-1 GlutaMax和25 μmol · L-1氯喹中的0~3个后,培养细胞。
1.2.10 转染时细胞数对慢病毒滴度影响的测定计数293T细胞,分别在细胞数约为1×106、5×106、1×107、1.5×107、2×107和2.5×107时,吸除原有培养基,加入培养基与质粒混合液后开始培养细胞。
1.2.11 转染16 h后是否换液对获得慢病毒滴度影响的测定以1.2.5节使用的慢病毒生产方法作为对照组。在试验组中,省去转染16 h后换液步骤。
1.2.12 PEI工作液pH值对慢病毒滴度影响的测定在15 cm培养皿内培养293T细胞,将pH值分别为6.0、7.0、8.0、9.0和10.0的PEI浓储液稀释于150 μmol · L-1 NaCl溶液中,并将体积补至100 μL混匀用于转染试验。
以上1.2.9~1.2.12节中,生产病毒的其他步骤同1.2.5节所述,病毒浓缩和病毒滴度测定的步骤同1.2.6节所述。试验设置3个重复,结果取平均值后进行统计分析。
1.3 统计学处理数据用平均值±标准误(x±SE)表示,用SPSS 20.0软件进行统计学分析,采用独立样本t检验比较两组间差异。流式细胞术结果使用Flowjo软件进行分析。
2 结果与分析 2.1 N/P值和转染DNA总量对获得慢病毒滴度的影响测定了N/P值和转染DNA总量的不同对获得慢病毒滴度的影响,结果如图 1所示:在转染DNA总量低于2.6 μg时,不论N/P值大小,均不能获得滴度高于107 TU · mL-1的慢病毒。当使用总量大于10.5 μg的质粒DNA进行转染时,获得的病毒滴度不再显著升高。
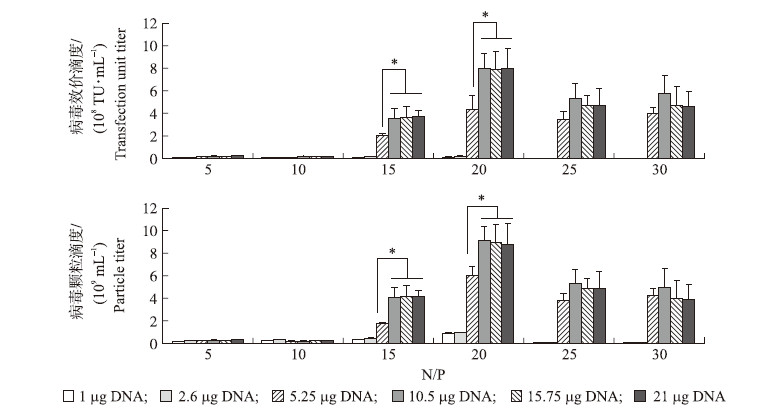 | 图 1 不同N/P值和DNA转染量对慢病毒效价滴度和颗粒滴度的影响 Fig. 1 The effect of different N/P ratio and the total DNA on the transfection unit titer and particle titer *P<0.05,* *P<0.01. The same as follows. |
如图 2所示:比较1、2、3和4组的试验结果发现,FBS对病毒生产有巨大提升作用,获得的滴度显著高于只添加氯喹和GlutaMax的两组。比较1、3、4和8组的结果可以发现,氯喹和GlutaMax对病毒生产仅有微弱的提升作用。
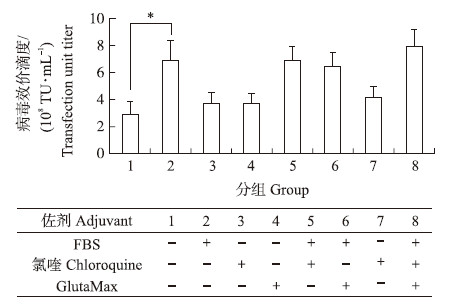 |
图 2 几种佐剂对所得病毒滴度的影响 Fig. 2 The effect of lentivirus titers if added adjuvants in cell culture medium
在1~8组中,“+”和“-”分别表示添加该成分和不添加该成分。 In 1-8 group,the “+”means to add the ingredients,“-”means not to add the ingredients. |
转染时细胞数对慢病毒滴度影响的测定结果如图 3所示:当初始细胞数大于5×106 mL-1,且不超过2×107 mL-1时获得的病毒质量较好。当细胞数仅为106 mL-1时慢病毒滴度显著下降。
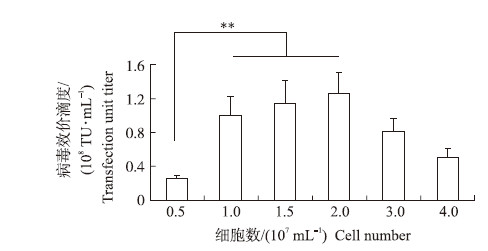 | 图 3 不同初始细胞浓度与病毒滴度的关系 Fig. 3 Relationship between different initial cell concentration and lentivirus titer |
换液组获得的滴度均值为7.85×108 TU · mL-1,不换液组获得的滴度均值为6.73×108 TU · mL-1,二者差异不显著(P>0.05)。此结果也进一步证明了PEI对细胞毒性很小,可以不换液以减小工作量。
2.5 PEI工作液pH值对慢病毒滴度的影响如图 4所示:在PEI工作液pH值分别为7.0、8.0和9.0时,获得的慢病毒滴度与在pH6.0或pH10.0时差异极显著。这也再次验证了PEI作为转染试剂对pH值要求不高这一优势,为试验带来了巨大便利。
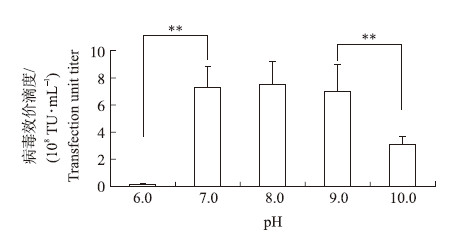 | 图 4 聚乙烯亚胺PEI工作液pH值对慢病毒滴度的影响 Fig. 4 Effect of pH value on the lenti virus titer in polyethylenimine(PEI)stock |
如图 5所示:使用PEI法生产获得的慢病毒比使用脂质体lipo3000获得的慢病毒滴度略高,但二者间差异不显著。
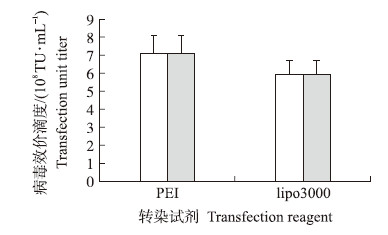 | 图 5 使用脂质体和PEI为转染试剂对慢病毒效价的影响 Fig. 5 Comparison of the effects of the use of liposome and PEI in the lentivirus production |
在本试验中,我们系统研究了使用PEI作为转染试剂生产慢病毒的方法,以及对步骤的优化情况。作为一种新型的转染试剂,PEI的优势主要在于其对于转染环境pH值的耐受性和高性价比。传统的磷酸钙转染法对pH要求极其苛刻[8],这必然会加大在实际操作过程中的困难。
本试验中值得关注的一点就是在培养基中添加氯喹的试验结果。有文章报道氯喹的添加不利于病毒滴度的提高[9],也有文章认为添加氯喹有利于提高病毒滴度[10]。后者一般认为,氯喹对于细胞内的溶酶体有抑制作用,因此它能保护进入293T细胞内的质粒,使之不易被降解,从而达到提高病毒滴度的目的[11, 12]。而前者的观点是氯喹对细胞本身是有一定毒性的,氯喹的存在会影响293T细胞的生长状况,从而更加不易获得高滴度的病毒[6]。从本试验结果看,添加氯喹试验组的病毒滴度仅略微高于对照组。这提示,氯喹对于慢病毒滴度的提升可能并无太大作用。
综上所述,PEI作为一种新的转染试剂,可以替代磷酸钙和脂质体用于高滴度慢病毒的生产。与二者相比,PEI具有更低的操作门槛和更高的性价比,从而具有很高的使用价值。
| [1] | 程志坚,兀飞,朱振中,等. 小鼠BMPR I b基因慢病毒载体构建及转染神经干细胞[J]. 陕西医学杂志,2012,41(7):771-774. Cheng Z J,Wu F,Zhu Z Z,et al. Construction of lentivirus vectors carrying BMPR I b genes and transfection of neural stem calls[J]. Shaanxi Medical Journal,2012,41(7):771-774(in Chinese with English abstract). |
| [2] | Kutner R H,Zhang X Y,Reiser J. Production,concentration and titration of pseudotyped HIV-1-based lentiviral vectors[J]. Nature Protocols,2009,4(4):495-505. |
| [3] | 张淑静,高誉珊,孙红梅,等. 慢病毒介导的小鼠PINK1基因RNAi载体的构建及在NIH3T3细胞中的筛选[J]. 现代生物医学进展,2015,15(23):4401-4405. Zhang S J,Gao Y S,Sun H M,et al. Construction of a lentivirus-mediated RNAi vector targetting mouse PINK1 gene and screening in NIH3T3 cell[J]. Progress in Modern Biomedicine,2015,15(23):4401-4405(in Chinese with English abstract). |
| [4] | 程腾,李佳佳,贺小英,等. 磷酸钙转染方法的优化[J]. 内蒙古师范大学学报(自然科学汉文版),2014,43(6):776-780. Cheng T,Li J J,He X Y,et al. The optimization of calcium phosphate transfection method[J]. Journal of Inner Mongolia Normal University(Natural Science Edition),2014,43(6):776-780(in Chinese with English abstract). |
| [5] | 蔡晶晶,宋小平,严继贵,等. 慢病毒载体包装与生产方法[J]. 长江大学学报(自然科学版),2014,11(9):121-124. Cai J J,Song X P,Yan J G,et al. Packaging and production method of lentivirus vector[J]. Journal of Yangtze University(Natural Science Edition),2014,11(9):121-124(in Chinese with English abstract). |
| [6] | Kuroda H,Kutner R H,Bazan N G,et al. Simplified lentivirus vector production in protein-free media using polyethylenimine-mediated transfection[J]. J Virol Methods,2009,157(2):113-121. |
| [7] | Reed S E,Staley E M,Mayginnes J P,et al. Transfection of mammalian cells using linear polyethylenimine is a simple and effective means of producing recombinant adeno-associated virus vectors[J]. J Virol Methods,2006,138(1/2):85-98. |
| [8] | 于福先,陈晓宇,朱志伟,等. 一种高效制备慢病毒表达载体的方法[J]. 农业生物技术学报,2011,19(3):583-588 Yu F X,Chen X Y,Zhu Z W,et al. A method for highly efficient preparation of lentivirus expression vector[J]. Journal of Agricultural Biotechnology,2011,19(3):583-588(in Chinese with English abstract). |
| [9] | Ciftci K,Levy R J. Enhanced plasmid DNA transfection with lysosomotropic agents in cultured fibroblasts[J]. Int J Pharm,2001,218(1/2):81-92. |
| [10] | 况野,房有荣,刘丽,等. 一种高效稳定的磷酸钙转染HEK293T细胞的方法[J]. 浙江大学学报(农业与生命科学版),2015,41(4):407-413. Kuang Y,Fang Y R,Liu L,et al. A high-efficiency and stable transfection approach by using calcium phosphate in HEK293T cells[J]. Journal of Zhejiang University(Agriculture and Life Science Edition),2015,41(4):407-413(in Chinese with English abstract). |
| [11] | Luthman H,Magnusson G. High efficiency polyoma DNA transfection of chloroquine treated cells[J]. Nucleic Acids Res,1983,11(5):1295-1308. |
| [12] | Boussif O,Lezoualc'h F,Zanta M A,et al. A versatile vector for gene and oligonucleotide transfer into cells in culture and in vivo:polyethylenimine[J]. Proc Natl Acad Sci USA,1995,92(16):7297-7301. |




