文章信息
- 林绍艳, 张芳, 徐颖洁. 2016.
- LIN Shaoyan, ZHANG Fang, XU Yingjie. 2016.
- 植物中多胺含量超高效液相色谱法的建立
- The establishment of UPLC method for measuring polyamines content in plants
- 南京农业大学学报, 39(3): 358-365
- Journal of Nanjing Agricultural University, 39(3): 358-365.
- http://dx.doi.org/10.7685/jnau.201511005
-
文章历史
- 收稿日期:2015-11-02
多胺(polyamines,PAs)是生物体内代谢过程中产生的具有生物活性的低分子质量脂肪族含氮碱,主要有腐胺(putrescine,Put)、亚精胺(spermidine,Spd)、精胺(spermine,Spm)和尸胺(cadaverine,Cad)。多胺具有多聚阳离子特性,能与带负电荷的膜磷脂及酶蛋白结合,是植物生长发育的重要调节物质,参与植物的生长发育[1]、果实成熟与衰老[2]、性别分化[3]、延迟衰老[4]以及逆境胁迫[5, 6, 7]等重要生理过程,还参与生化过程,包括DNA的复制转录、膜稳定、RNA和蛋白质的翻译[8, 9]等。在环境胁迫下,植物体内积累大量的多胺类物质,对稳定细胞膜、核酸及蛋白质等大分子物质的构象有重要的作用[10],故被认为是一类与植物逆境生理有密切关系的物质[11, 12]。关于多胺的作用机制,一般认为其作为植物激素的媒介,像cAMP一样起着“第二信使”的作用[4],因此检测植物体内的多胺含量是非常有意义的。多胺含量的检测方法很多,如衍生化法(苯甲酰化、丹磺酰化)[13, 14]、荧光比色法[15]、薄膜层析法[1]、氨基酸分析仪和纸电泳等,因此,如何建立一套快速、高效、准确的植物体内多胺含量的检测方法越来越受到重视。
高效液相色谱法(high performance liquid chromatography,HPLC)是测定植物体内多胺含量的常用方法,即多胺样品经过衍生化以后,利用液相的方法进行测定,以往的研究多采用此种方法[16, 17]。超高效液相色谱方法(ultra performance liquid chromatography,UPLC)是基于亚2 μm粒径的色谱柱填料颗粒为核心技术的分离技术[18],该方法具有超高分离度,在相同时间内可以分离出更多的色谱峰[19];具有超高速度,分离速度加快且分离度不变;具有超高灵敏度,更窄的色谱峰宽,更高的灵敏度。UPLC的优异性能使得该技术在生物、医药、食品等众多领域快速发展,UPLC的应用普及是今后色谱分析的必然趋势。本试验建立了UPLC在植物中定量测定多胺的方法,并利用小麦叶片、草坪草叶片作为样本进行测定和比较。
1 材料与方法 1.1 试剂与仪器主要试剂为苯甲酰氯、乙醚、氢氧化钠、氯化钠、乙腈(色谱醇)、甲醇(色谱醇)和Millipore超纯水。多胺标样为腐胺(Put,纯度>98%)、亚精胺(Spd,纯度>98%)、精胺(Spm,纯度>96%),均为Sigma公司的产品。
主要仪器为高效液相色谱仪(717 plus自动进样器,600泵系统,2487检测器,美国Waters公司)、超高效液相色谱仪(ACQUITY UPLC H-Class Core System,美国Waters公司)、Empower软件(美国Waters公司)、制冰机、烘箱、冷冻浓缩仪、高速冷冻离心机和涡旋仪。
1.2 小麦和草坪草的处理方法 1.2.1 小麦的处理将小麦种子播种于培养皿中发芽,露白后移栽到盆钵,于无菌人工气候箱中隔离培养(18~25 ℃,16 h光照,8 h黑暗),待长到3叶期,把新鲜白粉菌孢子(E26)均匀抖落在小麦叶片上进行诱导,接种后分时间段取小麦叶片作为样本,以未接种的小麦叶片作为空白对照。
1.2.2 草坪草的处理将匍匐翦股颖草坪草草皮块从试验地移栽到PVC种植盆中(长80 cm,宽40 cm,深40 cm),把草坪草放置于日光温室中栽培90 d,然后将草坪草转移进人工气候室中进行为期30 d的胁迫前适应性栽培,日夜温度设置为20 ℃/15 ℃,相对湿度为70%,光照强度为 650 μmol·m-2·s-1,每隔2 d修剪1次草坪草,使草坪草保持6 cm的统一高度。前期处理结束后,对匍匐翦股颖进行干旱胁迫处理:1)浇水对照,每隔1 d浇水1次,保持土壤含水量在28%;2)干旱处理,在干旱胁迫处理的17 d内禁止浇水,直至土壤含水量下降至10%。
1.3 试剂配制及样品制备 1.3.1 标样配制及衍生配制标样,分别称取0.1 g的Put、Spd、Spm,用超纯水定容到10 mL容量瓶中,将Put、Spd、Spm配成浓度为10 mg·mL-1的母液。根据Redmond等[20]苯甲酰化的方法,并稍作改进。分别吸取20 μL 10 mg·mL-1的 Put、Spd、Spm到10 mL离心管中,加入10 μL苯甲酰氯,再加入1 mL 2 mol·L-1的NaOH后涡旋20 s,在37 ℃烘箱中温浴反应20 min后取出,加入2 mL饱和NaCl溶液,颠倒混匀后,加入2 mL乙醚萃取,然后4 ℃、1 500 g离心5 min,取1 mL醚相到2 mL离心管中,真空干燥后用1 mL甲醇涡旋溶解,然后过0.45 μm滤膜待用。
1.3.2 样品制备及衍生分别称取1 g小麦叶片(鲜样)、0.1 g草坪草叶片(干样),放入研钵中加入液氮研磨成粉末后放入10 mL离心管中,并加入3 mL冰预冷的5%(体积分数)高氯酸,涡旋混匀,置于冰浴中浸提1 h,然后4 ℃、15 000 g离心30 min,吸出上清液放入新的离心管中,-20 ℃保存备用。吸取500 μL多胺提取液到10 mL离心管中,按1.3.1节衍生方法进行多胺的衍生。
1.4 色谱条件 1.4.1 高效液相色谱条件色谱柱Diamonsil C18(250 mm×4.6 mm×5 μm),柱温30 ℃,流动相为甲醇和水(体积比为70:30),流速0.7 mL·min-1,检测器波长230 nm,进样量10 μL。
1.4.2 超高效液相色谱条件色谱柱ACQUITY UPLC HSS C18(100 mm×2.1 mm×1.8 μm)& ACQUITY UPLC HSS T3(100 mm×2.1 mm×1.8 μm),柱温30 ℃,检测器波长230 nm,进样量2 μL。对流动相进行优化,3 个流动相设计如下:1)甲醇和水(体积比为70:30),流速0.43 mL·min-1;2)乙腈、甲醇和水(体积比为10:52:38),流速0.43 mL·min-1;3)乙腈和水(体积比为44:56),流速0.45 mL·min-1。
1.5 标准曲线绘制将标样Put、Spd、Spm衍生液用甲醇依次稀释为100、50、25、10、5、2.5和1 μg·mL-1,以峰面积为纵坐标,多胺标样浓度为横坐标绘制标准曲线,计算相关系数。
1.6 方法稳定性标样衍生后的样品放置在4 ℃冰箱中避光保存,分别在样品衍生后的当天、第3天、第10天,在最佳色谱条件下进样3次,通过Empower软件分析,得到样品的保留时间和峰面积,计算同一样品在放置不同时间后浓度的相对标准偏差。
1.7 方法回收率吸取1.3.2节中的多胺提取液500 μL到10 mL离心管中,另外再吸取1.3.2节中的多胺提取液 500 μL 和40 ng·μL-1多胺标样(Put、Spd、Spm)500 μL混合到10 mL离心管中,按1.3.1节衍生方法进行多胺的衍生,在最佳色谱条件下进样3次,通过Empower软件分析,得到样品的保留时间和峰面积,参照1.5节方法绘制标准曲线,计算样品中多胺和样品与标样中多胺的含量,计算方法的回收率。
2 结果与分析 2.1 色谱条件的选择 2.1.1 色谱柱的选择试验中采用的ACQUITY UPLC HSS色谱柱是一类高强度硅胶柱,耐受高压条件,具有很好的柱寿命和UPLC效率,ACQUITY UPLC HSS C18(100 mm×2.1 mm×1.8 μm)是超高效的、通用性的C18色谱柱,能提供分析物的优异峰形,而ACQUITY UPLC HSS T3色谱柱(100 mm×2.1 mm×1.8 μm)的固定相是与100%水溶液流动相兼容的C18固定相,用于保留和分离极性有机物,2种色谱柱对3种多胺都能很好地分离,3种多胺的标样Put、Spd、Spm在HSS C18色谱柱上的保留时间分别为1.07、1.65和2.54 min(图 1-A),在HSS T3色谱柱上的保留时间分别为1.24、1.99和3.19 min,待测物都能在3.5 min完全分离,而且峰形良好(图 1-B)。综合2种色谱柱的出峰时间,在满足待测组分良好分离和合理的保留时间的条件下,考虑有利于样品中组分与基质干扰峰的完全分离,故选择HSS T3为本试验的色谱柱。
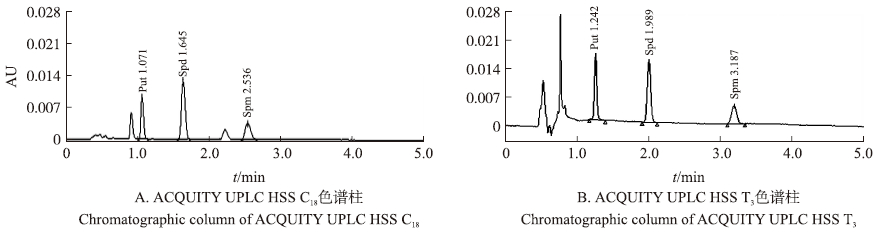
|
图 1 种不同色谱柱中多胺标样的UPLC色谱图 Fig. 1 The UPLC chromatogram of polyamines(PAs)standard with 2 kinds of chromatographic columns |
按1.4.1节的条件进行多胺标样的HPLC测定,结果显示,3种多胺的标样均可以得到良好的分离,且峰型良好,Put、Spd、Spm分别在6.45、8.60和11.55 min出峰(图 2)。
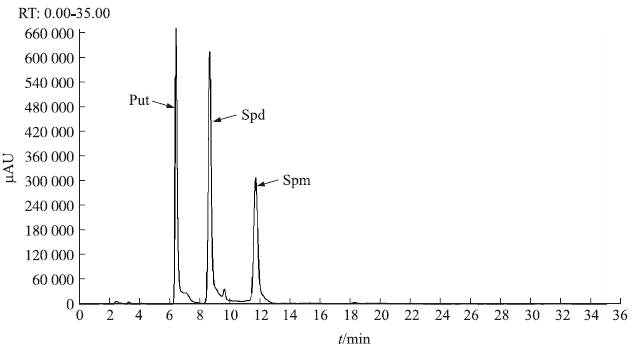
|
图 2 多胺标样的HPLC色谱图 Fig. 2 The HPLC chromatogram of PAs standard |
根据Waters公司提供的ACQUITY UPLC方法转换计算器计算出UPLC的流速,选用HSS T3色谱柱,但不能确定流动相的组成及配比,对此,本试验进行了流动相的优化选择,在3个流动相条件下,3种多胺的标样都可以得到良好的分离。在流动相为甲醇和水(体积比为70:30)时,Put、Spd、Spm分别在0.6、0.8和1.4 min出峰,3个组分保留时间最短,3个组分之间峰型间距太近,在分析复杂基质的植物样品时,这一条件易受到未知物的干扰,不利于组分的完全分离,且系统压力较大。在流动相为乙腈、甲醇和水(体积比为10:52:38)时,Put、Spd、Spm分别在1.18、1.95和3.35 min出峰,流动相组成有3种,系统压力也较大。在流动相为乙腈和水(体积比为44:56)时,Put、Spd、Spm分别在1.24、1.99和3.19 min出峰,流动相组成仅为2种,出峰时间适中,在流速调整为0.45 mL·min-1时,系统压力为9 500 psi左右,从而达到简便、快速、良好的分离效果(图 1-B),为最优流动相。
2.1.3 检测波长的选择多胺类物质在200~260 nm的紫外区都有较好的吸收响应值,传统多胺检测中多使用230和254 nm波长作为检测波长[17, 18],通过UPLC结果比较发现,Put、Spd、Spm在254 nm的紫外吸收值都较低,而在230 nm处有较大吸收值(图 3),另外,提取3种多胺的最大吸收峰的波长,由提取的PDA光谱图可见,Put、Spd、Spm均在225 nm左右有最大吸收值(图 4),综上所述,在满足最低检测限的条件下,最终选用230 nm作为3个组分的检测波长。
|
图 3 多胺标样在230 nm(1)和254 nm(2)色谱图的比较 Fig. 3 The comparison of chromatogram in PAs standard at wavelength of 230 nm(1)and 254 nm(2) |
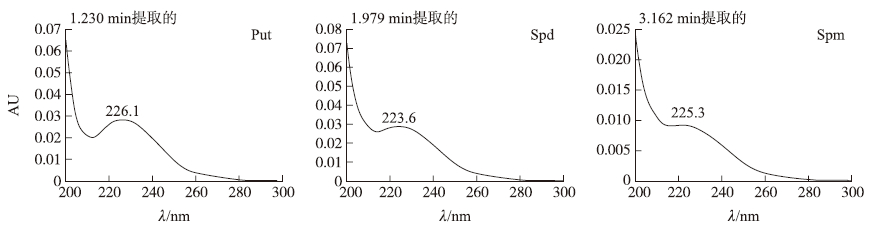
|
图 4 多胺标样的PDA光谱图 Fig. 4 The PDA chromatogram of PAs standard |
在以3倍信噪比(S/N=3)为仪器检出限的情况下,UPLC的测定结果得到Put、Spd的检出限均为0.1 μg·mL-1,Spm的检出限为0.25 μg·mL-1,Put、Spd的检出量均为0.5 μg·g-1,Spm的检出量为1.25 μg·g-1,根据UPLC测定结果,利用 Empower 软件分析得到Put、Spd、Spm的回归方程和相关系数(表 1)。
| 多胺PAs | 回归方程Regression equation | R2 |
| Put | Y=1 260X+1 060 | 0.999 3 |
| Spd | Y=1 770X+1 590 | 0.999 1 |
| Spm | Y=818X+656 | 0.999 0 |
取0.5、1、5、10 g·L-1 多胺标样进行衍生,衍生后的浓度分别为5、10、50和100 ng·μL-1。于4 ℃冰箱中避光保存,分别在标样衍生结束的当天、第3天、第10天采用最优的流动相进行测定,通过标准曲线(表 1)计算3种多胺的浓度。结果表明:在衍生结束的当天进行UPLC测定,标样Put、Spd、Spm浓度的相对标准偏差(RSD)为0.25%、0.15%和0.26%,第3天RSD为0.15%、0.20%和0.29%,第10天RSD为0.22%、0.12%和0.34%,样品平行之间结果稳定。多胺衍生后经过一段时间的存放,4个浓度多胺标样的UPLC峰面积测定值、浓度随着放置时间的延长均呈现下降趋势(图 5),因此,结束衍生处理的样品需尽快进行UPLC的测定,以免衍生样品发生降解而影响数据的准确性。
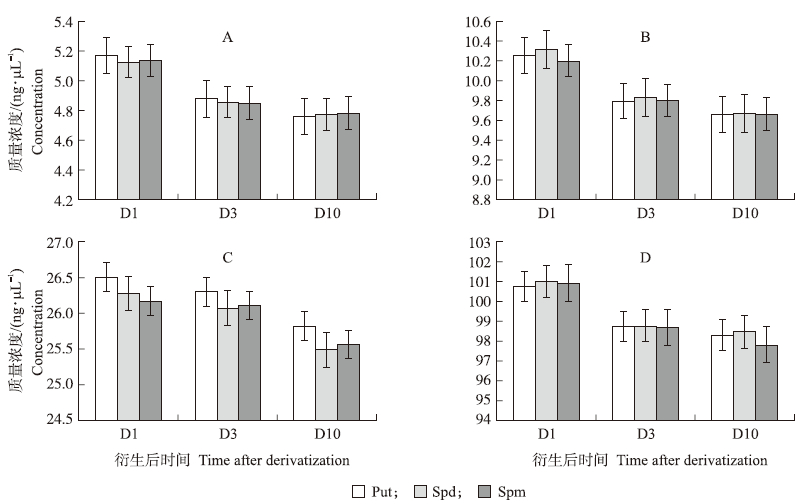
|
图 5 4个标样衍生后放置冰箱避光保存后的UPLC测定结果比较
Fig. 5 The comparison of four standards that place at refrigerator after derivatization
Fig. 5 D1、D3、D10分别为标样衍生后当天、第3天、第10天的结果;A、B、C、D分别表示3种多胺的标样浓度为0.5、1、5、10 g·L-1。 D1,D3,D10 represent the UPLC results of the day,the third day and the tenth day after derivatization;A,B,C,D represent the standards of PAs is 0.5,1,5,10 g·L-1. |
分别将500 μL小麦和草坪草叶片的多胺提取液与500 μL 40 ng·μL-1多胺标样混合,并按1.3.1节衍生方法进行多胺的衍生,每组3个重复,计算该方法多胺的回收率,回收率=[(样品+标样多胺含量测定值)-样品多胺含量测定值]/多胺标样加入量×100%。 经过计算得到Put、Spd、Spm的回收率分别为86%~ 92%、87%~95%和83%~96%(表 2)。
| 样品Sample | 处理Treatment | 多胺PAs | 样品中多胺含量/μgPAs in sample | 样品+标样多胺含量/μgPAs in sample and standard | 多胺标样加入量/μgPAs in standard | 测定回收值/μgRecovery value | 回收率/%Recovery rate |
| 小麦叶片Wheat leaves | 对照CK | Put | 10.67±1.02 | 28.39±0.14 | 20.00 | 17.72±1.15 | 88.62±5.76 |
| Spd | 2.12±0.30 | 20.07±0.05 | 20.00 | 17.94±0.31 | 89.70±1.55 | ||
| Spm | 4.59±0.51 | 21.21+0.52 | 20.00 | 16.61±0.85 | 83.07±4.25 | ||
| 处理1Treatment 1 | Put | 10.65±0.16 | 28.16±0.49 | 20.00 | 17.51±0.63 | 87.56±3.16 | |
| Spd | 3.10±0.10 | 20.75±0.34 | 20.00 | 17.55±0.30 | 87.73±1.48 | ||
| Spm | 5.05±0.19 | 22.34±0.21 | 20.00 | 17.29±0.26 | 86.46±1.29 | ||
| 处理2Treatment 2 | Put | 14.18±0.14 | 32.45±0.39 | 20.00 | 18.27±0.30 | 91.33±1.48 | |
| Spd | 8.63±0.08 | 26.64±0.29 | 20.00 | 18.01±0.21 | 90.06±1.06 | ||
| Spm | 5.20±0.23 | 23.89±0.28 | 20.00 | 18.69±0.41 | 93.47±2.07 | ||
| 草坪草叶片Turfgrass leaves | 对照CK | Put | 0.72±0.03 | 18.72±0.19 | 20.00 | 18.00±0.20 | 90.00±1.00 |
| Spd | 0.35±0.01 | 18.62±0.12 | 20.00 | 18.27±0.12 | 91.34±0.60 | ||
| Spm | 2.09±0.17 | 20.39±0.20 | 20.00 | 18.30±0.37 | 91.48±1.84 | ||
| 处理1Treatment 1 | Put | 0.89±0.11 | 19.24±0.11 | 20.00 | 18.35±0.04 | 91.75±0.19 | |
| Spd | 1.00±0.11 | 19.73±0.14 | 20.00 | 18.74±0.14 | 93.68±0.69 | ||
| Spm | 3.21±0.17 | 22.29±0.21 | 20.00 | 19.09±0.10 | 95.44±0.50 | ||
| 处理2Treatment 2 | Put | 4.83±0.04 | 22.55±0.44 | 20.00 | 17.39±0.19 | 86.93±0.97 | |
| Spd | 0.99±0.04 | 19.90±0.26 | 20.00 | 18.92±0.27 | 94.60±1.37 | ||
| Spm | 4.38±0.11 | 22.95±0.57 | 20.00 | 18.57±0.53 | 92.84±2.67 | ||
| 注: 小麦叶片的对照为未经过接菌的正常叶片,处理为接种后不同时间取的样;草坪草叶片的对照为正常浇水,处理为干旱胁迫后不同时间取的样。 Note: The CK of wheat leaves is the normal leaves that has not infected,the treatment of wheat leaves is the leaves that has infected different times;the CK of turfgrass leaves is the normal leaves that watering everyday,the treatment of turfgrass leaves is the leaves under drought stress different times. The same as follows. |
|||||||
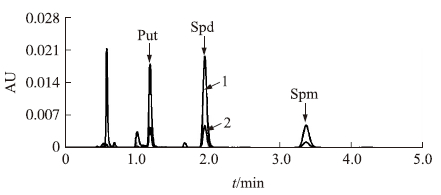
分别称取1.0 g左右的小麦叶片(鲜样)和0.1 g的草坪草叶片(干样),每组3个重复,按1.3.2节的方法进行多胺的提取和衍生,通过标准曲线(表 1)计算3种多胺的含量,结果表明植物样品在受到逆境胁迫时,体内的多胺含量也会随着提高(表 3)。图 6和图 7为小麦和草坪草的典型UPLC和HPLC色谱图。本试验在高效液相色谱仪上,小麦、草坪草的3种多胺虽然在15 min内能洗脱出峰,但是,由于受基质干扰峰的影响需要30~40 min才能确保多胺的完全洗脱分离,而在超高效液相色谱仪上,3种多胺在5 min内能洗脱出峰,大大缩短了测定的时间。
| mg·g-1 | ||||||
| 多胺PAs | 小麦叶片 Wheat leaves | 草坪草叶片 Turfgrass leaves | ||||
| 对照CK | 处理1Treatment 1 | 处理2Treatment 2 | 对照CK | 处理1Treatment 1 | 处理2Treatment 2 | |
| Put | 13.48±1.17 | 15.29±0.17 | 21.79±0.15 | 10.63±0.40 | 11.67±1.61 | 68.74±0.60 |
| Spd | 2.69±0.35 | 4.59±0.11 | 13.26±0.09 | 5.17±0.10 | 13.11±1.58 | 14.09±0.57 |
| Spm | 5.80±0.58 | 7.25±0.21 | 7.99±0.26 | 30.86±2.56 | 42.09±2.41 | 62.33±1.45 |
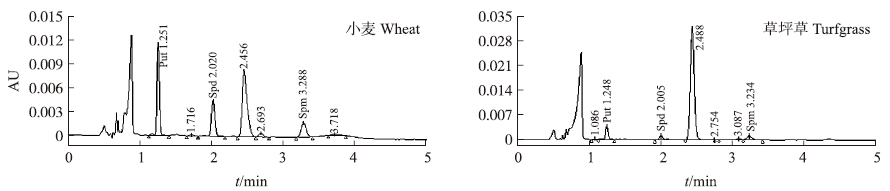
|
图 6 样品中多胺的UPLC色谱图 Fig. 6 The UPLC chromatogram of PAs in samples |
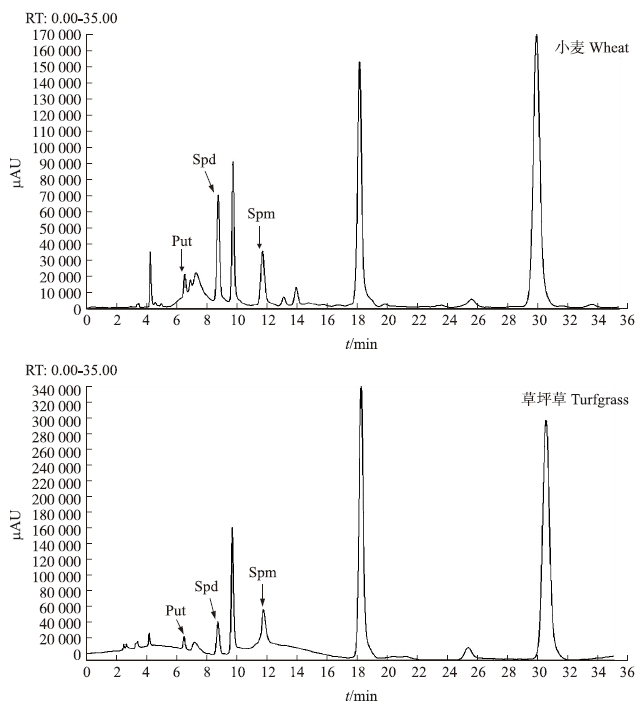
|
图 7 样品中多胺的HPLC色谱图 Fig. 7 The HPLC chromatogram of PAs in samples |
本文采用UPLC方法,经过试验的比较,选用了ACQUITY UPLC HSS T3色谱柱(100 mm×2.1 mm×1.8 μm),流动相为乙腈和水,流速为0.45 mL·min-1,等度洗脱,检测波长为230 nm,进样体积为2 μL,5 min内可实现植物中3种多胺含量的简便、快速、准确分析。在样品的前处理过程中,由于苯甲酰氯的保留时间与Spd的非常接近,而且在衍生后用乙醚萃取的时候苯甲酰氯很容易被萃取出来,因此在干燥的时候应适当延长时间以尽量减少苯甲酰氯的存在。衍生后的样品需避光保存,为了保证结果的准确性,做完衍生试验后应尽快进行UPLC的测定。
在测定小麦和草坪草叶片多胺含量时,UPLC在分析时间和分离效率上都较HPLC有较大程度的改善。由于植物样品不同,不同基质会干扰待测组分的定性定量分析,在传统HPLC方法中往往需要用梯度洗脱或延长洗脱时间来达到良好的分离目的,UPLC在保持传统HPLC优势的同时,大大缩短了分析时间,减少了复杂样品基质对待测组分的干扰,提高了分析效率。该试验建立了快速准确测定植物中多胺含量的UPLC色谱方法,为多胺在植物逆境代谢途径中的研究提供了一定的试验基础。
| [1] | 黄作喜,谢寅峰,胥伟,等. 黄瓜去根苗离体培养条件下多胺对雌花形成的影响[J]. 南京林业大学学报(自然科学版),2008,32(4):147-150. Huang Z X,Xie Y F,Xu W,et al. The effects of polyamines on formation of female flowers in derooted seedlings of Cucumis sativus L.in vitro[J]. Journal of Nanjing Forestry University(Natural Sciences Edition),2008,32(4):147-150(in Chinese with English abstract). |
| [2] | Xu C,Jin Z,Yang S. Polyamines induced by heat treatment before cold-storage reduce mealiness and decay in peach fruit[J]. Journal of Horticultural Science and Biotechnology,2005,80(5):557-560. |
| [3] | Luo H,Zheng Z,Lin S,et a1. Changes in endogenous hormones and polyamine during sexual differentiation of lychee flower[J]. Acta Horticulturae,2005,665:203-208. |
| [4] | 王晓云,邹琦. 多胺与植物衰老关系研究进展[J]. 植物学通报,2002,19(1):11-20. Wang X Y,Zou Q. Advances in studies on relationship between polyamines and plant senescence[J]. Chinese Bulletin of Botany,2002,19(1):11-20(in Chinese with English abstract). |
| [5] | Liu H P,Dong B H,Zhang Y Y,et a1. Relationship between osmotic stress and the levels of free,conjugated and bound polyamines in leaves of wheat seedlings[J]. Plant Science,2004,166(5):1261-1267. |
| [6] | Groppa M D,Ianuzzo M P,Tomaroand M L,et a1. Polyamine metabolism in sunflower plants under long-term cadmium or copper stress[J]. Amino Acids,2007,32(2):265-275. |
| [7] | 袁祖丽,刘秀敏,李华鑫. 多胺与环境胁迫关系研究进展[J]. 西北植物学报,2008,28(9):1912-1919. Yuan Z L,Liu X M,Li H X. Review on the relationship between polyamines and environmental stress[J]. Acta Botanica Boreali-Occidentalia Sinica,2008,28(9):1912-1919(in Chinese with English abstract). |
| [8] | Childs A C,Mehta D J,Gerner E W. Polyamine-dependent gene expression[J]. Cellular and Molecular Life Sciences,2003,60:l394-1406. |
| [9] | 赵福庚,刘友良. 高等植物体内特殊形态多胺的代谢及调节[J]. 植物生理学通讯,2000,36(1):1-5. Zhao F G,Liu Y L. Metabolism and regulation of uncommon polyamines in high plants[J]. Plant Physiology Communications,2000,36(1):1-5(in Chinese with English abstract). |
| [10] | Drolet G. Radical scavenging properties of polyamines[J]. Phytochemistry,1986,25:367-371. |
| [11] | Bitrian M,Zarza X,Altabella T,et al. Polyamines under abiotic stress:metabolic crossroads and hormonal crosstalks in plants[J]. Metabolites,2012,2(4):516-528. |
| [12] | Takahashi T,Kakehi J L. Polyamines:ubiquitous polycations with unique roles in growth and stress responses[J]. Annals of Botany,2010,105(1):1-6. |
| [13] | 关军锋,刘海龙,李广敏. 干旱胁迫下小麦幼苗根、叶多胺含量和多胺氧化酶活性的变化[J]. 植物生态学报,2003,27(5):655-660. Guan J F,Liu H L,Li G M. Changes of polyamines content and polyamine oxidase activity of roots and leaves during drought stress in wheat seedlings[J]. Acta Phytoecologica Sinica,2003,27(5):655-660(in Chinese with English abstract). |
| [14] | 傅善基,卢振铎,邹雄,等. 丹酰氯柱前衍生人尿液多胺高效液相色谱(HPLC)快速测定[J]. 山东生物医学工程,2002,21(2):42-44. Fu S J,Lu Z D,Zou X,et al. High performance liquid chromatography(HPLC)rapid determination of polyamines in human urine following pre-column derivatization with dansyl chloride[J]. Shandong Journal of Biomedical Engineering,2002,21(2):42-44(in Chinese with English abstract). |
| [15] | 乔勇进,冯双庆,李丽萍,等. 热处理对黄瓜贮藏冷害及内源多胺含量的影响[J]. 南京农业大学学报,2005,28(3):34-37. DOI:10.7685/j.issn.1000-2030.2005.03.008. Qiao Y J,Feng S Q,Li L P,et al. The effect of heat treatment on chilling injury and endogenous polyamine contents of cucumber[J]. Journal of Nanjing Agricultural University,2005,28(3):34-37(in Chinese with English abstract). |
| [16] | 刘俊,吉晓佳,刘友良,检测植物组织中多胺含量的高效液相色谱法[J]. 植物生理学通讯,2002,38(6):596-598. Liu J,Ji X J,Liu Y L,High performance liquid chromatography method for measuring polyamine content in plant tissue[J]. Plant Physiology Communications,2002,38(6):596-598(in Chinese with English abstract). |
| [17] | 蒋学美,王晓容,徐金刚,等,荔枝内源多胺的高效液相色谱分析[J]. 广东农业科学,2007,34(10):27-29. Jiang X M,Wang X R,Xu J G,et al. HPLC analysis of endogenous polyamine in litchi fruit[J]. Guangdong Agricultural Sciences,2007,34(10):27-29(in Chinese with English abstract). |
| [18] | 褚云霞,饶钦雄,陈海荣,等. 超高效液相色谱法测定矮牵牛中花青苷含量[J]. 上海交通大学学报(农业科学版),2014,30(2):55-61. Chu Y X,Rao Q X,Chen H R,et al. Determination of anthocyanidins in petunia by UPLC[J]. Journal of Shanghai Jiaotong University(Agricultural Science Edition),2014,30(2):55-61(in Chinese with English abstract). |
| [19] | 赵静,薛晓锋. 超高效液相色谱技术在食品与药品分析中的应用[M]. 北京:中国轻工业出版社,2012:58-101. Zhao J,Xue X F. Application of UPLC with Chemiluminescence Detection for Food and Pharmaceutical Samples[M]. Beijing:China Light Industry Press,2012:58-101(in Chinese). |
| [20] | Redmond J W,Tseng A. High-press liquid chromatographic determination of putrescine,cadaverine,spermidine and spermine[J]. Journal of Chromatography,1979,170:479-481. |




