文章信息
- 朱业培, 王玮, 吕青骎, 钱行, 徐幸莲, 周光宏. 2016.
- ZHU Yepei, WANG Wei, LÜ Qingqin, QIAN Hang, XU Xinglian, ZHOU Guanghong. 2016.
- 动物过敏原牛血清白蛋白间接竞争ELISA检测方法的建立
- Development of an indirect competitive ELISA for detection of animal allergen bovine serum albumin
- 南京农业大学学报, 39(2): 305-311
- Journal of Nanjing Agricultural University, 39(2): 305-311.
- http://dx.doi.org/10.7685/jnau.20150814
-
文章历史
- 收稿日期:2015-08-13
食物过敏是人体对食物中抗原物质产生的由免疫介导的不良反应[1]。目前全球约有25%的人受到过敏性疾病的困扰,其中儿童数量居多,并以每10年23倍的速度递增,而在我国就有2亿多食物过敏原患者[2]。近年来,随着食品工业的迅速发展,人们的饮食习惯和食品种类发生了巨大变化,许多原来不过敏的人群逐渐演变成过敏性体质;同时,随着现代环境卫生条件的改善,儿童尤其是新生儿期发生感染及暴露于微生物的概率逐渐降低,引起机体免疫系统发育不成熟,出现免疫系统紊乱,从而导致食物过敏性疾病发生率呈逐年上升趋势[3]。食物过敏对公众健康的影响已经成为全世界关注的公共卫生问题和食品安全问题。
据报道约90%的食物过敏反应主要是由常见的八类食物过敏原(大豆、花生、小麦、坚果、牛奶、蛋类、鱼类和甲壳纲动物)引起[4]。其中,牛奶是一类非常重要的过敏原,儿童发病率约为0.3%~7.5%,成年人发病率则小于1%[5]。目前,人们了解到牛乳中有30种以上的蛋白质与过敏反应有关,包括β-乳球蛋白(β-lactoglobulin,β-LG)、酪蛋白(casein,CAS)、α-乳白蛋白(α-lactalbumin,α-LA)、牛血清白蛋白(bovine serum albumin,BSA)和乳铁蛋白(lactoferrin,LF)等[6]。其中BSA引起的过敏反应较为普遍,美国有50%的牛奶过敏症是由其引起,且BSA引起机体的过敏反应不受其他牛奶过敏原的影响[7]。研究表明,引起牛肉过敏的主要过敏原就是存在于血浆中的BSA[8]。此外,BSA在医学临床及生物领域也有着广泛的应用[9],这使得过敏患者很难避免接触过敏原BSA而遭受健康威胁。为此,各国研究者纷纷开展针对食物过敏原检测方法的研究。目前,食物过敏原的检测主要采用酶联免疫法(ELISA)[10, 11]、聚合酶链式反应(PCR)法[12, 13]和高效液相色谱法[14, 15]等。其中,ELISA法是实验室、食品企业以及食品监管机构检测食品中过敏原最常用的方法[16],当前关于ELISA法检测动物过敏原BSA的研究报道主要以夹心ELISA方法为主[17, 18],但此方法费时、操作复杂。本研究旨在建立一种简便、快速、准确检测动物过敏原BSA的间接竞争ELISA方法,以期为我国过敏疾病的预防、食品标签标注、食品过敏原监测、预警以及食品安全法的顺利实施提供可靠的科学支持和坚实的技术保障。
1 材料与方法 1.1 材料 1.1.1 细胞及试验动物鼠骨髓瘤细胞SP2/0购于中国科学院上海细胞研究所。6~8周龄雌性BALB/c小鼠购于中国科学院上海实验动物中心。
1.1.2 主要试剂牛血清白蛋白(BSA)和聚乙二醇(PEG)购于美国Sigma公司;弗氏完全佐剂(FCA)、弗氏不完全佐剂(FIA)和四甲基联苯胺(TMB)显色液购于美国Promega公司;辣根过氧化物(HRP)标记羊抗鼠IgG购于美国Proteintech公司;聚偏二氟乙烯膜(PVDF)购于美国Millipore公司;其他试剂均为分析纯,购于南京化学试剂厂。
1.1.3 仪器与设备iMark酶标仪和Gel DocXR凝胶成像仪购于美国Bio-Rad公司;MCO-15AC CO2恒温培养箱购于日本SANYO公司;Allegra 64R台式高速冷冻离心机购于美国Beckman公司;PHS-2C精密酸度计购于上海雷磁仪器厂;96孔酶标板购于美国Corning Incorporated公司;DYY-6C电泳仪购于北京六一仪器厂。
1.1.4 缓冲液及其他溶液配制10×PBS缓冲液(0.1 mol · L-1,pH7.4):称取80 g NaCl、2 g KCl、2.58 g KH2PO4、29 g Na2HPO4 · 12H2O,加蒸馏水至1 000 mL,抽滤,室温长期保存,用时稀释10倍;包被液(0.05 mol · L-1碳酸盐缓冲液,pH9.6):称取0.17 g Na2CO3、0.258 g NaHCO3,加蒸馏水至100 mL,4 ℃保存;洗涤液(PBST,pH7.4):含0.5 g · L-1 Tween-20的0.01 mol · L-1 PBS(pH7.4);封闭液:含10 g · L-1明胶的PBST(pH7.4),4 ℃保存;终止液(2 mol · L-1 H2SO4溶液):量取11.1 mL浓H2SO4,加入到80 mL蒸馏水中,冷却后定容至100 mL。
1.2 试验方法 1.2.1 单克隆抗体的制备1)动物免疫:选取6只6~8周龄雌性BALB/c小鼠,将BSA与FCA混合首次免疫,皮下注射100 μg,每隔2~3周强化1次,方法和剂量同前。4次免疫后,小鼠尾静脉取血检测血清效价,抗体效价达到1 : 10 000以上时进行小鼠细胞融合。未免疫的小鼠血清为阴性对照血清,-20 ℃冻存。2)细胞融合:小鼠腹腔注射100 μg BSA,3 d后处死,无菌条件下摘取脾脏,破碎并收集脾细胞。将Sp2/0骨髓瘤细胞与脾细胞按1 : 20的比例混合,通过PEG促使细胞融合,并将融合细胞铺于细胞培养板中,置于CO2培养箱中培养10 d后筛选检测。3)融合筛选及亚克隆:吸取细胞上清液进行间接ELISA检测,选取竞争效果最好、阳性最强的细胞,采用有限稀释法进行亚克隆,检测至100%阳性后,挑出单克隆孔扩大培养定株,获得稳定分泌抗BSA的杂交瘤细胞株。4)腹水制备及纯化:选取稳定分泌特异性抗体的杂交瘤细胞株9G6注射BALB/c小鼠腹腔,约7~10 d后收集腹水,用Protein A亲和层析法纯化腹水。5)纯度鉴定:利用SDS-PAGE电泳检测纯化抗体,结果进行蛋白质条带灰度扫描,并用Quantity One 4.6凝胶分析软件进行纯度鉴定。
1.2.2 单克隆抗体的蛋白免疫印迹分析过敏原BSA经SDS-PAGE电泳后转膜到PVDF膜上,用100 g · L-1马血清室温封闭2 h(或4 ℃过夜),用PBST洗涤3次;加入制备的鼠抗BSA单克隆抗体(1 : 1 000倍稀释),室温作用1.5 h,用PBST洗涤3次;加入HRP标记羊抗鼠IgG(1 : 5 000倍稀释),室温作用1.5 h,PBST洗涤3次,于TMB显色液中显色2 min。
1.2.3 单克隆抗体的交叉性测定采用间接ELISA法[19],将马血清、猪血清、兔血清、羊血清、狗血清、鸡血清和小鼠血清分别包被在酶标板上,将抗BSA单克隆抗体作为一抗,分别以PBS和BSA标准品作为阴性对照和阳性对照,用HRP标记羊抗鼠IgG为二抗,室温孵育1 h,洗涤后,用TMB试剂显色,于酶标仪450 nm处测定吸光值(D450)。以待测样品孔的D450值与阴性对照孔D450值之比大于2的设定为有交叉反应,反之则为无交叉反应。
1.2.4 间接竞争ELISA的建立1)抗原包被:用包被液将BSA稀释至工作浓度,每孔100 μL加入酶标板,37 ℃包被2 h(或4 ℃包被过夜),弃包被液,用PBST洗涤5次,拍干。2)封闭:按每孔200 μL加入封 闭液,室温封闭2 h,弃封闭液,用PBST洗涤5次,拍干。3)竞争结合:先将BSA加入酶标板,每孔100 μL,再加入抗BSA单克隆抗体,每孔100 μL,室温竞争反应2 h,弃溶液,用PBST洗涤5次,拍干。4)加酶标二抗:加入HRP标记羊抗鼠IgG稀释至工作浓度,每孔100 μL,室温反应1 h,弃溶液,用PBST洗涤5次,拍干。5)显色:加入TMB试剂,每孔100 μL,室温避光显色30 min;加终止液,每孔100 μL,于酶标仪450 nm处测定D450值。
1.2.5 间接竞争ELISA检测条件的优化1)最佳抗原包被浓度和抗体稀释度的确定:采用方阵滴定法[20],抗原质量浓度分别选取8、4、2、1、0.5、0.25、0.125和0 μg · mL-1,抗体稀释倍数分别为1 : 1 000、1 : 2 000、1 : 4 000、1 : 8 000、1 : 16 000、1 : 32 000、1 : 64 000。以D450值在1.0左右对应的抗原抗体浓度作为包被抗原和抗体最佳工作浓度。2)酶标二抗稀释度的确定:在优化出的最佳抗原包被浓度和抗体稀释度下,将HRP标记羊抗鼠IgG以1 : 5 000、1 : 10 000、1 : 20 000、1 : 40 000的稀释度进行对比试验,选择D450值在1.0左右的酶标二抗浓度为最佳工作浓度。
1.2.6 标准曲线的制作及线性范围的确定根据以上步骤确定的最佳条件,将BSA标准品稀释为460 ng · mL-1,并以2倍梯度稀释,共计23个浓度梯度,进行间接竞争ELISA测定D450值,制作标准曲线。其中以lgX为横坐标(X为竞争抗原浓度),以各浓度孔的D450值为纵坐标绘制标准曲线。选择标准曲线呈明显相关的区段,以lgX为横坐标,以抑制率(D标/D0×100%)为纵坐标绘制标准曲线,并根据曲线的具体情况选择最佳的线性模型,其中D0为零标准品孔吸光值,D标为各浓度标准品孔吸光值。
1.2.7 灵敏度、精密度和添加回收率试验1)灵敏度试验:随机选择10个孔进行零标准品间接竞争ELISA检测,计算D450值的平均值(D0)和标准差(SD),按照公式LOD=(D0-2SD)/D0×100%进行计算,在标准曲线上算出对应的BSA质量浓度为此方法的检测下限(LOD),即灵敏度。2)精密度试验:以批内和批间变异系数(CV)表示该ELISA方法的精密度。分别设3个浓度梯度的待测样品,同一样品测定2个批次,每个批次重复测定32次。以每批次内3个水平变异系数的平均值代表各批内变异系数,总的批内变异系数为2个批次批内变异系数的平均值。批间变异系数是将两批次每个水平按64次重复计算变异系数,再取平均值。3)回收率试验:将不同浓度BSA标准品与小麦粉蛋白溶液搅拌均匀,作为待测样品,参照1.2.4节检测待测样品中BSA浓度,并根据公式计算回收率:回收率=(测量质量浓度/实际质量浓度)×100%,以小麦粉蛋白溶液作为空白对照。
2 结果与分析 2.1 单克隆抗体的纯度鉴定及蛋白免疫印迹分析将纯化后鼠抗BSA单克隆抗体进行SDS-PAGE电泳,可见抗体纯化后纯度较高,能达到95%以上(图 1)。纯化的单克隆抗体有2个条带,一条是蛋白质相对分子质量约为25×103的轻链,另一条是相对分子质量约为50×103的重链。纯化的单克隆抗体的免疫印迹分析结果表明:单克隆抗体能与BSA发生免疫反应(图 2),这也为过敏原BSA免疫学检测方法的建立奠定了基础。
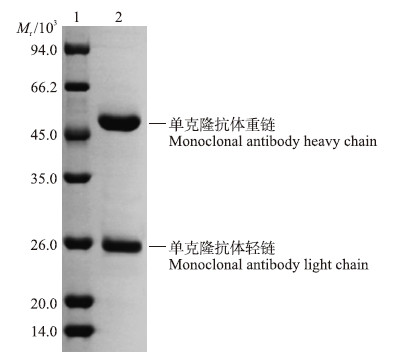 | 图 1 单克隆抗体SDS-PAGE电泳图 Fig. 1 Analysis of monoclonal antibody by SDS-PAGE 1. 蛋白质分子质量标准(低)Protein molecular weight marker(low);2. 鼠抗BSA单克隆抗体 Mouse anti-BSA monoclonal antibody |
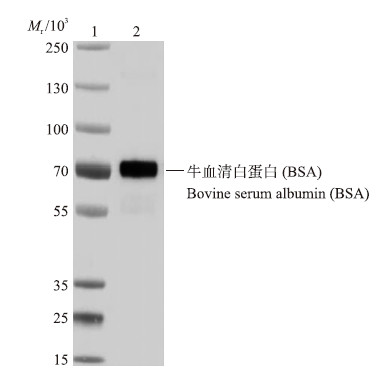 | 图 2 单克隆抗体免疫印迹分析图 Fig. 2 Analysis of monoclonal antibody by Western blot 1. 预染蛋白Marker prestained protein marker;2. 鼠抗BSA单克隆抗体 Mouse anti-BSA monoclonal antibody |
通过间接ELISA方法,检测了抗BSA单克隆抗体与7种其他动物血清和BSA的交叉反应性。结果(图 3)表明:该单克隆抗体与参试的其他动物血清基本不反应,针对BSA具有较高的特异性。
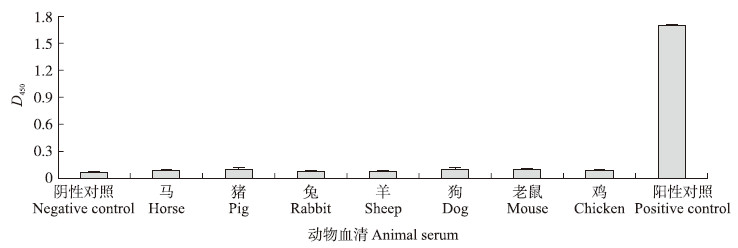 | 图 3 单克隆抗体的交叉性反应 Fig. 3 Cross-reactivity of monoclonal antibody |
根据方阵滴定的结果(表 1),选择D450值为1.0左右,阴性对照小、阳性对照/阴性对照值大的抗原包被浓度及抗体稀释倍数为最佳工作浓度。因此,确定包被抗原BSA的最佳包被浓度为0.25 μg · mL-1,对应的抗体最适稀释倍数为1 : 32 000。
| 抗原质量浓度/(μg·mL-1)Antigen concentration | 抗体稀释倍数Antibody dilution | 阴性对照Negative control | ||||||
| 1 000 | 2 000 | 4 000 | 8 000 | 16 000 | 32 000 | 64 000 | ||
| 8 | 3.824 | 3.885 | 3.912 | 2.715 | 1.766 | 1.757 | 1.128 | 0.098 |
| 4 | 3.852 | 3.882 | 3.915 | 2.927 | 1.923 | 1.893 | 1.197 | 0.083 |
| 2 | 3.803 | 3.893 | 3.918 | 3.857 | 2.142 | 2.139 | 1.442 | 0.110 |
| 1 | 3.863 | 3.897 | 3.283 | 3.136 | 1.978 | 1.843 | 1.294 | 0.093 |
| 0.5 | 3.867 | 3.895 | 3.924 | 2.838 | 1.725 | 1.664 | 1.023 | 0.094 |
| 0.25 | 3.904 | 3.134 | 2.717 | 1.913 | 1.063 | 1.044 | 0.608 | 0.068 |
| 0.125 | 3.922 | 2.760 | 1.856 | 1.054 | 0.567 | 0.586 | 0.324 | 0.066 |
| 0 | 0.146 | 0.084 | 0.048 | 0.024 | 0.018 | 0.013 | 0.012 | 0.064 |
将HRP标记羊抗鼠IgG进行不同梯度稀释,结果(表 2)显示:随着酶标二抗稀释度的增加,D450值逐渐减小;当酶标二抗以1 : 10 000稀释时,测定的D450值为1.008,接近 1.0,为酶标二抗的最佳工作浓度。
| 酶标二抗稀释度Dilution of HRP secondary antibody | ||||
| 1:5 000 | 1:10 000 | 1:20 000 | 1:40 000 | |
| D450 | 1.578 | 1.008 | 0.762 | 0.407 |
根据间接竞争ELISA方法的测定程序,以lgX为横坐标,以各浓度孔的D450值为纵坐标绘制标准曲线(图 4),并根据标准曲线计算出IC50为52.31 ng · mL-1。竞争抗原浓度对数为0.555 548~2.662 758,即竞争抗原浓度为3.593 8~460 ng · mL-1,在标准曲线中呈良好的线性关系。将此范围的浓度对数与抑制率进行线性分析,拟合的线性回归直线方程为y=-47.448 9x+135.866 3(R2=0.997 3,P<0.000 1),符合线性关系的判定标准。
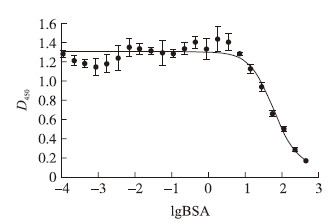 | 图 4 BSA间接竞争ELISA标准曲线 Fig. 4 Standard curve of IC-ELISA for BSA |
灵敏度测定结果见表 3。根据结果计算得出LOD为96.62%,代入上述线性回归直线方程计算出LOD=6.71 ng · mL-1,即灵敏度为6.71 ng · mL-1。
| BSA零标准品BSA zero standard | D0 | 2SD | ||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |||
| D450 | 1.474 | 1.469 | 1.457 | 1.433 | 1.485 | 1.442 | 1.426 | 1.459 | 1.431 | 1.408 | 1.448 | 0.004 9 |
分别设200、100和50 ng · mL-1 3个水平BSA标准品浓度,分2批,每批32个重复,测定结果见表 4。间接竞争ELISA方法第1批次批内变异系数为3.21%,第2批次批内变异系数为3.03%,总的批内变异系数为3.12%,批间变异系数为3.12%。本检测方法批内与批间的变异系数均小于5%,说明本方法精密度较高,重复性较好。
| ρ(BSA)/(ng·mL-1) | 第1批(n=32) The first group | 第2批(n=32) The second group | ||||
| 平均值/(ng·mL-1)Mean value | 标准差SD | 变异系数/%CV | 平均值/(ng·mL-1)Mean value | 标准差SD | 变异系数/%CV | |
| 200 | 201.73 | 6.86 | 3.48 | 200.79 | 7.16 | 3.16 |
| 100 | 98.79 | 2.77 | 2.68 | 99.19 | 3.07 | 2.67 |
| 50 | 50.23 | 1.62 | 3.48 | 49.83 | 2.02 | 3.27 |
将不同浓度的BSA标准品添加至小麦粉蛋白溶液中,制备不同污染浓度的样品,以间接竞争ELISA法检测样品中BSA的回收率,每个浓度重复32次。由表 5可见:当添加BSA的质量浓度为50~200 ng · mL-1时,随着样品中BSA质量浓度的增加,回收率变异系数减小,精确度提高,可知本试验的间接竞争ELISA方法能够满足检测要求。
| BSA浓度/(ng·mL-1) BSA concentration | 回收率/%Recovery | 变异系数/%CV | |
| 加入浓度Added concentration | 检测浓度Founded concentration | ||
| 200 | 198.75±7.44 | 99.38 | 3.74 |
| 100 | 98.79±4.52 | 98.79 | 4.52 |
| 50 | 46.12±2.16 | 92.24 | 4.68 |
食物过敏至今尚无特效疗法,微量甚至痕量的过敏原即可造成严重的后果。通过双盲安慰剂对照食物激发试验证实摄入55 mg BSA就可引发牛肉过敏患者的过敏症状[21]。此外,《中国药典》中规定生物制品中BSA残留量应低于50 ng · mL-1。ELISA方法作为最常见的食物过敏原分析检测方法,具有特异性强、灵敏度高、重复性好和准确性高等优点[22]。在已实施过敏原法规标准的美国、加拿大、日本和欧盟等国家和地区均推荐使用该方法为标准食物过敏原检测方法。
目前,在由两种单抗或单抗多抗配对建立的夹心ELISA方法中,如包被抗BSA抗体存在着交叉反应性,这将会使检测BSA含量的方法受到较大干扰。因此,筛选出高效价、高特异性的抗BSA单克隆抗体作为检测抗体是建立间接竞争ELISA方法的关键。本试验首先制备了特异性抗BSA单克隆抗体,并在此基础上对间接竞争ELISA方法的条件进行摸索,确定最佳的反应条件为:抗原BSA最佳包被浓度为0.25 μg · mL-1,抗体与酶标二抗的工作浓度分别为1 : 32 000与1 : 10 000。拟合线性回归方程为y=-47.448 9x+135.866 3,相关系数R2=0.997 3,其检测的线性范围为3.593 8~460 ng · mL-1,最低检测限为6.71 ng · mL-1,总的批内变异系数为3.12%,批间变异系数为3.12%,回收率为92.24%~99.38%。表明该方法特异性强,灵敏度高,重现性好,且线性范围较宽,可满足实际样本的定量检测要求,而且此方法操作简便,可实现多个样品的同时检测,无需昂贵的设备仪器。因此,本方法能有效检测食品中动物过敏原BSA,该方法的建立也为今后不同加工处理后动物过敏原BSA致敏性的测定提供有效的监测手段。
| [1] | El-Agamy E I. The challenge of cow milk protein allergy[J]. Small Ruminant Research,2007,68(1):64-72. |
| [2] | 陈颖. 食物过敏与食品过敏原[J]. 食品安全质量检测学报,2012,3(4):233-234. Chen Y. Food allergy and food allergens[J]. Journal of Food Safety and Quality,2012,3(4):233-234(in Chinese with English abstract). |
| [3] | 王玮,朱业培,范巧君,等. 高静压降低食物致敏性的研究进展[J]. 南京农业大学学报,2015,38(4):525-531. DOI:10.7685/j.issn.1000-2030.2015.04.001. Wang W,Zhu Y P,Fan Q J,et al. Research progress of reducing food allergenicity by high hydrostatic pressure[J]. Journal of Nanjing Agricultural University,2015,38(4):525-531(in Chinese with English abstract). |
| [4] | Wang W,Han J X,Wu Y J,et al. Simultaneous detection of eight food allergens using optical thin-film biosensor chips[J]. Journal of Agricultural and Food Chemistry,2011,59(13):6889-6894. |
| [5] | Pourpak Z,Motsafaie A,Hasan Z,et al. A laboratory method for purification of major cow's milk allergens[J]. Journal of Immunoassay and Immunochemistry,2004,25(4):385-397. |
| [6] | Hochwallner H,Schulmeister U,Swoboda I,et al. Cow's milk allergy:from allergens to new forms of diagnosis,therapy and prevention[J]. Methods,2014,66(1):22-33. |
| [7] | Wal J M. Cow's milk allergens[J]. Allergy,1998,53(11):1013-1022. |
| [8] | Fiocchi A,Restani P,Riva E. Beef allergy in children[J]. Nutrition,2000,16(6):454-457. |
| [9] | 郭玲,刘爱国,胡志和. 牛血浆中主要蛋白质的研究进展[J]. 食品科学,2009,30(21):489-492. Guo L,Liu A G,Hu Z H. Research advances in main proteins in bovine blood plasma[J]. Food Science,2009,30(21):489-492(in Chinese with English abstract). |
| [10] | Wang H Y,Li G,Wu Y J,et al. Development of an indirect competitive immunoassay for walnut protein component in food[J]. Food Chemistry,2014,147:106-110. |
| [11] | Ecker C,Ertl A,Pulverer W,et al. Validation and comparison of a sandwich ELISA,two competitive ELISAs and a real-time PCR method for the detection of lupine in food[J]. Food Chemistry,2013,14:407-418. |
| [12] | 王玮,韩建勋,袁飞,等. 多重PCR同时检测常见8种食物过敏原[J]. 中国食品学报,2011,11(6):152-157. Wang W,Han J X,Yuan F,et al. Detection of eight food allergens with multiplex PCR[J]. Journal of Chinese Institute of Food Science and Technology,2011,11(6):152-157(in Chinese with English abstract). |
| [13] | Eischeid A C. Development and evaluation of a real-time PCR assay for detection of lobster,a crustacean shellfish allergen[J]. Food Control,2016,59:393-399. |
| [14] | 李慧,陈敏,李赫,等. 反相高效液相色谱法测定乳清蛋白中的α-乳白蛋白和β-乳球蛋白[J]. 色谱,2007,25(10):116-117. Li H,Chen M,Li H,et al. Determination of α-lactalbumin and β-lactoglobulin in whey protein by reversed phase high performance liquid chromatography[J]. Chinese Journal of Chromatography,2007,25(10):116-117(in Chinese with English abstract). |
| [15] | Monaci L,Pilolli R,de Angelis E,et al. Multi-allergen detection in food by micro high-performance liquid chromatography coupled to a dual cell linear ion trap mass spectrometry[J]. Journal of Chromatography A,2014,1358:136-144. |
| [16] | 王守法,阚春月,许学书. 酶联免疫吸附试验在食品检测中的应用[J]. 食品科学,2009,30(23):489-492. Wang S F,Kan C Y,Xu X S. Application of ELISA method in food detection[J]. Food Science,2009,30(23):489-492(in Chinese with English abstract). |
| [17] | Khamehchian S,Madani R,Golchinfar F,et al. Development of a sandwich enzyme-linked immunosorbent assay(ELISA)for determining of bovine serum albumin(BSA)in trivalent measles-mumprubella(MMR)vaccines[J]. Human Vaccines,2008,4(5):375-378. |
| [18] | 张加利,蔡芳,高强,等. 牛血清白蛋白单克隆抗体的筛选与双抗体夹心ELISA 检测方法的建立[J]. 中国生物制品学杂志,2008,21(11):999-1001. Zhang J L,Cai F,Gao Q,et al. Screening of monoclonal antibody against bovine serum albumin and development of double antibody sandwich ELISA for BSA[J]. Chinese Journal of Biologicals,2008,21(11):999-1001(in Chinese with English abstract). |
| [19] | 陈贺,匡渤海,刘志刚,等. 口虾蛄主要过敏原TM的单抗制备和免疫学特性鉴定[J]. 免疫学杂志,2010,26(11):991-995. Chen H,Kuang B H,Liu Z G,et al. Preparation and immunological properties identification of monoclonal antibodies against Oratosquilla oratoria de Haan TM allergen[J]. Immunological Journal,2010,26(11):991-995(in Chinese with English abstract). |
| [20] | 王海燕,袁飞,吴亚君,等. 食品中过敏原胡桃蛋白间接竞争ELISA检测方法研究[J]. 中国食品学报,2010,10(5):217-222. Wang H Y,Yuan F,Wu Y J,et al. Detection of allergen walnut protein in food by a indirect competitive enzyme-linked immunosorbent assay(ELISA)[J]. Journal of Chinese Institute of Food Science and Technology,2010,10(5):217-222(in Chinese with English abstract). |
| [21] | Kanny G,de Hauteclocque C,Moneret-Vautrin D A. Food anaphylaxis to bovine serum albumin[J]. Journal of Allergy and Clinical Immunology,1998,101(1):137-139. |
| [22] | 郑义成,华萍,杨安树,等. 食物中过敏原检测技术研究进展[J]. 食品科学,2010,31(21):417-421. Zheng Y C,Hua P,Yang A S,et al. Research advance in detection technologies for allergen in food[J]. Food Science,2010,31(21):417-421(in Chinese with English abstract). |




