文章信息
- 曹洋, 叶平生, 荣超, 李林, 张瑜娟, 张源淑, 沈向真. 2016.
- CAO Yang, YE Pingsheng, RONG Chao, LI Lin, ZHANG Yujuan, ZHANG Yuanshu, SHEN Xiangzhen. 2016.
- 高精料日粮对干奶期奶山羊肝脏中游离氨基酸重分配的影响
- The effects of high concentrate diets on the redistribution of free amino acids in the liver of goats in dry period
- 南京农业大学学报, 39(2): 289-296
- Journal of Nanjing Agricultural University, 39(2): 289-296.
- http://dx.doi.org/10.7685/jnau.201507017
-
文章历史
- 收稿日期:2015-07-09
反刍动物在上次泌乳结束至下次泌乳开始之间有一个40~60 d的泌乳停止期,称其为干奶期(dry period)[1, 2, 3]。干奶期是泌乳动物必经的一个阶段,在干奶期,一方面动物可以消除上一泌乳期导致的泌乳应激,乳腺组织得以更新。另一方面,一些特定的疾病在此期间可得到有效治疗[4, 5, 6]。所以,干奶期在整个泌乳阶段中是非常重要的,动物在干奶期恢复的程度可直接影响泌乳动物的健康或下一次泌乳能力。干奶期的一个重要生理意义就是为下一个泌乳期储备大量的乳成分前体物,包括氨基酸、脂肪酸及葡萄糖等,目前,这些前体物在干奶期动物体内的代谢变化的研究尚不多见。肝脏是动物机体内营养成分转化的重要枢纽,在糖、脂肪、蛋白质、维生素及激素等物质代谢中有重要作用,食物中营养物质(氨基酸、脂肪酸及葡萄糖等)的绝大部分要在肝脏中进行代谢。肠道吸收了这些营养物质在经门静脉进入肝脏,大部分在肝脏内转化代谢后由肝静脉汇入后腔静脉,进入心脏,最终分配给外周组织或乳腺利用。
目前,对干奶期动物饲养主要的做法是通过提供适当的营养,使泌乳动物体内蓄积一定的营养物质以供分娩后泌乳需要。在实际生产中为了使泌乳动物获得高产,普遍存在着干奶期过度饲喂问题,如在饲料中使用大量的精饲料。但精料饲喂量过多时,常会引起机体一系列的代谢变化,并可激活肿瘤坏死因子等,使机体处于免疫应激状态。肖定汉等[6]研究发现,干奶期精饲料喂料越多则产后体质量下降越明显,且对产后泌乳量有明显影响。因此,干奶期的营养也是乳业研究中面临的主要问题之一。
乳蛋白作为乳的重要营养物质之一,是决定乳品质高低的物质基础,而氨基酸(AA)作为乳蛋白合成的前体物,又是合成乳蛋白的物质基础,因此,AA在干奶期的储备直接影响着下一个泌乳期乳蛋白的合成及产量。但是在传统的高精料日粮饲喂模式下,干奶期AA在体内的代谢变化,特别是在通过肝脏代谢转化后的分配变化的研究尚未见报道。本试验分别采用高、低精粗日粮饲喂干奶期奶山羊,通过研究进出肝脏血液和肝脏组织中游离氨基酸(FAA)含量的变化,并结合分析外周血和肝脏组织中相关指标,探究高精料日粮饲喂干奶期奶山羊时,进入肝脏中氨基酸的分配变化及其可能的机制,为干奶期奶山羊的科学饲养管理提供理论基础。
1 材料与方法 1.1 试剂和仪器主要试剂:肌酸激酶(CK)、乳酸脱氢酶(LDH)、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移(AST)、丙二醛(MDA)、超氧化物歧化酶(SOD)检测试剂盒均购自南京建成生物工程研究所;脂多糖(LPS)酶联免疫检测试剂盒,购自北京瑞格博科技发展有限公司;邻苯二甲醛(O-phthalaldehyde,OPA),购自国药集团化学试剂有限公司;乙腈(Acetonitrile,色谱级),购自美国天地公司。20种AA标准品(Aldrich Chemical Company),由美国Holey教授馈赠,纯度均大于98%。
主要仪器:WYJ2100型可见分光光度计(尤尼柯仪器有限公司);RT-6000型酶标分析仪(深圳雷杜生命科学股份有限公司),C18 ODS(十八基硅烷)反相柱(4.6 mm×250 mm,美国Waters公司),Agilent-1200型高效液相色谱仪、二极管阵列检测器(DAD)、荧光监测器(FLD)、在线脱气机(安捷伦科技有限公司),HT-220A体卧式柱温箱(上海泉岛公司),MIKRO-22R低温冷冻离心机(德国Andreas Hettich GmbH8 CO.KG)等。
1.2 试验动物分组和饲养管理12只干奶期奶山羊,购自江苏省农业科学院六合养殖场,为波尔山羊与丽水本地山羊杂交后的杂种羊,体质量为(33.16±2.49)kg,健康状况良好。奶山羊饲养于南京农业大学农业部动物生理生化重点开放实验室动物房。试验开始前,记录并调整采食量,以保证每次喂料无剩余(每次饲喂日粮800 g,日喂料2次,总量1 600 g)。前10 d为适应期,期间安装瘤胃瘘管与肝门静脉和肝静脉血管瘘管,术后每天分早、晚2次用肝素钠和生理盐水护理血管瘘管,保障管道通畅。适应期后,动物随机分为2组,分别饲喂精粗比为40 : 60(对照组)和60 : 40(高精料组)日粮,饲料配方见表 1。试验期间,羊单栏饲养,自由饮水,日喂料2次(07:00—08:00和19:00—20:00),观察并记录试验奶山羊采食规律、行为表现和健康状况。
| % | |||||
| 原料组成 Ingredient component | 精粗比Concentrate to forage ratio | 营养组成2) Nutrition component | 精粗比Concentrate to forage ratio | ||
| 4:6 | 6:4 | 4:6 | 6:4 | ||
| 羊草Chinese wildrye | 40.00 | 26.70 | 净能3) Net energy | 5.69 | 5.82 |
| 苜蓿干草Alfalfa hay | 20.00 | 13.30 | 粗蛋白质Crude protein | 9.90 | 10.00 |
| 玉米Corn | 22.99 | 23.24 | 中性洗涤纤维Neutral detergent fiber | 36.64 | 34.55 |
| 麸皮Wheat bran | 0.00 | 20.77 | 酸性洗涤纤维Acid detergent fiber | 24.74 | 20.35 |
| 豆粕 Soybean meal | 15.00 | 13.66 | 钙Calcium | 0.80 | 0.90 |
| 石粉Limestone | 0.65 | 1.43 | 磷Phosphorus | 0.33 | 0.38 |
| 磷酸氢钙Calcium phosphate dibasic | 0.46 | 0.00 | |||
| 预混料1) Premix | 0.50 | 0.50 | |||
| 食盐Salt | 0.40 | 0.40 | |||
| 注: 1)1 kg预混料中含维生素D 2 500 U,维生素A 6 000 U,维生素E 80 mg,锌 62.5 mg,铜 6.25 mg,锰 50 mg,碘 0.125 mg,铁62.5 mg,钴 0.125 mg,钼 0.125 mg;2)营养素含量为计算值;3)净能单位为MJ · kg-1。 Note: 1)Provided per kg of premix:vitamin D 2 500 U,vitamin A 6 000 U,vitamin E 80 mg,Ze 62.5 mg,Cu 6.25 mg,Mn 50 mg,I 0.125 mg,Fe 62.5 mg,Co 0.125 mg;Mo 0.125 mg. 2)The component of nutrition is calculated value. 3)Net energy unit:MJ · kg-1. | |||||
血浆样品采集和处理:每期试验结束后,通过颈静脉采集外周血血液,并通过血管瘘管分别采集肝门静脉和肝静脉血液。采集的血液置于真空肝素钠采血管中,1 500 r · min-1离心10 min,收集上清液,保存于-20 ℃待测。
肝脏组织样品采集和处理:试验结束后,将动物进行颈静脉放血处死。采集肝脏组织样品,先用预冷的生理盐水清洗3次,再保存于-20 ℃待测。
1.4 瘤胃液pH的检测每期试验结束后,分别于饲喂后0、1、2、4、6、8和10 h通过瘤胃瘘管采集瘤胃内容物,收集瘤胃液,用pH计测定瘤胃液pH值。
1.5 游离氨基酸的定性和定量测定 1.5.1 标准样品处理称取各标准AA,分别溶于1 mL 0.1 mol · L-1的盐酸中,使其终浓度为1.0 mol · L-1。由于酪氨酸(Tyr)和天冬氨酸(Asp)溶解性较差,分别配成5.0×10-2和1.25×10-2 mol · L-1。
1.5.2 血浆样品处理取100 μL血浆与乙腈按1 : 2(体积比)充分混匀,于4 ℃静置30 min后,12 000 r · min-1离心30 min,去蛋白,取上清液备用。
1.5.3 肝脏样品处理取0.1 g肝脏与生理盐水(1 : 9)匀浆后,4 ℃条件下3 500 r · min-1离心15 min,取上清液,然后按照处理血浆的方法处理肝脏组织匀浆液。
1.5.4 色谱工作条件参考文献[7]并根据本实验室的前期工作,采用三元流动相梯度洗脱,流动相A为乙腈,流动相B为10 mmol · L-1的磷酸盐缓冲液(pH7.2,含0.3%四氢呋喃),流动相C为甲醇。OPA柱前衍生,柱温40 ℃,FLD检测(发射波长450 nm,激发波长340 nm),手工进样。整个分析过程流速恒定为1 mL · min-1。试验结果以保留时间定性,峰面积外标法定量分析。
1.6 血液指标测定 1.6.1 血液中脂多糖含量的测定酶联免疫检测试剂盒测定颈静脉血浆中脂多糖(lipopolysaccharide,LPS)的含量。
1.6.2 血液中氧化应激和抗氧化应激指标的测定用丙二醛(MDA)测试盒测定测定血液中MDA含量。用超氧化物歧化酶(SOD)WST-1法测试盒测定血液中SOD活性。
1.6.3 血液和肝脏中CK与LDH酶活性的测定用肌酸激酶(CK)测定试剂盒与乳酸脱氢酶(LDH)测定试剂盒分别测定颈静脉血液和肝脏组织中CK与LDH的酶活性。
1.6.4 血液和肝脏中丙氨酸氨基转移酶和天冬氨酸氨基转移酶活性的测定运用赖氏法测定丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)的酶活性。
1.7 数据统计与分析所得数据先用Microsoft Excel 2007作初步处理,然后用SPSS 16.0软件进行单因素方差分析。数据结果以平均数±标准误(x±SE)表示,组间差异用t测验分析。
2 结果及分析 2.1 高精料日粮对瘤胃液pH值的影响由图 1可见:奶山羊瘤胃液pH值随着采食时间呈曲线变化,在饲喂前最高,饲喂后随着时间的延长,pH值先逐渐下降,随后又上升。高精料组奶山羊在饲喂后2 h,瘤胃液pH值降至5.8,并持续到饲喂后8 h。高精料组奶山羊瘤胃液pH值一直低于对照组,且在饲喂后1、2、6和8 h差异达到极显著水平(P<0.01),在饲喂后4 h差异达到显著水平(P<0.05)。
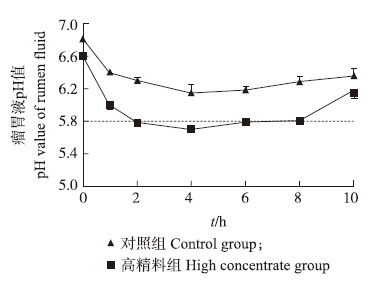 | 图 1 干奶期奶山羊瘤胃液pH值变化 Fig. 1 The change of pH value in rumen fluid of dry period goats 与正常对照相比Compared with control group:*P<0.05,* *P<0.01. |
根据每日瘤胃液pH值小于5.8的持续时间不少于4 h为亚急性瘤胃酸中毒(subacute rumen acidosis,SARA)发生的判断标准,可以认为本试验在高精料日粮饲喂条件下可诱导奶山羊发生SARA。
2.2 20种标准氨基酸的反相HPLC结果反相HPLC分析显示,在50 min内20种标准AA中有15种AA能够完全分离。表 2显示的是AA测定的各种参数,可以看出,在5.2~500 μmol · L-1浓度范围内,AA浓度和峰面积呈线性关系,相关系数为0.996~0.999。15种AA的日内和日间精密度均在6%以内,精密度符合试验要求,可以作为定量依据。
| 氨基酸 Amino acids | 回归方程与相关系数 Regression equation and correlation coefficients | 相对标准偏差 Relative standard deviation | 氨基酸 Amino acids | 回归方程与相关系数 Regression equation and correlation coefficients | 相对标准偏差 Relative standard deviation | ||
| 日间 Intra-day | 日内 Inter-day | 日间 Intra-day | 日内 Inter-day | ||||
| 天冬氨酸Asp | Y=7.733 6X+63.641,0.999 | 2.09 | 4.61 | 酪氨酸Tyr | Y=20.131X+116.46,0.999 | 4.35 | 5.67 |
| 谷氨酸Glu | Y=11.611X+85.397,0.999 | 2.82 | 4.24 | 缬氨酸Val | Y=35.549X+123.14,0.996 | 2.05 | 5.57 |
| 天冬酰胺Asn | Y=11.523X+73.955,0.999 | 2.24 | 5.76 | 色氨酸Trp | Y=16.113X-16.951,0.998 | 2.91 | 4.88 |
| 丝氨酸Ser | Y=16.003X+34.436,0.999 | 3.55 | 5.79 | 苯丙氨酸Phe | Y=17.072X+21.537,0.999 | 2.01 | 5.27 |
| 谷氨酰胺Gln | Y=30.476X+2.7159,0.999 | 3.99 | 5.49 | 异亮氨酸Ile | Y=18.062X+12.063,0.999 | 2.40 | 5.63 |
| 精氨酸Arg | Y=32.284X+275.55,0.999 | 5.53 | 5.55 | 亮氨酸Leu | Y=16.530X+37.707,0.999 | 3.67 | 5.05 |
| 苏氨酸Thr | Y=13.049X+122.16,0.999 | 4.19 | 5.88 | 赖氨酸Lys | Y=3.712X+26.851,0.996 | 3.34 | 5.54 |
| 丙氨酸Ala | Y=13.471X+99.775,0.997 | 2.53 | 5.15 | ||||
| 注:Y指峰面积;X指浓度。 Note:Y refers to the peak area;X refers to the concentration. | |||||||
由表 3可以看出:高精料组奶山羊肝门静脉血液中总必需氨基酸(total essential amino acid,TEAA),总非必需氨基酸(total non-essential amino acid,TNEAA)和总游离氨基酸(total free amino acid,TFAA)含量均高于对照组;除了Thr和Val,各FAA含量均高于对照组,分别是对照组的1.03~1.96倍,即高精料组奶山羊从肝门静脉进入肝脏的AA含量高于对照组相应AA。
高精料组奶山羊肝静脉血液中TEAA、TNEAA和TFAA含量均低于对照组;除Ala含量略高于对照组外,其余AA含量均低于对照组,高精料组/对照组比值为0.42~0.95,即高精料组奶山羊肝静脉血浆FAA含量低于对照组,意味着高精料组奶山羊经肝静脉出肝脏的FAA总量少于对照组。
| 氨基酸 Amino acids | FAA含量/(μmol·L-1) Content of FAA blood | 高精料组与对照组FAA含量比值 FAA content ratio of two groups | ||||
| 高精料组 High-concentrate group | 对照组 Control group | |||||
| 门静脉 Portal vein | 肝静脉 Hepatic vein | 门静脉 Portal vein | 肝静脉 Hepatic vein | 门静脉 Portal vein | 肝静脉 Hepatic vein | |
| Glu | 72.73±25.54 | 25.41±9.85 | 62.15±25.11 | 30.77±8.67 | 1.17 | 0.83 |
| Asn | 35.88±12.01 | 17.32±2.96 | 31.42±8.77 | 33.60±1.24 | 1.14 | 0.52 |
| Ser | 82.01±11.42 | 33.57±3.22 | 63.95±13.98 | 60.75±1.27 | 1.28 | 0.55 |
| Gln | 173.30±37.04 | 129.84±11.19 | 153.67±41.03 | 162.76±18.58 | 1.13 | 0.80 |
| Arg | 258.98±61.65 | 140.86±22.83 | 230.11±70.11 | 349.42±39.30 | 1.13 | 0.40 |
| Thr | 30.63±14.49 | 14.41±2.67 | 31.84±8.55 | 31.28±0.01 | 0.96 | 0.46 |
| Ala | 208.83±45.92 | 178.02±20.39 | 160.23±42.51 | 169.15±10.03 | 1.30 | 1.05 |
| Tyr | 123.73±57.99 | 41.81±14.06 | 63.05±9.33 | 78.64±0.57 | 1.96 | 0.53 |
| Val | 91.06±24.29 | 68.76±4.34 | 100.60±2.00 | 93.54±8.90 | 0.91 | 0.74 |
| Trp | 50.22±2.32 | 27.59±0.24 | 40.98±2.23 | 38.72±0.28 | 1.23 | 0.71 |
| Phe | 69.59±3.53 | 39.95±6.24 | 57.08±12.22 | 49.52±0.13 | 1.22 | 0.81 |
| Ile | 95.63±7.29 | 64.41±3.39 | 86.01±3.71 | 78.59±14.24 | 1.11 | 0.82 |
| Leu | 171.76±37.48 | 184.73±15.05 | 165.37±15.70 | 193.85±7.29 | 1.04 | 0.95 |
| Lys | 135.19±36.35 | 57.84±11.72 | 130.72±14.81 | 137.51±9.62 | 1.03 | 0.42 |
| TEAA | 644.08±80.26 | 457.68±46.67 | 612.59±49.55 | 623.00±13.67 | 1.05 | 0.73 |
| TNEAA | 955.46±132.40 | 566.83±53.54 | 764.58±140.72 | 885.08±37.88 | 1.25 | 0.64 |
| TFAA | 1 599.54±302.02 | 1 024.51±99.84 | 1 377.17±270.27 | 1 508.09±51.55 | 1.16 | 0.68 |
| 注: TEAA:总必需氨基酸Total free amino acids;TNEAA:总非必需氨基酸Total non-essential amino acid;TFAA:总游离氨基酸Total free amino acid | ||||||
由表 4可以看出,高精料组奶山羊肝脏组织匀浆液中TEAA、TNEAA和TFAA含量均低于对照组;除Ser含量略高于对照组外,其余AA含量均低于对照组,高精料组/对照组值为0.48~0.98,即高精料组奶山羊肝脏组织中FAA含量少于对照组,提示高精料饲喂引起肝脏中储存的AA含量减少。
| 氨基酸 Amino acids | FAA含量/(μmol·L-1) Content of FAA blood | 高精料组与对照组FAA含量比值 FAA content ratio of two groups | |
| 高精料组 High-concentrate group | 对照组 Control group | ||
| Glu | 87.95±8.00 | 99.42±6.01 | 0.88 |
| Asn | 5.98±0.65 | 7.93±0.89 | 0.75 |
| Ser | 23.91±4.08 | 22.87±4.63 | 1.05 |
| Gln | 16.52±1.84 | 18.90±1.47 | 0.87 |
| Arg | 42.24±4.30 | 44.50±4.31 | 0.95 |
| Thr | 110.25±14.18 | 115.22±8.02 | 0.96 |
| Ala | 32.25±1.73 | 34.99±4.99 | 0.92 |
| Tyr | 0.73±0.25 | 1.512±0.50 | 0.48 |
| Val | 5.40±0.57 | 5.53±0.98 | 0.98 |
| Trp | 1.59±0.41 | 1.90±0.42 | 0.84 |
| Phe | 1.96±0.24 | 2.99±0.55 | 0.66 |
| Ile | 2.71±0.26 | 4.04±0.53 | 0.67 |
| Leu | 15.89±1.54 | 17.84±1.89 | 0.89 |
| Lys | 12.20±1.49 | 15.53±2.59 | 0.79 |
| TEAA | 150.01±16.05 | 163.06±14.43 | 0.92 |
| TNEAA | 242.98±6.44 | 260.96±16.83 | 0.93 |
| TFAA | 392.99±15.57 | 424.02±30.11 | 0.93 |
由表 5结果可知:与对照组相比,高精料组奶山羊外周血中LPS含量极显著升高(P<0.01);MDA含量升高(P>0.05),SOD含量下降(P>0.05);抗应激指标(CK和LDH酶活性)均升高,其中LDH酶活性极显著增高(P<0.01),ALT和AST酶活性均显著高于对照组(P<0.05)。提示在高精料日粮的饲喂条件下,机体循环血液中LPS含量升高,肝脏组织出现一定程度的损伤,机体抗应激能力下降。
| 组织 Tissue | 指标 Item | 对照组 Control group | 高精料组 High-concentrate group | 组织 Tissue | 指标 Item | 对照组 Control group | 高精料组 High-concentrate group |
| 血液 | LPS/(EU·mL-1) | 0.88±0.02 | 1.14±0.01** | 肝脏 | CK/(U·mL-1) | 0.40±0.04 | 0.42±0.04 |
| Blood | MDA/(nmol·mL-1) | 3.24±0.10 | 3.61±0.33 | Liver | LDH/(U·L-1) | 58.19±19.72 | 88.98±27.08 |
| SOD/(U·mL-1) | 13.98±0.58 | 12.58±0.46 | ALT/(IU·L-1) | 0.56±0.10 | 0.71±0.11 | ||
| CK/(U·mL-1) | 0.26±0.10 | 0.33±0.05 | AST/(IU·L-1) | 11.57±1.02 | 13.69±0.92 | ||
| LDH/(U·L-1) | 3 495.62±116.64 | 4 214.08±118.13** | |||||
| ALT/(IU·L-1) | 1.02±0.21 | 1.88±0.22* | |||||
| AST/(IU·L-1) | 6.42±0.47 | 9.03±0.35* | |||||
| 注: LPS:脂多糖Lipopolysaccharide;MDA:丙二醛Malonaldehyde;SOD:超氧化物歧化酶Superoxide dismutase;CK:肌酸激酶Creatine kinase;LDH:乳酸脱氢酶Lactic dehydrogenase;ALT:丙氨酸氨基转移酶Alamine aminotransferase;AST:天冬氨酸氨基转移酶Aspartate aminotransferase. *P<0.05,* *P<0.01. | |||||||
肝脏组织中生化指标的结果与外周血血浆中生化指标的结果类似:与对照组奶山羊相比,高精料组奶山羊血浆中抗应激指标(CK和LDH酶活性)均上升,肝功能特异性指标ALT和AST酶活性也上升,但差异均不显著(P>0.05)。提示在高精料日粮的饲喂条件下,奶山羊机体抗应激能力下降,肝脏组织出现一定程度的损伤。
3 讨论 3.1 高精料日粮对机体健康的影响SARA是一种普遍的营养代谢性疾病,大量的研究显示高精料日粮饲喂将诱导SARA的发生[8, 9, 10, 11]。研究发现,当机体处于SARA状态时,瘤胃中大量的革兰氏阴性菌破裂溶解,释放大量的LPS[12, 13],其通过体循环到达全身各处,造成内毒血症,使机体处于免疫应激状态[14, 15, 16]。本试验研究结果显示,在高精料日粮的饲喂条件下,奶山羊发生SARA,外周血中LPS的含量极显著升高,表明饲喂高精料日粮能够诱导奶山羊SARA发生,引起循环血液中LPS含量升高,机体处于免疫应激状态。此外,臧长江等[17]研究也发现,LPS能对氨基酸组成和蛋白质代谢相关基因表达产生影响,通过干扰mTOR通路和JAK2/STAT5通路影响了乳蛋白及氨基酸组成。贾媛媛[18]利用高精料日粮分别饲喂泌乳期与干奶期奶山羊,并诱导机体发生SARA,结果发现高精料日粮导致动物体液皮质醇水平升高,机体处于免疫应激状态,引起乳脂合成前体物消耗增多,最终导致乳品质下降。
MDA和SOD是常用来表征机体抗氧化应激能力的指标。一般来说,SOD水平降低或MDA含量升高,意味着体内抗氧化应激能力下降。本试验中,高精料组奶山羊外周血中MDA含量比对照组奶山羊外周血中MDA含量要高,且外周血中SOD酶活性比对照组山羊外周血中SOD酶活性低,表明在高精料日粮的饲喂条件下,奶山羊体内抗氧化应激能力出现下降。
CK是一个敏感的应激指标,主要参与细胞内ATP的合成代谢,为细胞的生理活动提供能量。LDH也是一个表明机体抗应激能力的指标。在相同应激作用下,LDH水平越高,表明机体抗应激能力就越弱[19, 20]。董淑丽等[21]研究发现动物在热应激时,血液中CK浓度升高;张根军[22]研究发现生长猪在热应激条件下,血液中CK、LDH酶活性显著升高,且随应激时间的延长逐渐升高。转氨酶的种类很多,在体内物质代谢和营养物质相互转化中发挥着重要作用。ALT和AST主要来自于肝脏,当肝细胞受到破坏时容易导致血清中ALT和AST的升高,临床上常把检测血清ALT和AST作为诊断肝病的最常用、最敏感的指标[23, 24]。本试验研究发现,与对照组奶山羊相比,高精料组奶山羊外周血中CK酶活性升高,LDH酶活性极显著升高,表明在高精料日料的饲喂条件下,奶山羊抗应激能力减弱。再通过对肝脏组织的检测,发现与外周血结果一致,说明在高精料日粮的饲喂条件下,肝脏组织抗应激能力减弱。对肝功能特异性指标ALT和AST检测发现,与对照组奶山羊相比,高精料组奶山羊外周血血浆和肝脏组织中ALT和AST活力均显著升高,说明在高精料日粮的饲喂条件下,肝脏出现了一定程度的损伤。
3.2 高精料日粮对干奶期奶山羊肝脏中游离氨基酸重分配的影响日粮中大部分营养成分在空肠和回肠肠段被管壁的上皮细胞吸收后通过肝门静脉直接运送到肝脏。反刍动物中小肠和瘤胃是乳蛋白前体物的生成与吸收场所,肝脏是乳蛋白前体物的加工场所,乳腺则是乳蛋白合成的场所[25]。日粮中的蛋白在瘤胃中消化后,经过肠道以FAA的形式被吸收,最终经肝门静脉进入肝脏,大部分FAA在肝脏内都会得到转化代谢,经过转化代谢后由肝静脉汇入后腔静脉,进入心脏,最终分配给外周组织或乳腺利用。
本试验中,干奶期奶山羊在不同精粗比日粮饲喂4周后,与对照组奶山羊相比,高精料组奶山羊从肝门静脉进入肝脏的FAA含量升高,但经肝静脉出肝脏的FAA总量下降,表明肝脏组织中氨基酸重分配发生了变化,肝脏组织中AA消耗量增大。AA在肝脏中有2个去向,一方面储备在肝脏,另一方面在肝脏中发挥其作用,如调控细胞内蛋白质的循环(合成和降解)、尿素循环和尿酸合成、脂质和葡萄糖代谢、细胞内氧化-还原反应[26, 27, 28, 29, 30]等。本试验中,高精料组肝脏组织匀浆中FAA的含量降低,说明进入肝脏被过多消耗的AA并没有用于肝脏储存,可能参与了其他途径,如参与了机体的抗应激和抗损伤。
| [1] | 王花改,路素珍,李丽华,等. 奶农应重视奶牛的干奶期[J]. 中国乳业,2012(5):28-30. Wang H G,Lu S Z,Li H,et al. Dairy farmers should pay attention to the dry period of dairy cows[J]. Dairy Industry of China,2012(5):28-30(in Chinese). |
| [2] | Schaeffer L R,Henderson C R. Effects of day dry and days open on Holstein milk production[J]. Journal of Dairy Science,1972,55:107-112. |
| [3] | Wilton J W,Burnside E B,Rennie J C. The effects of days dry and days open on the milk and butterfat production of Holstein Friesian cattle[J]. Journal of Animal Science,1967,47:85-90. |
| [4] | 张学炜. 干奶期饲养对奶牛产后疾病的影响[J]. 中国奶牛,1996(5):39-40. Zhang X W. The effect of the dry period feeding on disease of postpartum cows[J]. Chinese Cows,1996(5):39-40(in Chinese). |
| [5] | 肖定汉,张圻,赵燕泸,等. 干奶期不同精料饲喂量对母牛产前产后血液学血液生化学及肝功能的影响[J]. 中国奶牛,1986(4):39-46. Xiao D H,Zhang Q,Zhao Y L et al.The effects of different concentrate diets feeding on prenatal and postnatal blood chemistry hematology and liver function of the dry period of cows[J] Chinese Cows,1986(4):39-46(in Chinese). |
| [6] | 肖定汉,李兰华,周凤仪. 母牛干奶期精料喂量与产后泌乳量、体重变化关系探讨[J]. 中国奶牛,1991(2):21-22. Xiao D H,Li L H,Zhou F Y. The relationship among the amount of concentrate feeding and postpartum lactation and weight change[J]Chinese Cows,1991(2):21-22(in Chinese). |
| [7] | 牟德海. OPA柱前衍生反相高效液相色谱法测定AA含量[J]. 色谱,1997,15(4):319-321. Mou D H. OPA precolumn derivatization RP-HPLC determination of AA content[J]. Chromatography,1997,15(4):319-321(in Chinese). |
| [8] | Beauchemin K A,Yang W Z,Rode L M. Effects of particle size of alfalfa based dairy cow diets on chewing activity,ruminal fermentation,and milk production[J]. Journal of Dairy Science,2003,86:630-643. |
| [9] | Zebeli Q,Dijkstra J,Tafaj M,et al. Modeling the adequacy of dietary fiber in dairy cows based on the responses of ruminal pH and milk fat production to composition of the diet[J]. Journal of Dairy Science,2008,91:2046-2066. |
| [10] | Oetzel G R,Nordlund K V,Garett E F. Effect of ruminal pH and stage of lactation on ruminal lactate concentration in dairy cows[J]. Journal of Dairy Science,1999,82(suppl 1):35. |
| [11] | Garrett E F,Nordlund K V,Goodger W J,et al. A cross-sectional field study investigating the effect of periparturient dietary management on ruminal pH in early lactation dairy cows[J]. Journal of Dairy Science,1997,80(suppl 1):169. |
| [12] | Gozho G N,Krause D O,Plaizier J C. Ruminal lipopolysaccharide concentration and inflammatory response during grain-induced subacute ruminal acidosis in dairy cows[J]. Journal of Dairy Science,2007,90:856-866. |
| [13] | Khafipoor E,Krause D O,Plaizier J C. Influence of grain induced sub-acute ruminal acidosis(SARA)on lipopolysaccharide endotoxin(LPS)and acute phase proteins[J]. Journal of Animal Science,2006,86:577. |
| [14] | Plaizier J C,Krause D O,Gozho G N,et al. Subacute ruminal acidosis in dairy cows:the physiological causes,incidence and consequences[J]. Journal of Veterinary,2008,176:21-31. |
| [15] | Ametaj B N,Zebeli Q,Iqbal S. Nutrition,microbiota,and endotoxinrelated diseases in dairy cows[J]. Revista Brasileira de Zootecnia,2010,39:433-444. |
| [16] | Steele M,AlZahal A O,Hook S E,et al. Ruminal acidosis and the rapid onset of ruminal parakeratosis in a mature dairy cow:a case report[J]. Acta Veterinaria Scandinavica,2009,51:39. |
| [17] | 臧长江,张养东,王加启,等. 脂多糖对泌乳奶牛乳中氨基酸组成及蛋白质代谢相关基因表达的影响[J]. 动物营养学,2012,24(9):1770-1777. Zang C J,Zhang Y D,Wang J Q,et al. The effect of LPS on amino acids composition and related gene expression of protein metabolism in dairy cows[J]. Journal of Animal Nutrition,2012,24(9):1770-1777(in Chinese with English abstract). |
| [18] | 贾媛媛. 亚急性瘤胃酸中毒对山羊血液皮质醇浓度和肝脏脂代谢的影响及其机制研究[D]. 南京:南京农业大学,2013. Jia Y Y. The Effect of SARA on blood cortisol and hepatic lipid metabolism in goats and its mechanism[D]. Nanjing:Nanjing Agricultural University,2013(in Chinese with English abstract). |
| [19] | Simaraks S,Chinrasri O,Aengwanich S. Hematological,electrolyte and serum biochemical values of the Thai indigenous chickens(Gallus domesticus)in northeastern,Thailand[J]. Journal of Science Technology,2004,26(3):425-430. |
| [20] | Zubeic D. Some biochemical parameters in the blood of grazing German improved fawn goats from Istria,Croatia[J]. Veterinarski Arhiv,2001,71(5):237-244. |
| [21] | 董淑丽,邓雯,雷雪芹,等. 热应激对动物血液生化指标的影响[J]. 家畜生态,2004,25(2):54-56. Dong S L,Deng W,Lei X Q,et al. The effect of heat stress on animal blood biochemical parameters[J]Animal Ecology,2004,25(2):54-56(in Chinese with English abstract). |
| [22] | 张根军. 生长猪热应激反应模型及适宜监测指标筛选[D]. 北京:中国农业科学院,2004. Zhang G J. Growing pigs heat stress response model and appropriate monitoring Indicators screening[D]. Beijing:Chinese Academy of Agricultural Sciences,2004(in Chinese with English abstract). |
| [23] | 沈霞芬. 家畜组织学与胚胎学[M]. 北京:中国农业出版社,2009. Shen X F. Animal Histology and Embryology[M]. Beijing:China Agriculture Press,2009(in Chinese). |
| [24] | 彭克美. 畜禽解剖学[M]. 北京:高等教育出版社,2009. Peng K M. Animal Anatomy[M]. Beijing:Higher Education Press,2009(in Chinese). |
| [25] | 赵静雯,赵圣国,孙鹏,等. 乳蛋白源前体物生成与利用的相关影响因素[J]. 中国畜牧兽医,2012,39(1):78-81. Zhao J W,Zhao S G,Sun P,et al. The related factors of generation and use of milk protein precursor[J]. Animal Husbandry and Veterinary of China,2012,39(1):78-81(in Chinese with English abstract). |
| [26] | Kong X,Tan B,Yin Y,et al. L-Arginine stimulates the mTOR signaling pathway and protein synthesis in porcine trophectoderm cells[J]. Journal of Nutrition Biochem,2012,9:1178-1183. |
| [27] | Wu G. Amino acids:metabolism,functions,and nutrition[J]. Amino Acids,2009,37(1):1-17. |
| [28] | Wu G,Wu Z,Dai Z,et al. Dietary requirements of "nutritionally non-essential amino acids" by animals and humans[J]. Amino Acids,2013,44(4):1107-1113. |
| [29] | Satterfield M C,Dunlap K A,Keisler D H,et al. Arginine nutrition and fetal brown adipose tissue development in nutrient-restricted sheep[J]. Amino Acids,2013,45(3):489-499. |
| [30] | Hou Y,Wang L,Zhang W,et al. Protective effects of N-acetylcysteine on intestinal functions of piglets challenged with lipopolysaccharide[J]. Amino Acids,2012,43(3):1233-1242. |




